Method Article
全自动毛细 Electrophoretic-based 免疫分析方法的程序和关键优化策略
摘要
利用商用平台检测总蛋白制剂中靶蛋白的 capillary-based 免疫分析方法。另外, 对细胞培养模型系统进行了暴露时间、蛋白质浓度和抗体稀释度的测定参数的优化。
摘要
与传统的免疫相比, 利用 capillary-based 免疫的新技术有望更快、更定量地评估蛋白质。然而, 类似于其他抗体蛋白的检测, 优化 capillary-based 免疫分析参数, 如蛋白质浓度, 抗体稀释, 和曝光时间是一个重要的先决条件, 产生有意义和可靠的数据.测量必须在测定的线性范围内, 信号的变化与裂解液浓度的变化成正比。在人类支气管上皮细胞系中, BEAS-2B 了选择适当的裂解浓度、抗体稀释和暴露时间的过程。通过 p53 和α-蛋白抗体, 在整个细胞提取蛋白浓度范围内显示出线性测定。一个信号耗尽的例子是在最高浓度的长曝光时间, 和α-蛋白抗体稀释曲线显示饱和。此外, 示例实验结果报告了阿霉素治疗细胞使用优化参数。
引言
毛细管电泳免疫测定细胞裂解中的蛋白表达, 采用大小或电荷分离系统, 并优于传统的免疫。例如, 与西方的印迹相比, 自动 capillary-based 程序消除了对凝胶、转移装置和手动洗涤的需要。此外, 所需的蛋白质的绝对数量是大约10倍少, 使 capillary-based 系统的理想使用与稀有细胞类型或有限的样本1,2。结果是获得在3小时使用自动化系统, 并已证明是比传统的西方印迹程序更定量和可复制性3,4,5。基于测定的过程包括载有十二烷基硫酸钠 (SDS)、糖 (荧光) 和标记分子量标记的含有堆积和分离矩阵的毛细管柱的样品。施加在毛细管上的电压根据大小将样品中的蛋白质分离, 紫外光针刺分离的蛋白质到毛细血管壁。然后用靶向特异性抗体和辣根过氧化物酶 (HRP)-共轭二级抗体对毛细血管进行免疫探查。通过电荷耦合器件 (CCD) 相机测量发光鲁米诺和过氧化物, 并对定量蛋白进行了分析。
尽管自动化的 capillary-based 电泳免疫分析平台的相对容易和速度, 优化的化验条件, 如蛋白质浓度, 抗体稀释, 和曝光时间是重要的获得准确, 重现性结果.一般而言, 应执行下列程序以优化这些系统的化验:
1) 对蛋白质靶的信号和特异性抗体进行评价和选择。如果可用, 纯化蛋白或靶表位可用于评估特异性;然而, 对来自模型系统的总蛋白中潜在的非特异性信号进行评估仍然很重要。
2) 下一步, 需要确定测定的动态范围。在一个理想的情况下, 信号加倍 (测量使用峰值面积) 是观察样品浓度加倍;然而, 在实际操作中, 以可预知的方式 (例如, 线性拟合) 对输入信号的比例变化足以使蛋白质定量化。此外, 这种优化将定义高信号的蛋白质浓度, 但仍然在线性范围内的实验模型。
3) 使用优化步骤2中选择的固定蛋白浓度确定最佳抗体浓度。随着抗体浓度的增加, 信号会增加直到饱和。在这种饱和水平附近的抗体浓度是需要精确测量蛋白质浓度。
该过程用于优化蛋白质浓度, 抗体稀释, 和曝光时间的自动 capillary-based 大小检测6显示使用全细胞提取物分离 BEAS-2B, SV-40 转化人支气管上皮细胞系。可以使用多个已发布的协议7,8,9来执行从单元格或组织提取物中分离出的蛋白质, 此处不包括。还报告了使用优化条件的试验结果的总和磷酸化 (丝氨酸 15, 丝氨酸 20) p53 的文化暴露于阿霉素 (一种常见的化疗药物诱导细胞凋亡10) 在 1.2, 1.8, 和2.4 µg/毫升培养基4小时前收获。将 p53 峰值区域归一化为ɑ-蛋白, 用作加载控制。
研究方案
注意: 确保所有的试剂和样品都是根据制造商和 #39 的协议编写的, 下面概述。在此过程中, 请佩戴适当的个人防护用品, 包括腈手套、实验室大衣、闭趾鞋和安全护目镜。单独提供所需的特定材料、试剂和设备的表。样品的总蛋白浓度应事先确定, 使用与所使用的裂解液相兼容的既定方法, 如布拉德福德化验 11 .
1. 从制造商提供的标准包中制备样品和试剂
- 以准备 400 mM 的糖 (数码电视) 的工作解决方案, 添加40和 #181; 去离子水的明确管含有供应商提供的库存。重要的是要避免引入气泡的解决方案, 混合的解决方案与缓慢和温和的移.
- 添加20和 #181; l 10X 示例缓冲区和20和 #181; 准备好的 400 mM 的红色显像管, 包含荧光5X 主组合 (请参阅 材料表 ).
注意: 主混合 (MM) 是由制造商密封的箔盖, 必须刺穿吸管尖端。用慢移轻轻搅拌, 避免在吸管中飞溅. - 下一步, 添加16和 #181; 去离子水, 2 和 #181; 提供10X 样品缓冲, 2 和 #181; l 的准备400毫米的解决方案, 以白色化梯管供应的制造商。轻轻混合, 并转移到0.6 毫升管变性.
- 通过用水稀释所提供的10X 解决方案1:100 来准备0.1x 示例缓冲区。准备足够的0.1x 样本缓冲器来稀释所有样品.
- 计算添加到样本中的0.1x 样本缓冲区的数量, 这将取决于最终所需的总蛋白质浓度。混合1部5x 荧光 MM 与4部分稀释样品, 以达到预期的最终蛋白质浓度。
- 按如下方式计算卷: (i) 体积5x 荧光 MM = (所需的最终蛋白质浓度)/5;(二) 蛋白质存量 = (所需的最终蛋白质浓度 x 总体积)/蛋白质浓度;(iii) 容积0.1x 样本缓冲器 = 总容积-5x 和 #160; 体积-蛋白质存量.
2。样品和梯子的变性
- 在95和 #176 中放置准备好的样品和化梯; C 热块为5分钟的涡流管, 在孵化后立即在台式离心机上执行旋转, 在冰上放置5秒.
注意: 有些蛋白质可能需要温和的变性条件 ( 例如 , 70 o C 为10分钟), 以防止蛋白质聚集和改善毛细血管基质中的迁移。如果在较高的分子量上有重涂抹, 请考虑此选项 (例如, 参见视频).
3。抗体的制备
- 由优化确定 (请参见 代表结果 和 视频 ), 准备所提供抗体的主抗体 (如 , 1:50, 1:100) 所需的稀释 (s)稀释剂 2.
注: 抗体通常用于高浓度的 capillary-based 免疫分析比传统的西方印迹。所提供的二级抗体可以不用稀释即可使用.
4。鲁米诺和过氧化物的制备
- 准备1:1 的鲁米诺和过氧化物混合物.
- 漩涡在冰上混合和储存.
注意: 这是很重要的, 这种混合物是准备新鲜的每一个实验的化验。250ul 完全混合需要运行一个完整的板块.
5。制备检测板
- 如图1所示 , 将上面的样品和试剂装入化验板。有关每行的详细说明, 请参阅。为了使油井蒸发最小化, 请确保在添加试剂时更换板盖.
- 在 A 行中, 吸管5和 #181; L 化梯子进入井 A1。对于剩余的行, 吸管准备的样品 (5 和 #181; 每) 进入油井 A2-A25.
注意: 这是当务之急, A1 井总是包含梯子, 因为第一个毛细管在墨盒是优化运行这个标准. - 在行 B 中, 吸管10和 #181; 抗体稀释剂 L 2 入每井 (B1-B25).
- 在行 C 中, 吸管10和 #181; 抗体稀释剂 L 2 成 C1。在余下的一排 C 井中, 吸管10和 #181; 主抗体 L (井 C2-C25).
- 在行 D 中, 吸管10和 #181; 亲和-HRP D1。在余下的 D 井中, 吸管10和 #181; 二次抗体 L (井 D2-D25).
- 在行 E 中, 吸管10和 #181; 新制备的鲁米诺-过氧化物混合成每井 (E1-E25).
- 最后, 添加500和 #181; 在每隔舱的每个前3排缓冲井中洗涤缓冲器.
注意: 重要的是要尽量减少气泡形成由移轻轻地和不驱逐最后的体积从尖端, 气泡可能会干扰毛细管加载和运行. - 一旦所有井都被装入, 在室温下将 1000 x g 离心到5分钟, 除去气泡, 确保液体在井底。弹出任何可见气泡与小吸管尖端或清洁针 ( 如 , 25 规范无菌和 #34; 代表顶部和 #34; 针).

图 1 。移模板的检测板. 颜色编码代表适当的试剂和样品 (多达24的总数) 添加到化验板。添加化阶梯到井 A1 (橙色), 准备好的样品从井 A2 到 A25 (淡蓝色), 抗体稀释剂2到井 B1-B25 并且 C1 (淡绿色), 主要抗体到井 C2 由 C25 (蓝色), 亲和-HRP 到好 D1 (深粉红色), 二抗体到水井 D2 高达 D25 (深绿色), 和鲁米诺混合到水井 E1 高达 E25 (紫色)。洗涤缓冲器添加到较大的刺穿井 (深蓝色) 的前三行。 请单击此处查看此图的较大版本.
6. 启动毛细管免疫分析仪
- 确保打开了该仪器和随附的计算机。不需要预热时间.
- 打开计算机上的检测软件。首先, 选择 #34; 化验和 #34; 在窗口和 #34 的右边的标签; 新的化验和 #34; 在和 #34 下; 文件菜单和 #34; 在左边。选择用于特定化验的尺寸、尺寸范围 ( 例如 、12-230 kDa) 和墨盒类型 ( 例如 、25毛细管).
注意: 你也可以输入化验参数, 包括蛋白质浓度, 抗体类型和稀释, 如果需要, 但这些不需要开始化验. - 通过按橙色面板顶部的按钮打开仪器的门.
- 小心地从其包装上卸下毛细管墨盒。不接触玻璃毛细管本身, 将墨盒放入墨盒托架。通过观察室内光线从橙色到蓝色的变化来验证墨盒的阀座.
- 将板牢牢地固定在长凳上, 并小心地剥开盘子下部的蒸发密封。弹出任何泡沫看到这些分离矩阵井与 sm所有吸管提示或清洁针 ( 例如 , 25 规范无菌和 #34; 代表顶部和 #34; 针).
- 将检测板放在板架上, 确保其完全就位, 并关闭仪器门.
- 单击软件中的 #34; 启动和 #34; 按钮.
注意: 如果未出现 "启动" 按钮, 则与仪器的连接已丢失。从左上菜单中选择 "仪器", 然后连接。用仪表序列号显示弹出窗口;选择此选项, 然后单击 "连接"。此时应显示 "开始" 按钮. - 当运行完成时, 丢弃该板。卸下墨盒并放置在锋利的容器中以供处理, 以及任何可能用于弹出气泡的针头。如果定期使用仪器 ( 例如 , 至少每周), 请保留电源以避免连接问题.
7。实验分析
- 在分析之前, 确保执行以下质量检查。
- 通过选择和 #34 来验证荧光标准; 显示标准和 #34; 图标。检查标准是否在和 #34 中正确标识; 图形视图和 #34; 选项卡。如果它们不正确, 请转到 #34; 单视图和 #34; 图标, 右键单击正确的峰值, 然后选择和 #34; 强制标准和 #34; 或右键单击不正确的峰值, 然后选择和 #34; 不是标准和 #34;对每个新毛细管执行此检查.
- 通过单击 #34 来验证化梯子; 示例和 #34; #34; 单视图和 #34; 图标。在 "实验" 选项卡中选择梯子。如果未正确识别峰值, 请右键单击并 #34; 图形视图和 #34; 选择和 #34; 删除峰值和 #34;.
注: 例如, 用于 12-230 kDa 套件的化梯应显示12、40、66、116、180和 230 kDa 和 #160; 调整峰值。如果不执行此步骤, 将不正确地计算样本峰值的大小, 产生虚假结果. - 查看和分析示例峰值。根据实验计算的需要, 从峰值表中导出数据, 包括分子量、峰值面积、峰值高度和信号噪声 (S/N).
结果
曝光时间-确定信号耗尽
当鲁米诺和过氧化物基质消耗过快时, 就会发生信号耗尽。这可以通过在不同的化学发光暴露时间检查数据来确定。在分析软件中, 转到 "编辑-#62; 分析和 #62; 图像"。曝光范围从5到480s。y-axis 在电泳报告的信号/时间, 所以每个曝光的数据应该有一个类似的信号/时间系数。如果鲁米诺逐渐耗尽, 这一系数随着 p53 DO-1 抗体 (图 2) 的出现而减少。由于基体损耗, 这种检测可以被认为是可测量的高达0.2 µg/µL 浓度只有在 5-三十年代的曝光。因此, 在这个例子中, 十五年代被确定为 p53 的最佳数据分析曝光时间。
裂解滴定法-确定线性动态范围
重要的是, 测量应采取的线性动态范围内的每一个化验, 在信号的变化, 由峰值面积的测量是成正比的变化, 蛋白质的数量在样品中。使用上一节中选择的十五年代最佳曝光时间, 对 p53 和ɑ-蛋白大于15倍的浓度范围 (图 3) 进行了线性检验。在我们的经验中, R2值和 #62; 0.9 的线性回归拟合被认为是可以接受的稀释范围的已知数量的纯化蛋白质 (如果化验是绝对定量测量) 或样本的未知目标蛋白 (如果化验是相对定量测量)。
抗体稀释的优化
使用饱和浓度的抗体有助于确保任何测量到的信号改变只因蛋白质数量的变化。作为一个示范, 两个 BEAS-2B 细胞线全细胞提取物 (0.2 µg/µL 总蛋白载入该检测), 探讨了连续稀释ɑ蛋白抗体浓度范围从 1:25-1:800 (图 4)。化学发光信号 (这里, 测量作为峰值区域) 被密谋反对抗体稀释。饱和度被观察到附近的1:50 稀释曲线开始一个引人注目的高原。
BEAS-2B 细胞的实验性试验-阿霉素治疗
使用优化的化验条件, BEAS-2B 细胞培养处理三不同浓度的阿霉素 (1.2, 1.8, 2.4 µg/毫升) 为 4 h (图 5,表 1)。通过修饰修饰激活 p53 介导的几个细胞反应, 包括细胞周期阻滞, 衰老, 和凋亡12。具体而言, 丝氨酸磷酸化15已归因于转录激活 p53, 导致凋亡后, 阿霉素治疗13。在这个演示中, ɑ-蛋白归一化的峰值区域被呈现为控制的褶皱。有趣的是, 3.5 到4倍的 p53 磷酸化在丝氨酸15和2倍增加的水平 p53 磷酸酯在丝氨酸20后观察到阿霉素 4 h 接触。这些结果表明 p53 的活化;然而, 没有剂量反应被视为浓度选择 (反之, 最低剂量测试诱发最高的反应)。在这个模型系统中, 总 p53 没有表现出明确的治疗反应。我们先前观察到 p53 磷酸化的活化作用, 在锌处理的 BEAS-2B 细胞中, 在类似的条件下, 没有增加总 p53 的水平.14。

图 2.曝光图像比较来检测信号耗尽。车道视图显示降低蛋白质浓度的 BEAS-2B 裂解探讨 p53 DO-1 抗体在1:500 稀释。化学发光信号系数, 报告为峰值高度在仪器软件, 被叠加。不同于峰值高度, 视觉波段的强度是自动生成和调整的仪器, 以帮助观看的波段, 是不可比拟的, 从一个小组到另一个。注意随着曝光时间的增加, 化学发光信号的减少, 信号开始消失 (分裂峰值) 在两个最长的曝光, 表明基底损耗。请单击此处查看此图的较大版本.

图 3.显示车道视图的裂解滴定法。在用 1:500 p53 DO-1 或1:50 ɑ-蛋白探测时, 用裂解滴定法显示车道视图(A)的 BEAS-2B 裂解液。不同于峰值区域的值, 视觉波段的强度是自动生成和调整的仪器, 以帮助观看的波段, 是不可比拟的, 从一个面板到另一个。线性回归分析 (B) 确认测试在整个范围内是线性的, 从0.01 到0.20 µg/µL 和0.025 到0.40 µg/µL, 分别为2和0.999 的 R0.985值。在线性范围中间选择了总蛋白浓度, 以适应在任一方向的潜在靶蛋白变化 (例如, 0.2 µg/µL 为α-蛋白)。请单击此处查看此图的较大版本.

图 4.α-蛋白抗体稀释曲线的两个独立的 BEAS-2B 蛋白质裂解与没有基线正常化。一个明确的减税从线性度看, 在 1:50 (0.02) 稀释, 表明饱和。因此, 1:50 被选择为这种抗体的最佳稀释。请单击此处查看此图的较大版本.
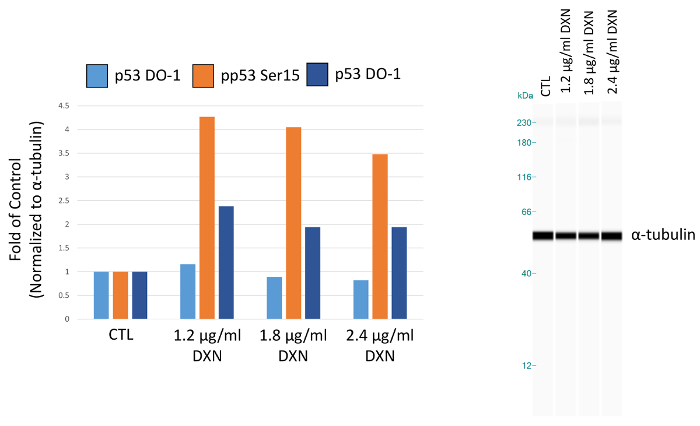
图 5。4 h 阿霉素 (德) 治疗对 BEAS-2B 细胞总和丝氨酸磷酸化 p53 蛋白表达的影响.峰值区域归一化为α-蛋白, 并绘制为控制 (CTL) 的褶皱。请单击此处查看此图的较大版本.
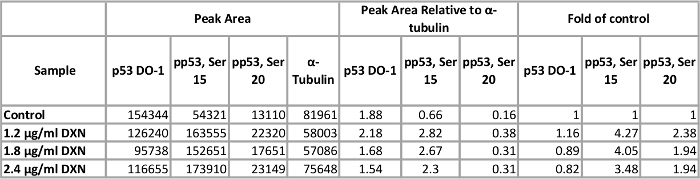
表1。4 h 阿霉素 (德) 治疗对 BEAS-2B 细胞总和丝氨酸磷酸化 p53 蛋白表达的影响.请单击此处查看此表的较大版本.
讨论
几十年来, 由于样品和试剂用量低, 与传统方法相比, 处理时间缩短, 且与自动执行过程4,15。有许多不同的协议为分离蛋白质使用了血丝, 包括电泳, 电动, 聚合物筛分和等电方法, 分离蛋白质由不同的物产 (分别,静电电荷, 隔板平衡, 筛分性能的分离矩阵, 和 pH 值)16。在这里, 我们描述一个抗体 (或免疫分析) 毛细管电泳方法, 使用聚合物筛分分离, 已自动化和商业采用的3。该系统的优点包括易于使用和操作, 标准化和商业化的试剂, 和可靠的, 敏感的测量, 需要较少的试剂和样品相比, 传统的蛋白质化验, 如西方印迹,酶联免疫分析和其他格式3,4,5。在以前对这项技术的评估中已经注意到, 可以评估的蛋白质的大小范围被可用的分离矩阵4所限制, 但是最近的产品已将可测量范围从2扩展到 440 kDa17.此外, 一些裂解物的缓冲器已知是不相容的化验18, 因此选择所使用的实验试剂必须事先考虑。
自动化程序的一个主要优点是通过标准化的方法和试剂实现结果的一致性。通过在过程中自动执行关键步骤, 从而最大限度地减少了检测失败的几率。然而, 重要的是要注意, 在议定书中必须坚持某些做法, 以尽量减少问题的毛细管 electrophoretic-based 免疫分析。首先, 至关重要的是, 在板料加载之前, 应立即制备鲁米诺/过氧化物混合物。一致的定时将导致在氧化剂添加后, 一致的发光, 这将导致对特定的抗体化验后的一致性测量。此外, 重要的是使用 non-expired 试剂, 这主要影响氧化剂的效力。此外, 必须严格遵守样品、抗体和其他试剂的装载顺序 (参见图 1)。任何试剂 pipetted 不到位将导致化验失败和浪费运行。
除了这些关键步骤外, 通过优化还可以克服与技术相关的主要问题。事实上, 这些条件是特定的每个模型系统/抗体组合, 因此应根据经验确定每一个新的化验。在本文中, 我们集中于三常见的优化程序: 曝光时间, 裂解滴定, 和初级抗体稀释。产生可测量结果的能力取决于对鲁米诺基质未迅速耗尽时的曝光时间的分析, 因为基体损耗会导致信号丢失。裂解滴定法测定每种方法的线性动态范围, 不同的模型系统, 以及不同的抗体, 即使是相同的蛋白质靶。抗体稀释选择或接近饱和浓度, 确保信号的变化不会受到缺乏的自由抗体, 但只有不同数量的可用蛋白靶位。在优化过程中的其他考虑因素可能包括抗体孵育时间和堆积/样品加载时间。在大多数情况下, 仪器的默认设置提供最佳的分辨率和灵敏度平衡。但是, 在某些情况下, 通过调整这些参数可以改善分辨率或灵敏度的低下。
毛细管 electrophoretic-based 免疫分析方法提供快速、高效和可重现的蛋白质测量。虽然这些方法主要用于研究和开发环境, 但这些技术的一致性在管理和临床应用中具有潜在的效用。例如, 对环境毒物或疾病进展患者的易感性亚群的识别可以基于可访问的矩阵 (如血液、尿液和唾液) 中所测量的蛋白质生物标记物。随着试剂和操作成本的下降以及可以同时评估的样品和靶数的增加, 我们很可能会看到用于这类应用的毛细管 electrophoretic-based 免疫分析方法。
披露声明
作者声明他们没有竞争的金融利益。这份手稿已被国家卫生和环境影响研究实验室审查并批准出版。该内容并不一定反映美国环保局的意见, 也不提及商号或商业产品构成背书或推荐使用。
致谢
作者想感谢美国环保局的研究和开发办公室-研究三角公园 (Tarpley) 图形和媒体团队的发展, 录音和编辑的教学视频的基思。我们还要感谢 ProteinSimple 的黛博拉普里切特关于优化我们的数据的有益对话.JM Guynn 得到了美国环境保护署橡树岭科学与教育研究/参与计划的支持。
材料
| Name | Company | Catalog Number | Comments |
| Wes instrument | ProteinSimple (Santa Clara, CA) | 004-600 | |
| P53 DO-1 primary antibody | Santa Cruz Biotechnology, Inc. | sc-126 | |
| phosphorylated p53 (ser 15) primary antibody | Cell Signaling Technology | 9286 | |
| phosphorylated p53 (ser 20) primary antibody | Cell Signaling Technology | 9287 | |
| alpha-tubulin primary antibody | Cell Signaling Technology | 3873 | used as a loading control |
| Compass Software | ProteinSimple (Santa Clara, CA) | provided with the Wes | |
| 12-230 kDa Master kit | ProteinSimple (Santa Clara, CA) | PS MK02 (since replaced by a new kit #) | |
| www.proteinsimple.com/consumables_sw_wes.html | INCLUDES PART NO: Wash Buffer (60 mL) 042-202 10X Sample Buffer (440 μL) 042-195 Pre-Filled Microplates (8) PS-PP01 Capillary Cartridges (8) PS-CC01 Antibody Diluent II (20 mL) 042-203 Luminol-S (1.5 mL) 042-233 Peroxide (1.5 mL) 042-234 Streptavidin-HRP (132 μL) 042-414 Standard Pack (8): Biotinylated ladder, fluorescent 5X master mix, DTT, and empty 0.6 mL tube PS-ST01 Anti-Rabbit Secondary Antibody 042-206 or Anti-Mouse Secondary Antibody 042-205 | ||
| Name | Company | Catalog Number | Comments |
| Cell culture, treatment, and harvest (using vendor recommended protocols; protocols not included in manuscript) | |||
| BEAS-2B cells | American Type Culture Collection (ATCC, Manassas, VA) | CRL-9609 | |
| keratinocyte growth medium, KGM Gold | Lonza Ltd (Basel, Switzerland) | 192152 | for cell culture |
| keratinocyte basal medium, KBM Gold | Lonza Ltd (Basel, Switzerland) | 192151 | serum free medium for chemical dosing |
| doxorubicin | Sigma-Aldrich (St. Louis, MO) | D1515 | |
| Coomassie Blue Bradford Assays | ThermoFisher Scientific (Waltham, MA) | 23200 | for protein quantification |
| Nuclear Extract kit | Active Motif (Carlsbad, CA) | D1515 | used to prepare whole cell lysates |
| INCLUDES: | |||
| Lysis Buffer AM1 | |||
| 1M dithiothreitol (DTT) | |||
| Protease Inhibitor Cocktail | |||
| 10X PBS | |||
| Phosphatase Inhibitors |
参考文献
- Bradley, H. L., Sabnis, H., Pritchett, D., Bunting, K. D. . Hematopoietic stem cell protocols. 1185, (2014).
- Guo, L., Eldridge, S., Furniss, M., Mussio, J., Davis, M. Use of Human Induced Pluripotent Stem Cell-Derived Cardiomyocytes (hiPSC-CMs) to Monitor Compound Effects on Cardiac Myocyte Signaling Pathways. Curr Protoc Chem Biol. 7 (3), 141-185 (2015).
- Chen, J. Q., et al. Absolute quantitation of endogenous proteins with precision and accuracy using a capillary Western system. Anal Biochem. 442 (1), 97-103 (2013).
- Chen, J. Q., Wakefield, L. M., Goldstein, D. J. Capillary nano-immunoassays: advancing quantitative proteomics analysis, biomarker assessment, and molecular diagnostics. J Transl Med. 13, 182 (2015).
- Liu, S., et al. The Application of a Novel Nanovolume Capillary Electrophoresis- Based Protein Analysis System in Personalized & Translational Medicine Research. J Bioanal Biomed. S3 (004), (2013).
- ProteinSimple Western. . Size Assay Development Guide, Revision 1. , (2014).
- Eaton, S. L., et al. A guide to modern quantitative fluorescent western blotting with troubleshooting strategies. J Vis Exp. (93), (2014).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Silva, J. M., McMahon, M. The fastest Western in town: a contemporary twist on the classic Western blot analysis. J Vis Exp. (84), e51149 (2014).
- Thorn, C. F., et al. Doxorubicin pathways: pharmacodynamics and adverse effects. Pharmacogenet Genomics. 21 (7), 440-446 (2011).
- Ernst, O., Zor, T. Linearization of the bradford protein assay. J Vis Exp. (38), (2010).
- Taira, N., Yoshida, K. Post-translational modifications of p53 tumor suppressor: determinants of its functional targets. Histol Histopathol. 27 (4), 437-443 (2012).
- Thompson, T., et al. Phosphorylation of p53 on key serines is dispensable for transcriptional activation and apoptosis. J Biol Chem. 279 (51), 53015-53022 (2004).
- Currier, J. M., Cheng, W. Y., Menendez, D., Conolly, R., Chorley, B. N. Developing a Gene Biomarker at the Tipping Point of Adaptive and Adverse Responses in Human Bronchial Epithelial Cells. PLoS One. 11 (5), e0155875 (2016).
- Moser, A. C., Hage, D. S. Capillary electrophoresis-based immunoassays: principles and quantitative applications. Electrophoresis. 29 (16), 3279-3295 (2008).
- Shintani, H. . Handbook of Capillary Electrophoresis Applications. , (1997).
- . Wes reagents and consumables :: ProteinSimple Available from: https://www.proteinsimple.com/consumables_sw_wes.html (2017)
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。