需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
大鼠舌的机械和粘弹性的体内评估
摘要
我们描述了麻醉大鼠模型中用于确定舌头的肌肉紧张度和粘弹性质的外科手术。该程序涉及舌下神经的特异性刺激,并将被动的李萨如力/变形曲线应用于肌肉。
摘要
舌头是大多数脊椎动物口腔地板上高度支配和血管化的肌肉液压稳定器。其主要功能包括支持咀嚼和吞咽,以及味觉和语音学。因此,舌头的强度和体积可以影响脊椎动物完成基本活动,如喂养,沟通和呼吸的能力。具有睡眠呼吸暂停的人类患者具有扩大的舌头,其特征在于肌肉紧张度降低和肌肉内脂肪增加,可通过磁共振成像(MRI)进行可视化和定量。测量舌的力产生和粘弹性的能力构成了获取与成像数据相关的功能信息的重要工具。在这里,我们提出了通过电刺激舌下神经测量麻醉Zucker大鼠舌力产生的技术,并确定粘弹性性质通过施加被动的李萨如力/变形曲线来解释舌头。
引言
舌头为咀嚼,吞咽,味觉和口语提供了重要的支持。外在和内在的肌肉组织的存在,具有明显的神经支配和解剖/功能,解释了这种肌肉液压稳定器的独特性。成像技术的最新进展提供了其复杂解剖学1的更详细的观点。舌头功能减退,舌萎缩,吞咽困难和言语障碍也是肌病情况的常见表现,如帕金森病2 ,肌萎缩性侧索硬化(ALS) 3 ,肌强直性营养不良(MD) 4等肌病。
与常见疾病相关的肌肉组成的变化影响舌头的机械和粘弹性质。例如,舌力的功能分析揭示了与衰老相关的收缩性质的变化ss ="xref"> 5,6 ,缺氧7,8和肥胖9,10 。在肌营养不良的情况下,增加的纤维化导致更高的肌肉僵硬度,这意味着当应用李萨如变形方案时,对变形的依从性降低11 。相反,肌肉脂肪含量的变化,如在肥胖患者中记录的那样,改变了骨骼肌13,14的代谢12和机械性质,并预测会增加肌肉对变形的依从性。增加的舌头脂肪也与人类17阻塞性睡眠呼吸暂停(OSA)的发展相关,通过增加舌体积到部分上呼吸道闭塞点(呼吸暂停) 15,16 。辛肥胖的Zucker大鼠10中已经记录了舌头脂肪浸润,这表明这种模型是研究脂肪浸润对舌头生理的影响的有价值的工具。
测量舌力需要精细的手术技术来分离和双向刺激舌下神经17,18 。之前已经在大鼠5,17,19,20 ,兔21和人22,23中描述了这样的技术,但对研究者有有限的视觉辅助。由于其高度的技术性质,详细协议的可用性将显着提高该技术的可访问性和可重复性。我们的实验范例的目标是生病ustrate一种有效和可靠的技术测量大鼠模型中舌头的强度和粘弹性。为了达到这个目的,大鼠被麻醉,舌下神经被暴露,气管插管,以确保自由进入动物的舌头。缝合环然后将舌头的尖端连接到能够控制力和长度的力传感器,而两个双极钩电极刺激舌下神经以引起舌头的收缩。在力测量完成后,力传感器的长度控制能力用于根据具有固定振幅(Lissajous曲线)的正弦波协议,持续时间和频率快速改变舌头的长度,从而允许推导其粘弹性11,24。协议将指导调查员通过解剖步骤,动物在实验平台上的定位rm,放置电极,最后到力和粘弹性数据的获取和分析。
研究方案
包括动物受试者在内的所有手术均已获得宾夕法尼亚大学机构动物护理和使用委员会(IACUC)的批准(协议号805822)。所述方法是终端,不需要使用无菌条件或药用级产品。
手术程序
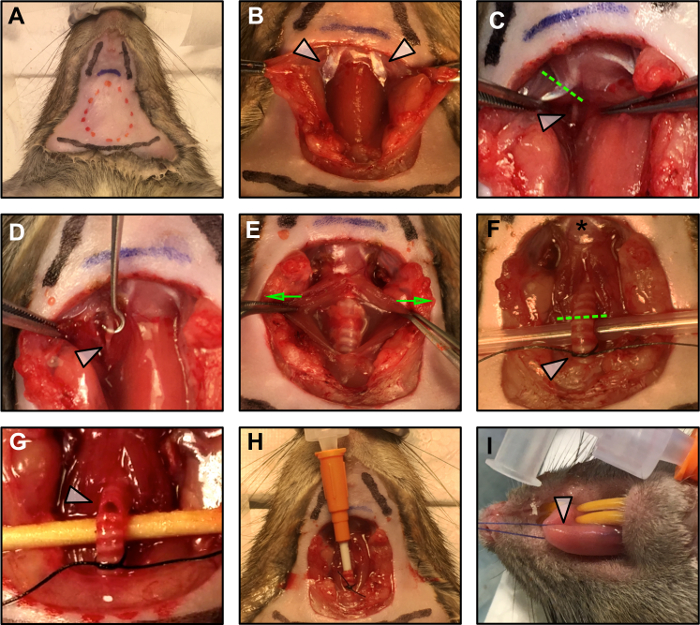
图1:外科手术。
(一)手术计划划定。红色虚线表示切口的面积。两条黑线表示颌骨的位置,而底部的黑线标记胸部的位置。蓝线表示舌骨。 (B)脂肪组织平滑解剖后,腹股沟肌肉后腹部(箭头)的暴露,舌下和下凸腺腺(C)切除二腹肌后腹部(虚线),露出舌下神经(白箭)。 (D)舌下神经(白色箭头)从周围筋膜清除。 (E)通过轻轻地将平滑肌分开,气管暴露(绿色箭头表示施加的力的方向),并抬起(F)以准备插管。星星表示舌头插入舌骨。绿色虚线表示插管切口。白色箭头表示插入时准备将套管固定到位的松散结。 (G)切开气管插管。 (H)将气管插管插入并用方形结固定在适当位置。 (一)将缝合线应用于舌头。target ="_ blank">请点击此处查看此图的较大版本。
- 麻醉和手术准备
- 将大鼠置于诱导室中,用4%异氟烷麻醉。
- 将动物仰卧在热源上,并保持麻醉剂中含有1-3%异氟烷的麻醉剂,确保呼吸频率至少为每分钟70次呼吸。
- 用减速器和脱毛霜剃掉颈部区域。使用脱毛霜时,用棉花贴布膏涂抹奶油,直到皮毛被去除。长时间接触脱毛膏可能会刺激皮肤。
- 用70%酒精清洁手术区域( 图1A )。
- 在进行初始切口之前,检查动物的呼吸模式和反射(缺少脚趾反射)。连续监测和评估麻醉深度至关重要线呼吸频率和每10分钟反射不足);在整个手术过程中,动物需要在深层次的麻醉手术平面下进行。
- 幽灵神经识别
- 通过切割和去除皮肤,用一对手术剪刀打开手术区域, 如图1A中的红点线所示 。
- 通过任何脂肪组织,舌下和下颌腺和气管周围的肌肉层进行钝性解剖。
注意:在解剖期间保守。尽可能使用钝性解剖,小心不要损伤脖子的血管。 - 识别气管侧面的双腹肌(PD)的后腹部( 图1B-白色箭头)。舌下神经在这肌肉下运行( 图1C-白色箭头)。用电烙术切除PD prox舌头到舌骨( 图1C-虚线)。
注意:不要让神经或周围的组织变干。在神经上加一滴矿物油保护。为了避免由于来自电极的刺激的场传播引起的肌肉收缩,请仔细地灼伤神经周围可能接触部位的肌肉组织。 - 使用一对精细镊子,从周围筋膜剖切舌下神经。在钩子的帮助下,确保至少3毫米的神经可用于连接双极电极( 图1D )。
- 使用微型止血钳,尽可能地将舌下神经远离舌骨( 图1D-白色箭头),以避免刺激反向蔓延。用微型止血钳施加压力5秒钟,压碎神经。当止血钳抓住神经,一个短暂的t女巫在舌头的底部应该是可见的。
- 对另一方重复该过程。
- 气管插管
- 通过平滑解剖轻轻分离周围平滑肌,暴露气管( 图1E - 如绿色箭头所示)。
注意:保守,优先使用钝性剥离。比较插管的直径与气管的直径。插管应正确配合在气管中,并应在缝合后保持稳定的插入,如步骤1.3.2至1.3.5所述。 - 使用一条缝合镊子轻轻抬起气管,并在其下方穿过4-0缝合线,靠近胸部。从喉部( 图1F - 白色箭头)绑扎第6和第7环之间的初始松散结。一旦插入插管以便将其固定就位,该结将被关闭。
- 滑动a的杆移植移液管(用矿物油润滑移液器以方便插入),将其提起并提升插管(IV 14 gx 3.25"插管)。
- 从喉部切开第4和第5个环之间的小切口( 图1G-白色箭头)。在第一次切口后,开口将趋于扩张,因此在进行初始切割时要保守,以避免完全切除气管。
注意:在进行气管切开之前,请确保插管准备就绪,然后进行麻醉。 - 通过插管开始麻醉管理,并将其轻轻插入切口,轻轻推入气管内约5圈的长度。使用缝合线将套管固定到适当位置,以形成气密密封( 图1H )。
注意:确保没有液体进入有缺口的气管,以避免充血ocation。气管切开后,动物会呼吸室内空气。因此,重要的是快速插入插管,使得维持麻醉的输送。当/如果移动动物,请监测插管在气管中的正确位置。 - 轻轻地从鼻锥上取下动物。
注意:使用注射麻醉剂代替异氟烷可以通过消除对气管插管的需要和从多余管道清除实验工作空间来简化手术。
- 通过平滑解剖轻轻分离周围平滑肌,暴露气管( 图1E - 如绿色箭头所示)。
- 舌缝合
- 在PBS中浸泡20厘米长的5/0缝合线(我们建议丝绸,黑色编织)。
- 在握住大鼠的嘴巴的同时,用缝合镊子轻轻握住舌尖。
- 通过舌头通过缝线( 图1I - 白色箭头)注意保持舌头湿润盐水以避免潜在的组织损伤。
- 连接大约4厘米宽的环(直径可以根据动物和力传感器之间的距离而改变)。
注意:确保缝合线和舌头是湿的,以方便插入,并避免组织不必要的损伤。
2.实验设置
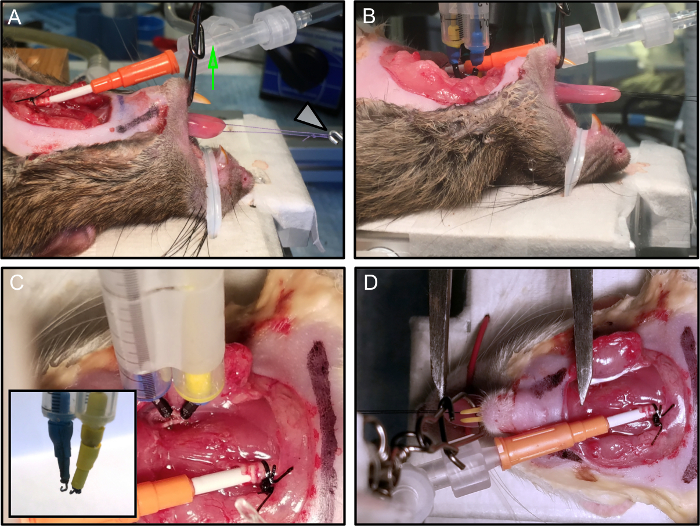
图2:定位和保护动物。
(A)鼠标位于实验平台上。钳口被固定,并且通过施加垂直张力(绿色箭头)保持开口。缝合线连接到力传感器(白色箭头)。 (B)连接电极。 (C)安装在显微操纵器上的每个电极稳定地连接到神经。嵌体显示t的终止他钩电极。 (D)舌头的最佳长度用游标卡尺测量,从舌骨水平插入到舌尖。在该图中,为了清楚,除去电极。 请点击此处查看此图的较大版本。
注意:将动物仰卧位置放置在设备的加热托盘上,使用以下固定措施,以避免在实验过程中移动。
- 将大鼠的鼻子用直接连接到加热平台的塑料涂层的金属扭结线固定在托盘上( 图2A , 2B )。
- 通过施加垂直张力来保持大鼠的嘴巴张开(使用3路旋转连接到9公斤测试单丝线并用相机棒固定)( 图2A - 绿色箭头)。
注意:稳定大鼠的另一种方法是使用啮齿动物口腔或其定制修饰。口腔保持开放和稳定是必要的,以避免颈部的运动,这可能影响测量的质量。 - 将缝合线连接到力传感器( 图2A - 白色箭头)。
- 使用手术胶带,固定大鼠的肢体和腹部以限制刺激期间的运动。
- 将两个刺激钩双极电极应用于解剖的舌下神经,向近端挤压部位( 图2C )。
- 使用由一对手术级钢29号针电极定制的刺激性双极电极,使用塑料支撑体彼此距离2mm彼此保持在一起(这里,我们使用两个1-mL血清移液管贴在一起)。
- 将针电极的尖端弯曲成钩形足够小以形成与神经(〜1mm直径)的稳定接触( 图2C-嵌体)。
- 将每个电极的两根电线连接到带有香蕉插座x BNC插孔的可堆叠双重连接柱,然后使用BNC分配器连接到原位肌肉测试系统(表3)的刺激器模块。
注意:确保动物稳定,颈部和舌头与力传感器杆对齐。继续监测呼吸频率,并确保约束不会干扰呼吸。
3.最佳长度(L 0 )和最大等距力测定
- 逐渐调整舌头的长度,并应用等长抽搐刺激,直到获得最大的力。
- 将L 0定义为等长抽搐力( 表1 )最大的长度,并记录后续归一化力量测量,因为每个动物的变化。使用游标卡尺测量从舌骨水平插入到舌尖的舌长度( 图2D )。
注意:电极的正确定位对于确保与神经的最佳接触至关重要。分别在刺激两个神经中的一个或两者时,最佳定位应该发挥类似的和相加的力。
- 将L 0定义为等长抽搐力( 表1 )最大的长度,并记录后续归一化力量测量,因为每个动物的变化。使用游标卡尺测量从舌骨水平插入到舌尖的舌长度( 图2D )。
- 在开始实验之前,将两个电极连接到刺激器,并进行一次试验强直性刺激( 表1 )。在收缩期间,监视动物以确保位置稳定,并检查颈部肌肉不必要的可见收缩。
- 通过强奸刺激20秒后应用抽搐来测量等距力。重复刺激3次,允许在刺激周期之间恢复4分钟(一个周期包括一个抽搐和打开e破伤风刺激),并记录最大的抽搐和强直力。
- 在收缩期间应用几滴PBS,始终保持舌头湿润。
注意:如果颈部肌肉收缩,请小心地更换电极的位置,使其不会碰到任何周围的肌肉组织,如果需要,可以对与电极接触的组织进行烧灼。
粘弹性特性测定(Lissajous曲线)
- 允许舌头在等距力测定后休息3 - 5分钟。执行从L 0开始的Lissajous曲线,因此动物和力传感器的位置不应该改变。
- 在不刺激舌下神经的情况下,随着位移(d)增加被动伸展周期( 表2 ), 即 5,10,15,20,25,30,35,40,50%的L 0 (更高的幅度可能需要双重的模式控制器r偏移值比305C-LR)。例如,40%L 0的振幅将导致舌头从+ 20%L 0变形到-20%L 0 。
- 在每个周期中使用固定的2 Hz正弦频率,重复10次,每个周期的持续时间为5 s。过去已经使用正弦频率的变化,如膜片24等组织,可以采用修改实验方案。
- 在每个周期之间允许30秒,并确保在整个过程中舌头湿润。
注意:在加入几滴PBS的过程中,保持舌头湿润。确保在拉伸期间保持夹爪的约束保持稳定就位,特别是当位移达到40%以上时。
- 实验完成后,动物仍然处于深层麻醉手术平台,根据经批准的IACUC动物保护安乐死动物ocol。解剖舌头进行进一步加工( 即冷冻切片或储存用于生化分析)。
结果
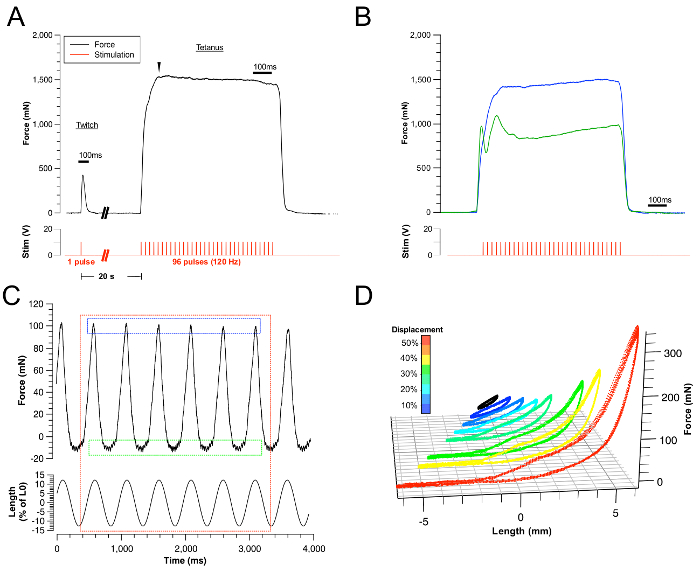
图3:代表性成果。
(A)成功的抽搐和强直性力量痕迹的例子。相应的刺激由红色迹线表示。 (B)由于亚最大收缩(蓝色痕迹)和颈部肌肉的间接刺激而导致的不成功的舌头强直性收缩的实例。可以通过重新定位刺激电极或避免电极终端和周围肌肉组织之间的接触?...
讨论
舌质代谢和/或组成的变化, 例如由肥胖引起的舌头脂肪浸润,预计会导致我们的方案评估参数的量化变化。舌力的量化是非常有意义的,因为突出和侵袭性活动之间的不平衡或整体舌头衰弱可能导致上呼吸道15的闭塞。旨在增加舌强度的运动技术已经成功应用于大鼠25,26 ,也在人体27,28,29中 ,其中它们有效地降低了睡眠呼吸暂?...
披露声明
作者没有什么可以披露的。
致谢
这项调查得到了两个国家卫生研究院的支持:HL089447("肥胖与OSA:了解舌头脂肪和代谢功能的重要性")和HL094307("了解肥胖与舌头脂肪之间的关系")
材料
| Name | Company | Catalog Number | Comments |
| SurgiSuite (heated Surgical tray) | Kent Scientific | SurgiSuite-LG | Includes heated platform |
| LED Lighting and Magnification Kit | Kent Scientific | SURGI- 5003 | |
| RC2 Rodent Circuit Controller | VetEquip | 922100 | |
| Isoflurane | Butler Schein Animal Health Supply | 29405 | |
| Alcohol Prep | Webcol | 6818 | |
| Cotton-tipped applicators | MediChoice | WOD1002 | |
| Hair clipper | Conair | ||
| Hair remover lotion | Nair | ||
| Medical tape | Transpore | 3M | |
| D-PBS | Corning | 21-030-CM | |
| Operating Scissors | World Precision Instruments | 503717-12 | |
| Hemostatic Forceps | Merit | 97-458 | Any tissue forceps can be used instead |
| Microdissecting Forceps, Angled, Serrated, 10.2 cm, SS | World Precision Instruments | 504479 | |
| Suture Tying Forceps | Fine Science Tools | 18025-10 | |
| Blunt Micro Hook | Fine Science Tools | 10062-12 | |
| Microhemostat | Fine Science Tools | 12075-14 | |
| Thermal cautery | WPI | 501292 | Disposable cauteries are available at lower cost |
| IV 14g x 3.25" cannula | BD | B-D382268H | For tracheal cannulation |
| Braided silk non-absorbable suture size 4-0 | Harvard Apparatus | SP104 | For stabilization of the tracheal cannula |
| Braided non-absorbable silk 5/0 suture | Surgik LC, USA | ESILRC15387550 | For suturing the tongue |
| Plastic-coated metal twist-tie (or electrical wire) | For securing the rat's nose to the platform | ||
| Camera stick | |||
| 3 way-swivel and Trilene 9 Kg test monofilament line | Berkley | For securing the jaw and maintaining the mouth open | |
| Camera stick with adjustable angle | For supporting the 3 way-swivel and maintaining the mouth open. | ||
| in situ Muscle Test System | Aurora Scientific | 809C | This system is designed for mice and was modified by extending the platform. Alternatively the rat-specific 806D system can be used. |
| Dual-Mode Muscle lever (force transducer) | Aurora Scientific | 305C-LR | 309C offers higher excursion capabilities than 305C-LR. Link for more information and specifications: http://aurorascientific.com/products/muscle-physiology/dual-mode-muscle-levers/ |
| Needle Electrodes (surgical steel, 29 gauge) | AD Instruments | MLA1204 | 300C is recommended for use in mice. |
| Magnetic Stands | World Precision Instruments | M10 | Used for making the bipolar stimulating hook electrodes |
| Kite Manual Micromanipulator | World Precision Instruments | KITE-R and KITE-L | Require a steel plate |
| Stackable Double Binding Post with Banana Jack x BNC Jack | McMaster Carr | 6704K13 | |
| Carbon fiber composites digital caliper | VWR | 36934-152 |
参考文献
- Sanders, I., Mu, L. A three-dimensional atlas of human tongue muscles. Anat Rec (Hoboken). 296 (7), 1102-1114 (2013).
- Ciucci, M. R., et al. Tongue force and timing deficits in a rat model of Parkinson disease. Behav Brain Res. 222 (2), 315-320 (2011).
- Easterling, C., Antinoja, J., Cashin, S., Barkhaus, P. E. Changes in tongue pressure, pulmonary function, and salivary flow in patients with amyotrophic lateral sclerosis. Dysphagia. 28 (2), 217-225 (2013).
- Wang, Z. J., Huang, X. S. Images in clinical medicine. Myotonia of the tongue. N Engl J Med. 365 (15), e32 (2011).
- Ota, F., Connor, N. P., Konopacki, R. Alterations in contractile properties of tongue muscles in old rats. Ann Otol Rhinol Laryngol. 114 (10), 799-803 (2005).
- Schwarz, E. C., Thompson, J. M., Connor, N. P., Behan, M. The Effects of Aging on Hypoglossal Motoneurons in Rats. Dysphagia. 24 (1), 40 (2008).
- Pae, E. -. K., Wu, J., Nguyen, D., Monti, R., Harper, R. M. Geniohyoid muscle properties and myosin heavy chain composition are altered after short-term intermittent hypoxic exposure. J Appl Physiol. 98 (3), 889-894 (2005).
- Fuller, D. D., Fregosi, R. F. Fatiguing contractions of tongue protrudor and retractor muscles: influence of systemic hypoxia. J Appl Physiol. 88 (6), 2123-2130 (2000).
- Ray, A. D., Farkas, G. A., Pendergast, D. R. In-situ mechanical characteristics of the tongue are not altered in the obese Zucker rat. Sleep. 32 (7), 957 (2009).
- Brennick, M. J., et al. Tongue fat infiltration in obese versus lean Zucker rats. Sleep. 37 (6), 1095-1102 (2014).
- Stedman, H. H., Sweeney, H. L., Shrager, J. B., Maguire, H. C., Panettieri, R. A., Petrof, B., Narusawa, M., Leferovich, J. M., Sladky, J. T., Kelly, A. M. The mdx mouse diaphragm reproduces the degenerative changes of Duchenne muscular dystrophy. Nature. 352 (6335), 536-539 (1991).
- Goodpaster, B. H., Wolf, D. Skeletal muscle lipid accumulation in obesity, insulin resistance, and type 2 diabetes. Pediatr Diabetes. 5 (4), 219-226 (2004).
- Loro, E., et al. IL-15Rα is a determinant of muscle fuel utilization, and its loss protects against obesity. Am J Physiol Regul Integr Comp Physiol. 309 (8), R835-R844 (2015).
- Rahemi, H., Nigam, N., Wakeling, J. M. The effect of intramuscular fat on skeletal muscle mechanics: implications for the elderly and obese. J R Soc Interface. 12 (109), 20150365 (2015).
- Kim, A. M., et al. Tongue fat and its relationship to obstructive sleep apnea. Sleep. 37 (10), 1639-1648 (2014).
- Kim, A. M., et al. Metabolic activity of the tongue in obstructive sleep apnea. A novel application of FDG positron emission tomography imaging. Am J Respir Crit Care Med. 189 (11), 1416-1425 (2014).
- Gilliam, E. E., Goldberg, S. J. Contractile properties of the tongue muscles: effects of hypoglossal nerve and extracellular motoneuron stimulation in rat. J Neurophysiol. 74 (2), 547-555 (1995).
- Sokoloff, A. J. Localization and contractile properties of intrinsic longitudinal motor units of the rat tongue. J Neurophysiol. 84 (2), 827-835 (2000).
- Becker, B. J., Russell, J. A., Connor, N. P. Effects of aging on evoked retrusive tongue actions. Arch Oral Biol. 60 (6), 966-971 (2015).
- Connor, N. P., et al. Tongue muscle plasticity following hypoglossal nerve stimulation in aged rats. Muscle Nerve. 47 (2), 230-240 (2013).
- Seo, J., et al. Nerve cuff electrode using embedded magnets and its application to hypoglossal nerve stimulation. J Neural Eng. 13 (6), 066014 (2016).
- Friedman, M., et al. Targeted hypoglossal nerve stimulation for the treatment of obstructive sleep apnea: Six-month results. Laryngoscope. 126 (11), 2618-2623 (2016).
- Heiser, C., Maurer, J. T., Steffen, A. Functional outcome of tongue motions with selective hypoglossal nerve stimulation in patients with obstructive sleep apnea. Sleep Breath. 20 (2), 553-560 (2016).
- Syme, D. A. Passive viscoelastic work of isolated rat, Rattus norvegicus, diaphragm muscle. J Physiol. 424, 301-315 (1990).
- Connor, N. P., et al. Effect of tongue exercise on protrusive force and muscle fiber area in aging rats. J Speech Lang Hear Res. 52 (3), 732-744 (2009).
- Schaser, A. J., Stang, K., Connor, N. P., Behan, M. The effect of age and tongue exercise on BDNF and TrkB in the hypoglossal nucleus of rats. Behav Brain Res. 226 (1), 235-241 (2012).
- Puhan, M. A., et al. Didgeridoo playing as alternative treatment for obstructive sleep apnea syndrome: randomised controlled trial. BMJ. 332 (7536), 266-270 (2006).
- Guimarães, K. C., Drager, L. F., Genta, P. R., Marcondes, B. F., Lorenzi-Filho, G. Effects of oropharyngeal exercises on patients with moderate obstructive sleep apnea syndrome. Am J Respir Crit Care Med. 179 (10), 962-966 (2009).
- Ueda, H., Almeida, F. R., Chen, H., Lowe, A. A. Effect of 2 jaw exercises on occlusal function in patients with obstructive sleep apnea during oral appliance therapy: a randomized controlled trial. Am J Orthod Dentofacial Orthop. 135 (4), 430 (2009).
- Strollo, P. J., et al. Upper-airway stimulation for obstructive sleep apnea. N Engl J Med. 370 (2), 139-149 (2014).
- Perrier, P., Payan, Y., Zandipour, M., Perkell, J. Influences of tongue biomechanics on speech movements during the production of velar stop consonants: A modeling study. J Acoust Soc Am. 114 (3), 1582-1599 (2003).
- Connor, N. P., et al. Tongue muscle plasticity following hypoglossal nerve stimulation in aged rats. Muscle & nerve. 47 (2), 230-240 (2013).
- Brady, J. P., et al. AlphaB-crystallin in lens development and muscle integrity: a gene knockout approach. Invest Ophthalmol Vis Sci. 42 (12), 2924-2934 (2001).
- Spassov, A., et al. Differential expression of myosin heavy chain isoforms in the masticatory muscles of dystrophin-deficient mice. Eur J Orthod. , ciq113 (2010).
- Lever, T. E., et al. Videofluoroscopic Validation of a Translational Murine Model of Presbyphagia. Dysphagia. 30 (3), 328-342 (2015).
- Gantois, I., et al. Ablation of D1 dopamine receptor-expressing cells generates mice with seizures, dystonia, hyperactivity, and impaired oral behavior. Proc Natl Acad Sci. 104 (10), 4182-4187 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。