需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
高脂膳食喂养和高通量三测定在果蝇中的含量
摘要
这是一个高脂肪饮食喂养协议, 以诱发肥胖在果蝇, 一个模型, 了解的基本分子机制牵连脂。它还提供了一种高通量三测定方法, 用于测量在各种饮食、环境、遗传或生理条件下的果蝇中的脂肪积累和潜在的其他 (昆虫) 模型。
摘要
心脏病是全世界人类死亡的头号原因。许多研究表明, 肥胖与人类心脏功能失调之间有密切的联系, 但是需要更多的工具和研究来更好地阐明所涉及的机制。一个多世纪以来, 基因高度驯服的果蝇模型在发现重要基因和分子通路方面起到了很大的作用, 证明它们在物种中是高度保守的。许多生物过程和疾病机制在功能上被保存在飞行中, 如发育 (如, 身体计划, 心脏), 癌症和神经退行性疾病。最近, 关于肥胖和继发性疾病的研究, 如模型生物体中的心脏病, 在确定参与人体代谢综合征的关键调控因子方面发挥了极为关键的作用。
在这里, 我们建议使用这种模式的有机体作为一个有效的工具, 以诱导肥胖,即, 过度脂肪积累, 并制定一个有效的协议, 以监测脂肪含量的形式, 标记积累。除了高度保守的, 但不太复杂的基因组, 苍蝇也有短寿命的快速试验, 结合 cost-effectiveness。本文提供了一个详细的协议为高脂肪饮食 (风) 喂养在果蝇诱导肥胖和高通量三 (标签) 测定的相关增加脂肪含量, 目的是高度重现性和有效的 large-scale 基因或化学筛选。这些协议提供了新的机会来有效地调查肥胖所涉及的监管机制, 并为药物发现研究提供一个标准化的平台, 用于快速测试候选药物对发展或预防肥胖、糖尿病及相关代谢疾病。
引言
在这个时代, 肥胖及其相关的经济负担是一个世界性的问题1。每三美国人中就有两个超重或肥胖与相关的心脏疾病, 在成年人口的主要死因2。需要采用新的有效方法来充分研究代谢综合征的遗传和分子成分, 并利用模型生物体进行调控。因此, 我们选择果蝇果蝇模型, 因为它与哺乳动物共享最基本的生物过程, 包括老鼠和人类3,4,5,6。在进化过程中,果蝇的基因组是高度保守的, 但总体上要小得多, 基因重复性和代谢复杂度更低, 这使得它非常适合理解许多人类疾病所牵连的基本机制4,7,8. 另外, 由脂肪组织、肠道和胰腺所进行的特征过程在苍蝇中代表, 并在葡萄糖和脂代谢中调解调节功能, 例如, 与人相似9, 10,11。此外, 在人类控制肥胖, 胰岛素抵抗和糖尿病的基本分子通路在果蝇12,13,14中的功能保存,15,16. 象更高的有机体,果蝇有跳动的心脏在发展期间由相似的过程形成对那哺乳动物心脏3,17。因此, 开发一个可靠的风喂养协议和高通量标签化验, 适应有效的筛选目的使用的遗传工具盒的果蝇, 提供了一个重要的手段来研究和理解的基本遗传基础潜在的复杂代谢疾病。
风食品本身是由标准的实验室飞行食品补充椰子油, 其中主要是组成的饱和脂肪酸已知与代谢综合征18。当在哺乳动物模型中诱发肥胖, 例如啮齿目动物, 可能需要月19,20, 我们的优化风喂养协议在果蝇有效和性增加个体脂肪含量的问题天12,14。该协议, 与高通量标记化验, 允许有效的大规模筛选的影响, 遗传因素, 环境影响和药物候选者发现新的调节脂肪代谢。因此, 这些协议可能与理解和/或对抗肥胖和肥胖相关的人类病症有关。
该喂养方案具有通用性, 可用于研究单饱和脂肪酸和不饱和脂肪酸的代谢和功能作用。使用此高通量标签检测不仅限于黑腹果蝇, 而且可以适应各种具有角质层或硬细胞外基质的小模型生物体 (如如、其他果蝇种、线虫和其他新兴的无脊椎动物模型有机体) 在不同的环境、遗传或生理条件下测量脂肪含量, 在发育的任何阶段, 成年或代谢疾病的阶段。标签法是基于比色测量的一系列酶反应, 将标签降解成游离脂肪酸, 甘油, 甘油 3-磷酸盐和最后的 H2O2 , 反应与 4-基安 (4--和 35-dichloro-2-hydroxybenzene 磺酸 (35 地区) 生产一种用 96-井分光光度计测量的红色产品。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 风喂养协议
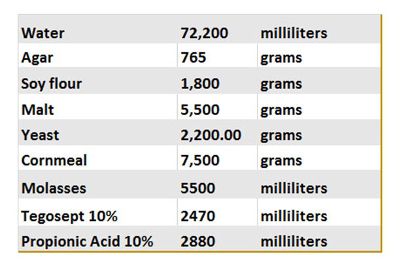
表1。飞行食品食谱.
这张桌子总结了不同的配料用来准备我们的控制食品。一旦制成, 10 毫升的食物被倒入瓶, 冷却和储存在4和 #176; C 用于长期存储.
- 风准备
- 以制作1公斤高脂肪食品, 称700克预制正常飞行食品 (见 表 1 ) 和300克椰子油, 使用分析天平放入两个单独的容器中.
- 在微波炉中单独加热每个容器, 直到内容完全融化。将椰子油倒入苍蝇食品容器中。用搅拌器搅拌, 直到油和苍蝇的食物混合好.
注意: 没有大块的食物或油应该是可见的。当苍蝇的食物在微波炉里融化时, 每隔1分钟停止, 混合食物, 防止沸腾. - 重新称量高脂肪食物。如果总重量小于1公斤 (700 克食物 + 300 克椰子油), 加水 (大约10毫升), 以补偿在加热过程中的蒸发, 并带回重量1公斤.
- 每瓶倒入约10毫升混合高脂肪食物 (约25% 瓶体积)。其次, 用棉布覆盖, 防止苍蝇和 #39; 污染。在室温下冷却1小时, 然后将小瓶转移到4和 #176; C 存储4周.
注意: 正常食物 (NF) 被用作控制食品。也倒入10毫升 (约25% 瓶体积) 的 NF 每瓶。对于风食品, 用椰子油取代30% 的 NF 食品。对于控制和实验条件, 苍蝇得到相同数量的 NF 和风 (每瓶10毫升的食物).
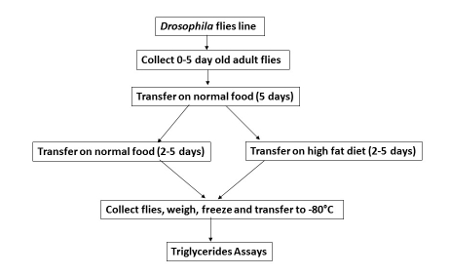
图 1 。风在 果蝇 中喂养.
计划显示不同的哺养的步为苍蝇在控制食物 (正常饮食没有加法椰子油-NF) 或风 (与椰子油的加法)。整个过程需要10天后, 最初收集成人苍蝇。 请单击此处查看此图的较大版本.
- 风喂养的 D. 腹中的风 注意: 该协议包括与任何飞线兼容的控制食物和喂养程序。控制和实验苍蝇放在含有相同数量食物的小瓶中 (NF 或风)。
- 使用 CO 2 来麻醉苍蝇.
注: 对于新手, 请阅读参考 21 , 以了解有关引发和处理 四腹果蝇 的概述。 - 收集0-5 天的老苍蝇从小瓶和转移 (通过翻转) 的苍蝇到新的小瓶含有 NF (以前温暖室温)。让苍蝇的年龄在21和 #176 增加5天; C.
- 在5天结束时, 从4和 #176 中取出含有风和 NF 的小瓶; C.
注意: 由于低温会使活苍蝇压力大, 在使用前, 让小瓶在室温下坐30分钟预热. - 使用湿巾, 清洁和清除从瓶子两侧多余的液体.
- 插入一小块滤纸, 大约1厘米 x 3 厘米, 放入高脂肪的食物中吸收任何多余的液体.
注意: 这一步是防止苍蝇粘风食物的关键. - 下一步, 将苍蝇转到高脂肪的食物上 (通过翻转)。把小瓶水平放置在他们的一侧, (不站立) 在21-22 和 #176; C 5 天.
注意: 避免高温, 因为这可以部分融化高脂肪的食物, 导致苍蝇坚持食物和死亡. - 5 天后, 转 (通过翻转) 从 NF 和风的苍蝇到新的小瓶没有食物, 让他们的内脏空30分钟。接下来, 开始称量苍蝇.
注意: 在这个风喂养协议的关键步骤之一是准备一个混合风, 没有任何大块的苍蝇食物或浓缩油。均匀混合和冷却风到45-30 和 #176; c 是可取的, 在倒入小瓶和储存的食物在4和 #176; c. 控制和实验果蝇的适当年龄匹配是重要的和控制的营养和环境条件前风喂养。在饲养阶段, 控制和实验苍蝇必须给予相同数量的 NF 和风。切勿从过度拥挤的小瓶或瓶子中收集苍蝇 (以避免代的影响)。在 NF 和风喂养过程中, 每次每瓶最多放25只苍蝇, 以避免饮食限制或其他拥挤效果。风由30% 椰子油组成, 因此温度在22和 #176 以上; C 可能部分熔化风, 导致苍蝇黏附在油腻的食物和模子。在把苍蝇放在风上之前, 清洗小瓶以除去残留的油, 并插入滤纸以吸收食物中多余的液体。在风的苍蝇孵化期间, 小瓶被放置在他们的两侧, 为苍蝇提供一个无脂肪的水平表面.
- 使用 CO 2 来麻醉苍蝇.
- 对每个基因型和性别进行衡量的苍蝇
- , 使用敏感比例记录 pre-labeled、空1.7 毫升管的重量.
- 使用苍蝇麻醉或 CO 2 , 麻醉和收集36苍蝇相同的基因型, 性别, 和喂养状态与一称量1.7 毫升管的刷子.
- 用同样的敏感秤称量装有苍蝇的管子.
- 确定此公式后的平均飞行重量:
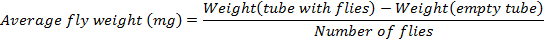
注意: 此协议中的苍蝇数量是 36. - 闪光冷冻1.7 毫升管包含苍蝇通过暴跌到液氮2分钟, 收集并把管成箱。接下来, 将这些箱子转到-80 和 #176; C (优选温度) 用于存储, 直到与标签检测一起使用.
注意: 液氮处于极低的温度。请使用适当的个人防护用具.
2。标记化验
- 准备标记标准浓度
- 准备500毫升 PBT (PBS 1X, 0.05% 海卫).
- 使用0.5 毫升管和标签解决方案 ( 材料表 ), 准备100和 #181; 空白的 L (仅 PBT) 和100和 #181; 六标准标签浓度 (2 和 #181; g/和 #181; 1 和 #181; g/和 #181; 0.5 和 #181; g/和 #181; 0.25 和 #181; g/和 #181;0.125、#181; #181;0.0625、#181、g、#181、L) 与 PBT.
- 将管子放在冰上, 然后继续研磨苍蝇.
- 研磨苍蝇
- 从-80 和 #176 中取出冻结的苍蝇; C (步骤 1.3)。把装有苍蝇的管子在冰上传输.
- 首先, 将 2 mm 金属研磨球放入96井球分配器中, 使用小画笔除去多余的球.
- 将96井研磨板倒置放在球分配器的顶部, 然后翻转将金属球直接转移到研磨板中。每个井应该有一个球.
- 使用多通道吸管, 将600和 #181 的 PBT 放入96井研磨板的每排.
- 用镊子, 每井加3只苍蝇。说明96井磨板每排/井中蝇类的基因型、性别和食物状况.
- 将瓶盖紧放在96井研磨板上。胶带可以放在顶部, 以确保没有泄漏.
- 将96井研磨板正确放置在研磨机中。将机器设置为最高速度, 并按下 #34; 运行和 #34; 研磨苍蝇3分钟.
- 3 分钟后, 停止研磨并进行板离心: centrifuge 为15分钟, 在 4000 x g, 4 和 #176; C。离心后, 小心地管理研磨板, 避免将上清与颗粒混合.
- 示例加载和标记内容确定
- 采取新的96井分光光度计板。使用多通道吸管, 负载200和 #181; L 的标签试剂到每行的板块.
- 加载20和 #181; 我的 PBT 进入第一排的第一井, 创建一个空白。移上下混合。避免形成气泡.
- 加载20和 #181; 每个标准稀释 (从步骤 2.1.2) 到第一排的剩余井中, 并由移上下混合。避免形成气泡.
- 使用多通道吸管, 将20和 #181 的每行的上清液从研磨板的每一排移到相应的96分光光度计板上。吸管向上和向下混合好。避免形成气泡.
- 下一步, 将透气箔放在96井板的顶部.
- 在37和 #176 上孵育盘; C 为 10 min.
注: 如果在井中有气泡, 离心板为2分钟, 在 2000 x g, 以消除所有气泡。气泡的存在会干扰吸光度的读数. - 使用兼容的微阅读器读取 550 nm 板的每个井的吸光度。其次, 跟踪标准曲线, 确定未知样品的浓度 [和 #181; g/和 #181; L].
- 若要确定每平均飞行重量的标签内容量, 请使用以下公式:
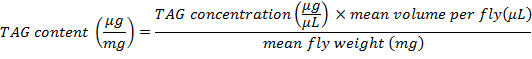
注意: 在本议定书中, 3 只苍蝇在600和 #181 中被剁碎; PBT 的 L; 因此, 平均每只苍蝇的体积是200和 #181; l.
- 布拉德福德化验和含蛋白质含量的标签内容的规范化
- 准备七100和 #181; 牛血清白蛋白 (BSA) 标准稀释 (75、#181; 100 和 #181; g/毫升; 150 和 #181; g/毫升; 200 和 #181; g/毫升; 250#181;500、#181;1000, #181, g/毫升) 与 PBT.
- 采取新的96井板和负载200和 #181; L 的1X 布拉德福德试剂到每行的板块.
- 在第一行的第一个井中, 添加10和 #181; L PBT 创建一个空白。移上下混合。避免形成气泡.
- 添加10和 #181; 每个标准稀释到第一排余下的井中, 并由移上下混合。避免形成气泡.
- 使用多通道吸管, 将10和 #181; 从每行的磨板上的飞清升到相应的96井板的排。吸管向上和向下混合好。避免形成气泡.
- 将透气箔置于96井板的顶部.
- 室温下孵育板5分钟。如果在井里有气泡, 离心板为2分钟在 2000 x g 去除他们.
注: 气泡的存在会干扰吸光度的读数. - 使用分光光度计阅读 595 nm 的空白、标准和未知样品的吸光度。使用标准曲线确定每一行中样本的浓度 [和 #181; g/和 #181; L].
- 使用以下公式规范化标记内容与蛋白质水平:

Access restricted. Please log in or start a trial to view this content.
结果
在四腹果蝇中, 与其他物种的情况一样, 雄性和雌性之间存在性异形,22。众所周知, 雌性比男性更大, 腹部中的脂肪比22多。为了测试我们的协议的有效性, 我们进行了标记分析, 以确定标准实验室野生 (w1118) 中的男女之间的标签内容差异。数据显示, 女性的全身脂肪比男性的要多 (图 2A, B
Access restricted. Please log in or start a trial to view this content.
讨论
肥胖诱导小鼠可能需要几个月19,20。在苍蝇中, 这种风喂养协议允许在几天或更短的时间内诱导过量的脂肪堆积, 导致脂肪堆积仅在18小时后增加 (参见图 2)。风哺养以被描述的协议增加葡萄糖内容12并且减少钢脂肪酶和 PGC-1 表达24。这与成人果蝇的禁食形成对比, 导致脂肪和葡萄糖含...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
我们想感谢埃丽卡-泰勒编辑这份手稿。这项工作的经费来自国家卫生研究院 (P01 HL098053、P01 AG033561 和 R01 HL054732) 的赠款、导流洞、博士后研究补编 (R01 HL085481) 和研究金 (AAUW) S.B.D., 以及美国心脏协会向 S.B.D. 提供的赠款。和 R.T.B。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Talboys Ball dropper/bead Dispenser | Talboys | #: 930150 | |
| Talboys High Throughput Homogenizer | Talboys | #: 930145 | |
| Grinding Balls, Stainless Steel | OPS Diagnostics, LLC | # GBSS 156-5000-01 | 5000 balls |
| Masterblock 96 Well deep Microplates | Greiner Bio-One | # T-3058-1 | case of 80 plates |
| Greiner 96 well microplate flat bottom | Sigma Aldrich | # M4436 | 40 plates |
| Greiner CapMat for sealing multiwell plates | Sigma Aldrich | # C3606 | 50 sealing plates |
| Reagent Reservoirs | Thomas Scientific | # 1192T71 | 12/PK |
| Thermo Scientific Finnpipette 4661040 | Thermo Scientific | # 4661040 | 1-10 ul multipipette |
| Thermo Scientific Finnpipette 4661070 | Thermo Scientific | # 4661070 | 30-300ul multipipette |
| Thermo Scientific Finnpipette 4661020 | Thermo Scientific | #4661020 | 10-100ul multipipette |
| Multichannel tips | Denville Scientific Inc | # P3131-S | for 10 uL pipette |
| Multichannel tips | Denville Scientific Inc | # P3133-S | for 200 uL pipette |
| Multichannel tips | Denville Scientific Inc | #P1125 | for 100 uL pipette |
| Forceps | Roboz Surgical | # 5 Dumonts | Super fine forceps |
| Mettler Toledo Excellence XS Analytical Balance Mfr# XS64 | Cole-Parmer scientific experts | # EW-11333-00 | |
| Metler Toledo Excellence XS Toploading Balance | Cole-Parmer scientific experts | # EW-11333-49 | |
| 96-Well microplate Centrifuge | Hettich Zentrifugen | # Rotina 420R | |
| Microplate Reader | Molecular devices | # SpectraMax 190 | |
| Lab-Line Bench Top Orbit Environ Shaker Incubator | Biostad | # 3527 | |
| Infinity Triglycerides reagent | Thermo Scientific | # TR22421 | |
| Triglyceride Standard | Stanbio | #2103 - 030 | |
| Quick Start Bradford Protein Assay | Bio-RAD | # 500-0205 | 1x dye Reagent |
| Coconut oil | Nutiva | # 692752200014 | 15 0z jar |
| PBS 10X | Thermo Scientific | # AM9625 | 500 ml |
| Triton X-100 | Sigma Aldrich | # 9002-93-1 | |
| Gas-permeable Foil | Macherey-Nagel | # 740675 | 50 pieces |
| filter Paper | VWR | # 28317-241 | Pack of 100 |
| Drosophila vials | Genesee Scientific | Cat #: 32-116SB | |
| Quick Start Bovine Serum Albumin Standard | Bio-Rad | # 5000206 | |
| FlyNap Anesthetic | Carolina | # 173025 | 100 mL |
| Kimwipes Low-Lint | Uline | # S-8115 | 1-Ply, 4.4 x 8.4" |
参考文献
- Ng, M., et al. Global, regional, and national prevalence of overweight and obesity in children and adults during 1980-2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet. 384, 766-781 (2014).
- Murphy, S. L., et al. Mortality in the United States, 2014. NCHS data brief, no 229. , Available from: https://www.cdc.gov/nchs/products/databriefs/db229.htm (2015).
- Bodmer, R. Heart development in Drosophila and its relationship to vertebrates. Trends Cardiovasc Med. 5, 21-28 (1995).
- Brumby, A. M., Richardson, H. E. Using Drosophila melanogaster to map human cancer pathways. Nat Rev Cancer. 5, 626-639 (2005).
- Chan, H. Y., Bonini, N. M. Drosophila models of human neurodegenerative disease. Cell Death Differ. 7, 1075-1080 (2000).
- Levine, M., et al. Human DNA sequences homologous to a protein coding region conserved between homeotic genes of Drosophila. Cell. 38, 667-673 (1984).
- Bier, E. Drosophila, the golden bug, emerges as a tool for human genetics. Nat Rev Genet. 6, 9-23 (2005).
- Bier, E., Bodmer, R. Drosophila, an emerging model for cardiac disease. Gene. 342, 1-11 (2004).
- Noyes, B. E., et al. Identification and expression of the Drosophila adipokinetic hormone gene. Mol Cell Endocrinol. 109, 133-141 (1995).
- Rajan, A., Perrimon, N. Of flies and men: insights on organismal metabolism from fruit flies. BMC Biol. 11, 38(2013).
- Rulifson, E. J., et al. Ablation of insulin-producing neurons in flies: growth and diabetic phenotypes. Science. 296, 1118-1120 (2002).
- Birse, R. T., et al. High-fat-diet-induced obesity and heart dysfunction are regulated by the TOR pathway in Drosophila. Cell Metab. 12, 533-544 (2010).
- Musselman, L. P., et al. A high-sugar diet produces obesity and insulin resistance in wild-type Drosophila. Dis Models Mech. 4, 842-849 (2011).
- Diop, S. B., Bodmer, R. Gaining Insights into Diabetic Cardiomyopathy from Drosophila. Trends Endocrinol Metab. 26, 618-627 (2015).
- Williams, M. J., et al. The Obesity-Linked Gene Nudt3 Drosophila Homolog Aps Is Associated With Insulin Signaling. Mol Endocrinol. 29, 1303-1319 (2015).
- Morris, S. N., et al. Development of diet-induced insulin resistance in adult Drosophila melanogaster. Biochim Biophys Acta. 1822, 1230-1237 (2012).
- Bodmer, R. The gene tinman is required for specification of the heart and visceral muscles in Drosophila. Development. 118, 719-729 (1993).
- Erkkila, A., et al. Dietary fatty acids and cardiovascular disease: an epidemiological approach. Prog Lipid Res. 47, 172-187 (2008).
- Ganz, M., et al. High fat diet feeding results in gender specific steatohepatitis and inflammasome activation. World J Gastroenterol. 20, 8525-8534 (2014).
- Wang, C. Y., Liao, J. K. A mouse model of diet-induced obesity and insulin resistance. Methods Mol Biol. 821, 421-433 (2012).
- Stocker, H., Gallant, P. Getting started: an overview on raising and handling Drosophila. Methods Mol Biol. 420, 27-44 (2008).
- Mathews, K. W., et al. Sexual Dimorphism of Body Size Is Controlled by Dosage of the X-Chromosomal Gene Myc and by the Sex-Determining Gene tra in Drosophila. Genetics. 205, 1215-1228 (2017).
- Golay, A., Bobbioni, E. The role of dietary fat in obesity. Int J Obes Relat Metab Disord. 21, Suppl 3 2-11 (1997).
- Diop, S. B., et al. PGC-1/Spargel Counteracts High-Fat-Diet-Induced Obesity and Cardiac Lipotoxicity Downstream of TOR and Brummer ATGL Lipase. Cell Rep. 10, 1-13 (2015).
- Chatterjee, D., et al. Control of metabolic adaptation to fasting by dILP6-induced insulin signaling in Drosophila oenocytes. Proc Natl Acad Sci U S A. 111, 17959-17964 (2014).
- Palanker, L., et al. Drosophila HNF4 regulates lipid mobilization and beta-oxidation. Cell Metab. 9, 228-239 (2009).
- Heinrichsen, E. T., Haddad, G. G. Role of high-fat diet in stress response of Drosophila. PLoS One. 7, 42587(2012).
- Kitahara, C. M., et al. Association between class III obesity (BMI of 40-59 kg/m2) and mortality: a pooled analysis of 20 prospective studies. PLoS Med. 11, 1001673(2014).
- Reis, A., et al. A comparison of five lipid extraction solvent systems for lipidomic studies of human LDL. J Lipid Res. 54, 1812-1824 (2013).
- Turne, C., et al. Supercritical fluid extraction and chromatography for fat-soluble vitamin analysis. J Chromatogr A. 936, 215-237 (2001).
- Na, J., et al. Drosophila model of high sugar diet-induced cardiomyopathy. PLoS Genet. 9, 1003175(2013).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。