Method Article
实时在体记录了拟南芥钙信号在使用荧光传感器的昆虫饲喂时
摘要
本议定书概述了喂养 hemipteran 的昆虫,如蚜虫等所产生的植物钙信号分析的简单方法。拟南芥转化与绿色荧光蛋白钙生物传感器 GCaMP3 允许实时在体成像的高时空分辨率的钙动力学。
摘要
钙离子预计将在与钙信号形成一个既定的植物防卫反应对微生物诱导和伤人致咀嚼昆虫,引起全身钙一部分生物相互作用的关键信号实体在植物中的信号。然而,钙在体内生物胁迫中的作用是目前尚不清楚。此协议说明基因编码钙传感器来喂食的 hemipteran 害虫检测中植物的钙信号使用。Hemipterans 如蚜虫等刺穿少量细胞与专业,拉长吸口器,使它们钙动力学研究植物面临生物胁迫,有别于伤人的响应时的理想工具。此外,荧光生物传感器革命化测量的信号分子在体内动物和植物。表达绿色荧光蛋白为基础的钙生物传感器,GCaMP3,在模式植物拟南芥中允许植物钙动力学在昆虫饲喂,以高时空分辨率的实时成像。可重复和鲁棒性的测定已采用荧光显微技术的分离 GCaMP3 叶,允许连续测定钙动力学之前、 期间和之后昆虫饲喂。这揭示了一个高度本地化快速钙海拔周围蚜在几分钟内发生的站点。议定书 》 可以适应其他生物的胁迫,如额外的昆虫种类,而拟南芥使用允许快速生成的突变体促进这一现象的分子分析。
引言
钙 (Ca2 +) 是植物中最无处不在的信号元素之一。短暂回升胞浆 Ca2 +浓度 ([Ca2 +]cyt) 由一个复杂的下游组件网络解码和参与这两个生物和非生物胁迫1,2的答复。在 [Ca2 +]cyt的崛起是对微生物诱导,形成常见的植物防御反应3,,45一部分的第一反应。[Ca2 +]cyt的升幅,指出伤人致咀嚼昆虫,如鳞翅目昆虫6,7回应。不过的潜在作用的植物的 Ca 不探讨了2 +信号响应活生物对只有几个细胞造成损害的威胁。桃蚜蚜是构成重大的威胁到世界农业8,9,hemipteran 昆虫和 Ca2 +从细胞外空间射流见于叶布满蚜10。一种测量植物 Ca2 +的鲁棒性和可重复的方法信号虽然蚜饲料从叶子荧光的 Ca2 +传感器,用蚜虫和 GCaMP3 提供新颖的工具,对此协议概述解剖在生物交互过程中的 Ca2 +的作用。
Ca2 +-选择性微电极以前曾被用于衡量 [Ca2 +] 植物11,12。最近,成为标准化的发光和荧光的方法。这些生物传感器绑定 Ca2 +和发出的光,允许为非平行的机会,研究细胞和整个组织中的 Ca2 +互动。Ca2 +传感器可以作为染料注射或稳定生产介绍了生物传感器编码到通过变换 (即基因编码传感器) 有机体的基因组序列。后者提供的主要优点是容易在活组织中的表达和有能力的亚细胞定位13。从水母(水母) 分离的水母素蛋白是第一个基因编码的 Ca2 +传感器部署在植物14。作为一种发光蛋白,水母素不需要外部的光,避免了漂白的生色团和自体荧光15励磁。水母素已被成功地用于测量 [Ca2 +] 通量对各种刺激反应,包括温度16,病原体17,,1819、 盐强调20 21和伤人7。然而,它是相对较低的信号强度,使 [Ca2 +] 通量检测单个细胞中和从差传感器表达困难13组织处于不利地位。
Ca2 +传感器,可以发出荧光的发展补充了水母素通过允许详细亚细胞和组织水平动力学分析的 Ca2 + 。最常见的荧光传感器之一是荧光共振能量转移 (FRET)-基于 Cameleons。FRET Cameleons 由两种蛋白质,通常 CFP 和 YFP,被带进密切接触所致的 Ca2 +到 CFP YFP 链接器区域中的钙调素域绑定的构象变化。此联系人允许能量的转移从 CFP YFP,和由此产生的变化在这些荧光的荧光可以准确定量测定 [Ca2 +] 通过荧光信号从这两个比率的计算荧光团22。FRET Cameleons 均优于水母素和非比率计量的荧光染料,,因为他们较少受23蛋白质的表达水平,经常有更大的荧光产量,使细胞和亚细胞成像23。例如,FRET Cameleons 最近曾确定植物的长途 Ca2 +信号并解决这些到细胞水平24,,2526。
最近的突破与荧光 GFP 基于 Ca2 +传感器已高度敏感单-荧光 (单-FP) 生物传感器的发展。单-FP 生物传感器包括一个单一的循环排列后绿色荧光蛋白钙调素和挂钩 M13 肽与 Ca2 +绑定到钙调素,所以导致钙调素与绿色荧光蛋白介导水反应发生 GFP 作用和增加荧光灯产量27,,2829。单-FP 传感器提供几个 FRET Cameleons,包括简单的实验设计和潜在的高时间分辨率成像30的优点。虽然单-FP 传感器不能简单量化绝对 [Ca2 +] 作为 FRET 传感器,他们是优越的因为信号5,23的 Ca2 +的时空动态的分析。GCaMPs 是无疑的单-FP 传感器28之一,经历了多次修订,以加强其荧光产量、 动态范围、 Ca2 +亲和力和信号信噪比31,32,33,34.GCaMPs 已经成功应用于动物的系统,如斑马鱼运动神经元35和水果飞神经肌肉接头34。GCaMP3 的随机突变导致在其他类的单-FP 传感器,包括超灵敏 GCaMP636和 GECOs29中。GECOs 最近在拟南芥(下称拟南芥) 用于衡量 Ca2 +通 ATP、 甲壳素、 和细菌诱导 flg22 的响应。这项研究也表明 R GECO 生物传感器表现优于 FRET Cameleon YC3.6 的最大信号变化和信号噪声比5。
由于易用性、 高荧光产量和可以通过 GCaMP 生物传感器的高时间分辨率,GCaMP3 基因编码在拟南芥下花椰菜花叶病毒35S 启动子。拟南芥研究的遗传工具允许对 Ca2 +信号测定 GCaMP3 的详尽分子分析。此外,GCaMP3 传感器可以可视化下荧光显微镜,而不是昂贵的共焦系统。此协议允许对整个组织成像,必要时进行实验与活的生物胁迫。实验的设计使得35S::GCaMP3植物离体的叶片漂浮在水,以防止昆虫逃脱,限制饲喂到为特定的组织。本文所述的方法因此允许喂饲蚜在叶片 Ca2 +动力学分析导致信号响应的新型植物的表征。此方法也可用于其他生物的压力,例如额外的昆虫物种和微生物病原体,与其他植物组织,如根的工作。
研究方案
1.植物制剂 (天 1-4)
- 在第 1 天,消毒 35S::GCaMP 种子使用三个 75%乙醇洗涤,洗净和板每 1 分钟 100 毫米 2 到广场 ¼ 强度村蕃塑料板和斯库格 (MS) 培养基 (食谱: 1.1 g 村蕃和斯库格的介质,7.5 g 蔗糖、 10 g Formedium 琼脂和去离子水 1 L) 37.
- 三天在 8 ° C,以获得同步萌发分层在黑暗中的幼苗。
- 在实验的第 4 天,将 GCaMP 苗移到在 23 ° C,与 16 h 光和 8 h 暗光周期的受控的环境室 (CER)。
2。昆虫饲养 (天 11-12)
- 实验的第 11 天,将 15 成人 蚜 添加到 5 周龄土壤种植拟南芥植物使用潮湿的艺术家 ' s 油漆刷 (大小 2 或 4) (在 22 ° C,10 h 光和 14 h 黑 photoperio 在 CER 中成长d)。
- 笼放置透明塑料管材 (10 厘米 x 15 厘米) 周围的植物和一个塑料盖盖在植物上的蚜虫。
- 留下蚜虫出没植物为 24 h 在 22 ° C 在 CER 中 16 h 光和暗光: 8 h 周期。
- 在实验的第 12 天,删除所有成年 蚜 用画笔。
注: 昆虫可以被植物的眼睛。这样,若虫与类似的发育年龄人口。大致在此期间将产生 1 若虫每位成人。 - 在较低温度 16 ° C,在 CER 中留下 8 h 光和 16 h 暗光周期,以防止若虫太迅速增加的大小受侵染的植物。
3。叶支队 (天 19)
- 的实验 19 天,从 CER 删除 35S::GCaMP3 苗和分离用一把锋利的剪刀每株大叶。
- 使用一把镊子,将离体的叶片放入含有 300 µ L 的蒸馏水,背面朝上的 96 孔板的井。重复的额外叶子 ( 图 1)。

图 1: 35S::GCaMP3 叶片检测。从每个 16 日龄 35S::GCaMP3 拟南芥幼苗的大叶子是分离和漂浮在 300 µ L 的蒸馏水在 96 孔板上。脱离后的一天的照片。 请点击这里查看此图的大版本。
- 盖板在透明的塑料包装和铝箔,放在室温下一整夜允许应力的脱离消退。
4.荧光显微镜 (天 20-22)
- 在实验的第 20 天,从铝箔删除 96 孔板和转移到荧光体视显微镜。配置立体荧光显微镜用 450 490 nm 光激发 GFP 和捕获 500 和 550 毫微米之间的荧光发射。
- 从殖民地建立 11 日通过删除植物从土壤并将其放在一个透明的盒子盖收集老年的蚜虫。保持在进行实验时在框中所载的昆虫。
- 96 孔板在显微镜下的地方。改变灯光的照射下,直到 GCaMP3 荧光可以清楚地可视化离体叶片的血管中。保持曝光恒定为所有实验;对于当前的协议,1-s 曝光用增益 3.5 ( 图 2)。
- 调整放大倍率和显微镜的缩放等 4 口井可以观察到在一个框架中; 当前的协议,7.8 X 放大倍率和-127.8330 毫米的一个重点用于。
- 将一个蚜虫转移到离体叶片在显微镜下用潮湿的画笔。未经治疗作为对照,相邻的叶子的离开,但轻轻触摸它用笔画来模仿触摸蚜虫传输过程中的发生。别忘了在显微镜来防止昆虫逃脱地点回在 96 孔板塑料包装。
- 通过单击开始荧光录制的成对 (1 蚜治疗和未经处理的 1) 叶子 " 开始实验 " 内置显微镜软件 ( 图 2)。记录测量 50 分钟
注意: 对于当前的协议的时间间隔为 5 的测量之间采用。 - 后 50 分钟,通过点击停止录制 " 停止实验 " 和删除叶蚜虫。将荧光测量另存为图像文件 (例如, 标记的图像文件格式,TIFF)。
- 重复与叶子进一步对实验; 成像可以扩展到图像 2 成对的叶一次,允许同时成像的 2 基因型。
5。数据收集
- 将图像文件导入到斐济 (图像 J) 和通过点击将它们转换为 32 位 " 图像 " > " 型 " > " 32-位; " 这允许图像转化为热图视频 (见第 7 步)。
- 丢弃的蚜虫也不要在一个地方超过 5 分钟通过查看在显微镜下的昆虫运动的样品。
注意: 这通常是样品,绝大多数和达 100 治疗可能需要找到 30 个样品展示成功解决。 - 像素 (或转换为毫米,如果已知) 的测量尺度和时间框架所使用的相同时间间隔期间设置显微镜通过点击 " 图像 " > " 属性。 "
- 使用游标,周围地区的绿色荧光蛋白分析组织放置区域的利息 (率 ROI)。
注: 在当前的协议中,圆形 ROI 50 像素 (0.65 毫米) 直径采用 3 个感兴趣的地点: 蚜取食网站 (Fs)、 上 (Sm),叶中脉的系统性区域和系统性的地区毗邻,中脉 (" 侧组织" Sl) ( 图 2)。- 通过绘制一个椭圆创建投资回报率 (使用 " 椭圆工具 "),和编辑使用大小 " 编辑 " > " 选择 " > " 指定。 " 见 图 2。
- 为对照,在叶片对那些选择 (即, 同一区域的作为在哪里蚜取食处理叶叶片) 处理后的叶片上的类似区域中选择 Roi ( 图 2)。

图 2: 分析 GCaMP3 荧光显微镜下的。左: 对照叶。右图: 蚜虫治疗叶。蚜饲养网站是用箭头表示。条码秤 = 1 毫米 (A) 明亮的领域、 形象。放大倍数: 7.8 X,集中:-127.8330 毫米,曝光: 1 美国 (B) GFP 图像其中的表演吴用于荧光定量分析的 Roi。Fs = 觅食地,Sm = 系统性中脉,Sl = 系统性的横向组织。放大倍数: 7.8 X,集中:-127.8330 毫米,曝光: 1 s。GFP 激发使用 450 到 490 nm 金属卤化物灯,和荧光发射被抓获 500 和 550 毫微米之间。 请点击这里查看此图的大版本。
- 通过单击使用时间系列分析仪插件 " 插件 " > " 时间系列分析仪 ",随着时间的推移分析原料荧光值 (F) 在投资回报率。添加感兴趣的投资回报率 (" 添加 [t] ")。确保选择了投资回报率,选择 " 得到平均; " 中,投资回报率将显示每个帧的 F 值表。
- 将此数据复制到电子表格。
- 通过先选择区域使用计算的喂养的现场信号面积 " 不规则选择工具。 " 概述最大的绿色荧光蛋白信号,然后通过单击计算此形状的面积 " 分析 " > " 措施。 "
- 计算使用 MTrackJ 插件通过单击喂养现场信号的速度 " 插件 " > " 跟踪 " > " MTrackJ."
- 单击上 " 添加 " 按钮,然后单击光标的中心当它首先是可见的信号。单击再边上的在它的最远的点信号传播。单击 " 措施 " 来计算的速度信号。
6。数据分析
- 定义的蚜虫解决通过从斐济显微镜图像帧播放点。
注意: 沉淀的时间是其间蚜虫停留在单一位置 5 分钟或更多的框架。解决事件的持续时间,还可计算出在斐济图像。 - 规范 F 数据 (δ F/F) 根据方程 δ F/F = (F-F 0) /F 0,F 0 在哪里平均基线荧光计算从 F 平均值蚜虫之前录制的第 60 帧解决了。重复的未经处理的控制。
- 绘制的归一化的 GFP 荧光 (δ F/F) 随着时间的推移为处理和未经处理的叶片中,投资回报率。丢弃样品 (两叶),如果不接受治疗的控制显示大型 Ca 2 + 瞬变 (即 δ F/F 升以上 0.2)。
- 重复,直到每基因型分析了至少 20-30 可行样品。
7。创建时间课程视频
- 转换 32 位图像文件到生成热点地图通过单击使用 NucMed_Image 下尿路症状插件 " 插件 " > " NucMed " > " 查找表。 " 在查找表菜单,选择 " 蓝色绿色红色" 以将图像转换为热图。
- 增强对比度的热图突出蚜虫引起 GFP 信号使用 " 过程 " > " 对比度增强 " > " 调整饱和的像素 %。 "
- 使用时间印章插件通过点击添加时间信息 " 插件 " > " 时间压模 "。设置 " 开始时间 " 在 " 0 " 和 " 区间 " 基于用于显微镜 (如 5 s) 的时间间隔。
- 出口这个视频音频视频交错 (AVI) 文件。
注意: 这个视频可以然后编辑进一步在其他软件包 (例如, Microsoft Movie Maker)。
结果
图 3和图 4 是代表从比较蚜虫治疗叶与对照实验结果。GFP 荧光高度本地化的增加周围可见喂养网站在大部分的样品,几分钟内虽然 Ca2 +动力学在未经处理的控制叶片保持相对稳定 (图 3A和3B)。它也是可能观察 GFP 荧光在一些实验中 (图 3B) 的初始峰值后二次增加。在达 50%的处理叶子,蚜虫也不要,样品应该被丢弃。在哪解决发生样本中,27%的样品不表现出明显增加 GFP 荧光周围觅食地 (图 3和表 1);因此,25-30 重复样品应平均为定量的分析。区域的可视化和喂养网站 [Ca2 +]cyt高程速度应揭示信号大约 110 µ m,行驶 6 µ m/s (表 1)。此外,没有 [Ca2 +]cyt海拔应该在蚜虫经处理后,在系统中脉 (图 4A) 或系统性的横向组织区域 (图 4B) 叶内,系统检测到。随着时间的推移 [Ca2 +]cyt动力学代表性样本如视频 1所示。它也是能够分析蚜虫沉降行为的追踪号码和显微镜下的单个沉降事件的持续时间。这些行为代表结果所示表 1,显示蚜虫采取大约 10 分钟才定居,和当他们做成功定居,这平均持续了 20 分钟。因此,这种昆虫被落户全部 [Ca2 +]cyt高程的单一位置。
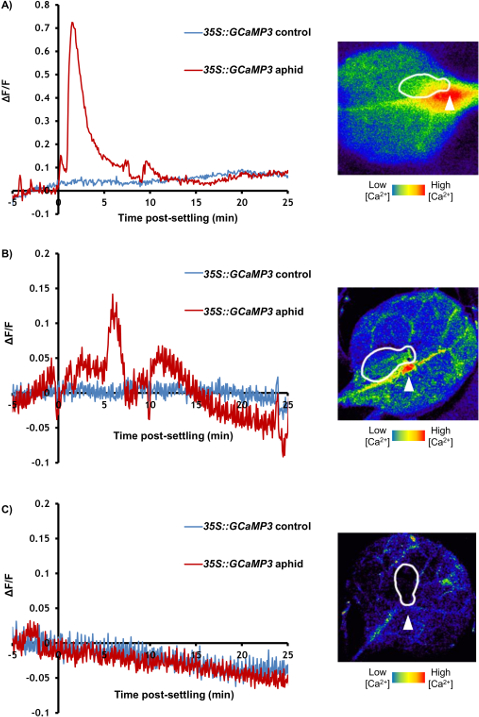
图 3: GCaMP3 可以用来检测蚜虫引起 Ca2 +信号分离叶中喂食地点。左: 代表痕迹 (n = 30) 的归一化 GFP 荧光 (δ F/F). 35S::GCaMP3叶饲养地点周围痕迹显示 5 分钟才定居直到 25 分钟后解决。控制 = 未经处理的35S::GCaMP3叶对应位置。右: 代表体视显微镜图像的 [Ca2 +]cyt海拔看到周围喂养网站35S::GCaMP3的叶子上的蚜虫。GFP 荧光是彩色插图规模。白色和喂养网站所述的蚜虫 id 用箭头表示。放大倍数: 7.8 X,集中:-127.8330 毫米,曝光: 1 s。GFP 激发使用 450 到 490 nm 金属卤化物灯,和荧光发射被抓获 500 和 550 毫微米之间。(A) 一个大蚜诱导 [Ca2 +]cyt海拔示例。(B) 例平均蚜诱导 [Ca2 +]cyt高程。(C) 没有蚜虫诱导 [Ca2 +]cyt海拔示例。请点击这里查看此图的大版本。
| 参数 | 平均 (± 扫描电镜) |
| [Ca2 +]cyt高程 | |
| 显示 [Ca2 +]cyt高程的样本数的百分比 | 73% |
| 波波头的速度 | 5.9 µ m/s (± 0.6) |
| 最大范围的传播 | 110 µ m2 (± 18) |
| 蚜虫行为 | |
| 落定数目 (> 5 分钟) | 2 (± 0.1) |
| 安定 (所有时间) 的总数 | 3.8 (± 0.4) |
| 时间解决成像b | 20 分钟 (± 2) |
| 直到第一次结算c时间 | 11 分钟 (± 1.4) |
| 用的总时间的百分比定居 | 62%(± 3) |
表 1: [Ca2 +]cyt高程和蚜虫行为参数在35S::GCaMP3成像。从可行样品中的沉降计算参数 > 5 分钟发生。 (A) 的速度,可见信号的起始点从传播的最远点。(B) 用于荧光分析的初始沉降事件的持续时间。(C) 之间的时间长度成像的开始和第一次蚜定居。[Ca2 +]cyt高程数据以前提交的植物细胞 (当前状态: 初始 QC)。
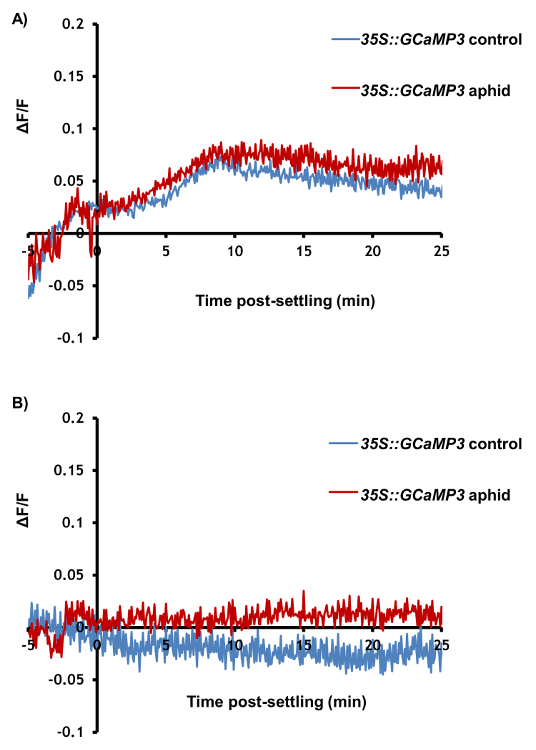
图 4: GCaMP3 无法检测到蚜虫引起 Ca2 +信号系统性喂养的网站。代表痕迹 (n = 30) 的归一化 GFP 荧光 (δ F/F) 地点系统性蚜在网站35S::GCaMP3 叶。痕迹显示 5 分钟才定居直到 25 分钟后解决。控制 = 未经处理的35S::GCaMP3叶对应位置。(A) δ F/F 系统性中脉地区。(B) δ F/F 在系统性的横向组织区域。请点击这里查看此图的大版本。
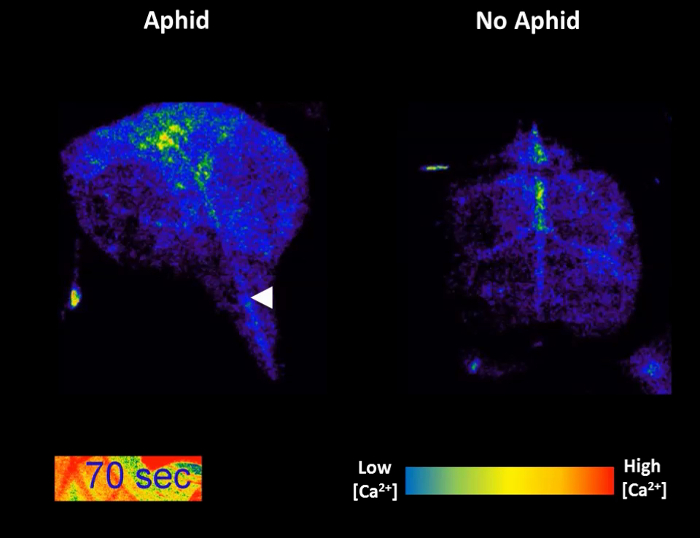
视频 1: GCaMP3 花期结束时间为蚜虫饲料。GFP 荧光是彩色插图规模。带箭头表明蚜虫觅食地的位置。左: 35S::GCaMP3叶暴露蚜成人。右图: 35S::GCaMP3无蚜控制叶。请单击此处以查看此视频。(右键单击下载。)
讨论
在本文中描述的方法允许植物的实时分析 Ca2 +期间如昆虫饲养的生物胁迫信号转导。它演示了这种威胁的第一个植物反应之一是一个本地化 [Ca2 +]cyt海拔喂食地点周围的昆虫。通过突变体,使用此方法将允许这样的信号,是不可能的以前的分子和生理表征。在本议定书中关键的一步是确保离体的叶片不过分打扰脱离过程 (步骤 3.2) 或将昆虫转移至叶 (步 4.5) 时。考虑到当前的协议提供的 [Ca2 +]cyt ,而不是绝对的浓度的相对测量,至关重要的是,显微镜设置保持不变,整个试验。期间的投资回报率的选择与分析数据,还有人类的偏见的可能性,因此,它建议实验进行双盲。
有几个显著的优势,在与本议定书的生物胁迫期间测量 [Ca2 +]cyt 。首先,使用单个荧光荧光高产允许进行在体视显微镜,这是成本低于用共焦显微镜的成像。使用单个荧光也使数据收集和分析简单,正只是一个测量记录。此外,体视显微镜的使用允许成像的整个叶子,既然许多生物相互作用,包括植物蚜虫的相互作用,发生在大的空间尺度上,这至关重要。高时间分辨率的图像捕获可能与 GCaMP3,基于快速解除关联 Ca2 +从传感器后绑定23,30 ,荧光灯产量高,允许测量采取达每 5 s。此外,叶片检测可防止逃跑的昆虫,一个关键的限制进行这种实验研究整个植物(正在编写)的一步。离体的叶片也确保这种昆虫饲料从预定义的位置,允许动力学分析的 Ca2 +之前、 期间和之后喂养。该协议还确保类似发育阶段叶片用于分析。
本议定书的主要缺点是源于非比率计量生物传感器的使用。与单-FP 生物传感器,GFP 排放的变化可能会导致从实验变量以外 [Ca2 +]cyt,如细胞的 ph 值、 运动或生物传感器的表达水平的变化。这些问题根本不会遇到与 FRET Cameleons 期间别发愁,如能量转移到 YFP CFP 只发生在 Ca2 +绑定。改变个别荧光的荧光性质其他条件很难模仿对方变化强度的 CFP 和 YFP,并天生就用的比率计算进行规范化为许多这些测量其他光学工件23,30。这使得绝对 [Ca2 +]cyt估计与 FRET Cameleons 更可靠。因此,GCaMP3 是最好用于作为一个生物传感器测量相对 [Ca2 +]cyt,虽仍不足以检测和表征中植物5,(in preparation)生物现象。因此,有必要使用控件来显示观察到的效果是由于 Ca2 +,包括 Ca2 +-相关遗传突变体(正在编写)或药理 Ca2 +通道抑制剂如 La3 +.重要的是,单-FP 生物传感器通常显示更大的荧光产量和更大的动态范围 (即,在花期对 Ca2 +绑定增加) 比 FRET Cameleons23,这使得 GCaMP 更适合组织级成像,FRET Cameleons 则用共聚焦显微镜5,25细胞成像的有用工具。
在执行本议定书,过程中很可能需要进行故障排除,将会产生一些问题。例如,它被建议,样品中的控制 (治疗) 叶显示大 [Ca2 +]cyt海拔丢弃 (步骤 6.3)。这种瞬变最有可能是应激诱导的显微镜的结果。事实上,知道蓝色光是争取 Ca2 +信号38,,3940,41,和高强度的光也可能导致温度和渗透胁迫,这两个国家也诱发 [Ca2 +]cyt海拔21,,2542。因此,为了减少这种压力,它是重要的来进行这个试验在一个通风良好、 温度控制的房间里,避免不必要地长时间的曝光。它也是重要的是不破坏叶子过分或显微镜,防止触摸引起 [Ca2 +]cyt海拔43,,4445期间脱离。用昆虫沉降,也可能遇到问题。与蚜,昆虫不要停留在几个样品中的叶子上。这可能是防御的伤口引起,在离体的叶片46,47或由蓝灯昆虫的干扰的结果。的确,视觉在蚜被受三种感光细胞,其中包括与峰值的敏感性为 490 nm48。减少显微镜曝光和处理与护理蚜虫可能减轻痛苦并鼓励定居。
当前文章概述了议定书 》 规定到植物与昆虫相互作用的分子理解和植物对生物胁迫响应的新见解。它可实现之一的植物对昆虫饲养第一响应可视化并有助于进一步调查通过大量拟南芥的遗传资源可用。此外,此协议允许用于活着的生物,相反对提取49或诱导子50。将来,此技术可以应用到其他生物的胁迫,如额外的昆虫物种、 线虫或病原微生物,以及对非生物胁迫。也可以修改 GCaMP3 显微镜图像其他植物组织,替代 Roi 的叶,或甚至整株植物。此外,还有潜在的生物传感器是遗传ly 在其他植物中编码。因此,本文概述了议定书 》 有潜力卧底的 Ca2 +信号在一系列植物和其它物种之间的新型生物相互作用的分子基础。
披露声明
作者有没有冲突的利益要申报。
致谢
我们要感谢格兰特 · 卡尔德 (约翰英纳斯中心,英国) 为关于显微镜的忠告。作者还要感谢约翰英纳斯中心园艺和昆虫学部门为他们提供援助。这项工作由博士奖学金从约翰 · 英尼斯基金会 (电视) 中,从生物和约翰 · 英尼斯基金会授予 B/JJ004561/1 (T.V.,硕士,J.C.,外长,S.H.,颚和 D.S.),年工业安置从约翰 · 英尼斯中心 (文学硕士)从英国 (J.C.),JST PRESTO (手机) 与赠款小型断路器 1329723 和 IOS 1557899 从国家科学基金会 (手机和球) 生化学会了夏天奖学金。
材料
| Name | Company | Catalog Number | Comments |
| 35S::GCaMP3 Arabidopsis | John Innes Centre/Universty of Wisconsin | - | Step 1.1 |
| 100 mm2 square plastic plates | R & L Slaughter Ltd, Upminster, UK | For growing GCaMP plants (Step 1.1) | |
| ¼ strength Murashige and Skoog (MS) medium | homemade: 1.1 g Murashige and Skoog medium, 7.5 g sucrose, 10 g Formedium agar, 1 L de-ionised water | - | For growing GCaMP plants (Step 1.1) |
| Col-0 Arabidopsis | - | - | For growing aged aphid colony (Step 2.1) |
| Myzus persicae(Sulzer) | clone US1L, Mark Stevens, Brooms Barn | - | Orginally from Rothamsted Research, UK (Step 2.1) |
| Artist's paintbrush size 2 | Hobbycraft | 610101 | To tranfer aphids (Steps 2.1, 2.4 and 4.6) |
| 96-well MicrotitreTM plate | ThermoFisher Scientific | 2101 | To contain the detached GCaMP3 leaves (Step 3.2) |
| Aluminium foil | Wrap Film Systems, Telford, UK | 26B06 | To cover plates with floating leaves overnight (Step 3.3) |
| Clear plastic wrap | SC Johnson & Son, Racine, WI, USA | To cover plates with floating leaves overnight, and to cover leaves during microscopy (Steps 3.3 and 4.7) | |
| M205FA stereo microscope | Leica Microsystems | - | For GFP imaging (Step 4.1) |
| Leica Application Suite v3.2.0 | Leica Microsystems | Microscope software (Step 4.1) | |
| Fiji (Image J) v1.48a | National Institutes of Health, USA) | - | For image analysis (Step 6.1) |
参考文献
- Sanders, D., Pelloux, J., Brownlee, C., Harper, J. F. Calcium at the crossroads of signaling. Plant Cell. 14, S401-S417 (2002).
- Dodd, A. N., Kudla, J., Sanders, D. The language of calcium signaling. Annu Rev Plant Biol. 61, 593-620 (2010).
- Blume, B., Nurnberger, T., Nass, N., Scheel, D. Receptor-mediated increase in cytoplasmic free calcium required for activation of pathogen defense in parsley. Plant Cell. 12 (8), 1425-1440 (2000).
- Lecourieux, D. Proteinaceous and oligosaccharidic elicitors induce different calcium signatures in the nucleus of tobacco cells. Cell Calcium. 38 (6), 527-538 (2005).
- Keinath, N. F., et al. Live cell imaging with R-GECO1 sheds light on flg22- and chitin-induced transient [Ca2+]cyt patterns in Arabidopsis. Mol Plant. 8 (8), 1188-1200 (2015).
- Verrillo, F., Occhipinti, A., Kanchiswamy, C. N., Maffei, M. E. Quantitative analysis of herbivore-induced cytosolic calcium by using a cameleon (YC 3.6) calcium sensor in Arabidopsis thaliana. J Plant Physiol. 171 (2), 136-139 (2014).
- Kiep, V. Systemic cytosolic Ca(2+) elevation is activated upon wounding and herbivory in Arabidopsis. New Phytol. 207 (4), 996-1004 (2015).
- Blackman, R. L., Eastop, V. F. Aphids on the world's crops: an identification and information guide. , John Wiley & Sons, Ltd. (2000).
- Ng, J. C. K., Perry, K. L. Transmission of plant viruses by aphid vectors. Mol Plant Pathol. 5 (5), 505-511 (2004).
- Ren, G. W., Wang, X. F., Chen, D., Wang, X. W., Liu, X. D. Effects of aphids Myzus persicae on the changes of Ca2+ and H2O2 flux and enzyme activities in tobacco. J Plant Interact. 9 (1), 883-888 (2014).
- Brownlee, C., Wood, J. W. A gradient of cytoplasmic free calcium in growing rhizoid cells of fucus-serratus. Nature. 320 (6063), 624-626 (1986).
- Miller, A. J., Sanders, D. Depletion of cytosolic free calcium induced by photosynthesis. Nature. 326 (6111), 397-400 (1987).
- Kanchiswamy, C. N., Malnoy, M., Occhipinti, A., Maffei, M. E. Calcium imaging perspectives in plants. Int J Mol Sci. 15 (3), 3842-3859 (2014).
- Ridgway, E. B., Ashley, C. C. Calcium transients in single muscle fibers. Biochem Biophys Res Commun. 29 (2), 229(1967).
- Plieth, C. Plant calcium signaling and monitoring: pros and cons and recent experimental approaches. Protoplasma. 218 (1-2), 1-23 (2001).
- Campbell, A. K., Trewavas, A. J., Knight, M. R. Calcium imaging shows differential sensitivity to cooling and communication in luminous transgenic plants. Cell Calcium. 19 (3), 211-218 (1996).
- Mithofer, A., Mazars, C. Aequorin-based measurements of intracellular Ca2+-signatures in plant cells. Biol Proced Online. 4 (1), 105-118 (2002).
- Kwaaitaal, M., Huisman, R., Maintz, J., Reinstadler, A., Panstruga, R. Ionotropic glutamate receptor (iGluR)-like channels mediate MAMP-induced calcium influx in Arabidopsis thaliana. Biochem J. 440 (3), 355-365 (2011).
- Ranf, S., Eschen-Lippold, L., Pecher, P., Lee, J., Scheel, D. Interplay between calcium signalling and early signalling elements during defence responses to microbe- or damage-associated molecular patterns. Plant J. 68 (1), 100-113 (2011).
- Zhu, X. H., Feng, Y., Liang, G. M., Liu, N., Zhu, J. K. Aequorin-based luminescence imaging reveals stimulus- and tissue-specific Ca2+ dynamics in Arabidopsis plants. Mol Plant. 6 (2), 444-455 (2013).
- Kiegle, E., Moore, C. A., Haseloff, J., Tester, M. A., Knight, M. R. Cell-type-specific calcium responses to drought, salt and cold in the Arabidopsis root. Plant J. 23 (2), 267-278 (2000).
- Miyawaki, A., et al. Fluorescent indicators for Ca2+ based on green fluorescent proteins and calmodulin. Nature. 388 (6645), 882-887 (1997).
- Koldenkova, V. P., Nagai, T. Genetically encoded Ca2+ indicators: properties and evaluation. BBA Mol Cell Res. 1833 (7), 1787-1797 (2013).
- Choi, J. Identification of a plant receptor for extracellular ATP. Science. 343 (6168), 290-294 (2014).
- Choi, W. G., Toyota, M., Kim, S. H., Hilleary, R., Gilroy, S. Salt stress-induced Ca2+ waves are associated with rapid, long-distance root-to-shoot signaling in plants. Proc Natl Acad Sci USA. 111 (17), 6497-6502 (2014).
- Evans, M. J., Choi, W. G., Gilroy, S., Morris, R. J. A ROS-assisted calcium wave dependent on atrbohd and tpc1 propagates the systemic response to salt stress in Arabidopsis roots. Plant Physiol. 171 (3), 1771-1784 (2016).
- Nagai, T., Sawano, A., Park, E. S., Miyawaki, A. Circularly permuted green fluorescent proteins engineered to sense Ca2+. P Natl Acad Sci USA. 98 (6), 3197-3202 (2001).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nat Biotechnol. 19 (2), 137-141 (2001).
- Akerboom, J., et al. Crystal structures of the GCaMP calcium sensor reveal the mechanism of fluorescence signal change and aid rational design. J Biol Chem. 284 (10), 6455-6464 (2009).
- Okumoto, S. Quantitative imaging using genetically encoded sensors for small molecules in plants. Plant J. 70 (1), 108-117 (2012).
- Ohkura, M., Matsuzaki, M., Kasai, H., Imoto, K., Nakai, J. Genetically encoded bright Ca2+ probe applicable for dynamic Ca2+ imaging of dendritic spines. Anal Chem. 77 (18), 5861-5869 (2005).
- Tallini, Y. N. Imaging cellular signals in the heart in vivo: cardiac expression of the high-signal Ca2+ indicator GCaMP2. Proc Natl Acad Sci USA. 103 (12), 4753-4758 (2006).
- Tian, L. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat Methods. 6 (12), 875-881 (2009).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. J Neurosci. 32 (40), 13819-13840 (2012).
- Pedelacq, J. D., Cabantous, S., Tran, T., Terwilliger, T. C., Waldo, G. S. Engineering and characterization of a superfolder green fluorescent protein. Nat Biotechnol. 24 (1), 79-88 (2006).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Murashige, T., Skoog, F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiol Plant. 15 (3), 473-497 (1962).
- Baum, G., Long, J. C., Jenkins, G. I., Trewavas, A. J. Stimulation of the blue light phototropic receptor NPH1 causes a transient increase in cytosolic Ca2+. Proc Natl Acad Sci USA. 96 (23), 13554-13559 (1999).
- Johnson, C. H. Circadian oscillations of cytosolic and chloroplastic free calcium in plants. Science. 269 (5232), 1863-1865 (1995).
- Johnson, C. H. Circadian oscillations of cytosolic and chloroplastic free calcium in transgenic luminous plants. Plant Physiol. 114 (3), 1408-1408 (1997).
- Harada, A., Shimazaki, K. I. Phototropins and blue light-dependent calcium signaling in higher plants. Photochem. Photobiol. 83 (1), 102-111 (2007).
- Plieth, C., Hansen, U. P., Knight, H., Knight, M. R. Temperature sensing by plants: the primary characteristics of signal perception and calcium response. Plant J. 18 (5), 491-497 (1999).
- Meyerhoff, O., et al. AtGLR3.4, a glutamate receptor channel-like gene is sensitive to touch and cold. Planta. 222 (3), 418-427 (2005).
- Knight, M. R., Campbell, A. K., Smith, S. M., Trewavas, A. J. Transgenic plant aequorin reports the effects of touch and cold-shock and elicitors on cytoplasmic calcium. Nature. 352 (6335), 524-526 (1991).
- Legue, V. Cytoplasmic free Ca2+ in Arabidopsis roots changes in response to touch but not gravity. Plant Physiol. 114 (3), 789-800 (1997).
- Koo, A. J. K., Gao, X. L., Jones, A. D., Howe, G. A. A rapid wound signal activates the systemic synthesis of bioactive jasmonates in Arabidopsis. Plant J. 59 (6), 974-986 (2009).
- Mousavi, S. A., Chauvin, A., Pascaud, F., Kellenberger, S., Farmer, E. E. GLUTAMATE RECEPTOR-LIKE genes mediate leaf-to-leaf wound signalling. Nature. 500 (7463), 422-426 (2013).
- Kirchner, S. M., Doring, T. F., Saucke, H. Evidence for trichromacy in the green peach aphid, Myzus persicae (Sulz.) (Hemiptera : Aphididae). J Insect Physiol. 51 (11), 1255-1260 (2005).
- Prince, D. C., Drurey, C., Zipfel, C., Hogenhout, S. A. The leucine-rich repeat receptor-like kinase BRASSINOSTEROID INSENSITIVE1-ASSOCIATED KINASE1 and the cytochrome P450 PHYTOALEXIN DEFICIENT3 contribute to innate immunity to aphids in Arabidopsis. Plant Physiol. 164 (4), 2207-2219 (2014).
- Chaudhary, R., Atamian, H. S., Shen, Z. X., Brigg, S. P., Kaloshian, I. GroEL from the endosymbiont Buchnera aphidicola betrays the aphid by triggering plant defense. Proc Natl Acad Sci USA. 111 (24), 8919-8924 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。