Method Article
磁共振显微镜下切除活体脑组织的代谢支持
摘要
当前的协议描述了一种方法, 用户可以在收集磁共振显微镜数据的过程中维持急性海马和皮质切片准备工作的可行性。
摘要
本议定书描述的程序, 以支持正常代谢功能的急性脑切片准备在收集磁共振 (MR) 显微镜数据。虽然有可能执行 MR 收集活体, 切除哺乳动物组织, 这样的实验传统上受到限制的分辨率限制, 因此无法可视化组织显微结构。相反, 实现了显微图像分辨率的 MR 协议需要使用固定的样本来满足在冗长的扫描时间内静态、不变的条件的需要。当前的协议描述了第一个可用的 mr 技术, 它能够在显微镜分辨率下对活体、哺乳动物组织样本进行成像。这类数据对于理解微观层面的 pathology-based 对比变化如何影响宏观 MR 扫描的内容, 如临床中使用的, 具有重要意义。一旦认识到这一点, 就可以发展出更灵敏和更准确的诊断方法, 这将直接转化为早期疾病治疗、更准确的治疗监测和改善患者结局。
虽然所描述的方法侧重于脑切片的准备, 该协议适用于任何切除组织切片, 因为改变了气体和液的准备, 以适应组织的特定代谢需要。该协议的成功执行应导致生活, 急性切片准备, 展示 mr 扩散信号稳定的时间长达15.5 小时。目前的系统的主要优势, 其他 mr 兼容灌注设备是它与 mr 显微镜硬件的兼容性, 以获得更高的分辨率图像和能力提供恒定的, 不间断的流动, 仔细规范的液条件。减少样本吞吐量是这个设计的考虑因素, 因为一次只有一个组织切片可以成像。
引言
由于磁共振成像 (MRI) 系统已稳步发展到越来越高的场强, 更多的细节有关的组成和状态的活体组织已成为可辨。尽管有这样的硬件进展, 磁共振成像在分辨率足以可视化组织细胞结构仍然没有在诊所。因此, 在考虑临床扫描的内容时, 必须推断组织的细胞水平特征。这种推断需要了解从模型系统中所采集的数据中收集到的等价过程, 可以直接观察到。传统上, 这些模型包括来自水生生物的细胞, 如爪蟾的卵细胞和兔 californica L7 神经元1,2。这些是第一个动物细胞, 可供观察与 MR 方法, 由于其超大尺寸: 约1000μ m 和300微米直径, 分别。最近, 硬件设计的进步使得哺乳动物细胞的一个最大的例子-α-运动神经元-将使用 MR 显微镜技术在固定组织上成像3,4。虽然这些研究表明使用 mr 直接可视化哺乳动物的细胞材料, 这些固定样本在其 mr 特性中有很大的不同, 因此不能作为等效的代表性模型5, 6。更重要的是, 观察与复杂的生物过程相结合的 mr 对比变化需要活体样本, 在成像实验过程中可以被摄动和测量。
为方便 mr 显微镜对活体组织的研究, 提出了一个协议, 其中包括商业显微硬件7接口的 purpose-built, MR 兼容, 内径氧和灌注装置以前所描述的8.这种设计的独特优势包括哺乳动物组织中的细胞级分辨能力, 以及在组织灌注部位对溶解气体含量和 pH 值的精确控制。此外, 与大多数的外植体 MR 研究, 中断灌注在图像采集, 以避免流动文物, 这种设计支持使用连续灌注的数据收集, 已表明, 以改善生理状况分离的组织9,10。最后, 它的闭合记录室和切片保留硬件帮助减少可能发生在长时间的图像收集过程中的运动工件的可能性。
虽然当前的协议描述了适用于急性海马和皮质切片的程序, 但对液代谢物的精确控制使这个系统能够容纳各种各样的组织类型和实验条件。此设计的局限性包括与多层灌注室11相比, 样品吞吐量降低;但是, 在将来使用 multi-coil 数组时, 此限制可能会被克服。
此外, 虽然所描述的系统可以在水平或垂直配置中使用, 但当前协议的特点是它在垂直定向的 600 MHz 光谱仪中的应用。任何能够进行 MR 显微研究的系统--通常是窄孔 (6 厘米)、高场强 (≥500 MHz) 光谱仪--都将容纳所描述的氧和灌注设备。但是, 对成像线圈、渐变、探头系统或其他必需的成像硬件的更改可能需要改变灌注设备和 mr 扫描参数。
研究方案
所有动物实验都遵循美国国家科学院和 #39 的指导原则; 实验室动物的护理和使用指南 , 并得到佛罗里达大学和 #39 的审查和批准;机构动物保育和使用委员会 (IACUC)。从事动物学科研究时, 遵循所有适用的规章制度.
1. 准备用于维护中枢神经系统组织的液
- 制作新鲜的人工脑脊液 (aCSF).
- 生成2升碳酸氢 aCSF 液, 用双蒸馏或反渗透法将1500毫升的水净化成4升烧瓶。将磁性搅拌棒放在烧瓶中, 用搅拌板搅动液体.
- 入纯净的水, 溶化以下数量盐: 14.03 g (120 毫米) 氯化钠, 4.37 g (26 毫米) 碳酸氢钠, 0.41 g (1.5 毫米) 二磷酸钾, 0.69 g (1.4 毫米) 硫酸镁七水合物, 0.59 g (2 毫米) 钙氯二水合物, 0.45 克 (3 毫米) 氯化钾, 和3.6 克 (10 毫米) 葡萄糖.
注: 液的化学成分将根据组织的特定代谢要求和实验所需的条件而有所不同. - 将此解决方案彻底混合, 直到所有盐溶解。使用额外的纯净水调整音量到2升.
- 使用冰点凹陷 osmometer 测试 aCSF 的渗透。使用山梨醇调整到 300 mOsm/千克。添加324毫克山梨醇到2升 299 mOsm/千克 aCSF 液将增加渗透到 300 mOsm/千克 (约 1 mOsm 每 324mg).
注: aCSF 可存储在4和 #176; C 在密闭的密封瓶中, 有效期不超过24小时.
2。设置灌注系统
- 准备 aCSF 液.
- 平衡 aCSF 到环境温度 (〜23和 #176; C), 而气体与95% 卡波金 (95% O 2 , 5% CO 2 ; 1/16 升/分) 通过直接冒泡不少于 1 h。 注: 不同的组织类型或所需的实验条件可能需要调整液温度或气体含量。液中溶解气体含量的理想条件可以通过改变供应气体各组分的百分比浓度 ( 图 1 ) 来精确控制.
- 一旦 aCSF 达到所需的温度和卡波金饱和度, 请确认 pH 值在生理范围 (7.3-7.4)。在整个实验过程中, 继续向液油藏 (1/16 升/分钟) 直接注入气泡气体, 以保持适当的溶解氧含量和有利于健康组织新陈代谢的 pH 条件.
- 是灌注线的质数。
- 将连接到蠕动微泵的进气管浸入准备好的 aCSF (300 mOsm, pH 7.3-7.4, 连续的毒气).
- 通过氧设备 ( 图 2 ) 和通过磁孔和渐变线圈堆叠 (顶部到底部) 的灌注线, 并将线圈放在一旁直到探头总成。将氧挂在烧杯上方, 以捕捉任何 aCSF 流出物.
注: 根据 MRI 系统设计, 灌注线可能需要通过磁铁孔和梯度线圈或探头体基础, 然后再启动系统与 aCSF。确认在开始启动程序之前, 灌注线放置不会干扰探头本体的装配或探头插入钻孔. - 确认预定的流量 (2 毫升/分钟) 被选中, 并开始通过在泵上切换来填充灌注线.
- 反转空的在线气泡补漏白, 以便 aCSF 将置换内部包含的空气.
- 将氧和 #39; s 气体端口连接到卡波金的第二个源 (流形或二次卡波金圆柱), 并设置1/16 升/分的流量.
- 确认卡波金流经氧和 #39 的气体交换膜, 将氧上的排气口浸入水中.
- 一旦 aCSF 被检测到从灌注室滴下, 通过手动搅动从流入管线中清除任何可见的气泡.
- 确认氧的操作正确, 将氧气电极浸入 aCSF 流出的灌注室.
注: 氧气表上的读数应接近所提供气体中所含氧气的百分比.
3。组织准备
- 安乐死
- 将一只大鼠 (125-150 克) 放入麻醉机的感应室, 并在氧气载体气体中以1升/分的速率向4% 氟烷暴露4分钟.
- 将昏迷的老鼠从麻醉室中取出.
- 通过将大鼠置于仰卧位来进行扶正反射试验。检查是否有任何动作和 #8212; 头部转动、腿部抬起、脊柱弯曲等, #8212; 指示动物正在转向它的胃.
- 通过用棉签触摸动物的张开的眼睛来执行眨眼反射测试。检查是否有任何反应和 #8212; 盖子闭合, 肌肉抽搐等和 #8212; 到这种感官输入.
- 最后, 用镊子或止血在大鼠和 #39 的脚趾之间挤压皮肤, 执行肢体退缩反射试验。检查腿部是否有屈曲.
注意: 在正自反测试结果的情况下, 不要继续 使用安乐死. - 当三反射测试中的任何一个引起反应时, 立即将鼠返回到麻醉室, 并允许另外2分钟接触到4% 异氟醚.
- 全部执行三自反测试。重复2分钟的麻醉照射必要的, 只有在完全缺乏对所有三反射试验的反应已经观察到.
- 安乐通过断头台斩首的老鼠.
- 脑切除术
- 清除大鼠脑部的毛解剖。从俯卧位置的头部开始。使用剪刀, 削减 rostrally 通过皮肤从颈部背部的鼻子和揭露头骨.
- 用钝探针从颅骨表面取出软组织.
- 从尾端工作, 用 rongeurs 切除颅骨的枕骨、顶叶和额骨.
- 用微剪刀沿纵裂切开硬脑膜, 并从两个半球剥离回层.
- 通过将头部转到仰卧位并将颅神经切断到腹侧, 将大脑从颅骨中移除.
- 切片隔离
- 将大脑返回到俯卧位, 并通过移除所有的组织尾向横裂, 并侧至伞, 将含有海马体的中心部分隔离。沿横向平面 ( 即 冠状切片) 进行两次切口, 用直刃刀片.
- 用氰胶水将脑部和 #39 的尾部-大多数的飞机 vibratome 到中心的切割槽中.
- 添加 ice-cold, 卡波金起泡 aCSF 到 vibratome 切割浴缸, 并将尼龙固定件放在里面.
- 切割300和 #956; m 厚切片以获得每个半球的3到4可用切片准备 (6 到8总数).
- 从一个半球分离海马体或皮质区, 并修剪切片, 使其适合于圈和 #39; 5 毫米直径的组织.
4。样品定位和灌注系统组件
- 线圈准备
- 填充 microcoil 和 #39 的组织室, 由 vibratome 和 #39 的带氧 aCSF, 用转移吸管切割槽. 使用解剖范围,
- 采用修剪的大脑样本并将感兴趣的区域 (eg. 锥体细胞层) 放置在圈上.
- 插入组织固定装置 (尼龙网网贴在尼龙垫圈上) 在整个成像实验中保留样品位置.
注: 快速通过样品定位过程, 以尽量减少暴露在强光。根据需要使用转移吸管提供额外的含氧 aCSF.
- 装配内径氧、圈和探头
- 将修改后的圈组件 ( 图 3 ) 固定在表钳中, 并通过插入缩醛支持钉在线圈上的孔上.
- 通过将灌注室放置在圈和 #39 的组织上, 并使用微型电缆领带将两者可以在一起, 来密封灌注系统.
- 使用线切割器从电缆领带上修剪多余长度.
注: 成功密封后, 应观察流出线的液, 在灌注室的硅胶密封周围不应出现渗漏现象。在探头装配前无法确认这些条件可能会对成像硬件造成严重损害. - 一旦 aCSF 可以被看见滴入废物水库, 采取圈和氧并且附有装配对成像探针身体的顶端.
- 将渐变堆栈滑过组件并将渐变置于探测器顶部。提供了详细说明线圈、氧和探头硬件组件的相对位置和正确连接的照片 ( 图 4 ).
5。执行 MR 图像收集
- 将组装的探头插入磁铁孔
- 将探头本体靠近磁谱仪孔打开在磁体的底部.
- 通过在磁体顶部的孔开口处收回多余的灌注线长度.
- 一旦所有可用的时差都已从灌注管线中取出, 则将探头体推进底座上的磁铁孔, 同时从钻孔顶部的灌注管线中去除更多松弛.
- 将探头底座上的两个固定螺钉固定到填充堆栈的相应插槽中.
- 在进行检查前, 请确认 aCSF 流出到废物库中时, 在探针插入过程中没有挤压或避免灌注线.
注: 未能确认液流出会导致永久性的灌注损伤, 并有可能对 mr 成像硬件造成灾难性的损害. - 在没有液的情况下, 将返回线移到废物库中, 卸下探测器体并确认液流在尝试重新插入之前已再次出现。先前已描述了组合灌注系统和成像光谱仪的示意图布局 8 .
- 连接探头体
- 将流入和流出的流水线从渐变冷水机组上连接.
- 打开渐变冷水机的泵, 确认水温设置 (19 和 #176; C).
- 使用软管钳将空气冷却器装置的空气软管连接至探头本体.
- 将空冷水机组上的流量旋钮转至 #34; 1 #34; 位置.
- 将热电偶线连接到探头本体.
- 将同轴电缆从前连接到探头本体和 #39; s 质子 (H) 通道上的射频输入/输出.
- 将渐变放大器上的电源线连接到探测体.
- 在 RF 机箱内, 打开 B0 补偿单元的电源, 所有三渐变放大器 (x、y、z) 和主设备.
- 准备分光计
- 使用控制台上的可变温度调整模块设置预期的钻孔温度.
- 匹配 (阻抗) 和调谐 (频率) 射频电路通过调整探头内的可变电容器。这是通过操纵探针体底部的魔杖来完成的.
- 调整光谱仪的当前设置和 #39 的垫片线圈, 使样品的磁场均匀性最大化.
- 开始图像收集
- 收集先导图像以确定样品在磁体孔内的空间位置。二维梯度回波的典型参数如下 (TR/TE = 100/4 毫秒, 平均值 = 1, 脉冲角度 = 30 o , 时间 = 6 秒, 矩阵 = 64 x 64, 视野 = 0.3 x 0.3 cm, 分辨率 = 47 x 47 和 #956; m).
- 收集扩散加权飞行员, 以确认适当的扫描几何和组织的位置, 如果适用。二维扩散加权先导扫描的典型参数如下 (TR/TE = 2000/11.6 毫秒, 时间 = 4.3 分钟, #916; = 6 毫秒, and #948; = 1 毫秒, 平均值 = 1, b = 1200 (1860 有效) s/mm 2 , 矩阵 = 64 x 64, 视图字段 = 0.2 x 0.2 cm, 分辨率 = 31 和 #956; m).
- 采集扩散加权时间序列来确定急性切片制备的稳定性特征。二维扩散加权图像的典型参数如下 (TR/TE = 2000/11.6 毫秒, 时间 = 1.5 小时, #916; = 6 毫秒, #948; = 1 毫秒, 平均值 = 42, b = 十三世纪年代/mm 2 , 矩阵 = 64 x 64, 视图字段 = 0.2 x 0.2 cm, 分辨率 = 31 和 #956; m)。注: 在给定系统中, 特征稳定性的特征将因所描述的协议而异, 具体取决于所使用的 mr 对比度 (例如 T1,T2、扩散、易感性)、物理摄动以及单位时间内的 mr 信号变化所产生的扰动.
结果
液制剂
在成功就业的内径氧化装置, 在供应的卡波金的气体将达到100% 饱和的条件, 在 aCSF 液。这可以通过改变所提供气体的氧浓度, 并使用氧气计 (图 1)8来测量灌注室内 aCSF 液中溶解氧含量的变化。根据亨利定律, 与液体样品相平衡的溶解气体量与该气体的分压成正比, 条件是温度保持不变12。利用这一知识和精确气体标准, 可以量化 aCSF 样品中所含溶解氧的数量。这是通过校准氧气表使用饱和溶液 (直接冒泡1小时或以上) 的 aCSF 被暴露在已知成分的气体: 一气体高氧浓度, 如卡波金 (95% O2) 和另一个低氧浓度, 如氮气 (0% O2)。之后, 可以通过将氧电极的尖端浸入样品中进行测量。通过对灌注井的出水进行测量, 证实了孔内氧的正常工作。氧气计测量的溶解氧百分比应与供应气体中所输送的氧气浓度的百分比相匹配。如果测量值低于供应气体, 这将意味着一个硬件故障, 可能导致代谢不足的组织切片。
示例外观和行为
急性切片制剂, 接受灌注足以提供必要的代谢物和带走代谢废物很快达到相对稳定状态。从这一点, 急性切片可以受到外部扰动, 他们对这些变化的反应可以测量为科学研究。对于 MR 实验, 跟踪时间上的兴趣信号是一个常用的实践来证明急性切片准备工作的相对稳定性13。扩散加权信号是特别敏感的变化, 组织的水的流动性, 内容和分布, 可以通过使用这种对比机制来检测梗塞梗死在缺血性中风14,15。在不同的灌注条件下维持的急性皮质切片上的规范化扩散信号的绘制表明, 在组织隔离完成后 (图 5), 相对稳定 (2 ± 3%, 超过15.5 小时)。不管灌注条件 (间歇或连续) 或 MRI 扫描长度 (短 [4 分钟] 或长 [1.5 h])8, 都保持了扩散信号的稳定性。如果切片不显示信号的稳定性随着时间的推移, 如尖锐的扩散信号增加观察到活体皮层没有接受灌注, 这是暗示的次优实验条件。在确定切片准备中的稳定信号条件之前, 不应尝试进行摄动实验。
除了信号稳定性外, 在采集图像时必须确认正确的样品定位。即使样品位置在解剖显微镜下的组织放置过程中被控制, 在灌注装置的组装过程中, 或者由于在插入磁体之前对线圈或探头的粗暴处理, 样品位置的变化可能发生。确定适当的海马位置可以通过收集短 (2 分钟), 试点扫描与扩散对比 (图 6)。由于锥体细胞层对扩散加权的敏感度比相邻的海马叶片更灵敏, 因此该结构在扩散权重图像中会出现一个较暗的波段。不显示此特征特性的设置包含偏心样本, 可能需要重复。
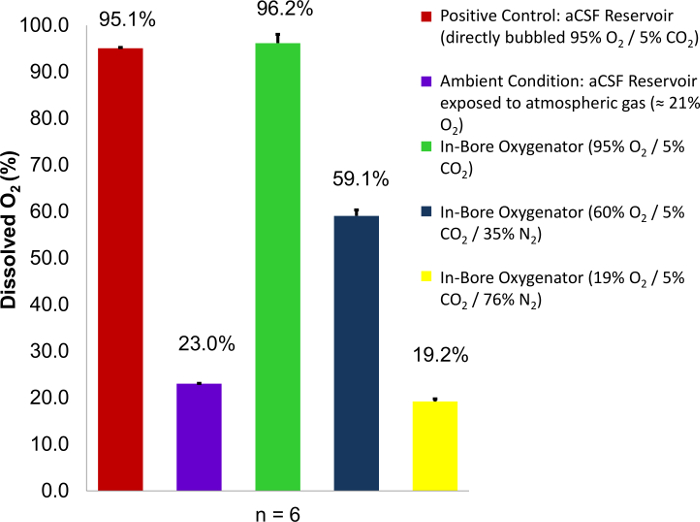
图 1: aCSF 液的溶解氧含量为提供气体中的百分比为 O2含量的函数。含有可变浓度氧的卡波金混合物 (95%、60% 和 19%) 作为供应气体使用。然后从灌注井中取出百分比的溶解氧读数, 并与两个已知的对照: 一个液油藏直接冒泡与卡波金 (95% o2), 和一个液水库暴露于大气条件 (23% o2).在每种情况下, 组织灌注部位的氧饱和度接近于所使用的卡波金混合物中的 O2浓度的100%。误差线等于样本方法的标准偏差。图在原始文章8的许可下复制。请单击此处查看此图的较大版本.
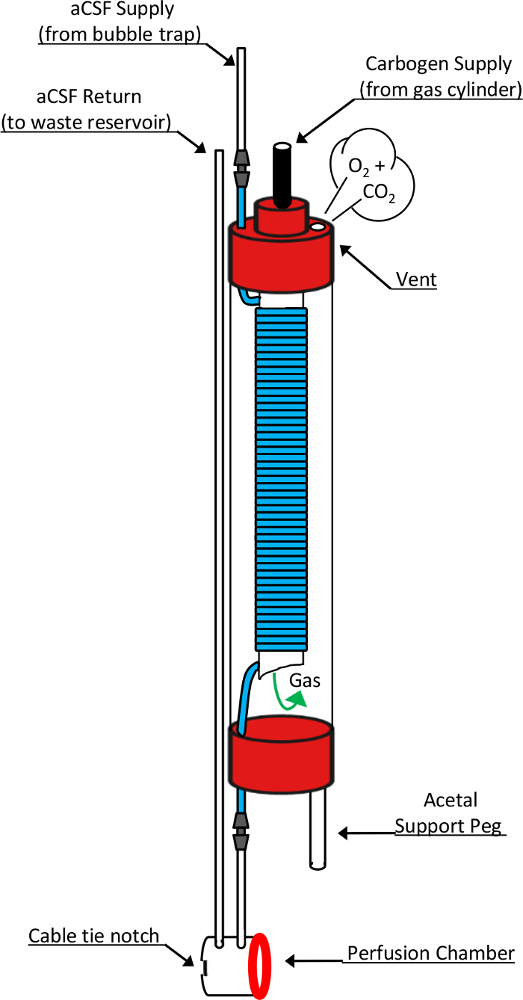
图 2: 内径氧和灌注室的示意图绘制此图显示了负责这些关键设备功能的详细设计元素。通过气泡陷阱泵出的新鲜液通过10毫米核磁共振管的顶端进入氧。在这样做, 它转变成一个高透气性硅管 (蓝色段), 盘绕在一个开放的, 5 毫米核磁共振管嵌套内。卡波金气体通过顶部的5mm 管进入会议厅, 通过开放式的底部, 并通过了连续的硅胶油管前退出氧通过一个排气孔在10毫米管帽。在这种曝光过程中, 流经硅胶管的液会与所提供的气体混合物的化学成分饱和。在退出氧, 液直接进入灌注室前进入返回线导致废物收集水库。对此设计至关重要的其他组件包括缩醛支持 peg, 它允许氧垂直站在修改的 RF 圈上, 一个硅胶垫圈 (红色环), 它形成氧的灌流室和圈的组织良好, 和电缆领带缺口, 可容纳电缆领带的位置, 用来形成这种可逆的印章。此图已经过修改, 并在原始文章8的许可下进行了复制。请单击此处查看此图的较大版本.

图 3: 对圈程序集的修改, 允许接口到内径氧.两个凹槽3.0 毫米 x 1.5 毫米 (黑箭头) 被切开了到装配的边, 适应宽度的缆绳领带用于密封灌注室。一个通道 (15 毫米 x 3 mm x 4 mm) 连接在线圈的后表面的树丛。两个尼龙空间放置在通道的两侧 (红色箭头) 作为一个捕捉的电缆领带头, 简化了密封程序。在线圈总成的顶部钻孔 (2 mm x 14 mm) (黄色的哦) 加入缩醛支持钉, 以确保氧。此图已经过修改, 并在原始文章8的许可下进行了复制。请单击此处查看此图的较大版本.

图 4: 照片蒙太奇详细介绍了圈、氧和探头组件的相对位置和正确的装配.这些图像功能的关键硬件组件的氧和 microperfusion 设备, 并说明如何独立的部件相互之间的接口。(A)分解-视图照片显示所有组件在密封组织井或探头本体的组装之前的相对位置。已注意准确显示零件的相对位置;然而, 在这个系列中, 一节灌注线已经翻了一倍, 使所有的元件都适合于图像框架内。(1 = 探针头, 2 = 圈汇编, 3 = 尼龙组织保留圆环, 4 = 灌注井, 5 = 缆绳领带, 6 = 在孔氧, 7 = 梯度卷, 8 = 泡影陷井)。(B)组件跟随线圈和氧总成。在这个图像中, 尼龙固定环已被放置在圈的组织, 以确保一个样本。氧底部的缩醛支撑钉已固定在圈上的相应孔上。在灌注井的开口端上的硅胶垫片被放置在组织上, 并且在这些部件周围收紧了电缆栓以密封灌注室。最后, 圈的底座已连接到探头头的顶部。(C)组件跟随探测程序集。在最后一个面板中, 电缆领带的长度超过了圈。梯度线圈堆叠, 然后滑入到位, 小心推进气缸向探头, 而通过过剩的灌注线, 氧, 并通过其中空中心圈。一旦梯度连接到探头头上, 它们就会通过拧紧探针上的固定项圈, 在渐变的螺纹底座上进行。请单击此处查看此图的较大版本.

图 5: superfused 急性皮质切片的扩散信号稳定性.(A)对不同流范式的四急性切片的规范化扩散信号值在一段时间内被绘制, 在安乐死后长达21.5 小时。切片在其初始扩散信号测量的±5% 内保持在15.5 小时之后, 无论流是连续的还是间歇性的, 独立于 MR 扫描长度 (1.5 小时或4分钟)。从甲醛固定皮层的信号记录作为阳性对照 (n = 1) 的稳定性由于固定组织样品的静态, 不变的性质。相反, 在活切片中测量的流支持 (n = 1) 的扩散信号是代谢缺陷的控制。不同流试验的试验参数如下: 连续 (流总是 on, 每次扫描时间 = 1.5 小时), 间歇性 (流在扫描间隔10分钟, 每次扫描 = 1.5 小时), 长间隔, 长扫描 (流扫描期间, 但暂停10分钟之间的扫描, 每次扫描 = 1.5 小时), 长时间间隔, 短扫描 (流1.5 小时间隔扫描, 每次扫描时间 = 4 分钟)。(B)分析了从面板 (A) 中显示四活切片流实验的组方法的数据。从分组, superfused 皮层切片的扩散信号剖面显示, 随着时间的推移变化不大 (2 ±3% 以上15.5 小时), 而 non-perfused 控制 (n = 1) 在实验早期表现出戏剧性的信号不稳定性 (15% 到 6.5 h)。此图已经过修改, 并在原始文章8的许可下进行了复制。请单击此处查看此图的较大版本.
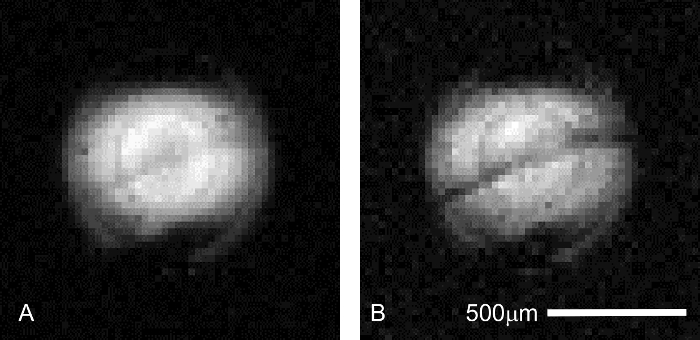
图 6: 在先导成像过程中确认海马切片的位置.在运行一个延长磁共振显微镜会议之前, 正确放置的样本是至关重要的, 以确保资源, 如扫描仪时间和昂贵的液添加剂不浪费。在海马 CA1 区的锥体细胞层可以在较快的 (4.3 分钟), 低分辨率 (31 μ m x 31 μ m 在平面内) 试点扫描, 以确保利益组织正确放置在与微线圈。两个图像共有的扫描参数如下: TR/TE = 2000/11.6 毫秒, δ = 6 毫秒, δ = 1 毫秒, 平均值 = 1。(A) b = 0 (227 有效) s/mm2。在这个初步的扫描, 地层 pyramidale 只是可见作为一个灰色, 对角带中心在线圈的励磁剖面。(b) B = 1200 (1860 有效) s/mm2。在较高的扩散加权, 层的对比增加, 因为金字塔细胞层变得比组织在相邻的叶片 (以上: 地层 oriens; 下面: 地层 radiatum)。请单击此处查看此图的较大版本.
讨论
目前的协议描述了必要的程序, 标准代谢维护的急性脑切片准备接受磁共振显微镜。这个过程是目前唯一可用的方法, 它能使活体哺乳动物组织与 MR 在解决细胞的分辨率上可视化。虽然描述的液条件是专门针对中枢神经系统组织, 该协议是广泛适用于任何方式的活组织准备通过调整的液和气体成分以及灌注流速和温度。
在描述的过程中可能遇到的最常见的问题包括那些与代谢物供应的失败有关。由于碳酸氢盐缓冲系统的失效, 在气态不足时, 钙盐的沉淀可能发生在 aCSF 内。这种沉淀物会堵塞灌注管线, 造成严重的硬件损坏。如果在探针组装后的液中观察到盐沉淀物, 请立即关闭蠕动泵, 停止灌流。确认存在足够的碳酸氢钠水平 (4.37 克/2 升) 在液, CO2级 (5.0%) 的供应气体, 和卡波金气体流量 (1/16 升/分钟) 到两个水库和氧。最后, 确定 pH 水平在生理范围内 (7.3-7.4) 稳定。如果氧气和 pH 值仍未适当调节, 应更换气体交换膜。
如果切片在预期的实验时效上不显示信号稳定性, 请确认 aCSF 混合物中存在正确的化学成分, 并且保持正确的渗透 (300 mOsm) 和 pH 值 (7.3-7.4)。此外, 确保卡波金天然气供应到液水库和氧在1/16 升/分钟。如果这些步骤不正确的液条件, 更换气体交换膜建议。如果在排除液条件后组织稳定性不达标, 应考虑手术方案的细化, 重点是尽量减少组织收获和灌注应用之间的时间间隔。
披露声明
作者没有利益冲突透露。
致谢
这项工作得到了国家卫生研究院 (1R21NS094061-01A1) (NIH 1R01EB012874-01) (S10RR031637) 和国家科学基金会 (合作协议 No.) 的资助。DMR-1157490) 通过国家高磁场实验室 (NHMFL) 先进的磁共振成像和光谱学 (序号) 设施在 UF 和佛罗里达州。
材料
| Name | Company | Catalog Number | Comments |
| Perfusate Preparation | |||
| Osmette A | Precision Systems Inc. | 5002 | freezing point depression osmometer |
| Stir Plate Type 1000 | Barnstead/Thermodyne | SPA1025B | magnetic stir plate with heating element |
| Accumet Basic pH Meter | Fisher Scientific | AB15 | pH Meter |
| pH Probe | Fisher Scientific | 13-620-AP61 | probe for pH measurement |
| Oxygen Meter | Microelectrodes Inc. | OM-4 | meter for sampling the oxygen content of gasses or the disolved oxygen content of liquid perfusates |
| Oxygen Electrode | Microelectrodes Inc. | MI-730 | microprobe for the oxygen meter |
| Scale | Denver Instrument Co. | A-160 | microscale for weighing chemical components |
| Name | Company | Catalog Number | Comments |
| Slice Preparation | |||
| Lancer Vibratome | Ted Pella Inc. | Series 1000 | vibratory tissue slicer |
| Disecting Microscope | Carl Zeiss Inc. | OPMI 1-FC | tabletop, binocular disecting microscope |
| Name | Company | Catalog Number | Comments |
| Perfusion System | |||
| Masterflex L/S | Cole-Parmer | 7523-50 | peristaltic micro perfusion pump |
| Oxygen Regulators x 2 | Victor Medical | VMG-05LY | device for regulating gas flow |
| e-sized carbogen cylinders x 2 | Airgas | gas tanks containing carbogen gas | |
| in-bore oxygenator | developed in house | device responsible for pH and oxygen regulation in the perfusate | |
| Name | Company | Catalog Number | Comments |
| MR Imaging Hardware | |||
| Micro Surface Coil (200mm dia., modified) | Bruker Biospin | B6371/0001 | four-turn micro (200mm dia) surface-style radiofrequency coil |
| Micro 5 probe body | Bruker Biospin | Z3395 | microimaging probe used in the 600 MHz spectrometer |
| Micro 5 gradient coils | Bruker Biospin | M81111 | gradient coil stack used with micro 5 probe body |
| 600 MHz Spectrometer | Oxford Instruments | superconducting magnet (14.1T) used for MR image generation | |
| Imaging Console | Bruker Biospin | Avance III | support and control hardware including gradient amplifiers, preamps, & workstation used for MR image generation |
| Air Blower | Bruker Biospin | BCU-II, -80/60 | Air chiller unit used in conjunction with the probe's heating coil to regulate temperature inside the magnet bore |
| Gradient Chiller | Thermo Scientific | Neslab Merlin M33 | Water chiller used to disipate heat generated by the gradient coils |
参考文献
- Aguayo, J. B., Blackband, S. J., Schoeniger, J., Mattingly, M. A., Hintermann, M. Nuclear magnetic resonance imaging of a single cell. Nature. 322, 190-191 (1986).
- Schoeniger, J. S., Aiken, N., Hsu, E., Blackband, S. J. Relaxation-time and diffusion NMR microscopy of single neurons. J. Magn. Reson. B. 103, 261-273 (1994).
- Flint, J. J., et al. Magnetic resonance microscopy of mammalian neurons. Neuroimage. 46, 1037-1040 (2009).
- Flint, J. J., et al. Magnetic resonance microscopy of human and porcine neurons and cellular processes. Neuroimage. 60, 1404-1411 (2012).
- Kamman, R. L., Go, K. G., Stomp, G. P., Hulstaert, C. E., Berendsen, H. J. C. Changes of Relaxation times T1 and T2 in rat tissues after biopsy and fixation. Magn. Reson. Imag. 3, 245-250 (1985).
- Shepherd, T. M., Thelwall, P. E., Stanisz, G. J., Blackband, S. J. Aldehyde fixative solutions alter the water relaxation and diffusion properties of nervous tissue. Magn. Reson. Med. 62, 26-34 (2009).
- Massin, C., Boero, G., Vincent, F., Abenhaim, J., Besse, P. -. A., Popovic, R. S. High-Q factor RF planar microcoils for micro-scale NMR spectroscopy. Sensor. Actuat. A-Phys. 97, 280-288 (2002).
- Flint, J., Menon, K., Hansen, B., Forder, J., Blackband, S. J. A microperfusion and in-bore oxygenator system designed for magnetic resonance microscopy studies on living tissue explants. Sci. Rep. 5, 18095 (2015).
- Khong, Y. M., et al. Novel intra-tissue perfusion system for culturing thick liver tissue. Tissue Eng. 13 (9), 2345-2356 (2007).
- Schumacher, K., Khong, Y. -. M., Chang, S., Ni, J., Sun, W., Yu, H. Perfusion culture improves the maintenance of cultured liver tissue slices. Tissue Eng. 13 (1), 197-205 (2007).
- Shepherd, T. M., Blackband, S. J., Wirth, E. D. Simultaneous diffusion MRI measurements from multiple perfused rat hippocampal slices. Magn. Reson. Med. 48, 565-569 (2002).
- Henry, W. Experiments on the quantity of gases absorbed by water, at different temperatures, and under different pressures. Phil. Trans. R. Soc. Lond. 93, (1803).
- Bui, J. D., Buckley, D. L., Phillips, M. I., Blackband, S. J., Blümler, P., Blümich, B., Botto, R., Fukushima, E. Studies of perfused brain slices with MR microscopy. Spatially Resolved Magnetic Resonance. , 337-343 (1998).
- Moseley, M. E., et al. Early detection of regional cerebral ischemia in cats: Comparison of diffusion- and T2-weighted MRI and spectroscopy. Magn. Reson. Med. 14 (2), 330-346 (1990).
- Moseley, M. E., et al. Diffusion-weighted MR imaging of acute stroke: Correlation with T2-weighted and magnetic susceptibility-enhanced MR imaging in cats. Am. J. Neuroradiol. 11, 423-429 (1990).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。