Method Article
Bioink Precellularization 无源混合装置打印软骨及皮肤组织类似物的应用
摘要
软骨和皮肤类似物是 bioprinted 使用 nanocellulose 藻酸盐为基础的 bioink。在通过单步被动混合装置打印前, bioinks cellularized。证明该结构具有均匀 cellularized, 具有较高的生存能力, 并具有良好的分化标志。
摘要
打印是一种用于组织工程应用的快速、可重复制造的强大技术。在这项研究中, 软骨和皮肤类似物是捏造后, bioink pre-cellularization 利用一种新的被动混合单位技术。这项技术的目的是简化的步骤涉及混合的细胞悬浮成一个高度粘性的 bioink。通过打印沉积的纤维的分辨率, 必须保证在印刷之前细胞分布的均匀性, 以避免没有细胞的区域的沉积, 或能堵塞针头的大细胞团块的滞留。我们证明了在打印软骨和皮肤类似物之前, bioink 细胞悬浮的能力。两种组织类似物都可以培养长达4周。组织学分析显示细胞活性和沉积的组织特异细胞外基质 (ECM) 标记, 如多糖 (堵嘴) 和胶原蛋白 I 分别。
引言
最近几年, 三维 (3D) 打印技术已经变得更容易被研究人员利用, 使得这种技术可以更广泛地用于组织类似物的制造。打印承诺通过促进快速和可重复的多层面组织结构的制造来革命性生物医学研究。打印技术的关键在于能够精确控制生物材料 (称为 bioinks) 在三维度的沉积。这使得形成具有不同区域的基质组成、生物活性因子和细胞的复杂支架能够更准确地重述本机组织结构。
打印已被用于制造许多组织应用, 包括软骨1, 皮肤的2, 肌肉3, 和骨4。这些组织是有吸引力的打印由于其固有的条纹微结构, 适用于重述通过层的沉积。特别是, 皮肤拥有一个定义良好的多层结构5, 这是适用于制作通过分层沉积技术, 如打印。此外, 打印可用于生成具有必要的解剖尺寸和形状来修复组织缺损的构造。能够产生患者特定的大小和形状的生物材料6可以开始解决对许多组织的部分修复的需求, 包括但不限于骨缺损、软骨损伤和皮肤病变, 其程度因病人.
在这项研究中, 两个组织类似物 (关节软骨和皮肤) 是通过打印 pre-cellularized bioinks。确保适当的混合 bioink 与细胞悬浮, 可以确保均匀的细胞分布, 同时保持细胞活力可能是一个挑战。Bioinks 适合打印通过挤出通常是高度粘性, 因此需要广泛的混合, 以确保均匀混合。对细胞的机械损伤在苛刻的混合条件下可能发生, 并且消极地影响生存能力。研究表明, 在喷墨打印过程中, 大多数细胞死亡发生在准备过程中, 如混合7,8。虽然传统的搅拌与搅拌9可能足够低粘度 bioinks 适用于喷墨打印10, 混合的细胞到高粘度 bioink 更适合挤出打印更困难。为了满足这一需要, 在印刷过程11中, 混合喷嘴的使用变得更加 bioinks。这些混合器也被广泛应用于微的研究, 其中混合的低雷诺数的流体是重要的12。利用连续混合过程将细胞悬浮液混合成 bioink, 可以在印刷过程中保持均匀。然而, 由于细胞悬浮液具有低粘度相比, bioink, 困难将出现在防止沉淀的细胞在印刷过程中9,13,14。或者, 在打印前将单元格混合到 bioink 中可能会解决此问题。
为了最大限度地减少细胞死亡在混合到一个 bioink, 我们开发了一种技术的基础上的被动混合单位, 以混合细胞成一个 bioink 在最小的步骤数。通过混合单元通过物料流动产生的混沌混合, 足以将两个组件性混合在一起15,16。这种方法主要是为了简化任何细胞悬浮与任何 bioink, 适用于挤出打印混合。混合过程中的步骤数被最小化, 以消除混合中的用户变化。过多的混合步骤可能会耗费大量时间, 不适用于所有 bioinks, 尤其是在涉及单元格时。第二, 我们的目的是开发一个混合过程, 既保持不育, 并尽量减少样品损失。
在这份手稿中, 我们展示了混合的细胞悬浮与 bioink 使用被动混合装置技术, 最大限度地减少处理和结果的高细胞活力和均匀分布。这些 pre-cellularized bioinks 然后用于 bioprint 软骨或皮肤构造与一个或两个细胞类型, 分别培养长达6周。bioink 使用的是海藻酸盐-nanocellulose 混合, 它以前显示适合打印1。
研究方案
本议定书遵循了韶大学人类研究伦理委员会的指导原则。
注: 所有步骤均应在无菌生物安全柜内执行。
1. 消耗品、Bioink 和细胞的制备
- 获取两个注射器, 一个注射器 (图 1a) 用于单元悬浮, 而另一个注射器用于 bioink (图 1b)。
- 获取一个无菌的被动混合单元 (图 1c), 可以通过口锁连接与双注射器耦合。
- 获取一个配药单元 (图 1d), 它可以按控制速率同时从两个无菌注射器中挤出体积。
注: 本研究使用的混合比为10:1。因此, 使用12毫升注射器和1毫升注射器的要求, 10:1 混合单位。 - 获取一个无菌墨盒 (图 1e) 和一个无菌的女性-女性口锁连接器, 直接混合 bioink 和细胞悬浮。
- 获取或准备与细胞悬浮液混合的 bioink。
注意: 在本协议中, 使用了 nanocellulose/海藻酸盐为基础的 bioink。此 bioink 通过添加无菌 100 mM CaCl2解决方案后的打印来交联。 - 使用0.5% 胰蛋白酶/EDTA 溶液分离单元格, 并使用台盼蓝排除方法17计算单元格总数。
注意: 在这个协议中, 人成纤维细胞被利用。 - 确定最终打印结构中所需的单元格密度。使用以下方程式计算必须稀释的收获细胞的浓度, 以达到这一目标最终细胞密度。
注意: 在此协议中, 使用了 5 x 106单元/mL 的最终单元格密度。- 为实验选择一个所需的单元格浓度: C单元格 (单元/mL)。
- 根据需要的构造总数计算Vbioink所需的 bioink 数量:
Vbioink = V构造 x NContructs
注: 例如, 每个构造的 bioink 的体积是100µL。如果打印30构造, 则需要的 bioink 卷为3毫升。 - 计算所需的单元格数:
N单元格 = C单元格 (1.1 x V生物) - 重 1/10th中的单元格 (N单元格), bioink 的音量:
V单元格挂起 = 0.1 x v生物
注意: 例如, 如果 vbioink = 3 ml, 则 v单元悬浮= 0.1 x 3 ml = 0.3 ml
2. 细胞悬浮和 Bioink 的混合
- 将细胞悬浮液转移到细胞悬浮注射器中。
- 将 bioink 转移到另一注射器或获得含有 bioink 的注射器。
- 拉 bioink 注射器柱塞回, 并插入注射器到配药单位。将设备垂直放置在口锁定连接器的上方 (图 1f1)。
- 将该注射器的柱塞拉回与 bioink 注射器类似的长度, 并插入配药单元 (图 1f2)。
- 通过扭口锁连接器 (图 1f3) 将两个注射器连接到混合单元。
- 通过推动配药单元来挤出注射器内的空气来使混合系统处于最佳。在解决方案到达口锁之前停止启动 (图 1g4)。
- 启动后, 通过口锁连接器 (图 1g5) 将填充墨盒连接到混合单元的末端。确保填充盒中的柱塞在附件之前处于底部。
- 慢慢压缩 (图 1h6) 配药单元, 将 bioink 和单元悬浮混合在一起, 放入墨盒 (图 1i7)。
- 将填充盒中的柱塞向下推入无菌吸管尖端, 以接触混合后的 bioink 细胞混合物。保持配药, 直到压缩, 以确保细胞/bioink 混合物没有挤压回混合单位。
- 将墨盒盖上, 然后轻轻敲击工作表面, 将任何气泡移至墨盒顶部 (活塞端)。
注意: 此时, 细胞/bioink 混合物已准备好打印。以下各节将概述特定的应用程序和打印过程。
3. 用混合装置与手动刮刀混合法测定细胞活力
- 分离人成纤维细胞 (段落 7) 与0.5% 胰蛋白酶或 EDTA 解答在80% 汇合, 计数数字, 并且重在培养基在充足的细胞密度达到最后的集中在与 bioink (1:10 个细胞: bioink 比率) 混合以后 5 x 106单元格/mL。
- 使用被动混合单元技术 (步骤 2) 或通过刮刀将细胞混合到 bioink 中, 以评估两种技术对细胞活力的影响。
- 使用被动混合单元技术1、2或3次将电池混合到 bioink 中, 然后使用 100 mM CaCl2将其分配到交联的模具中。
注意: 要执行额外的混合, 将电池/bioink 直接混合到注射器而不是墨盒中。然后再混合的混合通过搅拌单元后的前协议, 但没有细胞注射器组件。 - 混合的细胞成一个单独的 bioink 使用手动机械混合通过刮刀 30, 60, 或九十年代. 转让混合物 (为每个混合时间) 到一个模子为交联使用100毫米 CaCl2。
- 在标准条件下交联和培养完成后, 将样品转移到一个井板上。
- 经过1天的培养, 洗涤的结构 (n = 3-4 每组) 在无血清细胞培养基30分钟. 染色溶液中的细胞 (4 µM 素 AM, 1 µM 溴 homodimer-1) 30 分钟。
- 再洗两次, 在37° c 的情况下, 在无血清细胞培养基中孵育样品, 共1小时。
4. 单细胞型软骨类似物的打印
- 绘制所需组织模拟的3D 模型。转换为打印的 Gcode 文件, 并在 bioprinter1上加载 Gcode 文件。
注意: 在本协议中, 具有尺寸 4.8 x 4.8 x 0.9 mm3的方形结构作为 STL 文件导出。使用以下设置生成了 Gcode 文件: 层厚度, 0.3 毫米;填充图案, 直线;加密密度, 25%;速度, 10 毫米/秒。 - 分离和冷冻主要人鼻腔软骨细胞 (hNC) 从患者在被参考的协议之后1。
- 在37° c 时采用标准培养基, 解冻并扩大低温保存的 hNCs, 在单层培养中扩展一次。分离细胞在 80-90% 汇合与0.5% 胰蛋白酶/EDTA 解答和计数使用台盼蓝排除协议。所有的实验都是使用 hNCs 在2通道进行的。
- 重 hNCs 100 x 106细胞/毫升, 在300µL 培养基中补充10% 胎牛血清, 1% 青霉素-链霉素, 50 µg/毫升抗坏血酸, 为与 bioink 混合的准备。
- 混合 hNC 细胞悬浮成 nanocellulose/海藻酸盐为基础的 bioink 后, 被动混合单位协议在 10:1 bioink: 细胞悬浮比获得最后的细胞浓度 9 x 106细胞/毫升。
- 确保 bioprinter 通过紫外线照射消毒, 用70% 乙醇擦拭。通过放置在层流柜中保持不育。
- 将无菌印刷喷嘴连接到包含 bioink/电池悬浮混合的墨盒, 并插入 bioprinter。
- 手动或按特定于打印机的协议校准 bioprinter。
- Bioprint 的晶格结构, 细胞载货结构使用以下印刷参数: 25G 锥形喷嘴在压力25人民军。Bioprint 无细胞结构 (与不含细胞的细胞介质混合) 作为控件。
- 通过添加 100 mM CaCl2的离子解决方案, 将结构交叉链接为 5 min. 在标准培养条件下 (37 ° c、5% CO2和95% 相对湿度), 在培养基中冲洗结构和孵育。每隔一秒或第三天更改媒体。
- 在2和4周收集样本进行组织学分析。使用新蓝色着色剂18来着色用于堵嘴生产的样品。
5. 具有两种细胞类型的皮肤类似物的打印
- 绘制所需组织模拟的3D 模型, 并转换为打印的 Gcode 文件。在 bioprinter 上加载 Gcode 文件。
注意: 在本协议中, 具有尺寸 4.8 x 4.8 x 0.9 mm3的方形结构作为 STL 文件导出。然后使用以下设置生成 Gcode 文件: 层厚, 0.3 毫米;填充图案, 直线;加密密度, 25%;速度, 10 毫米/秒。 - 准备细胞混合到 bioink 的打印。对于皮肤类似物的制备, 使用了两种细胞类型。两个细胞类型被混合到 bioink 和打印。
- 获得初级高密度纤维板。在 DMEM 生长培养基中维持这些细胞, 辅以10% 胎牛血清、1% 青霉素-链霉素和50µg/毫升抗坏血酸。分离细胞在 80-90% 汇合与0.5% 胰蛋白酶/EDTA 解答和计数。
- 在引用的协议1后面的患者中隔离和冷冻主 hNC。在单层培养中解冻和扩展冷冻 hNCs。分离细胞在 80-90% 汇合与0.5% 胰蛋白酶/EDTA 解答和计数。
- 在增长介质中, 重两个单元格类型在 100 x 106单元格/mL。混合细胞悬浮在一起在一个1:1 的比率, 以达到最终的总浓度 100 x 106细胞/毫升在300µL 的媒体。
- 混合50:50 细胞悬浮高密度纤维板和 hNC 成 nanocellulose/海藻酸盐为基础的 bioink 后, 被动混合单位协议在 10:1 bioink: 细胞悬浮比获得最后的细胞浓度 9 x 106细胞/毫升。
- 确保 bioprinter 被灭菌或放置在层流柜中以保持不育。
- 将无菌印刷喷嘴连接到包含 bioink/电池悬浮混合的墨盒, 并插入 bioprinter。
- 手动或特定于打印机的协议校准 bioprinter。
- Bioprint 的晶格结构, 细胞载货结构使用以下印刷参数: 25G 锥形喷嘴在压力25人民军。Bioprint 无细胞结构 (与不含细胞的细胞介质混合) 作为控件。
- 通过添加 100 mM CaCl2的离子解决方案, 将结构交叉链接为 5 min. 在标准培养条件下 (37 ° c、5% CO2和95% 相对湿度), 在培养基中冲洗结构和孵育。每隔一秒或第三天更改媒体。
- 在2和4周收集样本进行组织学分析。使用马尾松的三染色19来染色 i 型胶原生产的样品。
结果
结果本论文分为两部分。首先, 用机械方法或被动混合单元对细胞活力进行 post-mixing 分析。其次, 对软骨和皮肤结构进行了培养和分析, 为相关的组织学标记。
在这两种情况下, 细胞分布均呈均匀。但是, 使用刮刀 (图 2b) 进行手工混合的操作比混合使用被动混合单元 (图 2a) 有更多的方差。使用刮刀的程度、速度和混合技术高度依赖于用户。然而, 混合单元成一个 bioink 与被动混合单位标准化混合, 并尽量减少不同批次的变化。此外, 30、60和九十年代的混合时间可能不足以将大量的细胞混合成大量的 bioink。更严格的混合通过搅拌与刮刀可能是必要的。相比之下, 利用一个被动混合单位更好地保持混合比的细胞 bioink 在混合期间, 并确保一个均匀混合进行。此外, 样品损失是一个关注与传统的混合技术, bioink 可以留在后面的培养皿, 管, 和混合工具, 由于其高粘度。细胞活力高, 混合混合单位 (和 #62; 90%)1、2或3次。当采用被动混合装置时, 混匀率在缓慢稳定混合速率下约1分钟。虽然混合与刮刀显示高活力后, 混合30和六十年代, 大于九十年代的混合导致显著减少的可行性相比, 其他组 (77.9 ± 14%, p和 #60; 0.05) (图 2c)。这可能是由于过度混合造成的细胞损害。长期活/死染色后14天和28天的文化显示在补充图 1。细胞在14天开始传播, 并在28天的高度传播, 并表明良好的生存能力。
在培养后, 通过组织学分析软骨和皮肤组织的类似物。分析软骨结构在天 0, 14 和28显示了增加的数量和覆盖面的堵嘴, 通过一个新蓝色污点显示 (图 3a-3c)。在0天, 没有污渍被注意到, 而在14天, 染色仅限于细胞的近端位置。然而, 在28天的文化, 新蓝色是发现整个结构, 证明形成了 chondrocytic ECM。利用 Bioprinted 三染色 (图 3d-3f) 对胶原进行组织学染色, 分析了皮肤结构。与软骨结构相似, 天0样品没有显示胶原沉积。在14天的文化中, 大量的胶原蛋白沉积在细胞周围, 并沿着构造的表面。这是进一步加强了28天, 由于高密度胶原层被发现在建筑表面和散装。

图 1: 无源混合单元系统.(a) 1 毫升注射器用于细胞悬浮 (b) 12 毫升注射器与 bioink, (c) 配药单位, (d) 无源混合装置, (e) 灌装墨盒, (f) bioink 注射器 (1) 和细胞的组装悬浮注射器 (2) 在配药单元中, 将被动混合单元的附着在两个注射器 (3) 的末端, (g) 附着在母-雌性口锁连接器 (4) 上, 并附着在填充盒 (5) 上完成组装, (h) 将配药单元压缩为混合单元 (6), (i) 继续向下推分配单元, 将电池悬浮液与 bioink 混合, 并放入填充盒 (7)。请单击此处查看此图的较大版本.
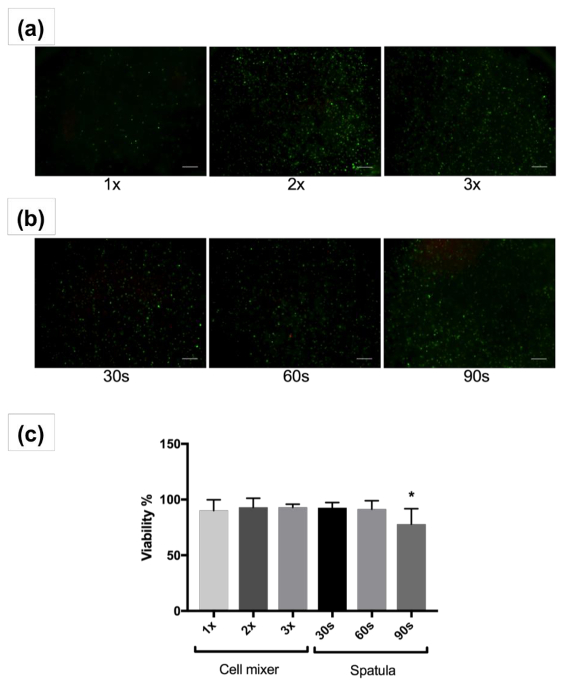
图 2: 细胞活力图像和分析.具有代表性的图像显示活 (绿色) 和死 (红色) 人成纤维细胞后混合与被动混合单元 1, 2, 或3次 (a) 或铲刀为 30, 60, 或90秒 (b) 和3D 文化为1天。显示4X 放大倍数的图像。刻度线表示200µm. (c) 人成纤维细胞与被动混合装置或刮刀和3D 文化混合后1天的平均存活率。误差线显示平均值的标准偏差, * 0.005。请单击此处查看此图的较大版本.
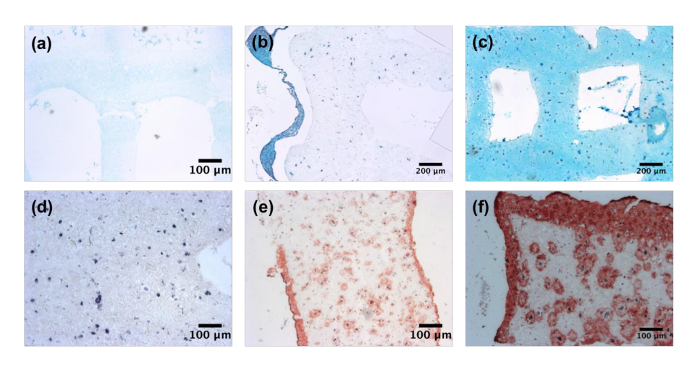
图 3:组织特异细胞外基质沉积.Bioprinted 软骨构造染色为多糖利用新蓝色在 (a) 天 0, (b) 14 和 (c) 28。在5X 放大倍数下捕获的图像。Bioprinted 皮肤构造染色的胶原 i 使用马尾松的三 (d) 天 0, (e) 14, 和 (f) 28。在5X 放大倍数下捕获的图像。请单击此处查看此图的较大版本.
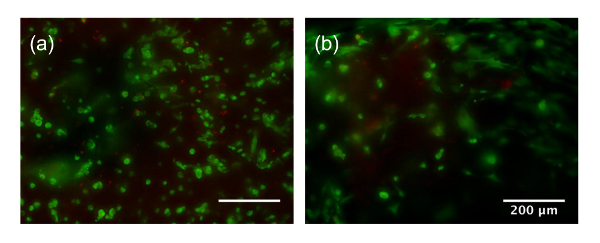
补充图 1:14 天 (a) 和28天 (b) 的单元格生存能力。刻度条是200µm, 绿色指活细胞, 红色指死细胞。请单击此处查看此图的较大版本.
讨论
如本手稿所示, pre-cellularized bioinks 是 bioprinted 制造的软骨或皮肤类似物, 被培养长达4周。用被动混合单元法混合后的细胞活力高于传统的混合方法。此外, 使用混合单元的混合过程的简化使处理步骤的数量降至最低, 并允许在混合的范围内保持更好的一致性。最终, 这会在 bioink 的细胞分布和结构和实验组之间取得更好的重现性。在4周的培养后, 分别观察了软骨和皮肤类似物的组织特异性 ECM 成分, 如堵嘴和胶原蛋白的沉积。这表明混合技术和选择的构造几何的灵活性, 以制造不同的组织目标。软骨和皮肤类似物的制作展示了 nanocellulose 藻酸盐 bioink 和打印技术用于不同的工程组织目标的灵活性。我们将讨论以下研究的两个组成部分: (1) 被动混合单元技术, (2) 细胞在软骨和皮肤类似物中的行为。
将细胞悬浮液混合成 bioink 的技术的发展和优化对于这些结构的制作至关重要。与传统的低粘度水凝胶材料不同, bioinks 的高粘度导致了在印刷前 pre-cellularization bioink 的困难。作为一种替代传统的细胞法纳入 bioink, 一个协议的 one-step 混合的细胞悬浮到一个粘性 bioink 的发展和讨论。此外, 还对该混合技术在组织结构制作中的实际应用进行了评价。这种 one-step 混合方法比传统的混合技术有几个优点, 包括控制混合比, 尽量减少高和不规则的剪切应力, 以及一个封闭系统, 以消除混合容器中的样品关闭。然而, 这项技术有几个关键步骤, 以确保它优于传统的细胞/bioink 混合方法。这是至关重要的, 以确保细胞在细胞的注射器被暂停和混合前好。在注射器中的细胞的升降和转移之间的时间间隔过大, 开始混合过程会导致细胞沉积, 这将导致不均匀的混合和分布成一个打印的灯丝。如果观测到沉淀, 则在混合前立即将被动混合装置装配的简单反演 (2-3 倍), 足以重细胞, 确保在混合前均匀分布。同样重要的是, 在确保混合比率保持不变的前提下, 消除或减少注射器中的气泡。如果在混合前 bioink 墨盒中存在较大的气泡, 建议将该溶液通过混合单元运行一次, 以确保彻底混合。如果气泡仍然存在, 轻轻敲击打印墨盒/注射器可以取代剩余的气泡。此外, 如果多个材料混合 (几个混合单位或材料) 是必要的更复杂的结构, 必须调整混合 bioinks/细胞悬浮液的浓度, 以确保经过混合稀释后, 适当最终的浓度仍然实现。
与其他混合技术相比, 被动混合单元是一种新的 cellularize bioinks 方法。与其他混合技术, 如双注射器混合, 或搅拌与刮刀或其他工具, 被动混合单位允许更一致的混合跨批次和用户。手工混合技术的性质, 如刮刀混合, 导致了较大的用户变化的程度和速度的混合。此外, 与人工混合在培养皿或试管中的混炼相比, 封闭系统, 如被动混合装置和双注射器混合几乎没有任何样品损失。
这两种组织的类似物都是由单一类型的 bioink 和一个或两个细胞类型组成的。然而, 组织类似物的打印, 包含具有不同细胞类型的不同 bioinks 区域的结构, 可能是制造更多的生理组织所必需的构造20,21, 22。更专业的 bioinks 具有独特的组成或功能, 可以通过混合多种类型的现有 bioinks 一起产生, 以创建 multimaterial bioinks 具有独特的组成或功能23, 24。这可能是特别重要的组织过渡区域, 如皮肤到皮下层或软骨的组织骨区的 bioink 组成的梯度25,26可能是必要的, 以确保开发这些在本机组织中发现的关键区域27。此外, 混合单位可用于混合生长因子和来说到 bioinks 之前, 打印。去除样品损失与闭合的混合系统是有吸引力的为使用昂贵和低浓度生物活性因素, 在样品损失可能导致他们的最终集中的变动在 bioprinted 结构之内, 特别是, 当渐变涉及。
任何混合技术的限制, 包括在本研究中使用的被动混合装置, 是对机械敏感细胞类型的损害的风险。例如, 孤立的干细胞, 如来自骨髓或胚胎, 或诱导多能干细胞更容易受到机械伤害28,29。由于混合过程中所涉及的剪切力, 混合作用使细胞出现异常的机械应力, 它们必须平衡以保持生存能力30。虽然在这项研究中使用原代成纤维细胞和软骨细胞的结果是良好的生存能力 (图 2), 需要更多的研究来确定更敏感的细胞类型的安全混合率和比率。在那之前, 建议在稳定的慢速下进行混合, 以最大限度地提高生存能力。此外, 本研究中选择的细胞密度是根据先前的研究结果1确定的。对于所有单元格类型, 此单元格密度可能不理想。特别是, 混合细胞在较高的浓度可能会导致增加细胞的接触, 可能提高细胞的生存能力和组织形成31,32。在类似的静脉, 被动混合单位可适用于混合细胞椭球或其他细胞聚合体33成 bioinks。
如本研究所示, 被动混合单元系统能迅速将细胞悬浮液混合成粘性 bioink。虽然对细胞的机械损伤的风险仍然存在, 该方法允许在单一的研究和用户之间的混合更一致。前 cellularized bioinks 利用这种方法被用来制造软骨和皮肤类似物, 被培养了长达4周, 并表明沉积的组织特异性 ECM 标记。未来的研究将集中在利用被动混合单元系统混合专业 bioinks 从标准化的 bioinks 制造更复杂的组织类似物。
披露声明
这份手稿的作者是 CELLINK 有限责任公司的雇员。
致谢
作者没有致谢。
材料
| Name | Company | Catalog Number | Comments |
| STARTINK Kit | CELLINK | SK0001 | Kit that contained all the elements for the CELLMIXER procedure |
| Live/Dead Kit | Life Technologies | L3224 | Kit for the analysis of cell viability after mixing |
| Masson's Trichrome | Sigma Aldrich | HT15-1KT | Kit for the analysis of collagen I deposition in the skin constructs |
| Alcian Blue | Sigma Aldrich | B8438-250ML | Kit for the analysis of glycosaminoglycan deposition in the skin constructs |
| INKREDIBLE+ bioprinter | CELLINK | Gen1+ | Printer utilized in the study |
| DMEM with Glutamax | Thermofisher | 10566016 | Media for culture of the cells |
| 10% fetal bovine serum | Thermofisher | A3160402 | Media supplement |
| Penicillin-Streptomycin | Life Technologies | 15070063 | Media supplement |
| live cell imaging solution | thermofisher | A14291DJ | component utilized using live/dead imaging |
| inverted microscope | Olympus | IX73 | microscope utilized |
| a digital color camera | Olympus | XC10 | microscope camera utilized |
| cellSens imaging software | Olympus | n/a | stock software with the microscope |
| ImageJ | NIH | n/a | open source image analysis software |
| GraphPad Prism 7 | GraphPad | n/a | software for statistical analysis |
| Slic3r software (v1.2.9) | Slic3r | n/a | open-source software to convert .stl file to gcode |
| primary adult human dermal fibroblasts | ATCC | PCS-201-012 | cell source for fibroblasts |
参考文献
- Avila, H. M., Schwarz, S., Rotter, N., Gatenholm, P. 3D bioprinting of human chondrocyte-laden nanocellulose hydrogels for patient-specific auricular cartilage regeneration. Bioprinting. 1, 22-35 (2016).
- Lee, V., et al. Design and fabrication of human skin by three-dimensional bioprinting. Tissue Eng Part C Methods. 20 (6), 473-484 (2013).
- Costantini, M., et al. Microfluidic-enhanced 3D bioprinting of aligned myoblast-laden hydrogels leads to functionally organized myofibers in vitro and in vivo. Biomaterials. 131, 98-110 (2017).
- Fedorovich, N. E., et al. Biofabrication of Osteochondral Tissue Equivalents by Printing Topologically Defined, Cell-Laden Hydrogel Scaffolds. Tissue Eng Part C Methods. 18 (1), 33-44 (2011).
- Vijayavenkataraman, S., Lu, W. F., Fuh, J. Y. H. 3D bioprinting of skin: a state-of-the-art review on modelling, materials, and processes. Biofabrication. 8 (3), 032001 (2016).
- Peltola, S. M., Melchels, F. P. W., Grijpma, D. W., Kellomäki, M. A review of rapid prototyping techniques for tissue engineering purposes. Ann Med. 40 (4), 268-280 (2008).
- Xu, T., Jin, J., Gregory, C., Hickman, J. J., Boland, T. Inkjet printing of viable mammalian cells. Biomaterials. 26 (1), 93-99 (2005).
- Cui, X., Dean, D., Ruggeri, Z. M., Boland, T. Cell damage evaluation of thermal inkjet printed Chinese hamster ovary cells. Biotechnol Bioeng. 106 (6), 963-969 (2010).
- Parsa, S., Gupta, M., Loizeau, F., Cheung, K. C. Effects of surfactant and gentle agitation on inkjet dispensing of living cells. Biofabrication. 2 (2), 025003 (2010).
- Derby, B. Inkjet printing of functional and structural materials: fluid property requirements, feature stability, and resolution. Annu Rev Mater Res. 40, 395-414 (2010).
- Colosi, C., et al. Microfluidic Bioprinting of Heterogeneous 3D Tissue Constructs Using Low-Viscosity Bioink. Adv Mater. 28 (4), 677-684 (2016).
- Ober, T. J., Foresti, D., Lewis, J. A. Active mixing of complex fluids at the microscale. Proc Natl Acad Sci. 112 (40), 12293-12298 (2015).
- Shabnam, P., Madhuja, G., Frédéric, L., Karen, C. C. Effects of surfactant and gentle agitation on inkjet dispensing of living cells. Biofabrication. 2 (2), 025003 (2010).
- Chahal, D., Ahmadi, A., Cheung, K. C. Improving piezoelectric cell printing accuracy and reliability through neutral buoyancy of suspensions. Biotechnol Bioeng. 109 (11), 2932-2940 (2012).
- Niu, X., Lee, Y. -. K. Efficient spatial-temporal chaotic mixing in microchannels. J Micromech Microeng. 13 (3), 454 (2003).
- Liu, R. H., et al. Passive mixing in a three-dimensional serpentine microchannel. J Microelectromech Syst. 9 (2), 190-197 (2000).
- Strober, W. Trypan blue exclusion test of cell viability. Curr protoc immunol. , (2001).
- Scott, J., Dorling, J. Differential staining of acid glycosaminoglycans (mucopolysaccharides) by alcian blue in salt solutions. Histochem Cell Biol. 5 (3), 221-233 (1965).
- Garvey, W. Modified elastic tissue-Masson trichrome stain. Stain technol. 59 (4), 213-216 (1984).
- Xu, T., Zhao, W., Zhu, J. -. M., Albanna, M. Z., Yoo, J. J., Atala, A. Complex heterogeneous tissue constructs containing multiple cell types prepared by inkjet printing technology. Biomaterials. 34 (1), 130-139 (2013).
- Kolesky, D. B., et al. 3D bioprinting of vascularized, heterogeneous cell-laden tissue constructs. Adv Mater. 26 (19), 3124-3130 (2014).
- Kolesky, D. B., Homan, K. A., Skylar-Scott, M. A., Lewis, J. A. Three-dimensional bioprinting of thick vascularized tissues. Proc Natl Acad Sci. 113 (12), 3179-3184 (2016).
- Rutz, A. L., Hyland, K. E., Jakus, A. E., Burghardt, W. R., Shah, R. N. A multimaterial bioink method for 3D printing tunable, cell-compatible hydrogels. Adv Mater. 27 (9), 1607-1614 (2015).
- KÖpf, M., Campos, D. F. D., Blaeser, A., Sen, K. S., Fischer, H. A tailored three-dimensionally printable agarose-collagen blend allows encapsulation, spreading, and attachment of human umbilical artery smooth muscle cells. Biofabrication. 8 (2), 025011 (2016).
- Gurkan, U. A., et al. Engineering anisotropic biomimetic fibrocartilage microenvironment by bioprinting mesenchymal stem cells in nanoliter gel droplets. Mol Pharm. 11 (7), 2151-2159 (2014).
- Ma, Y., Ji, Y., Huang, G., Ling, K., Zhang, X., Xu, F. Bioprinting 3D cell-laden hydrogel microarray for screening human periodontal ligament stem cell response to extracellular matrix. Biofabrication. 7 (4), 044105 (2015).
- Lu, H. H., Thomopoulos, S. Functional attachment of soft tissues to bone: development, healing, and tissue engineering. Annu Rev Biomed Eng. 15, 201-226 (2013).
- Aguado, B. A., Mulyasasmita, W., Su, J., Lampe, K. J., Heilshorn, S. C. Improving viability of stem cells during syringe needle flow through the design of hydrogel cell carriers. Tissue Eng Part A. 18 (7-8), 806-815 (2011).
- Parisi-Amon, A., Mulyasasmita, W., Chung, C., Heilshorn, S. C. Protein-Engineered Injectable Hydrogel to Improve Retention of Transplanted Adipose-Derived Stem Cells. Adv Healthc Mater. 2 (3), 428-432 (2013).
- Qiu, X., De Jesus, J., Pennell, M., Troiani, M., Haun, J. B. Microfluidic device for mechanical dissociation of cancer cell aggregates into single cells. Lab Chip. 15 (1), 339-350 (2015).
- Cukierman, E., Pankov, R., Yamada, K. M. Cell interactions with three-dimensional matrices. Curr Opin Cell Biol. 14 (5), 633-640 (2002).
- Loessner, D., et al. Bioengineered 3D platform to explore cell-ECM interactions and drug resistance of epithelial ovarian cancer cells. Biomaterials. 31 (32), 8494-8506 (2010).
- Lin, R. Z., Chang, H. Y. Recent advances in three-dimensional multicellular spheroid culture for biomedical research. Biotechnol J. 3 (9-10), 1172-1184 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。