Method Article
在体内挫伤脊髓损伤后影像血管动力学的双色法
摘要
我们介绍了一个在体内成像方法使用两种不同的荧光染料跟踪动态脊髓血管变化后, 挫伤脊髓损伤成人大大鼠。
摘要
脊髓损伤 (SCI) 在损伤部位引起明显的血管破坏。血管病理立即发生在 SCI 之后, 并持续贯穿于急性损伤阶段。事实上, 内皮细胞似乎是第一个死亡后, 挫伤 SCI。早期血管事件, 包括血-脊髓屏障 (BSCB) 的通透性增高, 引起性水肿, 并导致由复杂损伤机制造成的二次损伤。因此, 靶向血管破坏可能是减少继发性损伤的主要策略, 从而导致组织学和功能损伤。以往的研究大多是在尸检样本上进行, 无法捕捉血管网络的动态变化。在本研究中, 我们开发了一个体内双色双光子成像法来监测挫伤 SCI 后的急性血管动态变化。这种方法可以检测血流, 血管直径和其他血管病变在同一大鼠和后的不同地点。总的来说, 这种方法为研究血管动力学提供了一个绝佳的场所。
引言
外伤性脊髓损伤 (SCI) 是一种常见的损伤, 导致运动、感觉和自主功能受损。根据国家脊髓损伤统计中心 (和) 在 2016年, 大约有28.2万人受影响, 而其中69% 个主要是由于交通事故或瀑布1。这些病人往往需要重症监护;然而, 目前尚无有效的治疗方法。因此, 迫切需要新的有效的科技战略。
SCI 主要分为两个阶段: 原发性损伤和继发性损伤。主要损伤包括在撞击部位引起出血性坏死的物理侮辱2, 其次是一系列继发性损伤事件, 如炎症、细胞凋亡和残余轴突鞘, 逐步导致到形态学和功能缺陷的扩展3,4,5,6。出血是第一个可见的损伤迹象, 表明在 SCI7,8的急性阶段立即发生血管中断。旨在减少早期血管损伤的神经保护策略可以改善患者的康复, 但这需要更好地了解早期后血管事件的病理生理机制。
尽管以往的研究采用各种方法研究脊髓血管, 但仍有明显的局限性。最共同的缺点是只研究验尸样本, 例如, 氢清除9, 显影10, microangiogram8, 血管腐蚀铸造11, 和免疫组织化学12 ,13。虽然激光多普勒血提供无创 real-time 监测脊髓血流14, 它无法区分血管系统和检测血管形态学变化。动态对比增强 mri (DCE-mri) 也是无创的, 但它生成低分辨率的图像, 并需要昂贵的基础结构15。
虽然在体内使用2光子激光扫描显微镜 (2 p-LSM) 进行成像, 但已开发用于研究皮层中的 vasodynamics16、17、18, 但数量有限的研究显示的血管变化后, SCI. 唐 et al. 在半模型19中显示了病变部位边缘的血流变化, 但挫伤损伤后的影像更具挑战性, 原因有二。首先, 传统的玻璃光学窗口在损伤站点不会承受机械冲击和保持功能为成像。其次, 由于出血引起的软组织渗漏, 导致后成像困难。
在这里, 我们提出了一种新的双色成像方法, 允许成像相同的个别船只在前后的时间点。此外, 它提供了一个时间空间剖面的血管动态变化后, 挫伤 SCI。它还有可能在多个后时间点成像。本协议可直接应用于转基因动物研究神经血管的相互作用。
研究方案
所有外科和动物处理程序均按照《实验室动物护理和使用指南》 (国家研究委员会) 和《印第安纳大学医学院机构动物保育和使用指南》的规定进行。委员会.
1. 手术准备
- 对包括脊椎稳定剂在内的所有手术工具进行消毒。用70% 乙醇清洁手术桌和周围的所有区域。为准备 non-survival 外科手术, 在37° c 加热垫的顶部放置一个干净的手术垫。
- 使用六周的老大 (SD) 大鼠进行这项研究。用腹腔注射氯胺酮 (87.7 毫克/千克) 和嗪 (12.3 毫克/千克) 混合物称量和麻醉大鼠。当动物停止对脚趾捏刺激的反应时, 确认适当的麻醉阶段。皮下注射 0.01-0. 05 毫克/千克丁丙诺啡和5毫克/千克卡洛芬在手术前。
- 在2区域刮毛鼠: 颈部脊柱的背部和颈部区域在乳房的一侧。用控告手术磨砂和70% 酒精湿巾擦拭皮肤区域。在手术中用眼药膏防止干眼。将动物放在干净的外科垫上仰卧位。
2. 颈外静脉插管
- 找到颈外静脉, 在锁骨附近找到脉搏点, 用一把小弹簧剪刀切开, 在现场做一个垂直切口, 这是3解剖点的交叉: 右下颌骨的尾支, 更大的结核肱骨和柄 (图 1A)。用弹簧剪刀和细钳隔离容器。将远端与1无菌手术缝合线 (图 1C)20绑在一起。
- 准备一个1毫升注射器充满生理盐水和连接一个专门的导管由21口径针 (图 1B)。在容器上用一对微型剪刀做一个小切口, 然后将导管滑入血管。
- 通过绑上近端和远端 (图 1C) 来保护针。特制导管是由21口径的针头制成的。研磨的尖端平坦和焊缝与2毫米的一条尖端切断从另一个21口径针。这可以防止导管在外面打滑。
注意:少量的血液流入针头表明, 针头已成功进入血管。
- 通过绑上近端和远端 (图 1C) 来保护针。特制导管是由21口径的针头制成的。研磨的尖端平坦和焊缝与2毫米的一条尖端切断从另一个21口径针。这可以防止导管在外面打滑。
3. 脊柱稳定和 C5-C7 椎板切除术
- 将动物置于俯卧的位置。沿中线切割皮肤, No. 15 手术刀刀片在所需的脊柱水平。从两侧解剖 5th到 7th颈椎 (C5-C7) 的肌肉层, 以公开侧面切面 (图 2A)21。
注意:找到第二个胸椎 (T2), 找到肩胛骨之间的穗。从 T2 椎体向上计数, 找到 C7 椎骨21,22,23,24。 - 使用改良的稳定装置稳定大鼠的脊柱。在侧方椎骨两侧做一个狭缝。在裸露的横向加工面下滑动不锈钢臂, 拧紧螺钉以确保稳定性 (图 2B)。
- 小心移除 C5-C7 板 (椎板切除术,图 2C)。
- 在裸露的硬脑膜上放置一小块盐水浸泡的海绵, 使其保持滋润 (图 2D)。
4. 双光子 (2P) 成像窗口的安装
- 小块的海绵进入肌肉和脊椎之间的缝隙, 还有一条细线的海绵在脊髓和脊椎之间, 然后用纸巾粘胶封住周围的肌肉骨区。等待5分钟完全干燥 (图 2E)。
注意:这一步有效地防止未来的出血到窗口和泄漏的浸泡解决方案。 - 在微波炉中用 ddH2O 准备4% 琼脂。在琼脂完全溶解后, 等到它回到可触摸的温度。用琼脂溶液填充1毫升无菌注射器, 并将其置于窗口边缘以构建壁 (图 2E)。该解决方案固化迅速, 保持灵活性, 使镜头或目标自由移动。
- 当准备好进行成像时, 卸下海绵并将浸入式液体放入窗口中进行2P 成像 (图 2F)。将稳定的动物转移到2光子显微镜的暗室内, 并将2P 成像窗口直接置于透镜下。将镜片仔细地放到成像窗口中。
5. 注射第一荧光染料和基线成像
- 在盐水中制备0.5 毫升的罗丹明 B 异硫氰酸酯-葡聚糖 (4 毫克/毫升平均分子量 ~ 70 kda)。用溶液填充1毫升无菌注射器, 并将注射器连接到先前安装的导管。
注意:建议在使用前准备荧光染料溶液。 - 通过使注射器非常缓慢地注入第一个染料 (图 3B)。首先, 用目镜确定感兴趣的区域。使用电荷耦合器件 (CCD) 相机获得一个明亮的表面血管模式的图像, 在较低的放大率作为一个地标图像。切换到激光扫描模式, 然后打开2P 成像软件, 用于收集图像和线扫描数据。
- 选择合适的2P 激光激发波长、功率和荧光通道 (第一染料的红色通道) 与成像组织中使用的荧光相匹配, 然后执行活体成像 (图 3E)。在整个过程中, 把动物放在加热垫上。
6. C7 挫伤损伤使用莉萨设备
- 根据先前建立的协议25,26, 使用路易斯维尔伤害系统设备 (LISA) 装置执行 C7 中线钝挫伤损伤。
- 简言之, 将动物放在丽莎台上进行校准。
7. 注射第二荧光染料和损伤后的成像
- 准备0.5 毫升异硫氰酸荧光素-葡聚糖 (4 毫克/毫升, 平均分子量〜 70 kDa) 在生理盐水中相同的5.1。用1毫升无菌注射器填充溶液, 并与先前安装的导管连接。
- 将稳定的动物放回2P 显微镜暗室内, 映像同一个区域与第一染料的红色通道和第二染料的绿色通道 (图3D 和 #38; G)。
- 在成像结束时, 从脊柱稳定装置中释放出大鼠, 清洗琼脂壁。
8. 动物祭祀
- 成像后, 牺牲的老鼠 transcardial 灌注协议27。收集脊髓标本, 并修复4% 粉煤灰。
9. 离线数据分析: 船舶直径的量化
- 将图像文件传送到工作站进行离线分析。
- 打开 ImageJ 并选择 "文件", 然后选择以前保存的原始数据并打开相关的单个图像文件 (图 4B)。
- 通过选择 "分析" 后跟 "设置刻度" (图 4C) 来校准图像。使用图 4A中显示的公式计算以 "像素距离" 为单位的值。2光子光学透镜的标定决定了方程中的缺省值。"opticalZoom" 的值在与单个图像文件 (图 4B) 关联的 Excel 可扩展标记 Languagefile (XML 文件) 中找到。
- 绘制垂直于容器的长轴的直线 (图 4D1和 #38; E1), 然后选择 "分析", 后跟 "测量"。容器直径的测量显示在结果窗口中 (图 4D2和 #38; E2)。在容器中重复3次以获得平均值。
10. 离线数据分析: 红细胞 (红细胞) 速度的量化
- 将行扫描文件传输到工作站进行分析。
- 启动 ImageJ 软件, 然后选择 "文件", 然后选择以前保存的原始数据, 然后打开具有扩展名 "。
- 打开 "图像", 然后选择 "堆栈", 然后是 "图像堆叠"。将所有的文件转换为单个图像堆栈 TIFF 文件。
- 启动 Matlab 软件, 点击 "打开", 选择 "LSPIV_parallel" 代码文件。注: 可在 https://sourceforge.net/projects/lspivsupplement/files/18中下载用于 LS-PIV 的 Matlab 代码
- 选择以下命令: "运行" 和 #62; "更改文件夹" 和 #62; "动脉"。选择在10.3中生成的图像堆栈 TIFF 文件。
- 键入 "Y" 并按 Enter 键。
- 将光标分别放在图像的左侧和右侧, 程序开始处理数据。
- 在程序结束时, 输入2值以计算最终读取: "pixel_meter 转换值" 和 "扫描时间转换值"。这两者都可以在与行扫描数据相关的 XML 文件中找到。最后的值被表示为每秒毫米单位的速度的平均值和标准偏差 (毫米/s)。
结果
该方法能够监测体内在个别血管和外伤后脊髓血管的动态变化。首先, 通过颈外静脉安装导管, 为后续的荧光染料注射提供通道 (图 1A-C,图 3)。在第二步中, 使用专用设备来稳定暴露的 C5-C7 (图 1D-f,图 2AB)。这一稳定步骤可以消除呼吸伪影, 并提供稳定的成像。继椎板切除术 (图 2C) 后, 下一步是在 C5-C7 上安装2P 成像窗口 (图 2D-f)。在脊柱成像窗口周围减少周围组织出血是成功的血管成像的关键。下面的步骤是通过上述导管将罗丹明-葡聚糖荧光染料 (红色) 注入地标, 并将血管网络映射为基线 (图 3A-b, E)。在 C7 中线挫伤损伤与适度严重性后, FITC 葡聚糖 (绿色) 在所需的后时间点 (图 3A和 #38; D) 中引入。双色法的妙处在于, 当第一种染料因损伤而泄漏到软组织时, 仍然可以使用第二染料来检测血管结构 (图 3G)。
在成像过程中, 建议将动物放在加热垫上, 在麻醉诱导后保持身体核心温度。
采用双色法, 可以测量和计算单个血管的直径和红细胞流速 (红细胞速度)。对于直径, 你可以使用 ImageJ 测量容器在其最大直径3重复校准后 (图 4)。对于速度, 用 matlab 程序 (matlab R2013a) 测量线扫描图像以计算红细胞速度 (图 5)18。根据形态学、血流速度和血管直径, 血管可分为2类: 动脉和静脉 (见表 1)。
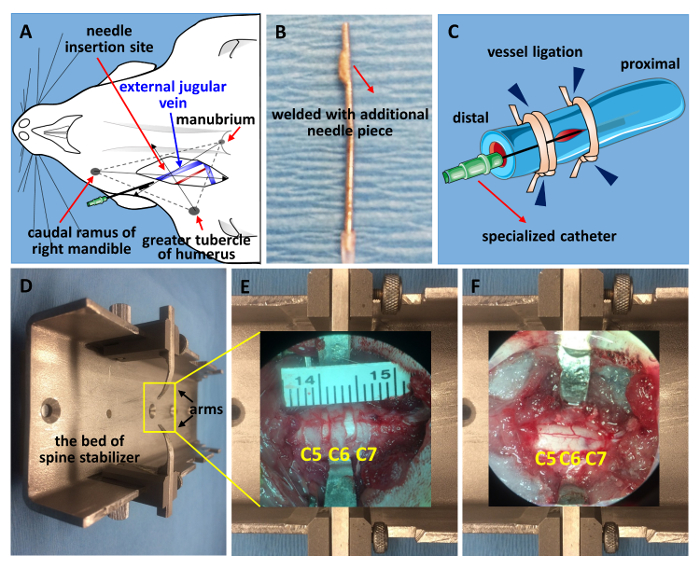
图 1.颈静脉插管和脊柱稳定。
(a)用于定位颈外静脉的示意图。(B) 由21口径针头制成的专用导管。该尖端是地面平坦和焊接的一块2毫米尖端从另一个21口径的针头切断。(C)导管的示意图。远端先结扎, 其次为近端导管稳定, 最后用针与血管 (血管结扎, 蓝色箭头) 固定在一起。(D)修改后的脊柱稳定器的图像。显示在椎板切除术前和挫伤 SCI (F)之后的 C5-C7 窗口。请单击此处查看此图的较大版本.
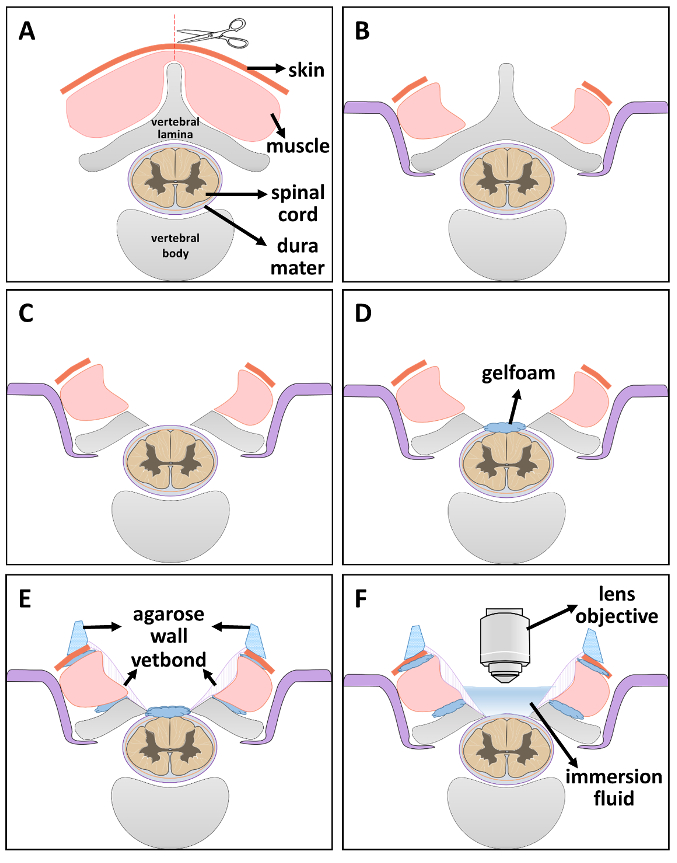
图 2.光学窗口安装 step-by 步骤示意图。
(A)步骤 1: 通过沿中线切割皮肤和肌肉来暴露脊椎。(B) 步骤 2: 脊柱稳定。(C)步骤 3: 椎板切除术。(D)步骤 4: 通过放置一块盐水浸泡的海绵保持脊髓的水分。(E)步骤 5: 用无菌海绵和 vetbond 密封间隙。干燥后, 在窗口边缘建立一层琼脂壁。(F)步骤 6: 当准备好进行成像时, 卸下海绵并将浸入式流体置于2P 成像窗口中。请单击此处查看此图的较大版本.
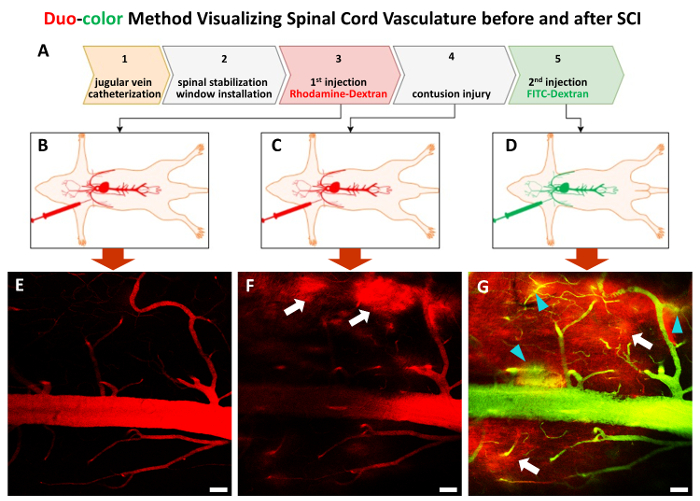
图 3.在体内双色方法过程 step-by 步骤.
整个过程由5步骤(A)组成。在步骤1和步骤2之后, 一对具有近似 70 KDa 大小的葡聚糖示踪剂, 在 (B和C) 和挫伤 SCI (D)之后, 依次注入一组用于标记脊髓血管的。(E)-(G)代表2P 图像在步骤3到步骤5中显示脊髓血管。白色箭头指向第一波红色染料泄漏区域 (F和G), 绿松箭头显示第二波绿色染料泄漏(g)。缩放栏 = 50 µm.请单击此处查看此图的较大版本.
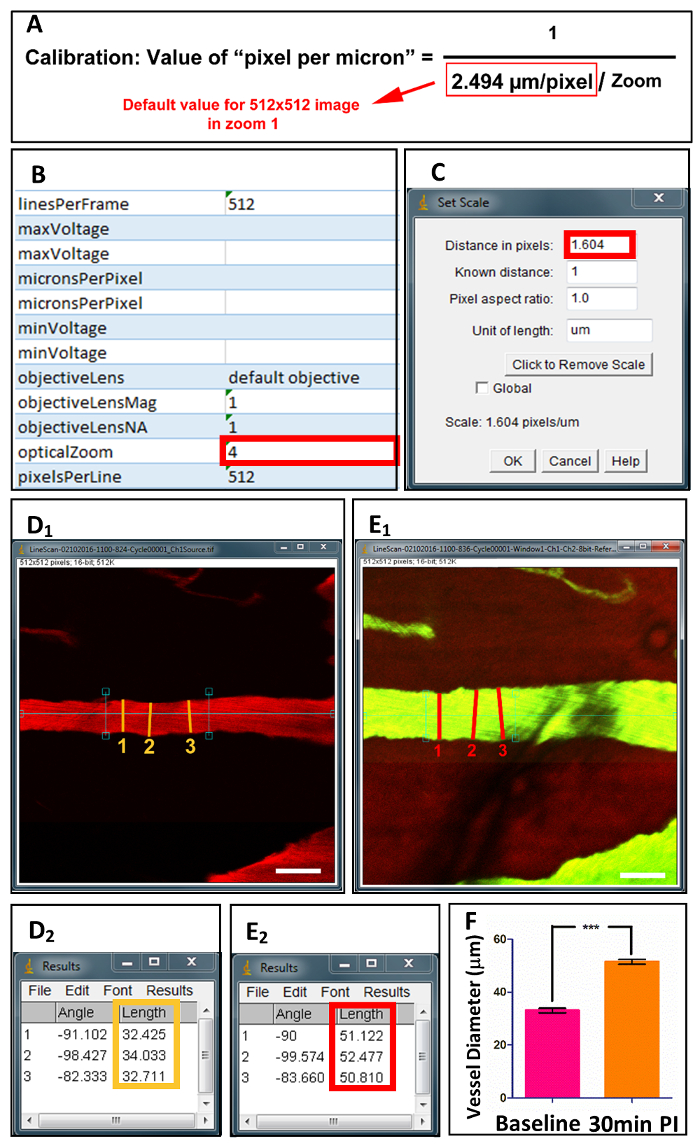
图 4.脊髓血管直径的采集和定量。
在准备之后, 单个图像文件是在2P 显微镜下获取的, 同时还有校准值的 XML 文件(B)。(A)等式显示基于光学变焦值的 "每微米像素" 的计算。在 ImageJ (C)中校准后, 容器直径在(D1)和(E1)损伤之前的纵向轴上测量3点。(D2)和(E2)显示测量值。(F)基线和30分钟后的船只直径的定量。缩放条 = 50 µm. 数据显示为平均值± SD, ** 和 #60; 0.0001, 双尾配对 t 检验. 请点击这里查看更大版本的这个数字。
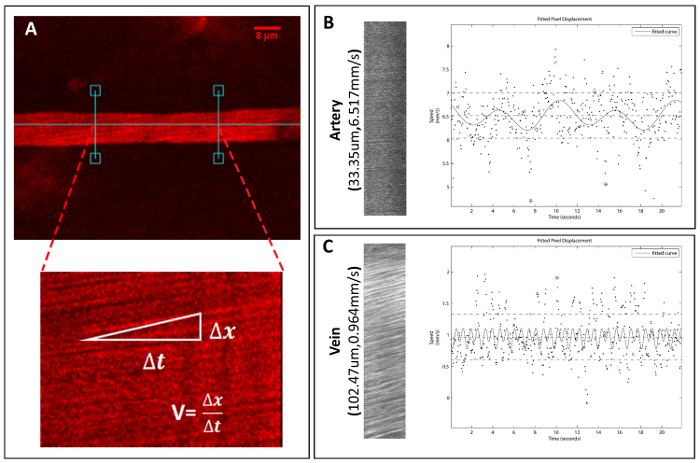
图 5.脊髓血管速度的采集和定量。
在2P 显微镜下获取线扫描图像文件, 计算单船速度。(a)一个选定的容器和方法的例子来评估血管红细胞的速度。(B)行扫描图像的动脉示例以及计算速度的相应绘图文件, 以及静脉(C)的示例。请单击此处查看此图的较大版本.
| 动脉 | 静脉 | |
| 形态 | 直、光滑、厚容器壁 | 树枝, 粗糙的边缘 |
| 血流速度 | 快速 | 缓慢但变化 |
| 直径 | 30-80 µm | 100-250 µm |
表 1: 识别船只类型的标准
讨论
对血管学研究的一个挑战是技术上的限制, 因为传统的技术主要局限于死后样本的血管结构变化。这本小说的活体成像方法, 使动态测量血流量和相关参数 (速度和血管直径) 使用 2 p LSM 在活鼠。它也允许重复检查在同一组的船只在不同时间点后, 挫伤 SCI。以前的2光子显微成像技术无法捕获创伤血管结构由于一个单一的示踪剂泄漏。我们的双色设计使动态血管成像的创伤模型。此外, 这种方法的灵活性提供了一个机会, 以产生一个时间空间剖面的急性血管变化后 SCI。
在我们的 in 体内双色成像方法中有几个关键步骤. 首先, 在延时成像之前, 确保脊髓的物理稳定性是至关重要的, 尤其是减少呼吸运动伪影。我们设计的脊柱钳形, 以提高脊柱的高度, 在稳定的轻微。因此, 与呼吸动物相关的脊髓运动可以大大减少 (图 1D-f, 2B)。建议在每一次成像会议开始前检查脊髓的稳定性。如果脊髓不能达到稳定, 则应调整脊髓钳的对准和松紧。第二, 外周组织 (骨骼、肌肉层和皮肤) 出血到成像窗口可能会受到污染的看法。为顺利成像会议, 海绵和组织胶粘胶应适用于周围组织, 以有效预防。第三, 我们选择的荧光染料的大小与白蛋白 (66 kDa) 相似, 这是主要的高分子量血浆蛋白。在稳态条件下, 染料主要保留在类似白蛋白28的血管内。损伤后, 染料通过破坏的内皮结构, 并泄漏到软组织, 导致显着增加的荧光强度的外围区域的血管 (图 3F-g)。此外, 我们选择外颈静脉插管有两个原因。首先, 它可以提供在任何时候的实验, 可持续的传递路线。其次, 它可以作为未来治疗注射的途径。
虽然我们的体内双色方法能够为创伤性血管成像研究提供一个新的场所, 但必须解决有关此技术的一些告诫。目前, 该技术的目的是评估血管的变化在2时间点 (基线和1后的时间点), 但它是可行的切换到多个时间点, 如果有额外的荧光染料和渠道可用。虽然有几项研究使用植入玻璃窗口为慢性活体成像, 他们没有能提供基线信息在同一艘船在创伤损伤以后19,29,30, 31,32。不像这些研究, 我们的窗口是一个 no-glass 窗口。这是方便的前后成像, 但它可能是一个挑战, 为长期观察重建窗口。我们未来的研究工作是对慢性影像技术的改进。血管系统由多种血管类型 (动脉、静脉、毛细血管) 组成, 在形态学和功能方面各有不同。在成像过程中, 血管类型的分化有助于梳理出明显的血管变化规律。上面的协议依赖于根据形态学和速度来识别容器的观察者;然而, 可以很容易地添加一种动脉特定的染料, 以便在容器类型33之间提供更明确的分类。
这项技术不仅限于评估挫伤和其他创伤模型, 如挤压伤和辐射损伤, 但也研究的重点是破坏 BSCB, 以及血管通透性的变化。除 SCI 外, 它还可用于研究其他神经退行性疾病, 如肌萎缩侧索硬化 (ALS) 和多发性硬化 (MS) 后的血管变化。此外, 它可以可的转基因动物模型研究动态神经血管相互作用。作为一种强有力的筛选工具, 未来的研究可以利用这里描述的成像技术来评估脊髓损伤的治疗效果。
总之,在体内双色方法是一种可靠的、real-time 的、体内方法, 用于评估动态血管变化, 这是对颞空间血管剖面的表征和对治疗的筛选减少继发性损害后 SCI。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了部分由 NIH NS059622, NS073636, 国防部 CDMRP W81XWH-12-1-0562, 优异审查奖 I01 BX002356 从美国退伍军人事务部, 克雷格 H 尼尔森基金会 296749, 印第安纳脊髓和脑损伤研究基金会 (ISCBIRF) 印第安纳州卫生署 (019919), 和玛丽罗斯霍曼乔治捐赠基金。
材料
| Name | Company | Catalog Number | Comments |
| Purdue Products Betadine Surgical Scrub | Fisher Scientific | 19-027132 | Skin sterilization |
| Ketamine (87.7 mg/kg)/Xylazine (12.3 mg/kg) | Patterson Veterinary | 07-881-9413, 07-890-5745 | Anesthetic agent |
| Buprenorphine(0.03 mg/mL) | Patterson Veterinary | 07-891-9756 | Pain relief agent |
| Carprofen | Patterson Veterinary | 07-844-7425 | Non-steroidal anti-inflammatory drug |
| Dukal Gauze Sponges | Fisher Scientific | 22-415-490 | Skin sterilization |
| Decon Ethanol 200 Proof | Fisher Scientific | 04-355-450 | Skin sterilization |
| Artificial Tears Eye Ointment | Webster Veterinary | 07-870-5261 | Prevent drying eyes |
| Cotton Tipped Applicators | Fisher Scientific | 1006015 | |
| Rhodamine B isothiocyanate–Dextran | Sigma-Aldrich | R9379 | Average mol wt 70kDa |
| Fluorescein isothiocyanate–dextran | Sigma-Aldrich | 46945 | Average mol wt 70kDa |
| Instrument Sterilizer | Fine Science Tools | 18000-50 | for sterilizing surgery tool |
| Spine stabilizer set | Custom Manufactured from Norton Neuroscience Institute | Contact Y. Ping Zhang for details. (yipingzhang50@gmail.com) | |
| Vetbond | 3M Animal Care Products | 1469SB | Tissue adhesive Glue |
| Gelfoam | Henry Schein | 9083300 | Stop bleeding |
| Noyes Spring Scissors | F.S.T | 15013-12 | |
| Fine Forceps- Dumont #5 | F.S.T | 11254-20 | |
| Rongeur | Fine Science Tools | 16021-14 | laminectomy |
| Surgical Retractor | Fine Science Tools | 17005-04 | |
| Scalpel | Fine Science Tools | 10003-12 | skin cut |
| Scalpel Blade #15 | Royal-Tek | BS2982 | skin cut |
| micro angled scissors | World Precision Instruments | 500260 | Can be from any vendor |
| 3-0 vicryl sutures | Ethicon | J393H | Can be from any vendor |
| Silk Black Braided Non-Absorbable Suture, 3-0, C-7, Reverse Cutting, 18" | LOOK | 786 | Can be from any vendor |
| 1 ml syringe | Henke Sass Wolf | 4010.200.V0 | Can be from any vendor |
| 21 gauge needle | BD | 305165 | Can be from any vendor |
| Agar | Sigma-Aldrich | A1296 | Can be from any vendor |
| Two-photon Laser Scanning Microscope | Bruker Fluorescence Microscopy | ||
| LISA device | Custom Manufactured from Norton Neuroscience Institute | Contact Y. Ping Zhang for details. (yipingzhang50@gmail.com) | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| HCImage Live | Hamamatsu Corporation | Imaging software | |
| PrairieView | Prairie Technologies/Bruker | Two-photon imaging software | |
| ImageJ | Image analysis software | ||
| Matlab statistics toolbox | The MathWorks, Inc. | https://www.mathworks.com/products/statistics.html?s_tid=srchtitle | Image analysis software |
参考文献
- National Spinal Cord Injury Statistical Center. Spinal Cord Injury Facts and Figures at a Glance. SCI Data Sheet 2016. , (2016).
- Dumont, R. J., et al. Acute spinal cord injury, part I: pathophysiologic mechanisms. Clin Neuropharmacol. 24 (5), 254-264 (2001).
- Beattie, M. S., Farooqui, A. A., Bresnahan, J. C. Review of current evidence for apoptosis after spinal cord injury. J Neurotrauma. 17 (10), 915-925 (2000).
- Liu, N. K., et al. A novel role of phospholipase A2 in mediating spinal cord secondary injury. Ann Neurol. 59 (4), 606-619 (2006).
- Wu, X., Xu, X. M. RhoA/Rho kinase in spinal cord injury. Neural Regen Res. 11 (1), 23-27 (2016).
- Li, X. G., et al. Combination of methylprednisolone and rosiglitazone promotes recovery of neurological function after spinal cord injury. Neural Regen Res. 11 (10), 1678-1684 (2016).
- Kulkarni, M. V., et al. Acute spinal cord injury: MR imaging at 1.5. T. Radiology. 164 (3), 837-843 (1987).
- Tator, C. H., Koyanagi, I. Vascular mechanisms in the pathophysiology of human spinal cord injury. J Neurosurg. 86 (3), 483-492 (1997).
- Kobrine, A. I., Doyle, T. F., Martins, A. N. Spinal cord blood flow in the rhesus monkey by the hydrogen clearance method. Surg Neurol. 2 (3), 197-200 (1974).
- Rivlin, A. S., Tator, C. H. Regional spinal cord blood flow in rats after severe cord trauma. J Neurosurg. 49 (6), 844-853 (1978).
- Koyanagi, I., Tator, C. H., Theriault, E. Silicone rubber microangiography of acute spinal cord injury in the rat. Neurosurgery. 32 (2), 260-268 (1993).
- Noble, L. J., Wrathall, J. R. Correlative analyses of lesion development and functional status after graded spinal cord contusive injuries in the rat. Exp Neurol. 103 (1), 34-40 (1989).
- Maikos, J. T., Shreiber, D. I. Immediate damage to the blood-spinal cord barrier due to mechanical trauma. J Neurotrauma. 24 (3), 492-507 (2007).
- Tei, R., Kaido, T., Nakase, H., Sakaki, T. Secondary spinal cord hypoperfusion of circumscribed areas after injury in rats. Neurol Res. 27 (4), 403-408 (2005).
- Cohen, D. M., et al. Blood-spinal cord barrier permeability in experimental spinal cord injury: dynamic contrast-enhanced MRI. NMR Biomed. 22 (3), 332-341 (2009).
- Drew, P. J., Shih, A. Y., Kleinfeld, D. Fluctuating and sensory-induced vasodynamics in rodent cortex extend arteriole capacity. Proc Natl Acad Sci U S A. 108 (20), 8473-8478 (2011).
- Schaffer, C. B., et al. Two-photon imaging of cortical surface microvessels reveals a robust redistribution in blood flow after vascular occlusion. PLoS Biol. 4 (2), e22 (2006).
- Kim, T. N., et al. Line-scanning particle image velocimetry: an optical approach for quantifying a wide range of blood flow speeds in live animals. PLoS One. 7 (6), e38590 (2012).
- Tang, P., et al. In vivo two-photon imaging of axonal dieback, blood flow, and calcium influx with methylprednisolone therapy after spinal cord injury. Sci Rep. 5, 9691 (2015).
- Thrivikraman, K. V., Huot, R. L., Plotsky, P. M. Jugular vein catheterization for repeated blood sampling in the unrestrained conscious rat. Brain Res Brain Res Protoc. 10 (2), 84-94 (2002).
- Walker, M. J., et al. A novel vertebral stabilization method for producing contusive spinal cord injury. J Vis Exp. (95), e50149 (2015).
- Anderson, K. D., Sharp, K. G., Steward, O. Bilateral cervical contusion spinal cord injury in rats. Exp Neurol. 220 (1), 9-22 (2009).
- Krishna, V., et al. A contusion model of severe spinal cord injury in rats. J Vis Exp. (78), (2013).
- Lepore, A. C. Intraspinal cell transplantation for targeting cervical ventral horn in amyotrophic lateral sclerosis and traumatic spinal cord injury. J Vis Exp. (55), (2011).
- Zhang, Y. P., et al. Spinal cord contusion based on precise vertebral stabilization and tissue displacement measured by combined assessment to discriminate small functional differences. J Neurotrauma. 25 (10), 1227-1240 (2008).
- Wu, X., et al. A Tissue Displacement-based Contusive Spinal Cord Injury Model in Mice. J Vis Exp. (124), (2017).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), (2012).
- Egawa, G., et al. Intravital analysis of vascular permeability in mice using two-photon microscopy. Sci Rep. 3, 1932 (2013).
- Farrar, M. J., et al. Chronic in vivo imaging in the mouse spinal cord using an implanted chamber. Nat Methods. 9 (3), 297-302 (2012).
- Evans, T. A., Barkauskas, D. S., Myers, J. T., Huang, A. Y. Intravital imaging of axonal interactions with microglia and macrophages in a mouse dorsal column crush injury. J Vis Exp. (93), e52228 (2014).
- Davalos, D., Akassoglou, K. In vivo imaging of the mouse spinal cord using two-photon microscopy. J Vis Exp. (59), e2760 (2012).
- Davalos, D., et al. Stable in vivo imaging of densely populated glia, axons and blood vessels in the mouse spinal cord using two-photon microscopy. J Neurosci Methods. 169 (1), 1-7 (2008).
- Shen, Z., Lu, Z., Chhatbar, P. Y., O'Herron, P., Kara, P. An artery-specific fluorescent dye for studying neurovascular coupling. Nat Methods. 9 (3), 273-276 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。