需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
硝酸酯 Anomeric Trichloroacetimidates 的单锅微波辅助转化
摘要
一个 2-叠-1-硝酸酯可以转换为相应的 2-叠-1-trichloroacetimidate 在一个锅的程序。该手稿的目的是演示微波反应器在碳水化合物合成中的效用。
摘要
以下过程的目标是提供一个 2-叠-1-硝酸酯的一锅转换的示范对 trichloroacetimidate 糖捐赠者。经叠硝化后的 glycal, 产品 2-叠-1-硝酸酯可以在微波辅助照射下水解。这种转变通常是通过强亲核试剂和延长反应时间来实现的。微波辐照诱导水解, 在没有试剂的情况下, 反应时间短。在脱硝后, 中间 anomeric 醇在同一锅中转化为相应的 2-叠-1-trichloroacetimidate。
引言
由于它们在分子生物学中无处不在, 碳水化合物一直是化学合成的长期目标。1,2,3在任何成功的合成运动的核心是正确部署糖基化反应, 以建立低聚糖链。4,5,6,7,8,9,10,11,12不奇怪的是, 有大量的方法来安装糖苷债券。13,14汤姆·柯尼希斯-克诺尔方法是已知最早的程序之一, 它涉及将糖氯化物或溴化物与酒精成分结合, 通常在重金属 (汞或银) 活化作用下。15相关的糖氟化物在1981年被醛集团首次作为捐赠者引入, 并因其热化学稳定性的提高而得到广泛应用。在反应谱的相反端的16是糖化, 它比其他卤化物的反应要多得多。增加的反应性伴随着增加的 stereocontrol, 特别是当形成α连接的寡糖。17除了 "haloglycosides" 外, thioglycosides 还发现了广泛的效用, 部分原因在于它们易于形成, 稳定性对大量的反应条件和活化亲试剂。18
上述方法的重点是将 anomeric 醇转化为 "氧", 即由受体分子中的酒精激活并最终取代的潜离组。Anomeric 氧活化, 如施密特学派所描述的, 重点是将 C1 氧本身转化为一个离群。19这种方法是最强大的, 广泛应用于化学糖基化反应。Trichloroacetimidate 捐赠者从还原糖和乙容易地准备, 在基地存在例如碳酸钾 (K2CO3) 或 18-环 [5.4. 0] undec-7-烯 (DBU)。这些物种, 然后激活使用刘易斯酸。20
最近, 我们报告说, 2-叠-1-trichloroacetimidate 捐助者可以直接从 glycals 的准备。这一过程涉及两个反应, 一锅程序从 2-叠-1-硝酸酯。21此详细的协议旨在帮助从业者成功完成高产转化。特别感兴趣的是该序列的第一步, 它着重于微波辅助加热下的热脱硝。我们也希望提供一个直观的教程, 在有机合成中使用微波反应器。
研究方案
1. 有代表性的微波辅助脱硝
- 将叠硝酸酯 (1.0 equiv, 0.2 摩尔) 放在8毫升的微波反应瓶中。反应的规模可以增加到几个摩尔, 而不会对反应进展产生任何不利影响。
- 将叠-硝酸酯溶于20% 蒽醌丙酮 (0.1 米, 2.0 毫升)。将吡啶 (5.0 equiv, 0.08 毫升, 1.0 摩尔) 加入反应釜。将该反应容器盖在微波反应器腔内, 并将其置于微波炉辐照瓶中。
- 照射解决方案在120° c 为15分钟, 搅拌和固定保持时间。保持时间表示辐照在指定温度和由此产生的压力下会发生多久。在2分钟的爬坡期内对报告的温度进行热反应。通过内置红外传感器监视温度。
- 15分钟后, 用薄层层析 (TLC) 对反应混合物进行分析, 确定起动材料的消耗量。使用1:1 乙酸乙酯/hexanes 作为淋洗。
- 用铈铵 molybate 染色法对薄层板进行可视化。反应物和产品的 rf会有所不同, 但还原酒精一般是0.05 到0.1 下 rf , 而不是反应剂。
2. trichloroacetimidate 的形成
- 在开始的材料的完全消耗量以后, 蒸发溶剂到减少的容量使用航空公司。然后, 用 (二氯甲烷) CH2Cl2 (1.0 毫升) 稀释, 用注射器除去水层。一旦水层被去除, 冷却反应混合物到0° c 使用冰水浴。
- 接下来, 添加 DBU (10 eq, 0.3 毫升, 1.9 摩尔) 和 22, 2-乙 (50 eq, 1.0 毫升, 10 摩尔) 的反应容器。这两种试剂都是多余的, 至少有1的碱基和1当量的 22, 2-乙是需要的。
- 允许反应混合物在升温到环境温度时搅拌。通过薄层色谱法监测反应, 确定起始物料消耗量。
- 使用1:1 乙酸乙酯/hexanes 作为淋洗。用铈铵 molybate 染色法对薄层板进行可视化。反应物和产品的 Rf会有所不同。
- 在开始材料的完全消耗量以后, 转移反应混合物到回收瓶和集中混合物在真空在30° c。溶剂的蒸发会使原油呈淡黄色至褐色油。
- 以 1.5 cm 色谱柱和1:4 乙酸乙酯/hexanes 为淋洗, 用硅胶柱层析法提纯粗品。imidate 的物理形态会因分子而异。
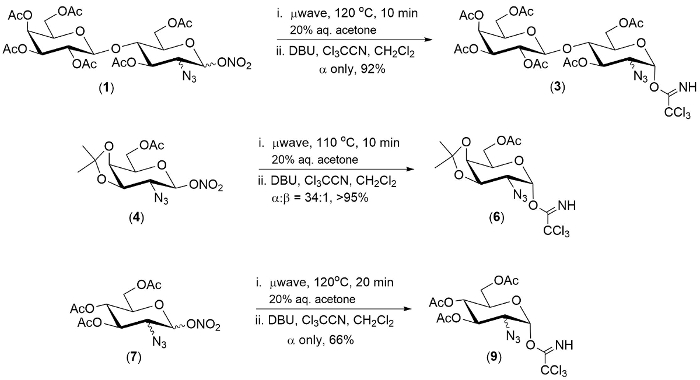
图 1.2-叠-1-硝酸酯的一锅转化为 2-叠-1-trichloroimidates 的代表性例子。请单击此处查看此图的较大版本.
结果
本文所述的技术在三 2-叠-1-硝酸酯的水池中被证明。在每种情况下, 反应的第一步是在20分钟内完成。
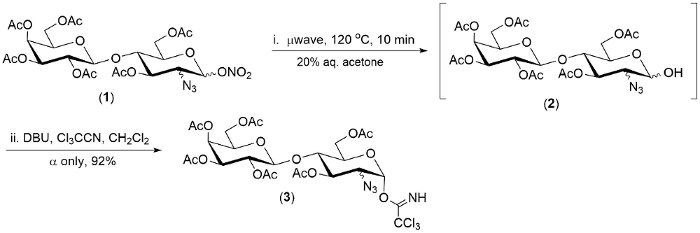
图 2.有代表性的例子水解 (1 ->2), 和一锅转换 2-叠-1-硝酸酯的1 (1>3)。
讨论
本教程中描述的协议提供了一种将硝酸酯转化为有用的、无功功能的方法。从更广泛的意义上说, 使用微波反应器来完成碳水化合物合成过程中的特定动作, 有可能使困难的转变变得轻便和例行。在本教程中, 我们的目标是演示如何在微波照射的情况下处理碳水化合物。
在父母反应的情况下, 以前的努力, 以实现脱硝通常依赖于强亲核试剂和延长反应时间。本文所描述的技术的?...
披露声明
作者没有相互竞争的金融利益。
致谢
作者要感谢范德比尔特大学和化学生物学研究所的资助。Mr. 伯克利埃利斯和 Prof. 是公认的高分辨率质谱分析。
材料
| Name | Company | Catalog Number | Comments |
| 230 400 mesh silica gel | SiliCycle Inc | R10030B | |
| TLC plates | SiliCycle Inc | TLG-R10014B-527 | |
| Ceric ammonium molybdate | Sigma-Aldrich | A1343 | |
| Solvent Still | Mbraun | MB-SPS-800 | |
| Infared spectrometer | Thermo | Thermo Electron IR100 | |
| Nuclear Magnetic Resonance | Bruker | 400, 600 MHz | |
| LC/MS | Thermo/Dionex | Single quad, ESI | |
| HRMS | Agilent | Synapt G2 S HDMS | |
| Microwave reactor | Anton Parr | Anton Parr G10 Monowave 200 | |
| DBU | Sigma-Aldrich | 139009 | |
| CCl3CN | Sigma-Aldrich | T53805 | |
| Pyridine | Sigma-Aldrich | 270970 | |
| Acetone | Fisher Scientific | A18-20 | Tech. grade |
| Phase separator | Biotage | 120-1901-A | |
| Rotary evaporator | Buchi | R-100 |
参考文献
- Nicolaou, K. C., Mitchell, H. J. Adventures in Carbohydrate Chemistry: New Synthetic Technologies, Chemical Synthesis, Molecular Design, and Chemical Biology A list of abbreviations can be found at the end of this article. Telemachos Charalambous was an inspiring teacher at the Pancyprian Gymnasium, Nicosia, Cyprus. Angew. Chem. Int. Ed. Engl. 40 (9), 1576-1624 (2001).
- Danishefsky, S. J., Allen, J. R. From the laboratory to the clinic: A retrospective on fully synthetic carbohydrate-based anticancer vaccines. Angew. Chem. Int. Ed. Engl. 39 (5), 836-863 (2000).
- Nicolaou, K. C., Hale, C. R. H., Nilewski, C., Ioannidou, H. A. Constructing molecular complexity and diversity: total synthesis of natural products of biological and medicinal importance. Chemical Society Reviews. 41 (15), 5185-5238 (2012).
- Zhu, X., Schmidt, R. R. New principles for glycoside-bond formation. Angew. Chem. Int. Ed. Engl. 48 (11), 1900-1934 (2009).
- Danishefsky, S. J., Bilodeau, M. T. Glycals in organic synthesis: The evolution of comprehensive strategies for the assembly of oligosaccharides and glycoconjugates of biological consequence. Angew. Chem. Int. Ed. Engl. 35 (13-14), 1380-1419 (1996).
- Bongat, A. F., Demchenko, A. V. Recent trends in the synthesis of O-glycosides of 2-amino-2-deoxysugars. Carbohydr. Res. 342 (3-4), 374-406 (2007).
- Feizi, T., Fazio, F., Chai, W. C., Wong, C. H. Carbohydrate microarrays - a new set of technologies at the frontiers of glycomics. Curr. Opin. Struct. Biol. 13 (5), 637-645 (2003).
- Palmacci, E. R., Plante, O. J., Seeberger, P. H. Oligosaccharide synthesis in solution and on solid support with glycosyl phosphates. Eur. J. Org. Chem. (4), 595-606 (2002).
- Stallforth, P., Lepenies, B., Adibekian, A., Seeberger, P. H. 2009 Claude S. Hudson Award in Carbohydrate Chemistry. Carbohydrates: a frontier in medicinal chemistry. J. Med. Chem. 52 (18), 5561-5577 (2009).
- Danishefsky, S. J., Mcclure, K. F., Randolph, J. T., Ruggeri, R. B. A Strategy for the Solid-Phase Synthesis of Oligosaccharides. Science. 260 (5112), 1307-1309 (1993).
- Demchenko, A. V. Stereoselective chemical 1,2-cis O-glycosylation: From 'sugar ray' to modern techniques of the 21st century. Synlett. (9), 1225-1240 (2003).
- Fraserreid, B., Wu, Z. F., Udodong, U. E., Ottosson, H. Armed-Disarmed Effects in Glycosyl Donors - Rationalization and Sidetracking. J. Org. Chem. 55 (25), 6068-6070 (1990).
- Bohe, L., Crich, D. A propos of glycosyl cations and the mechanism of chemical glycosylation; the current state of the art. Carbohydr. Res. 403, 48-59 (2015).
- Toshima, K., Tatsuta, K. Recent Progress in O-Glycosylation Methods and Its Application to Natural-Products Synthesis. Chem. Rev. 93 (4), 1503-1531 (1993).
- Koenigs, W., Knorr, E. Ueber einige Derivate des Traubenzuckers und der Galactose. Chem. Ber. 34 (1), 957-981 (1901).
- Mukaiyama, T., Murai, Y., Shoda, S. An Efficient Method for Glucosylation of Hydroxy Compounds Using Glucopyranosyl Fluoride. Chem. Lett. (3), 431-432 (1981).
- Meloncelli, P. J., Martin, A. D., Lowary, T. L. Glycosyl iodides. History and recent advances. Carbohydrate Research. 344 (9), 1110-1122 (2009).
- Lian, G., Zhang, X., Yu, B. Thioglycosides in carbohydrate research. Carbohydr. Res. 403, 13-22 (2015).
- Schmidt, R. R., Kinzy, W. Anomeric-Oxygen Activation for Glycoside Synthesis - the Trichloroacetimidate Method. Advances in Carbohydrate Chemistry and Biochemistry. 50, 21-123 (1994).
- Schmidt, R. R., Toepfer, A. Glycosylation with highly reactive glycosyl donors: efficiency of the inverse procedure. Tetrahedron Lett. 32 (28), 3353-3356 (1991).
- Keith, D. J., Townsend, S. D. Direct, microwave-assisted substitution of anomeric nitrate-esters. Carbohydr. Res. 442, 20-24 (2017).
- Bukowski, R., et al. Synthesis and Conformational Analysis of the T-Antigen Disaccharide(B-D-Gal-(1->3)-a-D-GalNAc-OMe). Eur. J. Org. Chem. 14, 2697-2705 (2001).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。