需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
体内在肿瘤微环境中 pH 值、 pO2、氧化还原状态、磷酸盐和谷胱甘肽浓度的 EPR 评价
摘要
利用可溶性基团和三苯三苯探针对低场 (L 波段, 1.2 GHz) 电子顺磁共振进行了分析, 以评估乳腺癌小鼠模型中肿瘤微环境中生理上的重要参数。
摘要
该协议表明, 低场电子顺磁共振 (EPR) 技术的能力, 结合功能顺磁性探针, 提供定量信息的化学肿瘤微环境, 包括pO2, pH 值, 氧化还原状态, 间质无机磷酸盐 (Pi) 和胞内谷胱甘肽 (GSH) 的浓度。特别是, 最近开发的可溶解多功能三苯甲的应用为 pH的体内并行测量提供了无与伦比的机会, pO2和pi 在Extracellular 空间 (希望探针)。用单个探针测量三参数, 可以独立于探针分布和测量时间来进行相关分析。
引言
在癌症进展和治疗中的关键作用越来越被赞赏1。在实体肿瘤的重要生理参数中, 组织缺氧2, 酸中毒3,4, 高还原容量5, 细胞内谷胱甘肽6,7,和间质 Pi8有很好的记录。无创性的体内 pO2, pH 值, Pi, GSH 和氧化还原评估提供了独特的洞察力的生物学过程中, 并帮助先进的工具, 临床前筛查抗癌药物和有针对性的治疗策略。通过磁共振成像 (MRI) 和低场强的 EPR 技术, 在组织中合理的射频穿透深度使它们成为无创评估这些参数的最合适方法。MRI 在很大程度上依赖于成像水质子, 并广泛应用于临床设置, 提供解剖分辨率, 但缺乏功能性分辨率。phosphorus-31 核磁共振 (31p-NMR) 测量胞外 Pi 浓度和 pH 值基于来自内源磷酸盐的信号可能有吸引力的特征, 但通常掩盖了几次更高的胞内 Pi 浓度9,10。与此相反, EPR 测量依赖于特殊设计的顺磁探针的光谱学和成像, 以提供功能分辨率。请注意, 由于 epr 的内在敏感性和内生背景 epr 信号的缺乏, 外源 epr 探针比外源核磁共振探针具有更大的优越性。最近开发的双功能 pH 值和氧化还原基团探针11和多功能的三苯基碳探针12为在体内同时测量数个参数提供了无与伦比的机会及其与探针分布和测量时间无关的相关分析。根据我们的知识, 没有其他方法可以同时评估活体中的体内生理上重要的化学参数, 如pO2, pHe, Pi, 氧化还原和 GSH。
探测体内功能测量:
图 1显示用于访问参数的顺磁探头的化学结构, 其中包括微粒和可溶探针。高功能敏感性, 活组织的稳定性和极小的毒性是一些好处, 使微粒探针优于可溶性探针的体内EPR 氧。例如, 微粒探针增加了组织植入部位的保留时间, 与可溶性探针相比, 允许在数周内对组织pO2进行纵向测量。另一方面, 可溶探针通过提供基于 EPR 的成像技术的空间分辨测量, 以及允许多种功能 (pO2、pH 值、Pi、氧化还原和GSH)。

图 1。装配评估试验的顺磁探针的化学结构.这包括微粒pO2探针, 林肯-小波 (R = O (CH2)3CH3) 和可溶性探针: 双重作用 pH 值和氧化还原探针, NR;谷胱甘肽敏感探针, RSSR;和多功能pO2, pH 和 Pi 探针的胞外微环境, 希望探针.在提供的引用11、12中描述了这些探测器的合成。请单击此处查看此图的较大版本.
研究方案
所有的动物工作都是按照西弗吉尼亚大学 IACUC 批准的议定书进行的。
1. 探头的合成与标定
- 微粒pO2敏感的林肯-小波探针
注意:林肯-小波纳米微晶的合成和制备如参考13 中所述。他们是非常稳定的, 可以保持在室温下多年。林肯-小波微粒探针的 EPR 线宽是一个pO2敏感参数。林肯-小波纳米微晶显示了理想线性依赖性的线宽对氧气浓度的范围从缺氧条件高达 760 mmHg的pO 2 分部压力13, 与内在线宽的值在缺席氧和斜坡的氧依赖性 (以 mG/mmHg) 略有变化的不同批次的晶制剂。因此, 每个特定批次都需要校准。- 重60毫克的林肯-小波纳米微晶。
- 对于氧敏感性校准, 暂停纳米微晶在3毫升的 Dulbecco 的修改鹰介质 (DMEM) 介质 (在浓度20毫克/毫升) 和油脂实验5分钟的冰与探针 sonicator 20 赫使用7瓦特的力量在5毫升玻璃圆底管。
- 将微气泡纳米微晶的1毫升放在 L 波段 (1.2 GHz) EPR 光谱仪的表面线圈谐振器中, 并获得连续波 (CW) epr 谱在37°c 的生理温度和氧浓度 0, 1, 2, 4, 8和20.9%。通过用气体控制器提供的气体混合物冒泡溶液, 保持氧气浓度, 并使用恒温器上的水浴保持温度。使用以下 EPR 光谱仪采集参数: 调制振幅, 100 毫克;调制频率, 100 赫;扫宽, 5 克;扫时间, 六十年代。
- 为了达到更好的信噪比 (信噪比), 使用调制幅度值的60% 的线宽 (例如, 使用调制振幅 0.6 g 的线宽为1克)。
- 替代简化校准程序: 记录空气冒泡和缺氧解决方案中的 EPR 光谱14。在后一种情况下, 根据参考14, 增加10毫米葡萄糖和 100 U/毫升葡萄糖氧化酶到1毫升探针溶液中, 保持样品中的缺氧。
- 用洛伦兹函数拟合 EPR 谱, 求出线宽、长波。 将纳米微晶的灵敏度评估为pO 2 作为在po2 上的依赖的斜率, 即作为值 (空气−LW 缺氧)/p o 2air, 其中,和长波缺氧分别为空气和缺氧条件下的光谱线宽;pO2air = 152 mmHg。
- 双功能 pH 和氧化还原探针, NR
注意:NR 探针是按照参考11中的描述合成的。它是稳定的室温, 无论是固体和水溶液。合成的 NR 探针保持在4摄氏度。氮超精细分裂, 一个 N 和信号振幅衰减率是对 pH 敏感的 NR 探针的光谱参数 (探针 pK a = 6.6 在37°c, pH 敏感性的范围从5.6 到 7.6) 和探针的减少容量 微环境, 分别。- 从冰箱中取下 NR, 让容器温暖到室温 (10-15 分钟)。重量6.34 毫克的 NR, 溶解在1毫升盐水溶液, 并调整 ph 值为7.2 与小整除数盐酸或氢氧化钠使用 pH 计。使用准备好的 NR 溶液 (10 毫米) 作为库存解决方案。
- 执行 NR 探针的 pH 校准, 如下所示 (请参阅参考11)。首先, 添加0.1 毫升的 NR 库存解决方案, 0.9 毫升2毫米钠磷酸盐缓冲, 150 毫米氯化钠。滴定获得的 1 mM NR 溶液与整除数的盐酸或氢氧化钠的 ph 值, 使用 ph 表。使用附加在恒温器上的水浴控制温度。
- 用 L 波段 EPR 光谱仪记录样品在1.5 毫升离心管内的 EPR 谱。使用以下 EPR 光谱仪采集参数: 调制振幅, 2.5 克;调制频率, 100 赫;扫宽, 60 克;扫时间, 二十年代。
- 测量超精细分裂常数 (N) 作为 EPR 谱的低和高场分量之间距离的一半, 并绘制它与 ph 值之间的间距, 以提供 pH 值的 L 波段 EPR 测量的校准曲线.
- 谷胱甘肽敏感 RSSR 探针
注意:RSSR 探针是按照参考15中的描述合成的。将合成的 NR 探针贮存在摄氏4摄氏度。亲脂 RSSR 二硫化双基化合物容易扩散到细胞膜上, 以反应细胞内谷胱甘肽, 并提供了一个可靠的方法, 以确定谷胱甘肽在体内使用 EPR16,17。该方法以 RSSR 探针硫醇谷胱甘肽的主要胞内池的高反应速率为基础。RSSR 双基与谷胱甘肽的反应分裂其二硫化物键 (参见方案 1) 导致两个基片之间的自旋交换被取消, 并在双基谱分量的减少和相应的增加 monoradical 成分。对于双基 RSSR 探针, monoradical 分量振幅的增加率与 gsh 浓度成正比, 是一种方便的谷胱甘肽敏感的 EPR 光谱参数。要评价谷胱甘肽浓度从体内EPR 测量, 前校准率的 RSSR 反应与 GSH 在相应的温度和 pH 值必须执行如下。- 从冰箱中取出 RSSR, 让容器温暖到室温 (10-15 分钟)。在1毫升的亚砜溶液中称量4.05 毫克的 NR, 并将其溶解。使用准备好的 RSSR 解决方案 (10 毫米) 作为库存解决方案。
- 确定 RSSR 与 GSH 反应的速率常数 (kobs) 在理想的温度和 pH 值下的数值, 如下所示。
- 首先, 添加20µL 的 RSSR 库存溶液 (10 毫米) 到0.98 毫升1毫米的磷酸盐缓冲液, pH 7.2, 150 毫米氯化钠, 获得0.2 毫米 RSSR 探针溶液。
- 在 pH 值为7.2 的0.1 米磷酸酯缓冲液中, 制备1、2和5毫米 GSH 浓度的溶液。为了准确地评估靶器官细胞中的 GSH 浓度, 从体内测量中,体外校准必须在 ph 值接近细胞内酸碱度的价值时进行。
- 混合等体积的0.2 毫米 RSSR 溶液和一个谷胱甘肽溶液中制备的步骤1.3.4。为探针的最后集中在0.1 毫米和谷胱甘肽在 0.5, 1, 或者2.5 毫米。
- RSSR 和谷胱甘肽溶液混合后立即将样品放入 epr 谐振腔中, 每12秒记录一次 epr 光谱10分钟。然后计算 monoradical 谱振幅增加的动力学。使用以下 EPR 光谱仪采集参数: 调制振幅, 1 克;调制频率, 100 赫;扫宽, 60 克;扫时间, 10-60 秒。
- 将所测的 EPR 动力学与 monoexponents 进行拟合, 并计算指数动力学τ的时间常数。线性回归 (1/τ = kobs x [GSH]) 提供了观察到的速率常数值的反应, 谷胱甘肽和 RSSR (例如, 在34摄氏度和 pH 值 7.2, kobs = 2.8 @ 0.2 M-1s-1)11。
- pO2、pH 值和 Pi 评估的多功能希望探头
注意:monophosphonated 的三苯甲酯希望探针是按照参考12中的描述合成的, 并保持在4摄氏度。在 ph < < pKa (a 酸型) 和 ph > > pKa (B 基本形式) 中, 希望的 CW EPR 谱表示由双峰, 由于磷超精细分裂, 一个 P.典型的仪器设置如下: 调制振幅, 37.5 毫克;调制频率, 100 赫;扫宽, 0.9 克;扫时间, 20-60 秒。在中间 pH 值 (5 < pH < 8) 中, 当 a 和 B 状态存在时, 希望探针的 EPR 谱为四重唱。希望的单个 EPR 线宽是pO2标记 (精度, ≈ 1 mmHg;pO2范围, 1-100 mmHg)。质子希望 (一种形式) 的分数是 pH 值, 范围从6到 8.0 (精确度, 0.05)。质子交换速率 (用 mG 表示) 与通过光谱模拟提取的 pi 值是一个 pi 标记 (精度, 0.1 毫米, 范围, 0.1-20 毫米)。校准程序是在生理温度 (37 °c), 溶液离子强度 (NaCl, 150 毫米), 和希望探针浓度0.2 毫米, 如前所述引用12,18, 并详述如下。- 从冰箱中取出希望探头, 让容器温暖到室温 (10-15 分钟)。
- 称10.7 毫克的希望探针, 溶解在1毫升盐水溶液, 并调整 pH 值为7.4。添加20µL 的希望 (10 毫米) 到0.98 毫升盐水溶液的准备库存解决方案, 以获得 0.2 mM 希望探针解决方案。
- 对于探针校准的 pH 值, 滴定0.2 毫米的希望探针溶液中添加了少量的氢氧化钠或 HCl, 最后稀释的样品少于1%。使用国家标准局 (美国) 推荐的参考溶液的 ph 值, 测量 ph 为37°c 的 ph 电极。使用附在循环器上的套接反应烧杯, 在 pH 测量过程中小心地保持参考和滴定溶液的温度。在探针溶液中加入10毫米葡萄糖和 100 U/毫升葡萄糖氧化酶, 保持缺氧状态。
- 在缺乏磷酸盐的情况下, 在缺氧条件下, 分别获得 A 和 B 形式的 EPR 谱 (ph ≤5和 ph ≥ 8)。
- 利用相应的光谱获得固有的光谱参数。即, 将谱线作为洛伦兹函数的卷积, 与期望探针的未解析超超精细结构近似的高斯函数进行模拟。计算的 EPR 谱与实验谱的拟合产生P和洛伦兹线宽 (ΔLpp) 的值, 由横向松弛率决定, 1/t2 (其中 1/t2 = (√3/2) Lpp用于连续波 EPR 中射频吸收线的测量导数), 以及高斯分布的宽度, G。
注意:以下是根据步骤1.4.2 中指定的条件测量的光谱所获得的参数:p(a) = 3.63 G, 一个p(B) = 3.37 g;1/吨2(A) = 23.6 毫克;1/吨2(B) = 9 毫克;G (A) = 40 毫克;G (B) = 45 毫克 (参见参考8)。 - 获取希望在中间 pH 值 (5 < pH < 8) 中的 EPR 谱 .利用在非耦合或松散耦合系统中的多个站点之间的交换理论, 根据先前描述的 18, 模拟获得的 EPR 谱的高场分量。使用为 A 和 B 状态获取的内部参数 (请参见步骤 1.4.5) 以减少变量数。将计算出的光谱与实验结果相匹配, 以查找分数 A (pa) 的值, 并将 pA值的依赖性绘制为 pH。将 pA的依赖性用于进一步研究中的 ph 值校准曲线。
注意:用标准滴定曲线拟合 pA的 pH 依赖性提供了离解常数的值, pKA (希望) = 6.98。在体内研究中, 获取希望探针的完整 EPR 谱是不切实际的, 因为需要额外的时间来获得 EPR 谱中磷超精细分裂的低和高场分量之间的间隙。因此, 在进一步的实证研究中, 仅对 EPR 谱的高场分量进行了测量和分析。 - 对于pO2的探针校准, 获取希望探针在各种氧浓度下的 EPR 谱。
- 通过使用气体控制器提供的混合气体冒泡来控制解决方案的pO2值。使用附加在恒温器上的水浴控制溶液温度 (37 °c)。
- 模拟 EPR 谱并将其与步骤1.4.6 中描述的实验结果相匹配, 以确定氧诱导松弛率的值。
注意:氧诱导松弛率的值为0.49 毫克/mmHg 的希望探针的 A 和 B 形式, 测量37°c8。 - 对于 [Pi] 的探针标定, 在各种磷酸盐浓度下获得希望探针的 EPR 谱。使用在 pka (pka = 6.9 在37°c)18和滴定它与各种磷酸盐浓度附近的 pH 值的希望根治解决方案。按照上述步骤, 保持温度和气体组成。
- 模拟 EPR 谱, 并将其与步骤1.4.6 中描述的实验结果相匹配, 以确定 Pi 引起的汇率值。
注意:在进一步研究中, pi 诱导汇率对 pi 的依赖性被用作校准。
2. 乳癌的小鼠模型
- MMTV-PyMT 自发性肿瘤模型
- 使用4-8 周大的女性朋友病毒 B 型易感性/NIH (FVB/N) 小鼠乳腺肿瘤病毒启动子 (MMTV) 多瘤中 T 抗原 (PyMT +) 小鼠自发形成乳腺肿瘤为体内 EPR 研究.
- 为比较正常乳腺和肿瘤的组织微环境, 请使用 PyMT 癌基因 (PyMT−、"野生型") 20 中缺乏年龄匹配的 littermate 女性.
- 在异氟醚麻醉 (见下面的探针传递) 的情况下, 每周在四周内对小鼠进行 L 波段 EPR 光谱学。
- 麻醉使用空气异氟醚 (3% 异氟烷), 并将鼠标放在一个可调节的桌子上, 右, 侧位与肿瘤 (乳腺) 接近表面线圈谐振器。
- 在鼠标放置后, 通过 intratissual (it) 注入进行探针管理, 调整 epr 光谱仪, 获得5-10 分钟的 epr 谱。
- 在同一 EPR 会议期间, 测量2-3 乳腺肿瘤 (从 MMTV-PyMT + 小鼠) 或非肿瘤携带乳腺 (从 PyMT−小鼠)。
- 原位 MET-1 肿瘤模型
- 生长 FVB/N 背景 Met-1 小鼠乳腺癌细胞在37摄氏度, 5% CO2和95% 相对湿度在 DMEM 含有10% 胎牛血清 (血清), 10 µg/毫升胰岛素, 5 ng/毫升 rhegf 促, 1% PSA (青霉素 G 钠, 硫酸链霉素, 和两性霉素 B), 以80% T175 瓶汇合。
- 用10毫升 PBS (1.54 毫米的2PO4, 155 毫米氯化钠, 2.71 毫米 Na2HPO4-7H2O, 没有氯化钙或氯化镁, pH 值 = 7.4), 吸入介质并冲洗附着细胞。
- 通过添加5毫升0.25% 胰蛋白酶-EDTA 溶液和摇瓶, 分离细胞。当细胞分离时, 加入10毫升 DMEM, 其中含有10% 的血清, 并收集细胞。
- 离心机的细胞悬浮在 132 x g 10 分钟4摄氏度。使用 hemocytometer 和并用重悬将每个单元格计数为每100µL 最小 DMEM 的 1 x10 6 单元格。
- 使用胰岛素注射器 (29G1/2 针), 慢慢地将100µL 肿瘤细胞悬浮液注入8周大的雌性 FVB/N 型野生小鼠的4乳房脂肪垫中。
- 通过触诊 (大约2-3 周后出现)、生长 (视觉) 和老鼠健康 (视觉) 来监测肿瘤的起始。
- 使用卡尺测量每星期一次肿瘤尺寸, 并使用该方程确定肿瘤体积:
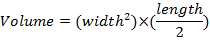
3. 对体内功能测量的探针传递
- 使用微粒林肯-小波探针 (协议 I) 用于 pO2在原位肿瘤模型中植入肿瘤细胞, 并将其内化的林肯-小波纳米微晶作为先前描述的14, 21, 并详述如下.
- 在 MET-1 肿瘤模型的情况下, 为林肯-小波纳米微晶内化成 MET-1 细胞, 在小波中暂停林肯-纳米微晶 DMEM, 浓度为20毫克/毫升, 油脂实验与探针 sonicator 在20赫上使用 7 W 功率在5毫升玻璃圆底管在冰上5分钟。
- 添加100µL (2 毫克林肯-小波) 的悬浮到一个 T75 瓶与10毫升培养基含有 MET-1 细胞 (约30% 汇合)。所有的程序都发生在一个安全的内阁和媒体含有青霉素和链霉素, 以尽量减少潜在的感染。
- 孵化细胞在37°c 72 小时, 直到他们达到80% 融合。
- 吸媒体。用10毫升 PBS 冲洗细胞五次。用5毫升胰蛋白酶-EDTA 分离细胞。收集细胞。离心机如上文所述的步骤2.2.4。用排除染料染色细胞的样本, 以确定细胞的生存能力和数量。
- 将单元格以 1 x 106的浓度 (每100µL 最小 DMEM) 暂停。
- 使用胰岛素注射器, 慢慢地注入100µL 细胞悬浮液, 其中包含了林肯-小波纳米微晶的4乳房脂肪垫8周大的雌性 FVB/N 野生型小鼠, 如步骤2.2.5 所述。
- 监测肿瘤的起始和生长情况, 如步骤2.2.6 和2.2.7 中所述。
- 使用微粒林肯-小波探针 (协议 II) 在自发或原位模型。将林肯-OBu 纳米微晶放在感兴趣的地点,例如, 使用胰岛素注射器注入正常乳腺或乳腺肿瘤。
- 可溶性探头
- 通过麻醉机吸入空气异氟醚混合物 (1.0 升/分和2-3% 异氟醚) 麻醉小鼠, 并将其置于 EPR 光谱仪的间隙。
- 调整仪器, 然后注入 NR (10-30 µL, 10 毫米), 希望探针 (10−30µL, 0.5-2 毫米) 在盐水, pH 7.2, 或 RSSR 探针的亚砜 (10 µL, 10 毫米) 解决方案 (it)。
4.体内功能测量
- 对于 EPR 光谱测量, 麻醉小鼠吸入空气异氟醚混合物使用麻醉机, 如步骤3.3.1 所述。
- 使用 L 波段 (1.2 GHz) EPR 光谱仪进行功能测量, 如下所示。
- 将表面线圈谐振器放到正常乳腺或乳腺肿瘤上, 调整光谱仪。
- 在植入后数周内, 从植入微粒探针中获取5−10的 EPR 谱。在可溶探针的情况下, 探针注入后立即获得 EPR 谱5-10 分钟。
- 分析 NR 探针的 EPR 谱, 找出超精细分裂, 一个 N 和信号振幅, I (t).使用在步骤1.2.4 中获得的校准曲线, 将N的值转换为 pH 值。分析了信号振幅 i (t) 的衰减率与初始振幅的相对变化, i (t = 0), 以每秒任意单位 (s-1) 计算。
- 拟合谷胱甘肽敏感 RSSR 探针的 EPR 谱 monoradical 分量的增加, 以获得指数动力学的时间常数来计算 gsh 浓度。
- 将多功能希望探针的高场分量的 EPR 谱与实验结果 (步骤 1.4.5) 相匹配, 以产生 pH 值, pO2和 Pi。
5. 统计分析
- 进行数据处理和统计分析。使用皮尔逊的 r 相关测试 (对于通常分布的数据集) 和长矛的秩阶相关 (对于数据分布被拒绝正态分布的数据集) 进行相关分析。
结果
组织pO2使用林肯-小波探针进行评估:
使用步骤1.1 中描述的过程, 我们进行了新制备的林肯-小波纳米微晶悬浮液的标定。图 2显示了林肯-小波探针的线宽的典型氧依赖性, 以及其在缓冲悬浮液中测定的 EPR 谱和在注射细胞肿瘤启?...
讨论
所提出的方法允许对化学药品的关键参数进行无创的体内评估, 即pO2, pH 值, 氧化还原状态, 以及间质 Pi 和胞内谷胱甘肽的浓度。磁共振技术, 如 MRI 和低场强 EPR, 是在这些参数的无创体内分析的选择方法。MRI 能直观地解剖结构, 但缺乏功能敏感性。与 MRI 相比, EPR 技术在与功能旋转探针结合使用时, 对微环境的局部参数提供了功能敏感性。根据我们的知识, 没有其他方法?...
披露声明
作者没有什么可透露的。
致谢
这项工作得到了 NIH 赠款 CA194013、CA192064 和 U54GM104942 的部分支持。WVCTSI 被确认为 VVK、AB 和 TDE 的启动。作者感谢 m. Gencheva 博士和 k. Steinberger 的帮助与说明性实验。内容完全是作者的责任, 不一定代表 NIH 的官方观点。
材料
| Name | Company | Catalog Number | Comments |
| L-band EPR spectrometer | Magnettech, Germany | L-band (1.2 GHz) electron paramagnetic resonance (EPR) spectrometer for collection in vitro and in vivo spectra of paramagnetic molecules | |
| Temperature & Gas Controller | Noxygen, Germany | Temperature & Gas Controller designed to control and adjust the temperature and gas composition | |
| Sonicator | Fisher Scientific | ||
| GSH (L-Glutathione reduced) | Sigma-Aldrich | G4251 | |
| MMTV-PyMT mice | In house | ||
| DMEM | Thermo Fisher Scientific | 11995065 | |
| Met-1 murine breast cancer cells | In house | ||
| C57Bl/6 wild type mice | Jackson Laboratory | ||
| Trypsin | Thermo Fisher Scientific | 25200056 | |
| Trypan Blue Exclusion Dye | Thermo Fisher Scientific | T10282 | |
| Ohmeda Fluotec 3 | |||
| Isoflurane (IsoFlo) | Abbott Laboratories | ||
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | sigma-Aldrich | S07051 | |
| Sodium Chloride | sigma-Aldrich | S7653 | |
| Hydrochloric acid | sigma-Aldrich | 320331 | |
| Sodium Hydroxide | sigma-Aldrich | S8045 | |
| Glucose | sigma-Aldrich | ||
| Glucose oxydase | sigma-Aldrich | ||
| Lauda Circulator E100 | Lauda-Brikmann | ||
| pH meter Orion | Thermo Scientific | ||
| LiNc-BuO probe | In house | The Octa-n-Butoxy-Naphthalocyanine probe was synthesizided according to ref 13 | |
| NR probe | In house | The Nitroxide probe was synthesizided according to ref 11 | |
| RSSR probe | In house | The di-Nitroxide probe was synthesizided according to ref 15 | |
| HOPE probe | In house | The monophoshonated Triarylmethyl probe was synthesizided according to ref 12 |
参考文献
- Siemann, D. W. . Tumor Microenvironment. , (2011).
- Tatum, J. L., et al. Hypoxia: importance in tumor biology, noninvasive measurement by imaging, and value of its measurement in the management of cancer therapy. Int J Radiat Biol. 82 (10), 699-757 (2006).
- Brahimi-Horn, M. C., Chiche, J., Pouyssegur, J. Hypoxia signalling controls metabolic demand. Curr Opin Cell Biol. 19 (2), 223-229 (2007).
- Haulica, A., Ababei, L. Comparative study of glycolytic activity in the erythrocytes of animals with chronic experimental hypoxia and with tumours. Neoplasma. 21 (1), 29-35 (1974).
- Matsumoto, K., et al. High-resolution mapping of tumor redox status by magnetic resonance imaging using nitroxides as redox-sensitive contrast agents. Clin Cancer Res. 12 (8), 2455-2462 (2006).
- Estrela, J. M., Ortega, A., Obrador, E. Glutathione in cancer biology and therapy. Crit Rev Clin Lab Sci. 43 (2), 143-181 (2006).
- Voegtlin, C., Thompson, J. W. Glutathione content of tumor animals. J. Biol. Chem. 70, 801-806 (1926).
- Bobko, A. A., et al. Interstitial Inorganic Phosphate as a Tumor Microenvironment Marker for Tumor Progression. Sci Rep. 7, 41233 (2017).
- Gillies, R. J., Raghunand, N., Garcia-Martin, M. L., Gatenby, R. A. pH imaging. A review of pH measurement methods and applications in cancers. IEEE Eng Med Biol Mag. 23 (5), 57-64 (2004).
- Gade, T. P., et al. Imaging intratumoral convection: pressure-dependent enhancement in chemotherapeutic delivery to solid tumors. Clin Cancer Res. 15 (1), 247-255 (2009).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magn Reson Med. 67, 1827-1836 (2012).
- Dhimitruka, I., Bobko, A. A., Eubank, T. D., Komarov, D. A., Khramtsov, V. V. Phosphonated Trityl Probe for Concurrent In Vivo Tissue Oxygen and pH Monitoring Using EPR-based Techniques. JACS. 135, 5904-5910 (2013).
- Pandian, R. P., Parinandi, N. L., Ilangovan, G., Zweier, J. L., Kuppusamy, P. Novel particulate spin probe for targeted determination of oxygen in cells and tissues. Free Radic Biol Med. 35 (9), 1138-1148 (2003).
- Bobko, A. A., Evans, J., Denko, N. C., Khramtsov, V. V. Concurrent Longitudinal EPR Monitoring of Tissue Oxygenation, Acidosis, and Reducing Capacity in Mouse Xenograft Tumor Models. Cell Biochem Biophys. 75, 247-253 (2017).
- Khramtsov, V. V., Yelinova, V. I., Glazachev Yu, I., Reznikov, V. A., Zimmer, G. Quantitative determination and reversible modification of thiols using imidazolidine biradical disulfide label. J Biochem Biophys Methods. 35 (2), 115-128 (1997).
- Roshchupkina, G. I., et al. In vivo EPR measurement of glutathione in tumor-bearing mice using improved disulfide biradical probe. Free Rad. Biol. Med. 45, 312-320 (2008).
- Khramtsov, V. V., Zweier, J. L., Hicks, R. . Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. , 537-566 (2010).
- Bobko, A. A., Dhimitruka, I., Zweier, J. L., Khramtsov, V. V. Fourier Transform EPR of Trityl Radicals for Multifunctional Assessment of Chemical Microenvironment). Angew. Chem. Int. Edit. 53, 2735-2738 (2014).
- Martin, M. L., Martin, G. J., Delpuech, J. J. . Practical NMR spectroscopy. , (1980).
- Lin, E. Y., et al. Progression to malignancy in the polyoma middle T oncoprotein mouse breast cancer model provides a reliable model for human diseases. Am J Pathol. 163 (5), 2113-2126 (2003).
- Eubank, T. D., et al. Granulocyte macrophage colony-stimulating factor inhibits breast cancer growth and metastasis by invoking an anti-angiogenic program in tumor-educated macrophages. Cancer Res. 69 (5), 2133-2140 (2009).
- Khramtsov, V. V., et al. Quantitative determination of SH groups in low- and high-molecular-weight compounds by an electron spin resonance method. Anal Biochem. 182 (1), 58-63 (1989).
- Komarov, D. A., et al. Electron paramagnetic resonance monitoring of ischemia-induced myocardial oxygen depletion and acidosis in isolated rat hearts using soluble paramagnetic probes. Magnetic Resonance in Medicine. 68 (2), 649-655 (2012).
- Song, Y. G., Liu, Y. P., Liu, W. B., Villamena, F. A., Zweier, J. L. Characterization of the binding of the Finland trityl radical with bovine serum albumin. Rsc Advances. 4 (88), 47649-47656 (2014).
- Khramtsov, V. V., Bobko, A. A., Tseytlin, M., Driesschaert, B. Exchange Phenomena in the Electron Paramagnetic Resonance Spectra of the Nitroxyl and Trityl Radicals: Multifunctional Spectroscopy and Imaging of Local Chemical Microenvironment. Analyt. Chem. 89 (9), 4758-4771 (2017).
- Samouilov, A., et al. In Vivo Proton-Electron Double-Resonance Imaging of Extracellular Tumor pH Using an Advanced Nitroxide Probe. Analyt. Chem. 86 (2), 1045-1052 (2014).
- Goodwin, J., et al. In vivo tumour extracellular pH monitoring using electron paramagnetic resonance: the effect of X-ray irradiation. NMR Biomed. 27 (4), 453-458 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。