Method Article
利用荧光排斥法和专用微流控器件对神经元进行高分辨率体积成像
摘要
容积是细胞生理病理特征的重要参数。我们描述了一种荧光排除方法, 允许对神经生长所隐含的突起和动态结构进行分析所需的亚测微轴向分辨率的体外神经元体积的全场测量。
摘要
体积是不同时间尺度神经元生理病理特征的重要参数。神经元是相当独特的细胞, 其扩展分支形态, 从而提出了一些方法上的挑战, 体积测量。在体外神经元生长的特殊情况下, 所选择的方法应包括测微轴向分辨率, 并结合对时间尺度的全场观测, 从几分钟到几小时或几天。不像其他方法, 如细胞形状重建使用共焦成像, 电基测量或原子力显微镜, 最近开发的荧光排除方法 (FXm) 有潜力, 以满足这些挑战。然而, 尽管它的原理很简单, 但实现神经元高分辨率 FXm 需要进行多重调整和一个专用的方法。本文提出了一种基于荧光排斥、低粗糙度多室微流控器件的组合方法, 最后 micropatterning 实现了局部神经元体积的体外测量。该设备提供的高分辨率使我们能够测量神经元过程的局部体积 (突起) 和某些特定结构的体积, 如生长锥 (gc)。
引言
近年来, 由于单细胞微生物的细胞大小动态平衡 ( 1 , 更普遍地是有丝分裂细胞2), 细胞体积的精确知识引起了人们越来越多的关注。然而, 细胞体积问题也与有丝分裂后细胞有关, 神经元构成了一个典型的例子。
体积的确是神经元生命中不同尺度和时间点的生理和病理事件的重要标志, 从与电活动相关的瞬态轴索形变 (毫秒刻度) 3到不可逆转的神经元肿胀发生在神经退行性疾病的无症状阶段 (在人类年) 4。然而, 最大的体积变化发生在一个中间时间尺度的天或周 (取决于被考虑的有机体) 在神经元生长。神经元的扩展和复杂形态学引起倍数问题, 其中细胞大小的调节。轴突长度和直径确实是严格的调节在体内, 每个神经元类型5,6特定的值。
这些问题, 复杂到地址在体内, 也可以用简化的方式来解决在体外.在这个目标中, 一个专门用于体积测量的方法, 它能够快速地跟踪增长动态 (例如, 在时间刻度中为), 并与在数小时或几天内的观察相兼容。多年来, 已经开发了几种方法, 以便直接或间接地访问细胞体积体外。共焦成像的细胞重建是其中之一, 但这种方法意味着标记和重复曝光, 同时显示有限的轴向分辨率约500毫微米7。请注意, 这两个最后的缺点是部分克服了一个更复杂和最近的方法, 称为格子光片显微镜8。原子力显微镜已经使用了9 , 但这种扫描方法本质上是缓慢和繁琐的。此外, 它需要与细胞的物理接触可能干扰的测量考虑到神经元的极端柔软性10。使用阻抗或共振的间接方法已用于不同的细胞类型11, 但不适用于像神经元这样的扩展粘接细胞。
最有希望的方法之一是建立在封闭腔内填充荧光染料的细胞被排除体积的测量。荧光排除法 (FXm) 在其原理上是简单的, 因为它不需要标注, 并且适用于具有潜在亚光学轴向分辨率的细胞群的快速、长期光学成像。更确切地说, z 的分辨率取决于培养室中的最大荧光强度 (即区域内没有单元格) 除以相机的动态范围, 尽管有几个噪声源限制了这个最终分辨率。此方法非常强大, 可以跟踪迁移粘附单元格12的体积, 也可以研究哺乳动物细胞有丝分裂过程中的体积变化, 如13中详细描述的那样。然而, 神经元构成了 FXm 考虑其广泛的分测微过程的方法学挑战。
我们在这里提出了一个方法, 以使光滑的 FXm 室, 以高精度访问的数量和高度的神经元分支和动态结构涉及神经元生长如生长锥。
为了优化轴向分辨率, 硐室应具有与所测量物体相似的高度。因此, 我们设计了不同的 FXm 设备的特点是中央测量室的三不同的高度。最薄 (3 µm 在高度) 专门用于突起测量: 这个低高度不包括躯体, 保持在近15µm 高中间室。较厚的中央腔 (10 和12µm) 足够高, 以跟踪整个细胞的生长。该装置还包括位于中心腔两侧的两个储层。四射入孔 (IH) 因而被执行并且被选定如下: 入口和出口为介绍细胞悬浮入芯片, 而另外二其他哺养水库。
我们首先用已知几何的光刻胶结构制造高度测量的校准盖玻片。然后我们想象了自由生长的神经元, 还有形态上受约束的神经元 micropatterns 的黏附力。
研究方案
这项研究是根据欧洲共同体关于实验室动物的护理和使用的指导方针进行的: 86/609/欧洲经济共同体。研究目的和协议在 ERCadg 项目大提琴的道德附件中被描述, 它被批准了并且由 ERCEA 经常审查。居里动物设施研究所已收到许可证 #C75-05-18, 24/04/2012, 报告给 matière d ' Ethique en expérimentation 活动巴黎中心和南部 (国家注册号: #59)。
1. 模具制造
注: 该模具包括连接到入口和出口的中央和中间腔室, 外加两个位于中心腔两侧的储层 (和进水口)。
- 使用扁镊子操纵51毫米直径硅片, 并将它们从一个地方转移到另一处。
- 中央腔硅模具
- 用正光刻胶填充2毫升的塑料吸管。将吸管放置在51毫米直径硅片的中心, 并按其储层, 直到覆盖约75% 的硅片表面与光刻胶。旋转外套在3000转每分钟三十年代。
- 将晶片从自旋涂布机转到热板, 表面温度为100摄氏度, 五十年代。
- 将晶片从热板转移到掩模光刻的衬底夹 (恰克)。通过 "DRIE 掩码" (参见补充文件 "masks_neuron_volume_chips" 和 "masks_neuron_volume_chips. dxf") 公开。
- 将晶片从恰克上取下, 然后将其潜入含有显影剂的100毫升玻璃结晶皿中 (稀释1:4 在去离子水中)。松开晶片, 保持1分钟, 并轻轻搅拌结晶盘。
注: 为了节省试剂, 在最高处将结晶皿填满1厘米。 - 从开发者那里拿回晶片, 把它浸入到一个100毫升的结晶皿里, 里面装满了去离子水, 大约十年代. 然后将晶片放在吸水性纸上, 用空气吹气枪将硅片烘干。
- 五十年代在一个热板上放置硅片, 表面温度为115摄氏度。
- 使用以下参数执行深层反应离子蚀刻 (DRIE) (DRIE 技术的更多信息可在参考资料14和15中找到);钝化步骤:50 sccm 的 C4F8, 他支持流 10 sccm, CP 10 W, 电感耦合等离子体 (ICP) 1500 W, 总压力24毫巴, 温度18°c;蚀刻步骤: 100 sccm 的 SF6, 他支持流 10 sccm, CP 11 W, ICP 1500 W, 总压力24毫巴, 温度18°c;钝化时间: 4 秒;蚀刻时间: 7 秒;总工艺持续时间: 通常为5分钟, 约10µm 蚀刻深度。
- 通过将基板潜水到充满丙酮的结晶皿中, 溶解光刻胶。
- 将晶片浸入食人鱼溶液中 (2/3 h2O2 (30%) 和 1/3 h24 (95%)), 用于5分钟。
注意: 总要添加 h2O2 , 然后是 h24 , 清洗后在去离子水中至少冲洗3次。
- 根据表 1-3中列出的参数执行步骤1.2.1 以1.2.11 来制造与中间腔对应的模具。
注: 每个表对应一个特定的装置, 其特征是中央观察室的某一高度。
注意: 使用增加的光刻胶高度 (每个设备的掩码1到 3) 执行整个过程, 请参阅辅助文件 "masks_neuron_volume_chips" 和 "masks_neuron_volume_chips. dxf")。- 将蚀刻硅片放在自旋涂布机衬底架上。
- 检查旋转涂布机是否工作正常, 通过验证基板的吸尘效果是否有效 (基板在标称转速时应旋转并保持到位)。
- SU-8 的粘度随靶厚度范围的高度而增大。总是使用20-30 毫升瓶储存 SU-8 光刻胶和倒在晶片之前, 自旋涂层 (SU-8 可能是太粘性, 用塑料吸管操作)。
- 将负环氧型光刻胶 SU-8 在承印物的中心, 直至覆盖约75% 的硅片, 然后使用表中列 "Spincoating" 所示的参数进行自旋涂层。
- 将涂覆的晶片放在热板上, 以表示 "软烘烤" 的持续时间和温度。
- 在掩模光刻上安装蚀刻晶片和适当的 "SU-8 掩码"。
- 使用专用对齐十字 (这些十字的典型尺寸:50 µm x 150 µm), 在每个掩码上设计蚀刻晶片与蒙版对齐。
注意: 设备两侧的两个十字交叉是足够的 (一个在左下, 一个在右上)。 - 公开使用掩码光刻 (波长 365 nm) 的 I 线与适当的紫外线剂量, 如行 "曝光能量" 所示。
注: 曝光时间的计算方法是将每种光刻胶的曝光能量 E 除以紫外线灯的有效功率, 由蒙版的吸收调节: x (1-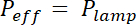 吸收掩码)。吸收约20% 的柔性面具和可忽略的铬硬面具。
吸收掩码)。吸收约20% 的柔性面具和可忽略的铬硬面具。 - 将所述涂层晶片放在热板上, 以在 "后烘烤" 中注明的持续时间和温度。
- 准备两个100毫升的玻璃结晶皿, 其中一个包含显影液, 另一只空。在 "开发" 行中显示的持续时间内, 在开发人员中潜水晶片。轻轻搅动结晶皿一直在发展
- 将硅片与异丙醇洒在空的结晶盘上大约5秒。最后, 把晶片放在吸水纸上, 用空气吹枪把它用加压氮气烘干。
- 将涂敷的晶片放在热板上, 以便在 "硬烘烤" (可选) 中注明的持续时间和温度。
注意: 此步骤有助于避免光刻胶中的裂纹, 并为下一步的步骤提供均匀平整的表面。 - 重复步骤 1.3.1 1.3.10 以完成表 1-3中列出的进程。
- 在最后一步的光刻, silanize 的最终主模具组成的3层的负光刻胶通过派遣两个100µL 液滴氯 (1 h, 1 h, 2 h, 2 h 氟辛) 硅烷的每一侧的主在一个100毫米的培养皿。用塑料石蜡膜封住培养盘, 室温下孵化20分钟。
注: 主模具已准备就绪, 可多次使用。
- 将蚀刻硅片放在自旋涂布机衬底架上。
2. 微芯片制造
- 将90克硅基有机聚合物 (烷:) 倒入100毫升的塑料杯中。添加10克的硫化剂 (1:10 的重量)。用塑料吸管搅拌混合物2-3 分钟。
注: 用10克的硫化剂混合90克, 制作6片。 - 将混合物放在真空干燥中, 泵约30分钟, 以去除被困在该硅烷中的气泡。
- 将主模放入 P100 培养皿中, 用注射器将混合物的15毫升倒入模具中。
注:15 毫升导致总芯片高度为1.5 毫米。 - 在真空干燥和泵内放置一个模塑结构, 直到没有更多的气泡爆裂在其表面。
注: 此步骤大约需要30分钟。 - 使用锥尖将晶片放在培养皿的底部, 以避免晶片下方的已死的。将该注塑模装置放置在烤箱中, 设置为70摄氏度, 至少2小时。
- 脱模在化学罩下使用不锈钢扁铲, 并将异丙醇倒在芯片上。把它放在引擎盖的不锈钢长凳上。
- 在硅片周围切开, 用手术刀脱模。
- 用手术刀或剃刀刀片在芯片上切开 (留下2毫米的边缘)。
- 冲床入口通过按1.5 毫米直径冲床牢牢地和驱动它切割和雕刻的入口孔。在芯片的四个专用区域内进行同样的注入液体。
- 在微结构光纤一侧粘附胶带, 清洁晶片。两边洒异丙醇。然后用吹气枪将压氮气的晶片烘干。
3. 制作图案化盖玻片 (24 x 24mm2)
注: 用弯镊子操作盖玻片。
- 聚鸟氨酸 (巴解组织) 模式
- 在玻璃盖玻片上应用O 2 清洗等离子。等离子参数: 泵送压力: 0.25 毫巴;O2供应持续时间: 3 分钟;气体流量:10 sccm;最大偏差: ±5 sccm;血浆持续时间: 3 分钟;设定压力: 0.36 毫巴;最大偏差: ±0.10 毫巴;设置功率:50 W;最大偏差: 5%;排气持续时间: 四十五年代。
- 混合484µL 醋酸和56µL 3-methacryloxypropyl 三氯, 完全与绝对乙醇, 以获得总容积15毫升。
- 使用1毫升尖锥, 在每个盖玻片上放一滴500µL, 等待2-3 分钟干燥使用洁净室超细纤维雨刷。
注: 硅烷化玻璃盖玻片可储存在室温下1月的塑料盒内密封的塑料石蜡膜。 - 将每个盖玻片放在一个干净的房间环境中的旋转涂布机上。将一滴正面光刻胶覆盖约75% 的盖玻片 (约500µL) 和自旋涂层在4000转每分钟三十年代达到0.45 µm 的最终厚度。
- 将盖玻片1分钟放在加热板上, 表面温度为115摄氏度。
- 使用掩码光刻, 根据制作者参数 (紫外线剂量约 50-60 mJ-1), 通过专用掩码将每个盖玻片以 435 nm (G 线) 的波长公开.
- 准备2玻璃结晶皿, 其中一个含有显影液 (不稀释), 另一种含有去离子水。
- 在开发人员中每盖玻片潜水1分钟, 并轻轻搅拌结晶盘。然后将晶片浸泡在去离子水中大约5秒. 将晶片放在吸水性纸上, 用空气吹气枪将晶圆干燥并加压氮气。
- 应用与3.1.1 中相同参数的激活 O2等离子体。
- 在罩下, 废黜四170µL 下降100µg/毫升巴解组织解决方案每 P100 培养皿。把盖玻片的图案面放在这些水滴上。用塑料石蜡膜封住培养皿以避免干燥。在 RT 一夜之间孵化。
注: 巴解组织的解决方案应保留在盖玻片的毛细现象。 - 准备四个接受者 (通常是 P60 培养皿), 填充三的 PBS 和第四个与去离子水。准备两个纯乙醇的玻璃结晶皿。
- 从培养皿中取出每个盖玻片, 将其浸入 10-15 s 的第一个 PBS 浴中, 通过将盖玻片垂直放在侧面, 将液体从吸收组织中排出, 然后将其插入例如在乙醇浴内的图案面。
注: 一旦完成了光刻胶的溶解, 就很难找到盖玻片的图案侧。因此, 在这个阶段, 跟踪它的位置是很重要的。 - 将乙醇结晶皿放在超声波浴 sonicator (120 瓦特/35 赫) 内, 让光刻胶溶解3分钟。
注: 改变乙醇浴每4盖玻片, 以限制稀释的 PBS, 可能会损害溶解的光刻胶。 - 从乙醇浴中取出盖玻片, 然后在第二个 PBS 浴缸中潜水几次。反复检查表面, 直到由乙醇剩余液膜产生的油腻表面消失。
- 淹没为 5-10 s 盖玻片入第三个 PBS 浴。然后立即将其转移到去离子水浴。将盖玻片放在吸水纸上, 用空气吹气枪将其干燥并加压氮气。
注: 在去离子水中的最后一次冲洗是用来避免在干燥步骤中形成 PBS 晶体。
- 高度标定用光刻胶结构
- 仅执行步骤3.1.4。3.1.8。使用专用掩码 (掩码 "光刻胶条纹", 请参阅补充文件 "Mask_Photoresist 条纹. dxf")。
4. 芯片组装及最终实施
- 玻璃底碟上的芯片组装
- 将该芯片和玻璃盘放在一起, 将其粘合到等离子腔内进行表面活化。参数: 泵下压力: 0.25 毫巴;O2供应持续时间: 3 分钟;气体流量:10 sccm;最大偏差: ±5 sccm;血浆期间: 三十年代;设定压力: 0.40 毫巴;最大偏差: ±0.10 毫巴;设置功率:50 W;最大偏差: 5%;排气持续时间: 四十五年代。
- 轻轻地把激活的盖玻片芯片与玻璃的接触, 并微妙地施加压力的边缘芯片, 以债券芯片的盖玻片。为了增加粘结强度, 将设备放在烤箱中70摄氏度, 5 到10分钟。
注: 不要按含有柱子的部件, 它们可能会在太大的压力下倒塌。 - 在罩下 (即RT) 和粘合后30分钟内, 在 IHs 处放置一个10µL 尖锥, 填充100µg/毫升巴解组织溶液, 然后注入液体。调整音量, 以便在每个 IHs 的顶部形成一滴。然后, 使用一个1毫升尖端锥, 添加 PBS 在培养皿周围的芯片。
- 让芯片在 RT 至少2小时的孵化时间。为过夜孵化, 密封的培养皿使用塑料石蜡膜, 以避免干燥。
注: 液体不应泄漏芯片外, 否则芯片必须丢弃。 - 按一个10µL 尖锥轻轻地进入每个, 吸了过量的液体。然后将尖端锥完全粘在插座内, 并绘制剩余的液体。
- 按照步骤 4.1.5 (排空) 和 4.1.3 (填充) 中给出的指示, 以层粘连蛋白取代巴解组织。在 RT 中孵育1小时。
- 按照步骤 4.1.5 (排空) 和 4.1.3 (填充) 中给出的说明, 用培养基替换层粘连蛋白。培养基成分: 记忆 81.8%;丙酮酸钠100毫米 1%;Glutamax 200 毫米 1%;马血清 5%;B27 补充剂 2%, N2 补 1%, 庆大霉素 0.2%;使用 220 nm 过滤器筛选解决方案。使用一个1毫升尖锥, 也更换的 PBS 周围的芯片由这个媒介。
- 在神经元播种之前, 将芯片放入37°c 和 5% CO2的孵化器中, 至少5小时 (或一夜)。
- 采用图案盖玻片的芯片组装
注意: 如果图案化的盖玻片包括正光刻胶参照对象, 请执行 4.2.1 4.2.9 的步骤。否则, 仅执行步骤 4.2.3, 在4.1.2 中表示的巴解组织图案盖玻片上贴上该设备, 然后将培养基内和周围的芯片放到步骤4.2.10 上。- 将一滴水放在长方形厚显微镜玻璃滑梯上, 并将盖玻片贴在玻璃滑梯上, 毛细现象 (非花纹侧面面对玻璃滑动)。在显微镜下, 用毡笔标记玻璃滑梯背面的光刻胶条纹的位置。
- 将图案化的玻璃盖玻片放在掩码光刻的掩模架上。依靠用毡笔制作的标记来居中光刻胶参考对象。
- 执行的等离子步骤, 如4.1.1 中所述的。
- 将该芯片放在掩码光刻的移动衬底夹 (恰克) 上。
注: 要增加光学对比度, 请将硅片置于该芯片下方。在对准过程中, 硅晶片应保持牢固地附着在卡盘上 (使用透明胶带将其粘附到卡盘上)。 - 在机械触点的极限处提起卡盘, 使芯片与位于盖玻片上的光刻胶条纹阵列对齐。
- 通过完成吊盘直到盖玻片的表面接触玻璃盖玻片, 实现芯片与零件之间的机械接触。
- 放下恰克从掩模架上卸下现在与芯片粘合的盖玻片。然后将该设备放入35毫米培养皿中, 并将所有东西转化为烤箱 (温度:70 °c), 5 到10分钟, 以增加粘结强度。
- 在步骤4.1.3 中执行。
注: 如果使用巴解组织图案盖玻片, 请直接从步骤4.2.7 到步骤4.2.9。 - 按照步骤 4.1.5 (排空) 和 4.1.3 (灌装) 中描述的过程, 将巴解组织替换为电镀介质。使用一个1毫升尖锥, 也更换的 PBS 周围的芯片由这个媒介。
- 把芯片放入孵化器调节在37°c 和 5% CO2 , 直到神经元播种, 至少有5小时的孵化时间。
5. 神经元文化
- 在88毫升的塑料瓶中混合10毫升的 HBSS 10x、2毫升的 Hepes 1 米和200毫升的无菌水, 准备100毫升的解剖培养基 (HH 培养基)。
注: HH 培养基可以在培养前的前一天准备。 - 解剖从 E18 小鼠胚胎中提取的海马, 从母亲安乐死的颈椎脱位 (C57BL/6J 小鼠从查尔斯河)。解剖步骤例如在16中详细说明。
- 将海马体放置在含有胰蛋白酶的塑料管中 (0.3 毫升胰蛋白酶 2.5%, EDTA 为2.7 毫升的 HH 培养基), 在37摄氏度时为10分钟, 以开始化学离解。
- 丢弃几乎所有的液体, 并用一次性塑料吸管替换5到10毫升的 HH。做3次。对于最后的填充, 使用1毫升的电镀介质而不是 HH。
- 机械分离组织使用1毫升尖端锥的志向和弹出的完整卷几次, 避免制造气泡和使用不超过15-20 通道。
- 在一个单独的500µL 接受者, 准备一个解决方案使用5µL 细胞悬浮稀释45µL 的 PBS。使用10µL 吸管1µL 这个溶液, 将稀释后的悬浮液插入 Malassez 细胞计数器。使用17中提供的指示来估计单元格数。
注意: 单个海马通常提供大约50万的神经元。 - 离心机在 100 x g 6 分钟的 RT。
- 丢弃上清液, 用所需的电镀培养基量代替, 以达到1000万细胞/毫升浓度。并用重悬细胞通过连续的渴望和弹出细胞悬浮与1毫升尖端锥。
- 绘制芯片中存在的电镀介质 (参阅步骤 4.1.5)。收集2-3 µL 的新鲜悬浮溶液使用一个10µL 的吸管和注入它在入口 (参考步骤4.1.3 中描述的注射过程)。在插座上立即重复同一操作。
- 在每个储层中注入相同体积的电镀介质 (参见步骤 4.1.3)。
注: 在显微镜下快速观察芯片, 检查细胞密度。最佳细胞密度的大小顺序对应于正方形表面的大约5-10 个细胞由4根柱子 (大约0.3 毫米2,即大约15-20 个细胞每毫米2)。 - 最后重复步骤 5.10, 改用 0.5-1 µL 细胞悬浮液达到靶细胞密度。
- 将种子芯片放入一个调节在37°c 5% CO2的孵化器中。
6. 荧光排斥观察
- 用成像培养基替代培养基。
- 准备成像介质, 如在 4.1.7, 但使用, 而不是无酚红和添加荧光葡聚糖。在这个目标, 稀释葡聚糖 (分子量1万克/摩尔, 股票溶液集中在10毫克/毫升在 PBS), 以达到最终浓度 0.5-1 毫克/毫升在成像介质。
注: 使用葡聚糖共轭物, 吸收/发射极大值496/524 或650/668。首选图像0.45 µm 高正的光刻胶结构 (以摆脱其在红色带宽的自动荧光) 和第二个图像神经元 (毒性较低)。 - 使用10µL 吸管清空所有入口, 并完全用成像介质重新填充 (请参阅步骤4.1.3 和4.1.5 以精确的介质置换方法)。
- 准备成像介质, 如在 4.1.7, 但使用, 而不是无酚红和添加荧光葡聚糖。在这个目标, 稀释葡聚糖 (分子量1万克/摩尔, 股票溶液集中在10毫克/毫升在 PBS), 以达到最终浓度 0.5-1 毫克/毫升在成像介质。
- 成像
- 将芯片置于装有环境室的荧光显微镜下, 调节在37摄氏度和 5% CO2。使用 40X, 数字孔径 (NA) 0.8 干目标, 30% 的全功率 (全功率: 3 W) 和30毫秒的曝光时间。获取焦点上的单元格图像 (在时间推移实验的情况下从单个到多个连续图像)。
- 图像分析
- 使用专用软件中实现的后台还原例程对图像进行规范化, 以获得均匀的背景。有关此软件中包含的图像处理步骤的详细信息, 请参见13 。输出图像具有。垫格式。
- 转换.垫文件入。TIFF 8 位图像使用常规放入补充材料 (conversion_mattotiff, 这要求 importfilevol. m)。
- 在 ImageJ 上执行导入 > 图像序列以从中生成视频。TIFF 图像。
- 计算一个正方形区域的平均强度 P, 在柱子的中心 (参考对象) 和单位的正方形区域的平均强度 B (背景,即高度零)。有关图像处理的详细方法的示例, 请参见18 。
注: 用作强度参照的正方形区域的横向尺寸必须约为柱直径的一半, 以获得足够的像素, 同时避免从柱子边缘产生光污染。 - 使用 P 和 B 值从强度i到高度h建立线性转换定律:
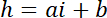
使用hc 的会议厅的已知高度, 和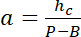
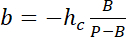
注: 该项显示无可检测的自体荧光。 - 选择感兴趣区域周围的区域, 使用 ImageJ 集成强度 (有关详细信息, 请参见19 ), 并应用在6.3.5 中获得的转换法来测量单元格室的体积。
注: 感兴趣的区域可以根据子细胞元素的荧光 (如肌动蛋白) 来选择,例如, 用于选择 gfp-LifeAct 神经元中的生长锥, 选择 gfp 发射通道中感兴趣的区域, 保存此区域使用 ROI 管理器工具, 然后测量封闭在葡聚糖发射通道内同一区域内的单元体积 (红色)。
结果
1和2节中描述的制造过程的结果由图 1A-1B的图像和图 1C的曲线来说明。图 1D表显示了两个不同代表性区域的µm 的粗糙度值,即位于中心和20高下一中间腔。用蚀刻硅晶片代替 SU-8 光刻胶, 获得了约7的粗糙度降低。然后, FXm 第一次应用于已知几何 (图 2A) 内10µm 高腔内的光刻胶条纹。在图像处理和强度到高度转换之后 (请参见图 2B的图表), 沿此条带 (图 2C) 的横断面上执行的 FXm 配置文件提供所需的高度配置文件 (图 2D)。图 2D显示了使用机械轮廓术和 FXm 方法获得的配置文件之间的比较。这些配置文件 (包括边缘和高原值) 非常相似, 验证了该方法。请注意, FXm 数据的散射并不代表方法的最终分辨率, 如在图 3和图 4中进一步评估的那样, 但由于使用的低强度而导致非常弱的可能影响GFP 通道中的光刻胶的自动荧光。
然后, 我们观察到突起在3µm 和10µm 高室 (图 3)。背景噪声的标准偏差约为 18 nm, 强度为高度转换和背景校正。此值略高于在硅表面上铸造的 SU-8 的物理粗糙度 (12 nm, 请参阅图 1D表), 但远低于从模具获得的在基材上测量的粗糙度。这些结果突出了钻孔入硅晶片的附加值, 而不是把孔 SU-8 光刻胶成铸柱。这样的低值允许高信噪比和非常清晰的图像, 如图 3A中显示的那样。作为可从这些图像中检索到的数据的示例, 我们计算了1.6 µm (即10 像素) 宽突起切片的体积 (请参见图 3B的图表)。在第一近似中, 这些数据的线性拟合给出了大约 400 nm 的平均突起高度值, 与例如在胼胝体5内10天的老幼崽中发现的 500 nm 轴突直径相比较。我们还结合 FXm 与 micropatterns 的黏附力组成的连续紧靠2µm 和6µm 宽条纹30µm 长度。我们的目的是研究突起宽度对其3D 形状的影响。图 3C显示了在10µm 高腔内获得的整个神经元图像的假颜色的3D 表示形式。突起在2µm 和6µm 宽条纹上传播, 而躯体位于最大条纹的末端。高度剖面画在三个不同的剖面。与图 3A中显示的图形一致, 在剖面上集成的曲面随突起宽度而增加 (图 3D)。
我们还专注于生长锥 (GC) 3D 结构。图 4-b显示两个不同的 GC 配置文件, 在3µm 高室中获得, 突出显示了它们的分支子结构。此外, 我们还进行了时间推移实验, 以跟踪12µm 高室中的 gc 体积的动态。图 4C显示了给定 GC 在几分钟的时间范围内收缩和重新激活的循环。多亏了 gfp-lifeact 小鼠的使用, 生长锥在 gfp 发射波长 (510 nm) 中被本地化为高肌动蛋白浓度。在波长确定的表面被用来整合在 647 nm 的葡聚糖发射波长计算 GC 体积。图 4D最后显示了在不同的时间点和位置上的 GC 卷在三个不同的神经元上的分布, 以大约6µm3的值为中心。
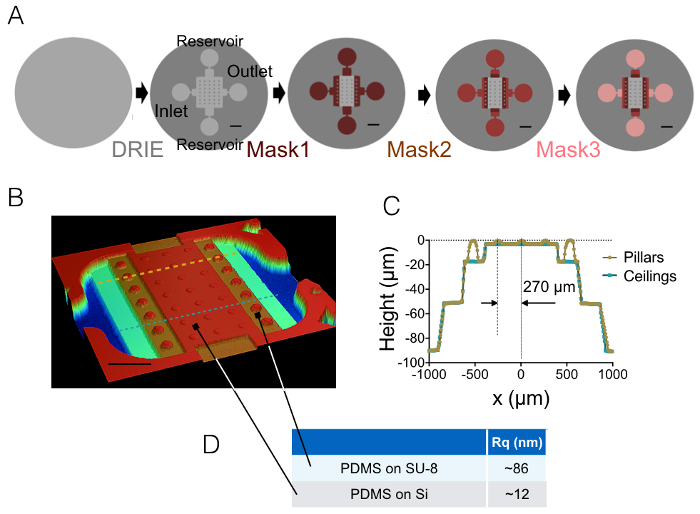
图 1: FXm.(A)方案的四个不同的主要步骤的微细加工导致最终模具。指出了入口、出口和水库的位置。缩放条: 1 mm。(B)使用光学轮廓获得的 FXm 室的图像。该图显示了中心腔内有3排10µm 高柱, 中间分室的高度为20、50和90µm。缩放条: 500 µm. (C)在 (B) 中绘制的两条虚线上的芯片横截视图。黄色/金色: 沿着柱子的剖面, 蓝色: 柱子之间的剖面。(D)表示在硅上模压的 50 x 50 µm2区域和20个µm 高 SU-8 中间腔 (参见这些区域位置的箭头) 测量的所用的塑料粗糙度值。平均值是从三个不同区域的测量得到的。请单击此处查看此图的较大版本.
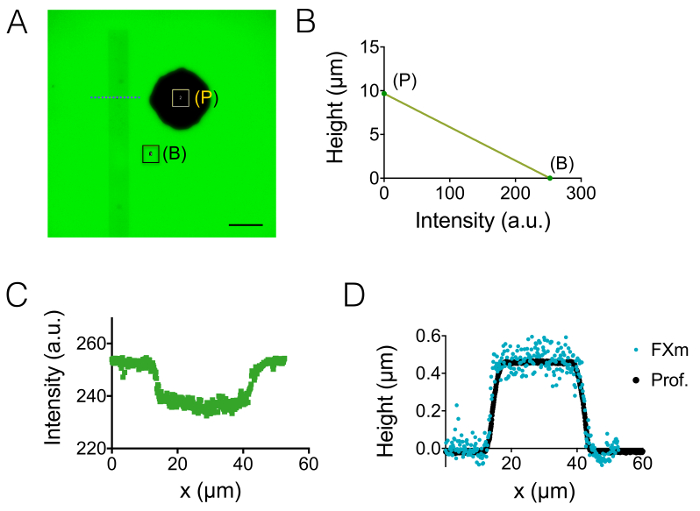
图 2: 使用光刻胶条纹作为感兴趣对象的 FXm 方法的校准.(A) GFP-荧光图像在10µm 高腔内填充1万兆瓦葡聚糖吸收 488 nm 在1毫克/毫升。(B: 背景, P: 支柱)。观察与干 40X NA 0.8 目标。刻度条:50 µm. (B)通过在 (a) 中显示的蓝色虚线的水平上获得的两个彩色矩形的平均强度获得的线性校准定律, 穿过光刻胶条纹 (0.45 µm 高正光刻胶)。(D)从机械轮廓 (黑点) 和 FXm 在强度到 (B) (蓝点) 数据高度转换后获得的轮廓进行比较。请单击此处查看此图的较大版本.
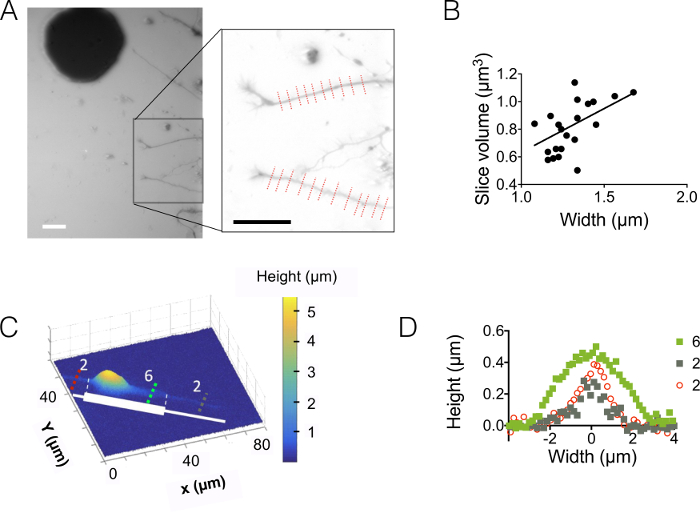
图 3: 突起卷成像.(A)突起从位于下一个15µm 中间室的躯体中延伸到中央3µm 高室。使用1万兆瓦葡聚糖吸收 488 nm 和 40X, NA 0.8 干目标的成像。使用背景还原例程后获得的嵌入突出显示两个突起, 并选择在右侧绘制图形。缩放条:30 µm。(B)突起切片卷作为从22配置文件 (平均10像素) 获得的突起宽度函数,即(a) 中显示的1.6 µm "突起切片") 中的。实线代表0.4 µm 通过原点的线性拟合。(C)在连续2µm 和6µm 宽树桩 (以白色表示) 的粘合剂条纹上的图案神经元的假彩色图像。测量是在10µm 高腔填充1万兆瓦葡聚糖吸收647毫微米和使用 40x NA 0.8 干目标。与 (C) 中显示的彩色虚线相对应的(D)高度配置文件, 保持相同的颜色代码。请单击此处查看此图的较大版本.
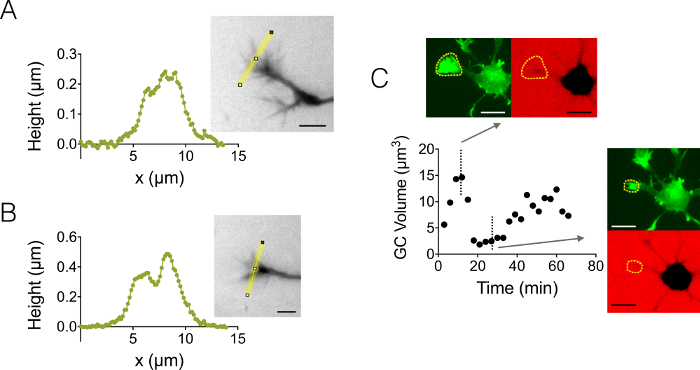
图 4: 静态和动态增长锥成像.(A-B)生长锥高度剖面获得的3µm 高室后强度到高度转换沿黄线显示在相关的图像。观察使用填充1万兆瓦葡聚糖吸收488毫微米和 40X, NA 0.8 干目标。(C)在12µm 高的腔内填充1万兆瓦的葡聚糖吸收 647 nm 的全神经元成像。对两个荧光通道进行了观察: 用于生长锥定位的 GFP (虚线黄线) 和 CY5 计算 GC 体积从荧光排除。用虚线黄线包括的曲面计算 GC 体积。该图显示了在两个代表性的不同时间点上, 在 GFP 和 CY5 通道中, GC 体积随时间变化和相关形貌。所有数据都是用 40x NA 0.8 干目标每3分钟获得的. 刻度条:10 µm.请单击此处查看此图的较大版本.
| 步骤 | 面具1:8 µm 层 | 面具两点半µm 层 | 面具3:40 µm 层 |
| SU-8 型 | 2007 | 2025 | 2050 |
| Spincoating | 三十年代 @ 2000 转每分钟 | 三十年代 @ 3050 转每分钟 | 三十年代 @ 3250 转每分钟 |
| 软烘烤 | 3分钟 @ 95 °c | 2分钟 @ 65 °c + 6 分钟 @ 95 °c | 3分钟 @ 65 °c + 7 分钟 @ 95 °c |
| 曝光能量 | 110兆焦耳/厘米2 | 155兆焦耳/厘米2 | 170兆焦耳/厘米2 |
| 曝光后烘烤 | 4分钟 @ 95 °c | 1分钟 @ 65 °c + 6 分钟 @ 95 °c | 2分钟 @ 65 °c + 7 分钟 @ 95 °c |
| 发展 | 2分钟三十年代 | 5分钟 | 6分钟 |
| 硬烤 (可选) | 3-5 分钟 @ 200 °c | 3-5 分钟 @ 200 °c | 3-5 分钟 @ 200 °c |
表 1: 为生成包含12微米高度的中心腔的设备而执行的光刻步骤.中间房间的高度:20, 50 和90µm。
| 步骤 | 面具1:10 µm 层 | 面具两点半µm 层 | 面具3:40 µm 层 |
| SU-8 型 | 2007 | 2025 | 2050 |
| Spincoating | 三十年代 @ 1500 转每分钟 | 三十年代 @ 3050 转每分钟 | 三十年代 @ 3250 转每分钟 |
| 软烘烤 | 3分钟 @ 95 °c | 2分钟 @ 65 °c + 6 分钟 @ 95 °c | 3分钟 @ 65 °c + 7 分钟 @ 95 °c |
| 曝光能量 | 125兆焦耳/厘米2 | 155兆焦耳/厘米2 | 170兆焦耳/厘米2 |
| 曝光后烘烤 | 4分钟 @ 95 °c | 1分钟 @ 65 °c + 6 分钟 @ 95 °c | 2分钟 @ 65 °c + 7 分钟 @ 95 °c |
| 发展 | 2分钟三十年代 | 5分钟 | 6分钟 |
| 硬烤 (可选) | 3-5 分钟 @ 200 °c | 3-5 分钟 @ 200 °c | 3-5 分钟 @ 200 °c |
表 2: 为生成包含10微米高度的中心腔的设备而执行的光刻步骤.中间房间的高度:20, 50 和90µm。
| 步骤 | 面具1:12 µm 层 | 面具2:32 µm 层 | 面具3:40 µm 层 |
| SU-8 型 | 2015 | 2025 | 2050 |
| Spincoating | 三十年代 @ 3250 转每分钟 | 三十年代 @ 2500 转每分钟 | 三十年代 @ 3250 转每分钟 |
| 软烘烤 | 3分钟 @ 95 °c | 2分钟 @ 65 °c + 5 分钟 @ 95 °c | 3分钟 @ 65 °c + 7 分钟 @ 95 °c |
| 曝光时间 | 140兆焦耳/厘米2 | 157兆焦耳/厘米2 | 170兆焦耳/厘米2 |
| 曝光后烘烤 | 4分钟 @ 95 °c | 1分钟 @ 65 °c + 5 分钟 @ 95 °c | 2分钟 @ 65 °c + 7 分钟 @ 95 °c |
| 发展 | 3分钟 | 5分钟 | 6分钟 |
| 硬烤 (可选) | 3-5 分钟 @ 200 °c | 3-5 分钟 @ 200 °c | 3-5 分钟 @ 200 °c |
表 3: 为生成包含3微米高度的中心腔的设备而执行的光刻步骤.中间房间的高度:18, 50 和90µm。
辅助数据1: masks_neuron_volume_chips. tiff。用于制造该器件的面具的示意图 (DRIE 面具和面具 1-3)。请单击此处下载此文件.
补充数据 2:文件 "masks_neuron_volume_chips. dxf"。电子文件, 允许制造 DRIE 面具和面具1-3。请单击此处下载此文件.
补充数据 3: "Mask_Photoresist 条纹. dxf"。电子文件, 允许制造光刻胶条纹光刻所用的面具。请单击此处下载此文件.
补充数据 4:文件 conversion_mattotiff请单击此处下载此文件.
补充数据 5:文件 importfilevol请单击此处下载此文件.
讨论
由于这些细胞的长而薄的延伸, 神经元的体积成像对 FXm 技术构成了挑战。本协议描述了用于神经元成像的同类型微流控装置的变体。
在微流控设计方面, 目标的选择是荧光排除成像的基础, 意味着横向分辨率和图像清晰度之间的权衡。在13中显示, 如果在焦点上进行成像, 并且在对象的轮廓之间留有足够的边距, 则导致焦点小于腔高的深度的高 NA 不会对体积测量的精度造成不利影响。本金和集成曲面的边界。然而, 由于光子扩散, 使用比聚焦深度高得多的腔会削弱图像的清晰度, 从而使感兴趣对象的边缘平滑。3µm 高室的制作减少了这种侧向模糊, 并提供了异常明确的荧光排除图像, 即使使用高 NA (0.8) 40X 目标, 以可视化高横向分辨率的神经分支。
芯片组装是一个关键步骤, 特别是在3µm 高室的情况下, 但谨慎操作, 如4.1.2 所述避免了屋顶的倒塌。与这些薄腔相关联的高表面体积比也引发了葡聚糖浓度随时间推移的稳定性问题。我们检查了在一夜的孵化后, 葡聚糖的表面吸收是微不足道的: 在用 PBS 代替葡聚糖后, 柱与背景之间强度的差异约为最初强度对比度的1至1000。这两个地区在葡聚糖的存在。请注意, 神经元可能会粘附在底部盖玻片和在其顶部。此效果在使用图案化盖玻片(即当我们不在其内部孵化粘附分子时) 消失, 因为因此涂层严格地在腔底上进行了定位。
除了具有挑战性的形态学, 神经元是相当适合 FXm, 因为这一事实的一个主要限制的方法,即葡聚糖吞, 是非常有限的这些细胞。我们选择一个 10 kDa 的配方, 以抑制在长范围 (小时) 任何可见的吞现象。
总之, FXm 的概念简单性是由本协议所解决的一系列实验问题所平衡的, 如纳米和测微室高度, 或背景校正, 以纠正不均匀的两根柱子之间的天花板。然而, 使用关闭微流控腔来限制荧光介质产生一些特定的限制, 如需要支撑柱, 降低有效的表面可用于细胞黏附, 或必须排除体细胞从中央室观察神经元的扩展与最高清晰度, 这限制了细胞区域的高分辨率观察。这个方法的一个可能的演变将是摆脱这个物理禁闭, 被光学一个替换。光片显微术的新发展可能会与 FXm 的未来相结合。
披露声明
作者声明没有利益冲突。
致谢
作者想确认 ChiLab, 材料和微系统实验室-米兰理工大学 DISAT, 在教授 Pirri, M Cocuzza 博士和 Marasso 博士的人, 为他们在过程开发和设备制造的宝贵支持。我们感谢 Quantacell 的维克多。我们感谢 Grandjean 和万伦 Chartier 从居里研究所的动物设施中支持小鼠, 以及为我们提供 GFP LifeAct 小鼠的和安娜-玛丽亚列侬 (居里研究所)。我们感谢 Thouvenin 从居里-拉里沙 144 Langevin 和 Clotilde Cadart、Venkova 马修和 Piel UMR, 帮助他们理解荧光排除方法。最后, 我们感谢皮埃尔-Gennes (CNRS 3750) 技术平台在微细加工方面的支持。这项工作得到部分支持, 由欧洲研究理事会高级赠款321107号 "大提琴", 大学 (SwithNeuroTrails 项目), Investissement 艾文莉, IPGG Labex 和 Equipex。
材料
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Plasmalab System 100 | Oxford Instruments | To perform DRIE | |
| MJB4 mask aligner | SUSS MicroTec | SU-8 photolithography | |
| NXQ 4006 Mask aligner | Neutronix Quintel | Photolithography associated to DRIE | |
| Plasma cleaner | Diener Electronic | Pico PCCE | |
| Cell culture hood | ADS Laminaire | Optimale 12 | |
| Centrifuge | Thermo Fisher Scientific | Heraeus Multifuge X1R | |
| Incubator 37 °C 5% CO2 | Panasonic | MCO-170AICUVH-PE IncuSafe CO2 Incubator | |
| Epifluorescence microscope | Leica | DMi8 | |
| PDMS Oven between 65 and 80 °C | Memmert | ||
| Mechanical profilometer | Veeco | Dektak 6M Stylus Profiler | |
| Optical profilometer | Veeco | Wyko NT9100 | |
| Vacuum desiccator | Verrerie Villeurbanaise (Kartel Labware) | 230KAR | Diameter 200 mm |
| Ultrasonic bath sonicator | Labo Moderne | SHE1000 | Volume of the bath: 0.8 liter |
| Hotplate | Stuart SD162 | SD162 | |
| Masks | |||
| DRIE | Supplementary data | ||
| Su8 Mask 1 | Supplementary data | ||
| Su8 Mask 2 | Supplementary data | ||
| Su8 Mask 3 | Supplementary data | ||
| S1805 calibration stripes | Supplementary data | ||
| Small laboratory equipment | |||
| 1.5 mm hole puncher | Sigma-Aldrich | 29002519 (US reference) | |
| Scalpel or razor blade | |||
| 9" Stainless Steel Flat Spatula with Spoon | VWR International | 82027-532 | To demold PDMS |
| Top Lip Wafer Handling | VWR International | 63042-096 | |
| Curved tweezer | FST | Dumont #7 Forceps - Standard / Dumoxel | To manipulate glass coverslips |
| Substrates | |||
| Silicon wafer | Prolog Semicor Ltd | ||
| 24x24 mm glass coverslips | VWR | 631-0127 | |
| Photoresists and developpers | |||
| AZ 1518 positive photoresist | Microchemicals GmbH | Before DRIE process, thicknes 1.8 µm | |
| AZ 351B developer | Microchemicals GmbH | To develop positive AZ 1518 photoresist | |
| SU-8 2007 | MicroChem | ||
| SU-8 2025 | MicroChem | ||
| SU-8 2050 | MicroChem | ||
| PGMA developer | Technic | To develop SU-8 negative photoresist | |
| Microposit S1805 resist | Chimie Tech Services | Positive photoresist used to obtain 0.5µm high structures | |
| MF 26A developer | Chimie Tech Services | To develop positive S1805 photoresist | |
| Laboratory consumables | |||
| Disposable plastic pipette 3 mL | LifeTechnologies - ThermoFisher | ||
| P100 Petri dishes | TPP | 93100 | |
| 20 mL syringe | Terumo | SS+20ES1 | |
| Transparent scotch tape | |||
| Square wipes | VWR | 115-2148 | |
| Parafilm | DUTSCHER | 90260 | Plastic paraffin film |
| Chemicals | |||
| (3-Methacryloxypropyl)trichlorosilane | abcr | AB 109004 | |
| PDMS and curing agent Sylgard 184 | Sigma-Aldrich | 761036 | |
| isopropanol | W292907 | ||
| poly-ornithine | Sigma-Aldrich | P4957 - 50 mL | |
| Ethanol absolute | Sigma-aldrich | 02865 | 99.8% |
| 3-methacryloxypropyl-trimethoxysilane | Sigma-aldrich | M6514-25ML | (C4H5O2)-(CH2)3- Si(OCH3)3 |
| acetic acid | Sigma-aldrich | 71251-5ML-F | |
| Dextran 10kW conjugated with Alexa488 | LifeTechnologies - ThermoFisher | D22910 | Absoprtion at 488 nm |
| Dextran 10kW conjugated with Alexa647 | LifeTechnologies - ThermoFisher | D22914 | Absoprtion at 647 nm |
| Culture medium | |||
| MEM | LifeTechnologies - ThermoFisher | 21090-022 | |
| Horse Serum | LifeTechnologies - ThermoFisher | 26050088 | |
| B27 | LifeTechnologies - ThermoFisher | 12587-010 | |
| Glutamax 200 mM | LifeTechnologies - ThermoFisher | 35050-061 | |
| Sodium Pyruvate GIBCO 100 mM | LifeTechnologies - ThermoFisher | 11360-070 | |
| Gentamicin | LifeTechnologies - ThermoFisher | 15710-049 | |
| PBS | Sigma-Aldrich | D8537-500ML | |
| HBSS 10x | LifeTechnologies - ThermoFisher | 14180-046 | |
| Hepes 1M | LifeTechnologies - ThermoFisher | 15630-056 | |
| trypsin-EDTA | Sigma-Aldrich | 59418C-100ML | |
| Neurobasal | LifeTechnologies - ThermoFisher | 21103-049 | |
| Neurobasal without phenol red | LifeTechnologies - ThermoFisher | 12348-017 | |
| Softwares | |||
| Routine in Matlab for background normalization | Quantacell | Contact Victor Racine: victor.racine@quantacell.com | |
| ImageJ | To select specific ROI for image analysis | ||
| Routine | ImageJ | Supplementary data | |
| Routine | Matlab | Supplementary data |
参考文献
- Jun, S., Taheri-Araghi, S. Cell-size maintenance: universal strategy revealed. Trends Microbiol. 23 (1), 4-6 (2015).
- Zlotek-Zlotkiewicz, E., Monnier, S., Cappello, G., Le Berre, M., Piel, M. Optical volume and mass measurements show that mammalian cells swell during mitosis. J. Cell Biol. 211 (4), 765-774 (2015).
- Kim, G. H., Kosterin, P., Obaid, A. L., Salzberg, B. M. A mechanical spike accompanies the action potential in Mammalian nerve terminals. Biophys J. 92 (9), 3122-3129 (2007).
- Iacono, D., et al. Neuronal Hypertrophy in Asymptomatic Alzheimer Disease. J Neuropathol Exp Neurol. 67 (6), 578-589 (2008).
- Cheli, V. T., et al. Conditional Deletion of the L-Type Calcium Channel Cav1. 2 in Oligodendrocyte Progenitor Cells Affects Postnatal Myelination in Mice. J Neurosci. 36 (42), 10853-10869 (2016).
- Kneynsberg, A., Collier, T. J., Manfredsson, F. P., Kanaan, N. M. Quantitative and semi-quantitative measurements of axonal degeneration in tissue and primary neuron cultures. J Neurosci Methods. 266, 32-41 (2016).
- Fouquet, C., et al. Improving axial resolution in confocal microscopy with new high refractive index mounting media. PloS one. 10 (3), (2015).
- Aguet, F., et al. Membrane dynamics of dividing cells imaged by lattice light-sheet microscopy. Mol Biol Cell. 27 (22), 3418-3435 (2016).
- Roland, A. B., et al. Cannabinoid-induced actomyosin contractility shapes neuronal morphology and growth. eLife. 3, (2014).
- Lu, Y. B., et al. Viscoelastic properties of individual glial cells and neurons in the CNS. Proc Natl Acad Sci USA. 103 (47), 17759-17764 (2006).
- Chen, J., Xue, C., Zhao, Y., Chen, D., Wu, M. H., Wang, J. Microfluidic impedance flow cytometry enabling high-throughput single-cell electrical property characterization. Int J Mol Sci. 16 (5), 9804-9830 (2015).
- Bottier, C., et al. Dynamic measurement of the height and volume of migrating cells by a novel fluorescence microscopy technique. Lab Chip. 11, 3855-3863 (2011).
- Cadart, C., et al. Fluorescence eXclusion Measurement of volume in live cells. Methods Cell Biol. 139, 103-120 (2017).
- Marasso, S. L., et al. A novel graphene based nanocomposite for application in 3D flexible micro-supercapacitors. Materials Research Express. 3 (6), 065001(2016).
- Welch, C. C., Goodyear, A. L., Wahlbrink, T., Lemme, M. C., Mollenhauer, T. Silicon etch process options for micro-and nanotechnology using inductively coupled plasmas. Microelectronic Engineering. 83 (4), 1170-1173 (2006).
- Fath, T., Ke, Y. D., Gunning, P., Götz, J., Ittner, L. M. Primary support cultures of hippocampal and substantia nigra neurons. Nat. Protoc. 4 (1), 78-85 (2008).
- abcam. Counting cells using a hemocytometer. , Available from: http://www.abcam.com/protocols/counting-cells-using-a-haemocytometer (2017).
- ImageJ. Getting intensity values from single ROI. Image Intensity Processing. , Available from: https://imagej.net/Image_Intensity_Processing (2017).
- ImageJ. 19. Tools. ImageJ User Guide. , Available from: https://imagej.nih.gov/ij/docs/guide/146-19.html (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。