需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
百里香精油应用于肉类干燥过程中微生物负荷的影响
摘要
微生物如大肠杆菌污染肉类产品会引起食源性疾病. 精油在肉类干燥过程中的应用尚未深入研究。在此, 我们提出了一种新的方法, 将百里香精油应用于肉类干燥过程中, 以减少干肉中的微生物负荷。
摘要
肉类是一种高蛋白的膳食, 用于配制干, 一种流行的食品零食, 在那里保存和安全是重要的。为了保证食品安全和延长肉类和肉类产品的保质期, 使用合成或天然防腐剂来控制和消除食源性细菌。越来越多的人对天然食品添加剂在肉类中的应用增加了兴趣。微生物, 如大肠杆菌, 污染肉类和肉类产品, 造成食源性疾病. 因此, 有必要改进肉类的保护过程。然而, 在肉类干燥时使用精油还没有深入研究。在这方面, 有机会增加干肉的价值, 并通过在干燥过程中应用精油降低食源性疾病的风险。在本议定书中, 我们提出了一种新的方法来应用百里香精油 (特奥) 在肉类干燥, 特别是在蒸气形式直接在干燥室。为了评估, 我们使用最小的抑制浓度 (MIC) 来检测样本中有害细菌的数量与原样品相比。初步结果表明, 该方法是一种可行的、可替代的合成防腐剂, 大大减少了干肉中的微生物负荷。
引言
干燥作为传统的保存食物的方法已经被使用了从远古时代。如今, 对干燥的兴趣越来越浓厚, 作为一种有效的食品保鲜方法1,2,3。它是用来制造各种特殊加工的肉类。其中最知名的是干。
干法是肉类保鲜的最古老的方法之一, 其基础是固化和干燥, 以降低水分活动, 从而延长其保质期4。如今, 干腌肉仍然很受欢迎, 食品的安全性、风味和质地是必不可少的。干制剂可用于几乎任何类型的肉类, 包括牛肉, 猪肉, 家禽, 或游戏5, 它需要切肉在瘦肉条和干燥。通常, 浸泡在固化溶液中的肉或吸烟与干燥一起使用, 以使干它的特色风味6。
尽管干燥的巨大兴趣, 以真正保存食物, 食源性暴发的风险由大肠杆菌从干燥肉是关键的, 需要控制。有一些研究报告食源性胃肠炎暴发, 特别是与大肠杆菌O157:H7, 归因于不充分的热处理在家庭干燥。即使在商业准备的生涩的7、8、9中也发生类似情况。莱文et al。10建议, 食源性微生物可以在干燥条件 (约60°c) 的情况下生存。大肠杆菌O157:H7 二十世纪九十年代中旬的食源性疾病暴发归因于地面干肉制品6,11。有趣的是, 在以前的所有病例中, 主要的风险是由被确认为可行但非可培养 (VBNC) 的细菌病原体引起的。在诸如温度变化或饥饿等各种压力下,大肠杆菌单元可以进入一个称为 VBNC 状态1213的特定状态。VBNC 细胞可以通过暴露在适当的条件下恢复到可培养细胞, 然后由于食源性污染而对人类健康构成威胁 14, 15.这意味着, 如果肉类是在干燥后立即消耗的产品, 它是安全的。但是, 如果储存不足, 如湿度增加, 病原体和微生物生长的复发风险很高。
除了干燥和腌料的方法, 消费者有很高的需求, 使用天然产品作为替代添加剂, 以改善食品质量16,17。对肉类天然食品添加剂的应用特别感兴趣, 而不是传统的合成防腐剂18,19,20,21。尽管在干燥肉类时使用精油缺乏足够的实验证据, 但该领域早期的研究已经显示出积极的结果22,23。
自中世纪以来, 人们已经认识到必需的油脂化合物 (EOCs) 的抗菌剂, 杀虫, 和寄生虫特征24,25,26。今天, EOCs 是最重要的一组生物活性天然化合物的一部分。在不同的 EOCs 中, 麝香是其中一个最知名的。它由85% 以上的特奥23组成。这种苯酚能防止微生物和化学物质在食物中变质。此外, 它的抗菌性能可能会改善与其他天然防腐剂2,27,28,29,30。现在, 百里香 (胸腺), 一种属于唇形家族的药草, 已被公认为调味剂, 也是一种非常有效的肉类防腐剂 31.由加西亚-Díez et进行的一项研究。30在肉类产品上发现, 与其他精油相比, 特奥对食源性致病菌的抑制作用更大。因此, 在干燥过程中施用精油, 有机会增加干肉的价值, 减少食源性疾病的风险。
在本协议中, 我们提出了一种新的方法来应用特奥在肉类干燥, 特别是使用它在蒸气形式直接在干燥室。为了评估, 我们使用麦克风来确定治疗样本中的致病菌与原生细菌的缺失。初步结果表明, 该方法是一种高效的合成防腐剂替代品, 大大减少了干肉中的微生物负荷。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 肉类制剂
- 从当地的屠杀中获得一小块牛肉 (从股二头肌中的新鲜牛肉), 转移到实验室。
注: 建议在常温下 (20-25 °c) 运输牛肉的腰部, 在密封袋内不超过20分钟。 - 为了对牛肉肌肉的外层进行消毒, 在层流安全柜中, 用500毫升的挤压瓶喷洒 70% (v/v) 乙醇, 以洗涤肌肉。应用0.025 克乙醇每1厘米的肌肉表面2 。
- 用小刀除去肉灌装的外表面, 以避免在肌肉内部残留乙醇。去掉大约3毫米的肌肉内部, 以保持肌肉的表面均匀。
- 将肌肉包装在塑料密封袋中, 并将其转移到冰箱。
- 储存的肌肉在-18 °c 1 天。然后, 解冻4摄氏度的冰冻肌肉6小时。
注: 对于解冻, 建议将肌肉从冰箱移动到冰箱。 - 在层流安全柜中, 用切肉机将每块肌肉切成0.5 厘米厚的切片。然后, 用小刀把它切成小 5 x 2.5 厘米2矩形样品。
- 将长方形的肉类样品包装在塑料袋中, 并将其存放在-18 摄氏度的冷藏库中供以后使用。
2. 在层流安全柜中编制标准化的接种和接种程序
- 准备标准化的接种 (1.5 x 108 CFU/毫升) 的大肠杆菌ATCC 25922, 以接种肉类样品。
- 为准备库存接种, 首先将冻干细菌培养 (由供应商交付) 转化为15毫升灭菌管, 预填充10毫升消毒的米勒韩丁汤 (BMHB)。在37摄氏度培养24小时的悬浮液。
- 准备细菌库存解决方案如下: 采取大约 0.1-0.2 毫升的细菌悬浮和稀释成一个20毫升瓶封闭与橡胶塞子与铝帽预填充与15毫升的灭菌 BMHB。在37摄氏度培养24小时的悬浮液。
- 存放在冰箱内的4°c 为标准化接种的准备。
- 从库存解决方案 (见步骤 2.1.1) 的大肠杆菌采取大约 0.1-0.2 毫升的细菌悬浮和稀释在15毫升塑料灭菌管预填充10毫升消毒的韩丁汤 (BMHB)。在37摄氏度的24小时内孵化试管。
- 为编制标准化的接种 (1.5 x 108 CFU/毫升), 添加少量此悬浮在15毫升灭菌管预填充与10毫升的灭菌 BMHB。
- 彻底涡旋混合物, 并测量光学密度 (OD) 在600毫微米由密度计32。
- 重复步骤 2.1.3 2.1.4, 直到表示为麦克法兰值的 OD 比清洁 BMHB 的值增加0.5。
- 为准备库存接种, 首先将冻干细菌培养 (由供应商交付) 转化为15毫升灭菌管, 预填充10毫升消毒的米勒韩丁汤 (BMHB)。在37摄氏度培养24小时的悬浮液。
- 为接种做法, 安置长方形肉样品在二个不同的铝箔 (20 cm x 30 cm), 一个为控制样品和第二为被接种的肉样品。
- 在第二个铝箔, 接种原始的长方形肉样品与800µL 细菌悬浮的选定的菌株 (这对应于 1.2 x 108 CFU 每肉样品) 通过均匀地分布接种在表面。
- 吸管400µL 在样品的一边和轻轻地传播使用无菌的细胞摊铺机在表面上。让他们干10分钟. 在样品的另一侧对其余的悬浮液重复相同的过程。
- 在第二个铝箔, 接种原始的长方形肉样品与800µL 细菌悬浮的选定的菌株 (这对应于 1.2 x 108 CFU 每肉样品) 通过均匀地分布接种在表面。
3. 干燥和特奥应用
- 将含有矩形肉类样品的铝箔从层流安全柜转移到烘干机: 用铝箔盖住, 然后将样品放在烘干机内。
- 在标准的实验室烘干机中进行干燥。
注: 首先, 预热烤箱到摄氏55摄氏度。此过程可以持续20分钟。- 干燥控制样品6小时在55°c, 与干燥空气相对湿度值从 30-45% 不等。
注: 干燥空气相对湿度值根据液体从肉类中蒸发的速率而变化。
- 干燥控制样品6小时在55°c, 与干燥空气相对湿度值从 30-45% 不等。
- 计算所应用的特奥体积, 并将必要的油浓度表示为每烘干机容积 (mL/升空气) 的特奥量。例如, 1.5 毫升的特奥在53升 (干燥机容积) 的剂量导致浓度为0.028 毫升/升空气。要确定特奥的 MIC 为大肠杆菌, 使用剂量1.5 毫升 (0.028 毫升/升空气), 1 毫升 (0.019 毫升/升空气) 和0.75 毫升 (0.014 毫升/升空气)。
- 在烘干之前, 为应用特奥蒸气 (以麝香作为主要化合物 79%), 浸泡一张滤纸 (12 cm x 20 cm) 与1.5 毫升药量的特奥并且安置入烘干机在风扇前面。
- 使用与对照样品相同的程序 (步骤3.1 和 3.2) 将特奥特处理的肉类样品烘干。
注: 干燥过程结束后, 样品被除去, 在烤箱上打开3小时, 在80摄氏度, 并设置空气阀指示100% 排气口, 以清洁的基本油残渣从烤箱。
4. 微生物分析
- 在肉接种与细菌之前, 检查肉样品为任何掺假。粘液的出现和发现任何强烈和刺鼻的气味都表明了肉类的腐烂。如果纹理感觉黏糊糊的, 细菌可能已经开始在肉的表面繁殖。
- 为了评估接种效率, 对原接种的样品进行试验, 检测是否存在大肠杆菌ATCC 25922, 并将其与未接种的对照样品进行比较。为此目的:
- 清洗每个肉类样本 (2 个控制样本和2种接种样本)。用缓冲的蛋白胨水 (8.5 克氯化钠) 将每个肉类样品挂在消毒瓶中. 1 克的蛋白胨, 5 片磷酸盐缓冲盐水, 1 克的吐温80在1升水) 的比率为 1:10 (瓦特/v), pH 值范围从 7-7.3。在室温下用 140 rpm 的摇床摇动10分钟。
注: 在接种程序后立即冲洗。 - 用经调整的 6 x 6 滴板程序, 对钢板计数琼脂 (PCA) 和麦康凯琼脂 (MCA) 中的陈、Nace 和欧文33进行总结, 评估细菌数量。
注: 6 x 6 滴法采用发酵液微稀释法, 用多通道吸管制备研究样品的10倍系列稀释, 比常规方法33更节省劳动密集型和更经济性34。 - 用 6 x 6 稀释法培养10倍的系列样品, 用于评价大肠杆菌。
注: 特别为 6 x 6 下落方法, 为耕种使用六5µL 下落, 从六选择的稀释被调查的样品与多通道吸管。在适当干燥的培养皿上, 滴入琼脂迅速吸收, 这种方法的种植非常方便和易于管理的34。 - 孵育培养皿在37°c 为24小时。在培养期后, 根据第5节所述, 评估培养皿 (CFU g-1 ) 中的大肠杆菌的菌落数量。
- 清洗每个肉类样本 (2 个控制样本和2种接种样本)。用缓冲的蛋白胨水 (8.5 克氯化钠) 将每个肉类样品挂在消毒瓶中. 1 克的蛋白胨, 5 片磷酸盐缓冲盐水, 1 克的吐温80在1升水) 的比率为 1:10 (瓦特/v), pH 值范围从 7-7.3。在室温下用 140 rpm 的摇床摇动10分钟。
- 干燥后, 取两个接种后的干样品, 并将其与两个干燥的非接种对照样品分别进行比较, 以进行可行的大肠杆菌。要确定此四samples 的存在或不存在大肠杆菌, 请按照以下步骤对每个肉类样品进行预浓缩过程:
- 将每个肉类样品挂在带有缓冲的蛋白胨水的消毒瓶中 (请参阅步骤 4.2.1), 并在室温下使用 140 rpm 10 分钟的振动筛进行摇动. 然后在6小时内孵化每瓶37摄氏度以进行预富集。
- 对于细菌的评价和培养, 按照步骤 4.2.2 4.2.4 中所述的相同步骤进行。
5. 审查结果
- 孵化完成后, 从孵化器中取出培养皿, 并按如下方式检查结果:
- 为了评估菌落总数, 在 MCA 上检查温有氧细菌在 PCA (白点) 和典型的大肠杆菌菌落 (红到深粉色) 上存在的板块。如果病原体缺失, 两 agars 均无生长。
- 计算菌落数并确定大肠杆菌(CFU/g-1干肉) 的数量。
注意: 在连续的两个稀释 (图 1) 中, 计算30个或更少的菌落数 (N)。CFU/g-1的干肉的编号N确定如下35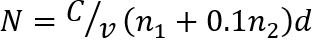
在其中, C是计数的所有水滴的菌落总数, v是每滴使用的样本稀释量 (这里, 0.05 毫升), n1 是第一稀释时使用的水滴数, n2 是滴数用于第二次稀释, d表示从其中捕获第一个计数的稀释。
- 要分析微生物数据, 请将菌落数转换为日志 CFU g-1 , 并将其与治疗的主要效果36的方差分析 (方差计算) 进行比较。
- 对多个平均比较36执行 Tukey 诚实显著差异测试 (Tukey HSD), 并确定治疗之间的显著差异。
Access restricted. Please log in or start a trial to view this content.
结果
我们首先开发了这种方法, 通过使用牛至精油 (OEO), 以提高食品安全和提高干肉的价值。一般而言, 上述实验表明, 在干燥过程中,大肠杆菌进入 VBNC 状态作为一种生存策略。这是由事实证明, 在干燥完成后没有可培养细菌 22.因此, 6 小时的预浓缩过程是必要的, 以允许计数的应变。在较短的时期内, 生长细胞的数量仍然非常低。结果是在预富集过程后, ...
Access restricted. Please log in or start a trial to view this content.
讨论
先前的研究表明, 导致食源性疾病的微生物在干燥过程中生存了10。因此, 必须在干燥前应用防腐剂, 以保证食品安全。在这项研究中, 我们专注于使用特奥。其原因有两个方面: 第一, 消费者对使用天然产品作为替代添加剂以提高食品质量的需求很高16;其次, 前一项研究表明, 在肉类干燥过程中使用 OEO 的结果为22。因此, 在肉类干燥过程中应用 OEO...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
这项工作得到了热带 AgriSciences 学院内部赠款机构的支持 (项目编号: 20175013) 和 CIGA 20182023 两项赠款, 来自捷克生命科学大学。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Meat cutter | Kalorik | KP 3530 | from Miami Gardens, FL, USA |
| Laminar safety cabinet | Faster s.r.l | from Italy | |
| Squeeze bottle of 500 mL | Merci | 632 524 325 025 | from CZ |
| Standard laboratory drier UFE 400 | Memmert | DE 66812464 | from Germany |
| Incubator | BT 120 | N/A | from CZ |
| Refrigerator and Freezer | Bosch | KGN34VW20G | from DE |
| Densitometer | Biosan | 220 000 050 122 | Latvia; supplier Merci, CZ |
| Escherichia coli ATCC 25922 | Oxoid | CL7050 | from CZ |
| Vortex | Chromservis | 22008013 | from CZ |
| Sterilized plastic tubes 15 mL | Gama | 331 000 020 115 | from CZ, supplier Merci |
| 20 mL injection vial | Healthy vial | hvft169 | from China |
| 20 mm sterile butyl rubber stopper | Merci | 22008013 | from CZ |
| 20 mm aluminum cap | Healthy vial | N/A | from China |
| Thyme essential oil | Sigma Aldrich | W306509 | from St Louis, MO, USA |
| Mueller Hinton Broth | Oxoid | CM0337 | from CZ |
| NaCl | Penta | 16610-31000 | from CZ |
| Peptone | Oxoid | LP0034 | from CZ |
| Phosphate-buffered saline | Sigma Aldrich | P4417 | from CZ |
| Polysorbate 80 (Tween 80) | Roth | T 13502 | from DE, supplier P-lab |
| Shaker SHO-1D | Verkon | DH.WSR04020 | from CZ, 10 - 300 rpm. 350 x 350 mm with a platform for flasks |
| Ethanol 70% | Bioferm | N/A | from CZ |
| MacConkey Agar | Oxoid | CM007 | from CZ |
| Plate Count Agar | Oxoid | CM0325 | from CZ |
| Filter paper | Merci | 480 622 080 040 | from CZ |
| Erlenmeyer flasks 250 mL | Simax | 610 002 122 636 | from CZ; supplier Merci CZ |
| Multichannel pipette | Socorex | S852820 | from Switzerland; supplier P lab, CZ |
| Microtiter plate | Gamma | V400916 | CZ |
| Microlitre pipette 100-1000 μL | Eppendorf | 333 120 000 062 | from Germany; supplier Merci, CZ |
参考文献
- Eklund, M. W., Peterson, M. E., Poysky, F. T., Paranjpye, R. N., Pelroy, G. A. Control of bacterial pathogens during processing of cold-smoked and dried salmon strips. J. Food Prot. 67 (2), 347-351 (2004).
- Mahmoud, B. S. M., et al. Preservative effect of combined treatment with electrolyzed NaCl solutions and essential oil compounds on carp fillets during convectional air-drying. Int. J. Food Microbiol. 106 (3), 331-337 (2006).
- Rahman, M. S., Guizani, N., Al-Ruzeiki, M. H., Al Khalasi, A. S. Microflora Changes in Tuna Mince During Convection Air Drying. Dry. Technol. 18 (10), 2369-2379 (2000).
- Faith, N. G., et al. Viability of Escherichia coli O157: H7 in ground and formed beef jerky prepared at levels of 5 and 20% fat and dried at 52, 57, 63, or 68 C in a home-style dehydrator. Int. J. Food Microbiol. 41 (3), 213-221 (1998).
- Hierro, E., De La Hoz, L., Ordóñez, J. A. Headspace volatile compounds from salted and occasionally smoked dried meats (cecinas) as affected by animal species. Food Chem. 85 (4), 649-657 (2004).
- Nummer, B. A., et al. Effects of Preparation Methods on the Microbiological Safety of Home-Dried Meat Jerky. J. Food Prot. 67 (10), 2337-2341 (2004).
- Greig, J. D., Ravel, A. Analysis of foodborne outbreak data reported internationally for source attribution. Int. J. Food Microbiol. 130 (2), 77-87 (2009).
- Eidson, M., Sewell, C. M., Graves, G., Olson, R. Beef jerky gastroenteritis outbreaks. J. Environ. Health. 62 (6), 9-13 (2000).
- Allen, K., Cornforth, D., Whittier, D., Vasavada, M., Nummer, B. Evaluation of high humidity and wet marinade methods for pasteurization of jerky. J. Food Sci. 72 (7), (2007).
- Levine, P., Rose, B., Green, S., Ransom, G., Hill, W. Pathogen testing of ready-to-eat meat and poultry products collected at federally inspected establishments in the United States, 1990 to 1999. J. Food Prot. 64 (8), 1188-1193 (1990).
- Keene, W. E., et al. An outbreak of Escherichia coli O157:H7 infections traced to jerky made from deer meat. JAMA. 277 (15), 1229-1231 (1997).
- Oliver, J. D. The viable but nonculturable state in bacteria. J. Microbiol. 43, 93-100 (2005).
- Oliver, J. D. Recent findings on the viable but nonculturable state in pathogenic bacteria. FEMS Microbiol. Rev. 34 (4), 415-425 (2010).
- Khamisse, E., Firmesse, O., Christieans, S., Chassaing, D., Carpentier, B. Impact of cleaning and disinfection on the non-culturable and culturable bacterial loads of food-contact surfaces at a beef processing plant. Int. J. Food Microbiol. 158 (2), 163-168 (2012).
- Li, L., Mendis, N., Trigui, H., Oliver, J. D., Faucher, S. P. The importance of the viable but non-culturable state in human bacterial pathogens. Front. Microbiol. 5, 258(2014).
- Hernández, H., Claramount, D., Kučerová, I., Banout, J. The effects of modified blanching and oregano essential oil on drying kinetics and sensory attributes of dried meat. J. Food Process. Preserv. , (2016).
- García-Díez, J., et al. The Impact of Essential Oils on Consumer Acceptance of Chouriço de vinho - A Dry-Cured Sausage Made from Wine-Marinated Meat - Assessed by the Hedonic Scale, JAR Intensity Scale and Consumers' "Will to Consume and Purchase.". J. Food Process. Preserv. 41 (4), (2017).
- Govaris, A., Solomakos, N., Pexara, A., Chatzopoulou, P. S. The antimicrobial effect of oregano essential oil, nisin and their combination against Salmonella Enteritidis in minced sheep meat during refrigerated storage. Int. J. Food Microbiol. 137 (2-3), 175-180 (2010).
- Holley, R. A., Patel, D. Improvement in shelf-life and safety of perishable foods by plant essential oils and smoke antimicrobials. Food Microbiol. 22 (4), 273-292 (2005).
- Petrou, S., Tsiraki, M., Giatrakou, V., Savvaidis, I. N. Chitosan dipping or oregano oil treatments, singly or combined on modified atmosphere packaged chicken breast meat. Int. J. Food Microbiol. 156 (3), 264-271 (2012).
- Ballester-costa, C., Sendra, E., Viuda-martos, M. Assessment of Antioxidant and Antibacterial Properties on Meat Homogenates of Essential Oils Obtained from Four Thymus Species Achieved from Organic Growth. Foods. 6 (8), 59(2017).
- Hernández, H., et al. The effect of oregano essential oil on microbial load and sensory attributes of dried meat. J. Sci. Food Agric. 97 (1), 82-87 (2017).
- García-Díez, J., Alheiro, J., Falco, V., Fraqueza, M. J., Patarata, L. Chemical characterization and antimicrobial properties of herbs and spices essential oils against pathogens and spoilage bacteria associated to dry-cured meat products. J. Essent. Oil Res. 29 (2), 117-125 (2017).
- Cavanagh, H. M. A. Antifungal Activity of the Volatile Phase of Essential Oils: A Brief Review. Nat. Prod. Commun. 2 (12), 1297-1302 (2007).
- Tajkarimi, M. M., Ibrahim, S. A., Cliver, D. O. Antimicrobial herb and spice compounds in food. Food Control. 21 (9), 1199-1218 (2010).
- Nedorostova, L., Kloucek, P., Kokoska, L., Stolcova, M., Pulkrabek, J. Antimicrobial properties of selected essential oils in vapour phase against foodborne bacteria. Food Control. 20 (2), 157-160 (2009).
- Burt, S. Essential oils: Their antibacterial properties and potential applications in foods - A review. Int. J. Food Microbiol. 94 (3), 223-253 (2004).
- Ramanathan, L., Das, N. Studies on the control of lipid oxidation in ground fish by some polyphenolic natural products. J. Agric. Food Chem. 40 (1), 17-21 (1992).
- Yamazaki, K., Yamamoto, T., Kawai, Y., Inoue, N. Enhancement of antilisterial activity of essential oil constituents by nisin and diglycerol fatty acid ester. Food Microbiol. 21 (3), 283-289 (2004).
- García-Díez, J., Alheiro, J., Falco, V., Fraqueza, M. J., Patarata, L. Synergistic activity of essential oils from herbs and spices used on meat products against food borne pathogens. Nat. Prod. Commun. 12 (2), 281-286 (2017).
- Hussein Hamdy Roby, M., Atef Sarhan, M., Abdel-Hamed Selim, K., Ibrahim Khalel, K. Evaluation of antioxidant activity, total phenols and phenolic compounds in thyme (Thymus vulgaris L.), sage (Salvia officinalis L.), and marjoram (Origanum majorana L.) extracts. Ind. Crops Prod. 43, 827-831 (2013).
- Gouveia, A. R., et al. The Antimicrobial Effect of Essential Oils Against Listeria monocytogenes in Sous vide Cook-Chill Beef during Storage. J. Food Process. Preserv. 41 (4), (2017).
- Chen, C., Nace, G., Irwin, P. A 6 x 6 drop plate method for simultaneous colony counting and MPN enumeration of Campylobacter jejuni, Listeria monocytogenes, and Escherichia coli. J. Microbiol. Methods. 55 (2), 475-479 (2003).
- Herigstad, B., Hamilton, M., Heersink, J. How to optimize the drop plate method for enumerating bacteria. J. Microbiol. Methods. 44 (2), 121-129 (2001).
- Greenwood, M., Roberts, D. Practical food microbiology. , Blackwell Pub. Available from: https://drive.google.com/file/d/0BzyVOLllJ0B1YmlEemZ5M1RZekU/view?ts=590d8019 (2003).
- Vaughan, G. M., Corballis, M. C. Beyond tests of significance: Estimating strength of effects in selected ANOVA designs. Am. Psychol. Assoc. 72 (3), Available from: http://dx.doi.org/10.1037/h0027878 204-213 (1969).
- Smith-Palmer, A., Stewart, J., Fyfe, L. Antimicrobial properties of plant essential oils and essences against five important food-borne pathogens. Lett. Appl. Microbiol. 26 (2), 118-122 (1998).
- Burt, S. a, Reinders, R. D. Antibacterial activity of selected plant essential oils against Escherichia coli O157:H7. Lett. Appl. Microbiol. 36 (3), 162-167 (2003).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。