Method Article
用于在大容量中查找特定细胞目标的串行剖面的多模式分层成像
摘要
本协议以扫描电镜 (SEM) 为目标, 以纳米尺度分辨率成像组织中的特定细胞为靶点。从树脂嵌入的生物材料中, 大量的系列部分首先在光学显微镜中被成像, 以识别目标, 然后以分层的方式在 SEM 中。
摘要
通过使用光和电子显微术的分级成像, 可以实现在混合细胞群或组织内超微结构分辨率的特定细胞的靶向。嵌入在树脂中的样品被切片成由数以百计的超薄切片的丝带组成的阵列, 并沉积在硅片或 conductively 涂层盖玻片上。阵列被成像低分辨率使用数字消费者, 如智能手机相机或光学显微镜 (LM) 快速大面积概述, 或广泛的领域荧光显微镜 (荧光显微镜 (FLM)) 后, 标签与显影。经过重金属染色后, 阵列在扫描电子显微镜 (SEM) 中成像。如果没有荧光标记, 则可以从 FLM 生成的3D 重建或从扫描电镜图像栈中的3D 重建中选择目标。对于超微结构分析, 在高分辨率的扫描电镜中最终记录了选定的目标 (一些纳米图像像素)。可以对任何 ultramicrotome 进行改装的功能区处理工具。它有助于与阵列生产和基板去除从切片刀船。本文讨论了一种允许在 SEM 中自动成像阵列的软件平台。与其他产生大体积 EM 数据的方法相比, 如串行块面扫描电镜 (SBF sem) 或聚焦离子束扫描电镜 (sem), 这种方法有两大优点: (1) 树脂嵌入样品保存, 尽管切片版本。它可以用不同的方式染色, 并以不同的分辨率进行成像。(2) 由于切片可以被染色后, 没有必要使用强块状的样品与重金属进行对比, 以介绍 SEM 成像或使组织块导电。这使得该方法适用于各种材料和生物问题。特别是前缀材料例如, 从活检银行和病理实验室, 可以直接嵌入和重建3D。
引言
在超微结构下重建大体积组织的研究已使用了许多基于 SEM 的不同成像方法1: 可使用的全面评论e. g., SBF-sem2, 谎言-sem3, 和阵列层析成像 (AT)4。而对于后一种方法, 样品材料被保留为一系列的序列部分在基板上, SBF 扫描电镜和表面扫描电镜是破坏性的方法, 工作在样品块和消耗它在成像过程中。由于在 SEM 中的树脂充电, 它们也依赖于强金属样本块5。
另一方面, 在组织样本中识别某些细胞或结构可能会从相关的光和电子显微镜 (克莱)6,7,8中获利。使用 FLM 的目标, 排除了大量重金属的应用, 因为这将淬火荧光信号9。对于这样只稍微金属的样品, 在是选择的方法, 因为阵列可能很容易后染重金属后, LM 成像。此外, 几乎任何样本类型可以用于, 甚至例行样本从病理学家的宝箱10。
另一个很大的优点是分层11或多分辨率成像12的潜力: 没有必要在高分辨率下映像所有内容, 因为可以在不同的模式 (例如、FLM) 中选择目标, 或者在低分辨率 SEM 图像。只对高分辨率的组织或细胞群感兴趣的区域进行成像, 可以节省数字数据存储空间, 并生成较小的图像数据集, 更易于处理。在这里, 在工作流演示使用一个相当弱的金属样品: 高压冷冻植物根 (拟南芥) 嵌入亲水性树脂。
如何在 FLM 和 SEM 中对阵列进行准备、染色和成像, 以及如何注册图像栈。此外, FLM 体积的3D 重建如何可以用来选择特定的细胞, 在扫描电镜的纳米分辨率。
研究方案
注: 样品块应聚合, 并含有一些重金属。图 1A-b中显示的两个示例的固定和嵌入协议已在其他地方11中描述。简而言之,图 1A中显示的示例是化学固定的, 染色的en 集团首先带有 1% OsO4, 然后是1% 个醋酸铀, 并嵌入在 Spurr 的树脂中。图 1B中显示的示例是高压冷冻, 用丙酮中的0.4% 个醋酸铀代替冷冻, 并嵌入 Lowicryl HM20 树脂中。使用无粉手套的下一步准备步骤。
1. 创建阵列
- 样块修剪
注: 在插入零件时, 始终拧紧螺钉。- 将样品块插入 ultramicrotome 的样品架中, 将持有者放到修剪块中, 然后将其滑入 ultramicrotome 的下一阶段。
- 用剃刀刀片在嵌入的组织周围修剪树脂, 在样品周围只留下一小圈树脂。从顶部修剪直到目标到达。
注意: 块面的形状可以是梯形的或长方形的 (我们已经成功地使用了这两种形状)。重要的是, 使用矩形的较长的边作为前导和尾部边缘, 以确保大面积的胶水混合物, 稳定的丝带覆盖。 - 将样品架插入 ultramicrotome 的臂中, 用刀座替换下一阶段的修剪块。将菱形修剪刀 (通常 45°) 插入刀座。将块面与修剪刀边完全平行对齐。
注: 要产生完全平行的前导 (底部) 和尾随 (顶部) 边缘, 只需转动或移动刀以修剪相反的侧面。对于大容量 (超过几个百节), 90°修剪刀是有利的。 - 平滑所有四边, 然后旋转样品架, 使前导和尾部边缘现在处于水平位置。
- 用粘合剂混合物小心地涂上块的前缘和尾部。使用由固定在牙签13上的几根头发形成的小刷子。快速执行此步骤, 因为此混合物的溶剂在几秒钟内蒸发。不要用这种混合物污染这个块面。让涂层样品块干燥5-10 分钟。
注: 对于较大的部分 (> 200), 最好只涂上前缘, 因为随着时间的推移, 胶水的凸起可能会在尾部边缘积聚, 并可能在刀刃上拉回部分。
- 基板的制备
- 将硅片切割成适合于刀船的尺寸 (大约 2 x 2.5 厘米2为巨型刀)。如果需要, 在清洗前用钻石划线标记晶片 (数字或字母), 或在清洗后使用永久性标记。用异丙醇和无绒组织手工清洁硅片。
注: 用于相关成像使用铟锡氧化物 (ITO) 涂层玻璃盖玻片。他们必须非常小心地处理, 并没有必要额外的清洗。 - 使用可拆卸胶粘剂将基板固定在托架的一端。
注: 或者, 衬底边缘可以与刀边平行固定, 使用两条胶带。 - 等离子活化 (辉光放电) 衬底与空气获得亲水性表面。这样做的方法是, 放置在基板上的水滴扩散到非常薄的胶片上 (低接触角,图 2C, D)。亲水化参数取决于所使用的等离子器件;有关此处使用的参数, 请参见材料表。
注: 等离子激活是非常挥发性的, 所以在承印物使用前立即执行此操作。 - 将托架插入基板托架的夹具中, 将所述安装的衬底靠近刀边, 以达到最佳润湿的刀船基板。
注: 在瓦克et al中给出了衬底支架的详细描述, 包括计算机辅助设计 (CAD) 图纸。11
- 将硅片切割成适合于刀船的尺寸 (大约 2 x 2.5 厘米2为巨型刀)。如果需要, 在清洗前用钻石划线标记晶片 (数字或字母), 或在清洗后使用永久性标记。用异丙醇和无绒组织手工清洁硅片。
- 切片准备
- 将一把巨型金刚石刀插入刀夹, 设置间隙角度 (用于巨型刀的 0°), 并用蒸馏水填充刀船。接近刀到一个距离的磨刀 mm 到样品。
- 使用衬底支架的螺钉 1–3 (图 2A) 将基板降低到水中。检查水线是否位于基板的上部第三处。
注: 检查衬底与托架之间的胶水是否经清洁钳轻推基体, 固化良好。它不应该移动。 - 因为在使用硅片时很难看到地面的间隙, 所以在你感觉到它触到地板之前, 要降低基体的表面。现在, 把基板提高少量。确保在切割时, 基体和载体都不能接触到刀船。
- 用注射器或吸管调节船上的水位。在观察双眼的同时, 加入或除去水, 直到水面的全部区域显示出 ultramicrotome 的最高光照明的均匀反射。
- 打开 ultramicrotome 的底部灯。确保手臂处于中间位置, 而不是使用 ultramicrotome 的手轮进行缩回。接近刀到样品, 直到刀刃的反射在块面上可见。
- 使用 ultramicrotome 的调整选项将样品与刀对齐。首先旋转刀, 然后旋转和倾斜的样品。
注: 如果光线条纹可以在试样和刀的间隙中看到, 则它是正确排列的, 显示平行边 (直线平行线而非楔形)。 - 检查样品的倾角: 在上下移动样品时, 要确保浅色条纹不变厚或更薄。如果需要, 使用弧调整螺钉来纠正这一点。移动刀接近样品, 直到它只是在块面上 (但不碰它)。
- 在控制单元设置截面厚度 (进料)、切削速度和切割窗口。
- 开始切片。如有必要, 请等待第一个完整节被剪切。切一些部分, 以确保它们粘在一起形成丝带 (否则胶水必须再次应用)。开始与高饲料价值 (最大, 200 毫微米为超刀), 直到第一个完整的部分被削减。然后, 设置所需的提要值。为获得足够的带状稳定性, 截面厚度为 100 nm, 切割速度为1毫米/秒是一个很好的起点。可达到的最低断面厚度约为 60 nm, 这取决于样品质量。
- 停止切片。从刀刃和小船上取下所有不必要的 (部分切) 部分, 用睫毛/猫的头发。如果有大量的小碎片漂浮在周围, 用吸管把水完全移走, 用清水填满小船。现在这个过程已经为第一个生产丝带做好了准备。
- 切片
- 开始切片。一旦一些部分 (实际数字取决于节和基板的大小) 已经被削减, 停止切片过程, 并通过轻轻抚摸在刀刃上与睫毛14或更好, 以一个非常从猫的皮毛软头发。
- 操纵 (推/拉) 带睫毛的丝带对基板, 并附上第一部分的基板。
注意: 必须轻轻地推上丝带, 直到它粘在基板的干部分。 - 继续切片并将丝带连接到基板上。从一侧开始, 用每个新的丝带逐渐移动到另一个侧面。
注意: 避免大量的水运动, 以避免松动已经连接的丝带。气流也是如此。使用 ultramicrotome 提供的呼吸盾牌。在不利的环境条件下, 建议使用 ultramicrotome 的存储模块15。 - 当基板完全覆盖的丝带 (通常第4-5 丝带是可行的), 轻轻地解除从刀船的基板使用机器人螺钉的基板持有人。
注: 适当的动作是: 垂直抬起 (螺丝 1) 和旋转/倾出 (螺丝 3), 或两者的组合。 - 在将色带阵列存放在无尘环境中之前, 先让其干燥。干燥后, 尽快从载体上取下粘合剂安装的基板 (在同一天, 否则衬底可能太难去除或甚至可能在拆卸期间断裂)。
2. LM 成像染色
注意: 可能有不同的染色/贴标方法, 包括免疫荧光协议。这里有一个直接的, 而非特异的污点被选择勾勒出细胞壁。
-
碘碘化染色
- 盖在一个大玻璃培养皿 (30 厘米直径) 的底部与 parafilm 和线的边缘菜与湿组织, 以建立一个潮湿的房间。
- 每盖玻片使用大约300-500 µL 的溶液。放置一滴为每个盖玻片在 parafilm, 并把玻璃倒在下降, 使部分与染色液接触。盖上盘子, 用铝箔包装, 以保护样品不受光线的侵害。在4摄氏度孵化样品16小时。
- 用镊子取出盖玻片, 在装有80毫升蒸馏水的100毫升烧杯中上下移动, 将其冲洗干净。在另一个烧杯中重复这一步, 用清水。用压缩空气仔细干燥盖玻片。
3. 在 FLM 中记录图像栈
- 将盖玻片放在一个共同的宽场 FLM 的舞台上。
- 为要观察的荧光选择适当的过滤器集 (材料表)。
- 用合适的物镜, 在每一节中取一个物体的图像: 试着填充视野, 保持方向常数。对于根尖, 使用了40X 空气目标。
注: 如果丝带不是完全平直的, 旋转的阶段可以帮助调整部分, 而拍摄图像。如果可能, 请将图像居中放在特定的特征上, 或将某一特征 (如节的边缘) 保留为记录图像边缘的相等距离。 - 如果可能, 请使用16位来限制饱和像素并保持曝光时间常数。
4. FLM 图像栈的注册
- 将图像系列导入斐济16作为虚拟堆栈。
- 从 "文件" 菜单中打开一个新的 TrakEM17 (空白)。
- 右键单击图像字段, 然后将堆栈导入 TrakEM, 作为 "每层一个切片"。
- 对齐图层 (右键单击图像域), 设置区域 (第一个图像为最后一个), 并选择 "无" 作为引用。对于所有设置, 请使用默认值, 然后选择 "刚性" 作为所需的转换。
- 注册完成且满意后, 通过右键单击并选择 "导出" 来保存对齐的数据集。制作平面图像, 设置从第一个到最后一个图像的范围, 并让软件显示结果堆栈。以 tif 格式保存堆栈。
5. 扫描电镜成像的染色和安装
注: 为准备染色溶液, 请参阅材料表。解决方案可存储在摄氏4摄氏度, 长达12月, 免受光线和空气的保护。
注意: 柠檬酸铅和醋酸铀含有有毒的重金属。根据当地当局的指示, 戴上手套, 处理废弃物。
- 盖在一个大玻璃培养皿 (30 厘米直径) 的底部与 parafilm 和线的边缘菜与湿组织, 以建立一个潮湿的房间。
注: 重要的是, 一些氢氧化钠颗粒位于染色滴附近的培养皿中, 以防止柠檬酸铅过量沉淀。 -
醋酸铀染色
- 将醋酸铀溶液在 2680 x g 上离心, 几秒钟就能沉积小颗粒。
- 每盖玻片使用大约300–500µL 溶液。放置一滴为每个盖玻片在 parafilm, 并把玻璃倒在下降, 使部分与染色液接触。
- 在室温下孵育10分钟, 在染色时盖上盘子。
- 用镊子取出盖玻片, 然后在装有蒸馏水的烧杯中上下移动 (见步骤 2.1.3)。
-
柠檬酸铅染色
- 在醋酸铀的孵化过程中, 准备柠檬酸铅溶液。
注: 柠檬酸铅应在使用前立即过滤, 以除去任何沉淀。也离心的柠檬酸铅溶液在 2680 x g 几秒钟, 如在步骤5.2.1。 - 每盖玻片使用大约300–500µL 溶液。在 parafilm 清洗盖玻片后, 立即在盖玻片上放置一滴, 然后将玻璃倒在滴上, 使切片与染色液接触。将滴 (300–500µL) 放在 parafilm 上, 然后在洗去盖玻片之后再清洗醋酸铀染色。
注意: 为了避免沉淀的形成, 不要呼吸到柠檬酸铅滴。 - 把洗过的盖玻片倒在水滴上 (没有必要把它烘干)。
- 在室温下孵育5分钟, 在染色期间盖上盘子。
- 用镊子取出盖玻片, 并按照上面所描述的用清水冲洗 (步骤 5.2.4)。
- 在醋酸铀的孵化过程中, 准备柠檬酸铅溶液。
- 用压缩空气仔细干燥盖玻片。
-
扫描电镜成像的安装样品
- 用粘碳垫将硅晶片装在铝存根上。
注: ITO 涂层的盖玻片可以使用银漆和铜胶带安装-确保导电表面连接到存根-或与上述碳垫。在这种情况下, 从 ITO 表面到存根的导电连接可以用一滴银漆制成。
- 用粘碳垫将硅晶片装在铝存根上。
6. 扫描电镜中的分层成像
注: 在场发射扫描电镜中, 选择低主能量 (3 伏或更低), 从50到 800 pA 范围内的光束电流, 以避免充电, 以及适当的工作距离, 以有效地收集二次和/或后分散的电子。光束电流的选择取决于样品的性质 (e. g, 嵌入树脂);电子剂量也将是一个折中之间的小电流 (对样品有害) 和高电流, 这有利于成像速度, 从而降低总的图像采集时间。用于反散射电子的专用探测器提供了良好的对比度, 对样品的充电不太敏感, 并且显示了样品的表面工件 (褶皱、刀痕) 的较少。应调整对比度和亮度, 使直方图居中。
-
SEM 成像
- 首先通过在低放大率下抓取每个角的图像, 大约 100x, 来定义数组的四个角。创建一个包含整个数组的感兴趣区域 (ROI)。分配具有以下参数的图像处理协议: 使用二次电子 (SE) 探测器, 它允许在大图像像素大小 (例如 1000 nm) 的高速成像, 和短停留时间 (例如, 0.2 µs)。
注: 为了克服电子光学限制在一个大扫描领域 (FOV), 可能导致畸变在图像的外围, 使用专用的低放大模式 (由多数 SEM 制造商提供) 或使用媒介, 1 到 2 k 扫描领域为单个图像。 - 通过创建一个 ROI, 在第一节中仅概述组织, 生成一个节集。使用图章工具将其复制到所有后续节。在需要时旋转 ROIs 以适应弯曲的丝带。
- 使用中间像素大小 (约 50 nm) 记录图像序列, 并在时间长度足够长的情况下识别和识别目标结构。对 6-10 k 像素范围内的单个图像使用 FOV。
注意: Atlas 5 软件可以自动收集由相邻图像组成的马赛克, 以覆盖整个串行部分的大 ROI/剖面区域。 - 在本节集中创建一个网站集, 其中包含用于更高分辨率 SEM 成像的目标结构。使 ROI 大到足以解释舞台精度。检查和调整网站的位置。
注意: 将 ROIs 放置在这样一种方式中是很重要的, 即中心, 其中的自动对焦和 autostigmation 将被执行, 不坐在 "空" 材料没有结构细节, e. g, 空泡。 - 定义自动对焦设置, 并至少检查功能区的长度 (即, 舞台必须移动的最长距离), 以便在靠近要映像的站点上的小 ROI 上执行。
- 定义高分辨率 SEM 采集的成像协议。要查看膜隔间, 请选择3–5图像像素大小。根据检测器选择停留时间, 以便图像不太嘈杂。
- 在开始获取之前, 请使用 check 协议选项在每个功能区的至少第一部分定义焦点值。
- 在整个系列目标 ROIs 上启动自动 SEM 成像。
- 将获取的数据导出为图像序列, 最好是 tif 格式。
- 首先通过在低放大率下抓取每个角的图像, 大约 100x, 来定义数组的四个角。创建一个包含整个数组的感兴趣区域 (ROI)。分配具有以下参数的图像处理协议: 使用二次电子 (SE) 探测器, 它允许在大图像像素大小 (例如 1000 nm) 的高速成像, 和短停留时间 (例如, 0.2 µs)。
7. 扫描电镜图像栈的注册
- 将图像系列导入到斐济作为虚拟堆栈。
注意: 这些数据文件将在几个 GB 的范围内, 这取决于分区的数量和 ROI 的大小。 - 裁剪扫描电镜图像栈, 以便进一步处理尽可能接近感兴趣结构的区域, 并调整亮度和对比度。
- 从 "文件" 菜单中打开一个新的 TrakEM17 (空白)。
- 右键单击图像字段, 然后将堆栈导入 TrakEM, 作为 "每层一个切片"。
- 对齐图层 (右键单击图像字段), 选择最小二乘作为模式, 设置区域 (第一个图像到最后一个), 并选择 "无" 作为引用。对于设置, 请使用默认值并选择 "刚性" 作为所需的转换。
- 注册完成并满意后, 通过右键单击并选择 "导出" 来保存对齐的数据集。制作平面图像, 将范围设置为从第一个到最后一个图像, 并让软件显示结果堆栈。以 tif 格式保存堆栈。
结果
此处描述的工作流 (图 1) 以嵌入在树脂块中的样本开始。在样品制备过程中, 应将一些重金属引入到组织中, 但没有必要使用对相当强金属化进行优化的协议。图 1A显示了一个植物根 (水芹) 块, 它通常与 1% OsO4和1% 个醋酸铀一起染色, 而 图 1B中的金属只使用0.5% 个醋酸铀。后一种样品类型是最适合的相关方法, 因为一些重金属趋于猝灭荧光。使用专用衬底支架 (图 2), 可以生成几个百节的数组 (图 1C)。荧光标记后, 此类阵列在标准的宽域 FLM (图 1D) 中进行成像, 然后用重金属溶液染色, 并在不同分辨率 (图 1E-G) 的 SEM 中成像。
阵列的可重现生成的重要工具, 特别是在将几个丝带从切片的刀船放到基板上时, 是基板持有者 (图 2A, 在作者的实验室中定制设计) 和巨型金刚石一条足以容纳显微镜幻灯片的小船的刀 (图 2B)。一个扁平的半月板, 允许良好的观察丝带, 是必要的, 可以通过等离子清洗的基板: 一小滴蒸馏水不应该形成一个透镜状结构在基板上, 如在图 2C (未经处理的基底),但薄膜 (图 2D, 等离子活化基板)。在这些条件下, 附着在 ITO 涂层盖玻片干燥部分的丝带很容易被可视化(图 2E), 并且可以在从水中的基体的升力中观察和控制。
例如, 用碘碘化物染色的阵列标记植物细胞壁, 用标准宽字段 FLM (图 3A) 进行成像。因为这些部分只有 100 nm 厚, 甚至在这里显示的过度染色介绍很少模糊。注册后, 从图像堆栈 (图 3B) 中选择完全包含在重建卷中的两个单元格, 以便在3D 中进行高分辨率成像 (请参见补充影片 S1)。随着醋酸铀和柠檬酸铅的进一步染色, 这些阵列被成像在 SEM 中.图 3C显示了一个概述, 记录了 60 nm 图像像素;图像中心的暗正方形表示自动对焦功能执行的位置, 附加剂量导致轻微污染。在这些串行部分中适当的 ROIs (总计51到248个切片), 其中包含在 FLM 堆栈中选择的两个目标单元格, 然后记录了 5 nm 图像像素大小 (图 3D; 请参见补充影片 S2)。
本文介绍的扫描电镜中的阵列自动分层成像是用软件/硬件平台解决方案蔡司地图集5完成的。首先, 使用 SE 检测器创建了整个阵列的概览, 具有非常大 (1000 nm) 图像像素和非常低的驻留时间 (图 4A)。仅列出组织的 ROI 被放在第一节上, 并传播到数组的所有其他部分。然后, 使用更长的驻留时间 (图 4B) 将此节集记录为 60 nm 图像像素。最后, 设置了一个站点集, 其中包含两个目标单元格加上一个 "层" 的周围单元格来计算舞台的不精确性, 并建立了以下参数: ESB (能量选择性反向散射) 探测器, 5 nm 图像像素, 非常长 (40 µs) 驻留时间 (图 4C)。放大到这样的图像显示亚细胞的细节 (图 4D), 如空泡 (V), 线粒体 (M), 核 (N) 和内质网 (箭头)。另请参阅补充影片 S3 , 从整个数组的概览到一个目标单元格的亚细胞细节。
这里显示的阵列 (200 节) 加上另外250节中的一个, 花了大约8小时来制作, 一晚为 LM 着色, 一天在 FLM 记录 (手动)。染后染色的总数约为1-2 小时, 具体取决于单个阵列的数量。对于 SEM 记录, 设置 Atlas 运行需要几个小时, 自动记录为中间分辨率 (60 nm 像素大小) 部分集 (200 节、450 x 200 µm2) 和大约5天的高分辨率 (5 nm 像素大小) ROI 3–4 h包含两个目标单元格 (200 个部分, 55 x 30 µm2)。请注意, 由于这里所示样品的金属含量很低, 必须使用非常慢的扫描速度来达到良好的信号噪声检测, 这意味着 (对于当前可用的探测器) 40 µs 的驻留时间用于高分辨率 ROI。
整个工作流中有几个步骤容易出现陷阱: 理想的功能区应该或多或少是直的, 并按正确的顺序排列 (图 5A)。但是, 通常会产生弯曲 (图 5B)、弯曲 (图 5D) 甚至折断的色带。这可能是由于不正确的修剪 (前导和尾部边缘不完全平行), 或不均匀应用胶粘剂, 但也从不对称或不均匀渗透样品。特别麻烦的是含有软硬成分的样品。后面的组件可能很难渗入, 例如此处显示的植物根的细胞壁 (图 5C)。在这种情况下, 折叠 (箭头) 可以很容易地造成的变化压缩和松弛在切片。对于扫描电镜中的自动成像, 弯曲带不是一个很大的问题, 因为 ROIs 可以旋转, 以适应丝带的曲率。
协议中的另一个关键步骤是染色: 不充分的洗涤可能导致部分的残留 (图 5E, F), 在最坏的情况下, 覆盖最有趣的区域 (图 5F中的两个目标单元格之一上的圆圈)。另外, 将灰尘 (图 5D, 强光散射粒子) 引入到刀船中,例如, 带有肮脏的衬底载体, 会造成严重问题: 在 FLM 中, 灰尘可以是高度荧光的 (cf.补充影片中的一些切片S1) 到某种程度上, 某些注册算法无法正常工作。但是, TrakEM17中的 "对齐" 函数可以处理补充影片 S1中演示的这些堆栈。
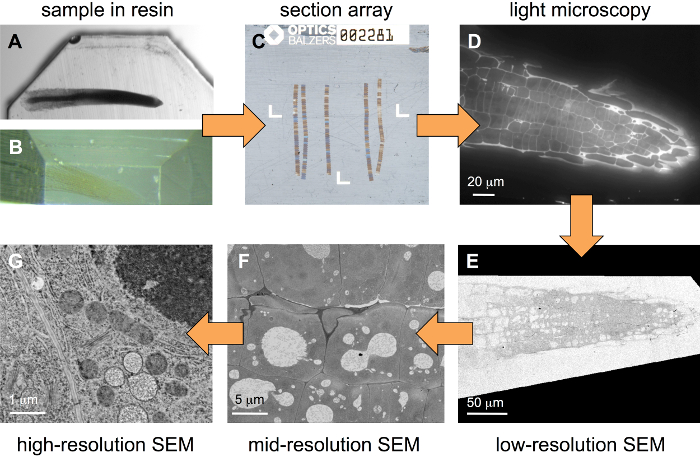
图 1: 相关分层成像的工作流.从嵌入在树脂块 (a、强金属示例) 中的示例开始, 该示例首先修剪 (B, 弱金属示例), 然后由一系列串行部分 (C) 组成的阵列放置在ITO 涂层盖玻片, 是用 ultramicrotome 生产的。用荧光染料染色后, 在宽域 FLM (D) 中记录一堆图像。在用重金属盐进一步染色后, 堆栈在 SEM (EG) 中以不同分辨率 (图像像素大小) 进行成像。请单击此处查看此图的较大版本.

图 2: 用于准备数组的工具.从并联装配的衬底支架与标准 ultramicrotome (a) 相连的七轴运动: 螺钉, 用圆圈突出显示, 用于垂直 (1) 和水平 (2) 运动, 而对于衬底载体的倾斜 (3)。.巨型金刚石刀与一条特大的小船容纳大基体 (箭头), 这里与一块等离子激活的硅晶片安装到一个滑动大小的铝载体 (B)。20µL 滴蒸馏水放置在未经处理的硅片基底上 (C) 或等离子活化基底 (D) 上。四缎带漂浮在刀船, 附着在 ITO 涂层盖玻片由他们的低端。请单击此处查看此图的较大版本.
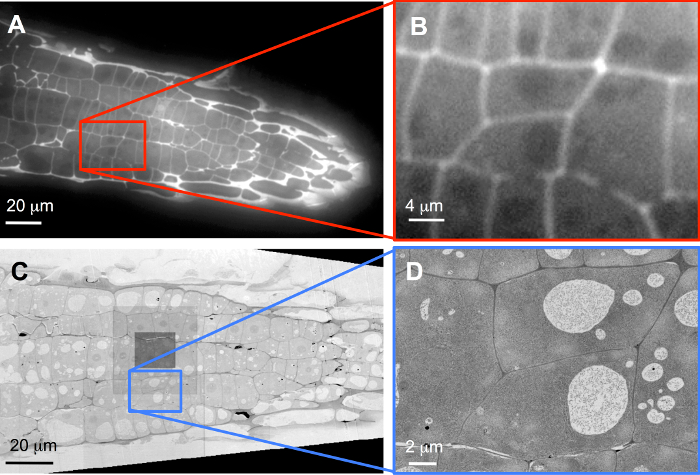
图 3: LM 数据与 SEM 数据的相关性.概述 (A、 C) 和目标单元格 (b、 d) 与 FLM (A、 B) 和 SEM (C、 d) 一起记录。(B) 是软件缩放, 原始数据在 1388 x 1040 像素相机芯片上记录了40X 物镜, 而 (C) 则记录了 60 nm 图像像素大小, (D) 与 5 nm 图像像素大小, 说明了真实在 SEM 中增加分辨率.请单击此处查看此图的较大版本.

图 4: 在 SEM 中使用蔡司地图集5的分层成像.使用 SE 检测器 (A) 记录有 1000 nm 图像像素的数组概述。节设置的 ROI 放置在每个部分的组织中, 并记录 60 nm 图像像素 (B)。在目标单元格上放置串行 ROI 并以 5 nm 图像像素 (C) 记录的站点集。当放大到这样高分辨率的图像 (D) 时, 胞内膜室, 如空泡 (V), 细胞核 (N), 线粒体 (M) 和内质网 (箭头) 变得可见。请单击此处查看此图的较大版本.
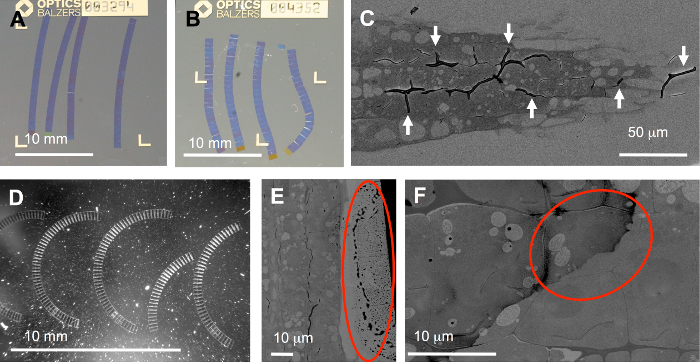
图 5: 典型问题.1. 从切片过程中产生: 放置在 ITO 涂层盖玻片上的丝带是理想的直(A), 但切片期间不规则的压缩可能会导致弯曲(B) 或曲线带(D), 甚至褶皱(C)。2. 在水中处理基材和丝带造成的,例如, 在切片和染色过程中: 基板上的光散射微粒 (D), 切片上的水滴的边缘 (在e中的圆圈), 或由于不足而涂抹在组织上的污垢。染色后洗涤 (F)。请单击此处查看此图的较大版本.
补充电影 S1: FLM 图像堆栈.435图像在斐济16中对齐, 使用 TrakEM17并另存为电影文件 (. avi)。请单击此处下载此文件.
补充电影 S2: SEM 图像堆栈.210在斐济16中对齐的图像使用 TrakEM17。此数据集的原始堆栈 (300 个图像) 为 15 GB。若要将堆栈从 3.3 GB 缩小 (在对齐和裁剪后仅为两个目标单元格), 则在 x 和 y 中用0.2 个因子 (使用斐济) 进行缩放, 然后另存为. avi 电影。请单击此处下载此文件.
补充影片 S3: 在 SEM 中使用不同的分辨率级别缩放.在. mp4 格式中创建并从 Atlas 5 软件导出的影片。请单击此处下载此文件.
讨论
通过多模态分层的方法对组织内特定细胞的工作流进行了演示: 将树脂嵌入的样品切片成一系列的串口, 这些切片被放置在导电基板上, 使用定制设计的衬底架。在 FLM 的荧光和成像标记后, 重建的体积用于选择目标细胞。在额外的染色轮与重金属引入对比, 这些目标是成像在几个百个部分, 在纳米分辨率的 SEM 使用一个自动化的软件平台。
为生产密被包装的数组与几个长的丝带, 与这里描述的一个衬底持有人是必要的。一个有技能和耐心的人可能会把几个丝带连接到一个硅基板上, 半浸入刀船中, 并通过逐渐降低水位来检索阵列, 直到丝带坐在基板上。然而, 根据我们的经验, 有一种倾向, 粉碎形成时, 基板接触的任何部分的刀船 (cf. 注意在1.3.2 中的协议)。此外, 该程序是更困难的 ito 涂层基体: (1) 由于 ito 玻璃的透明度, 很难看到边缘的水, 其中的丝带两端必须连接;(2) 由于 ITO 涂层表面比高度抛光的硅片粗糙得多, 在升力的过程中, 缎带往往会断裂,而由少数部分组成的小碎片则可能浮动, 从而破坏了节的顺序。
整个工作流也是可行的, 不与 FLM 数据相关。在这种情况下, 扫描电镜中的数据收集可能需要在几个会话中进行。为了确定目标, 可能需要进行初始3D 重建或至少评估低或中分辨率数据。此外, brightfield LM (不需要 FLM) 的常规组织学污渍也可以应用。当然, 其他选项6,7,8是阵列上的抗体标记, 如在18的初始文件中所示, 或基因编码的荧光蛋白 (XFPs) 或预嵌入标记在样品制备过程中保存荧光。
所讨论的方法的一般限制是使用一定厚度的截面和产生的3D 体积的离散采样: Z 分辨率只能与截面厚度一样好, 因为 SEM 只收集截面表面的数据 (depending 在主要能量/着陆能量选择了)。这意味着产生的3D 卷具有各向异性素, e. g, 5 x 5 x 100 nm3 , 如果使用 100 nm 部分和一个图像像素大小 5 nm。对于大小范围小于1µm 的非常小的实体, 这可能不足以实现真正的超微结构描述。一个更技术性的限制是在扫描电镜中用于自动成像的阶段的准确性。因此, 有必要选择比舞台精度规格更大的 ROI, 以保证整个目标区域的成像。
与 SBF-sem 和表面扫描电镜相比较的块面成像方法相比, 相关的是各向异性素的最终缺点, 如上文所述。用素-SEM, 当适当的漂移校正到位时, 可以获得 5 x 5 x 5 nm3的各向同性的。
在阵列制备过程中由于部分损失而重建体积的空隙也可能是 SBF-sem 或颤电镜没有遇到的问题。用胶水稳定的丝带, 这通常只是一个问题, 在丝带的最后一节: 它可能会被损坏时, 从刀刃上使用睫毛。但是, 按照我们的经验, 每个20–50节中的一个部分的丢失不会影响图像的注册。
另一方面, 染色后阵列的可能性给出了扫描电镜成像的良好信号和对比度, 即使是在弱金属样品上, 如这里所示的高压冰冻根尖。因此, 不需要通过大量的化学固定和金属化步骤来破坏最佳超微结构保存。此外, 从病理实验室的常规样品, 中间金属化提供了优秀的数据10。这样的后嵌入对比增强是不可能的 SBF 扫描电镜和谎言-sem 一般。此外, 由于这些方法具有破坏性,即, 在成像过程中消耗样本, 在不同的分辨率和地点进行分层成像, 或者在以后的时间点重复成像是不可能的。原则上, 无限卷, 包括大 FOVs (例如, 由几毫米为整个老鼠脑子在 connectomics) 由缝合马赛克创造, 并且大量的部分可以获得通过在, 而在说谎-SEM, FOVs 在100µm x 100 µm 以后很难用常规仪器实现。
在工作流中所描述的进一步自动化将是一个明确的优势, 因为上述方法 SBF-sem 和颤像-sem 在同一仪器中以全自动的方式执行切片和成像。一种切片的自动化存在: ATUMtome12可以生成和收集数以千计的节, 但使用 Kapton 磁带作为基板使此类阵列难以在 FLM 中进行图像处理。在这里使用的 ITO 涂层盖玻片, 即使是超分辨率成像也应该是可能的。另一个非常理想的自动化目标是记录 FLM 数据栈。另一方面, 自动化可能是昂贵的, 除了基板持有者, 这里提出的工作流仅依赖于通常在常规 EM 实验室或核心设备中可用的检测工具, 从而使其低级别访问。
披露声明
套件已收到补偿的 Boeckeler 仪器供应的功能模型的基板持有人。玛琳·泰勒是蔡司显微学有限公司的员工, 本文所提到的显微镜系统的制造商。此外, 蔡司还提供了一些解决方案, 如蔡司阿特拉斯解决方案包, 用于广泛应用于大面积、3D 成像扫描电镜和颤电镜仪器。所有其他作者都没有什么可透露的。
致谢
这项工作得到了德国联邦教育和研究部项目 MorphiQuant-3D 的赠款 FKZ 13GW0044 的支持。我们感谢 Carolin 巴特尔的技术支持。
材料
| Name | Company | Catalog Number | Comments |
| Instrumentation | |||
| Ultramicrotome | RMC | PT-PC | Alternative: Leica UC7 |
| Substrate holder | RMC | ASH-100 | Alternative: home built |
| Plasma cleaner | Diener | Zepto 40kHz | Alternatives: Ted Pella Pelco or other benchtop plasma cleaner Example Parameters for Diener Zepto with 40kHz generator (0-100W); 0.5 mbar, 5 sccm (Air), 10% performance |
| Widefield fluorescence light microscope | Zeiss | Axio Observer.Z1 | Alternatives: Leica, Nikon, Olympus |
| Fluorescence filter set | Zeiss | 43 HE (Cy3/DsRed) | |
| Objective lens | Zeiss | Zeiss Neofluar 40x | 0.75 NA |
| Decent workstation able to handle GB-sized image data | |||
| FESEM | Zeiss | Ultra 55 | Alternatives: FEI, Jeol, Hitachi, TESCAN |
| Name | Company | Catalog Number | Comments |
| Sectioning | |||
| Razor blades | Plano | T585-V | |
| Diamond knife for trimming 45° | Diatome | DTB45 | |
| Diamond knife for trimming 90° | Diatome | DTB90 | |
| Jumbo diamond knife for sectioning | Diatome | DUJ3530 | |
| Silicon wafer (pieces) | Si-Mat | Custom Made | Doping: P/Bor, orientation: <100>, thickness: 525 ± 25 µm, resistivity: 1-30 Ω-cm http://si-mat.com/silicon-wafers.html |
| ITO-coated coverslips | Balzers | Type Z | 22 × 22 × 0.17 mm https://www.opticsbalzers.com/de/produkte/deckglas-fenster/corrslide.html |
| Aluminium carrier | Custom Made | 76 × 26 mm | |
| Wafer forceps | Ideal-tek | 34A.SA | |
| Stubs forceps | Dumont | 0103-2E1/2-PO-1 | Dumoxel-H 2E 1/2 |
| Diamond scriber | Plano | T5448 | |
| Eyelash/very soft cat's hair | Selfmade | Alternative: Plano | |
| Brush | Selfmade | ||
| Pattex contact adhesive | Pattex | PCL3C | Kraftkleber Classic (the yellowish one) |
| Fixogum | Marabu | 290110001 | for fixing substrate to carrier |
| Adhesive tape | 3M | 851 | for fixing substrate to carrier |
| Isopropanol | Bernd Kraft | 07029.4000 | |
| Xylene | Carl Roth | 4436 | thinner for glue mixture |
| Rotihistol | Carl Roth | 6640 | alternative, limonene based thinner |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Image processing | Open source | Fiji (http://fiji.sc/#download) | |
| Image acquisition | Zeiss | Atlas 5 AT (module for Zeiss SEM) | Alternative for automated image acquisition: WaferMapper: https://software.rc.fas.harvard.edu/lichtman/LGN/WaferMapper.html |
| Name | Company | Catalog Number | Comments |
| Staining | |||
| Propidiumiodide | Sigma-Aldrich | P4170 | Stock solution: 1.5 mM in 0.1 % sodium azide |
| Uranylacetate | Science Services | E22400 | |
| Lead(II) Nitrate | Merck | 107398 | |
| Tri Sodium Citrate Dihydrate | Merck | 106448 | |
| NaOH pellets | Merck | 106469 | |
| 1M NaOH solution | Bernd Kraft | 01030.3000 | |
| Glass petri dish | Duran | 23 755 56 | |
| Name | Company | Catalog Number | Comments |
| Mounting | |||
| Stubs | Plano | G301F | |
| Carbon pads | Plano | G3347 | |
| Copper tape | Plano | G3397 | double-sided adhesive, conductive |
| Silver paint | Plano | G3692 | Acheson Elektrodag 1415M |
| Name | Company | Catalog Number | Comments |
| Solutions/mixtures | |||
| Adhesive mixture for coating blocks | Pattex contact adhesive /xylene as thinner, ratio 1:3. (Alternative for xylene: Rotihistol) | ||
| Reynolds lead citrate | 50 mL: Dissolve 1.33 g of lead(II) nitrate in 10 mL of dH2O. Dissolve 1.76 g of tri-sodium citrate dihydrate in 10 ml dH2O. Mix both and add 1 M sodium hydroxide until the solution is clear. Fill up with dH2O to 50 mL. | ||
| Propidium iodide staining solution | Prepare 1:1500 dilution from stock in dH2O. Vortex for adequate mixing. | ||
| Aqueous uranyl acetate | Dissolve 3 % uranyl acetate in dH2O (mix thoroughly). |
参考文献
- Peddie, C. J., Collinson, L. M. Exploring the third dimension: Volume electron microscopy comes of age. Micron. 61, 9-19 (2014).
- Wanner, A. A., Kirschmann, M. A., Genoud, C. Challenges of microtome-based serial block-face scanning electron microscopy in neuroscience. J Microsc. 259 (2), 137-142 (2015).
- Kizilyaprak, C., Daraspe, J., Humbel, B. Focused ion beam scanning electron microscopy in biology. J Microsc. 254 (3), 109-114 (2014).
- Wacker, I., Schröder, R. R. Array tomography. J Microsc. 252 (2), 93-99 (2013).
- Tapia, J. C., Kasthuri, N., Hayworth, K. J., Schalek, R., Lichtman, J. W., Smith, S. J., Buchanan, J. High-contrast en bloc staining of neuronal tissue for field emission scanning electron microscopy. Nat protoc. 7 (2), 193-206 (2012).
- Lucas, M. S., Günthert, M., Gasser, P., Lucas, F., Wepf, R. Bridging Microscopes: 3D Correlative Light and Scanning Electron Microscopy of Complex Biological Structures. Methods Cell Biol. 111, 325-356 (2012).
- De Boer, P., Hoogenboom, J. P., Giepmans, B. N. Correlated light and electron microscopy: ultrasructure lights up!. Nat Methods. 12 (6), 503-513 (2015).
- Verkade, P., Müller-Reichert, T. . Methods in Cell Biology Correlative Light and Electron Microscopy III. 140, 1-352 (2017).
- Gibson, K. H., Vorkel, D., Meissner, J., Verbavatz, J. -. M. Fluorescing the Electron: Strategies in Correlative Experimental Design. Methods Cell Biol. 124, 23-54 (2014).
- Wacker, I., Schröder, R. R., Schroeder, J. A. Pathology goes 3D: Exploring the potential of array tomography versus FIB nanotomography for a CADASIL sample. Ultrastruct Pathol. 41 (1), 114-115 (2017).
- Wacker, I., Spomer, W., Hofmann, A., Thaler, M., Hillmer, S., Gengenbach, U., Schröder, R. R. Hierarchical imaging: a new concept for targeted imaging of large volumes from cells to tissues. BMC Cell Biol. 17 (1), 38 (2016).
- Hayworth, K. J., Morgan, J. L., Schalek, R., Berger, D. R., Hildebrand, D. G. C., Lichtman, J. W. Imaging ATUM ultrathin section libraries with WaferMapper: a multi-scale approach to EM reconstruction of neural circuits. Front Neural Circuits. 8, (2014).
- Micheva, K. D., O'Rourke, N., Busse, B., Smith, S. J. Array Tomography: Production of Arrays. Cold Spring Harb Protoc. 11, 1267-1269 (2010).
- Fahrenbach, W. H. Continuous serial thin sectioning for electron microscopy. J. Elec. Microsc. Tech. 1 (4), 387-398 (1984).
- Harris, K. M., et al. Uniform serial sectioning for transmission electron microscopy. J Neurosci. 26 (47), 12101-12103 (2006).
- Schindelin, J., Arganda-Carreras, I., Frise, E., Kaynig, V., Longair, M., Pietzsch, T., Preibisch, S., Rueden, C., Saalfeld, S., Schmid, B., Tinevez, J. -. Y., White, D. J., Hartenstein, V., Eliceiri, K., Tomancak, P., Cardona, A. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Cardona, A., Saalfeld, S., Schindelin, J., Arganda-Carreras, I., Preibisch, S., Longair, M., Tomancak, P., Hartenstein, V., Douglas, R. J. TrakEM2 software for neural circuit reconstruction. PLoS ONE. 7 (6), e38011 (2012).
- Micheva, K. D., Smith, S. J. Array Tomography: A new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55 (1), 25-36 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。