Method Article
用数字聚合酶链反应检测循环核糖核酸 ROS1 和 RET 融合记录的血液检测方法
摘要
从血液中检测循环核糖核酸 (茨尔纳) 是临床诊断中未满足的需要。在这里, 我们描述的方法, 茨尔纳的特点, 从非小细胞肺癌患者使用敏感和特定的数字聚合酶链反应。测试满足设计要求, 在72小时内检测融合变体。
摘要
我们开发了一种新的方法来分离和鉴定肿瘤衍生循环核糖核酸 (茨尔纳) 的血液为基础的液体活检。从血液中恢复的茨尔纳的稳健检测代表了一种解决临床诊断中关键未满足需求的方法。该测试始于收集血液收集管含有防腐剂, 稳定茨尔纳。在这个测试系统中, 从血浆中分离出无细胞、exosomal 和血小板相关的 RNA。茨尔纳是反向转录为补充 DNA (cDNA) 和扩增使用数字聚合酶链反应 (dPCR)。对目标生物标志物以及控制基因的样品进行评估。测试验证包括检测的限制、准确性和分析样本的鲁棒性研究。这项研究开发的方法重现性检测多融合变种为 ROS1 (C-Ros 原癌基因 1; 8 变种) 和 RET (重新排列在转染原癌基因; 8 变种)。对示例处理工作流进行了优化, 使测试结果可以在样本收据72小时内持续生成。
引言
25% 的非小细胞肺癌 (NSCLC) 患者在诊断时可能没有足够的组织可供测试。即使在组织可用的情况下, 也可能没有足够的数量或质量来执行推荐的分子测试1,2。如果有足够的组织从活检的分子分析, 病人可能需要等待数周或更长的结果, 或开始治疗没有分子结果3,4。然而, 考虑到多目标治疗方案的出现, 对于被诊断为 NSCLC 的患者, 重要的是提供信息性的分子诊断。从液体活检中检测循环无细胞 DNA (cfDNA) 是解决传统组织测试的挑战的方法4,5,6。目前的可操作性突变的测试选项使用 cfDNA 和类似的 dPCR 工作流快速生成, 包括表皮生长因子受体 (egfr) 敏化突变ΔE746 A750 和 L858R, EGFR 抵抗突变 T790M, KRAS 原癌基因 (KRAS) 变种和 B 皇家空军原癌基因 (BRAF) 变种 V600E。虽然没有广泛采用的领域, 循环肿瘤衍生信使 RNA (mRNA) 分离的液体活检也可以提供重要的临床信息7,8,9。我们以前已经开发并报告了多路检测棘皮动物微管相关蛋白的方法, 如 4-变性淋巴瘤受体酪氨酸激酶 (EML4-ALK) 融合变种的血浆10。在本研究中, 我们将这些方法扩展为 ROS1 和 RET 的高阶多路复用 RNA 靶, 在每种检测中覆盖八个融合变种。目的是开发一种快速、灵敏、特异和可重复的技术, 用于检测先前诊断为 NSCLC 的患者血浆中的这些融合变种。
测试过程是在医生的办公室开始使用 RNA 稳定血液收集管11。这些管子含有细胞防腐剂以及 RNase 抑制剂。样品在一夜之间被运输优先权对美国病理学家集中的学院 (盖帽)-认可的或临床实验室改善修正 (CLIA)-被证明的实验室 (临床实验室) 为处理由能干的人员。一旦得到临床实验室, 每一个步骤的处理是根据批准的标准操作程序 (SOP) 进行。全血是离心恢复血浆, 然后用于隔离循环 RNA 是免费的血液或在封装基团, 如外来体和血小板 7, 8, 9.为了将 rna 从这些隔间分离出来, 我们选择了一种基于几种提取方法比较的 rna 恢复系统。分离 RNA 是集中和反向转录到 cDNA。在优化 cDNA 合成方法的过程中, 对几种逆转录酶和基因特异引物进行了评价, 以最大限度地提高 ROS1 和 RET 靶转录的转化率10。这对于低丰度的循环转录, 如肿瘤衍生的融合变种是至关重要的。最后, 我们优化 dPCR 底漆和探针浓度, 以允许多路检测的 RET 或 ROS1 融合变种和控制基因, glucuronidase β (GUSB)。然后, 在执行本报告所述的分析验证研究之前, 我们将每个优化研究的最佳条件组合为最终锁定的协议。该协议和这些结果为快速而敏感的工作流程提供了基础, 用于常规检测循环中的稀有融合变体。
研究方案
除非另有说明, 否则制造商的指示将遵循下面列出的试剂。PCR 检测是商业上可用的产品, 旨在探测 ROS1 和 RET 融合。
1. 与 RNA 一起在准备反向转录 (RT)-dPCR: 实验室最佳做法
- 在使用 RNA 时创建一个无 RNase 的环境。
- 使用可用于灭活污染 RNases 的商用喷雾剂。
- 使用经认证的无 RNase 试剂、小贴士和试管。使用障碍提示 pipettors, 以防止引入 RNases 或交叉污染的样品。
- 总是穿上实验室的外衣, 以防微粒从衣物中掉落到样品中。指定用于 RNA 处理的实验室大衣。
- 戴上手套, 防止皮肤 RNases 的样品污染。经常更换手套。
注意:假设实验室表面受到 RNase 的污染, 因为它们暴露在环境中。手套, 接触皮肤, 头发, 面糊, 冷冻手柄, 钢笔/标记,等被假定为不再 RNase。 - 使用前用 RNase 灭活喷雾净化 pipettors、benchtops、离心机和其他工作表面。
- 如果可能的话, 维护一组与 RNA 一起使用的设备。
- 在使用 RNA 样品时尽量减少实验室区域内气流的中断, 以防止微粒落入样品或污染工作区域。
- 将纯化的 RNA 贮存在-80 ˚C。
- 避免多次冰冻融化的 RNA 样本, 因为这可能会导致退化。
2. 用于阳性对照的分析 RNA 材料的生成
- 使用已发布的 mRNA 序列为感兴趣的融合变体设计合成 DNA10。
- 对于给定的融合变体, 选择一个 mRNA 融合序列, 其中包括融合站点加上足够长的侧翼两侧, 以覆盖 PCR 扩增子。
- 选择 50-250 nt 之间的核苷酸序列, 以模拟利用血小板富集等离子体捕获的循环 RNA 的大小。
- 将 T7 启动程序序列 (5 '-CAGAGATGCATAATACGACTCACTATAGGGAGA-3 ') 添加到目标序列的 5 ' 端。
- 将合成序列作为双绞链脱氧核糖核酸 (DNA) 片段排序。
- 将三 EDTA (TE) 缓冲器中的合成 DNA 重组为最终浓度为10µL。
- 使用体外转录将 60 ng 合成 DNA 转换为 RNA。
- 用苯酚/胍基试剂纯化 RNA 记录12。
- 包括 DNase I, 无 RNase 去除残留模板 DNA。
- 使用具有 rna 特异染料和标准的商用荧光计测量纯化的体外 RNA 的浓度。确保 RNA 位于所选标准所能接受的范围内。可能需要稀释。
- 用2% 琼脂糖凝胶混合 rna 凝胶染色和高射程 rna 阶梯, 包括 50-250 nt 大小范围, 确认成功的转录。
- 将每个体外RNA 的 500 ng 加载到凝胶上。
- 用5伏/厘米的凝胶。
- 使用光照可视化单个波段, 并记录结果。
- 确认每个融合变体的预期成绩单大小 (基于步骤2.1.2 中的设计)。
- 使用匹配的变异特异 PCR 方法确认 dPCR 检测每个的体外RNA (参见本协议的步骤 5-8)。
- 可选: 准备包含每个融合变体和控制基因 GUSB 的体外RNA 的摩尔混合物。
- 如果执行了步骤 2.9: 通过 dPCR 使用变体特定的 PCR 方法确认检测控制混合物中包含的每个融合变体 (参见本协议的步骤 5-8)。
- 通过测试0.25 到 2.5 fg10的浓度, 确定分析阳性控制所需的输入浓度。根据所需的复制号输出选择浓度。
- 确认后, 准备10µL 单使用整除数的分析 RNA 用于阳性控制 (步骤 4.4) 和存储在-80 ˚C。
3. 捐助者标本
- 收集10毫升的人全血标本在10毫升血液收集管 (BCT) 含有无细胞 RNA 防腐剂。
注意:所有人类捐助者均应同意研究使用, 在测试期间不得收集或使用捐助者特定的识别信息。 - 在 BCT 制造商指定的时间范围内处理整个血液样本。
- 汇集正常人血浆可以从商业来源购买在分析的正面控制之内使用。准备单一用途, 1 毫升整除数的汇集正常人血浆并且存放在-80 ˚C 为使用与正面控制 (步 4.4)。
4. 从等离子体中回收循环 RNA
注意: 在这个过程中快速工作是很重要的。
- 离心机全血管以 200 x g 为20分钟。
- 使用血清学吸管从离心采血管收集多达4毫升的血浆。小心不要打扰或吸入巴菲大衣层。
- 使用可从血浆中捕获外来体、血小板和无细胞 rna 的商用试剂盒分离循环 rna。将 RNA 从阳性对照样品中分离出来。
-
为每批临床样品准备积极的控制, 如下所示:
- 解冻1毫升的正常人血浆整除 (步骤 3.3)。
- 解冻10µL 分析 RNA 整除 (步骤 2.12)。
- 当乙醇加入到血浆裂解液中后, 将10µL 分析 RNA 添加到正常的人体血浆样品中, 准备阳性控制。
- 洗脱样品与100µL 核酸酶无水。立即进行 RNA 清理和浓缩。
- 样品可以储存在湿冰上, 并覆盖, 长达一小时。
- 用柱基法和洗脱在9µL RNase 水中浓缩 RNA。
- 立即进行步骤 5, 或将样品放在湿冰上长达一小时。
5. RNA 的反向转录到 cDNA
- 使用商业上可用的反向转录反应套件 (包括随机引物) 将浓缩循环 RNA 样本转化为 cDNA (请参见表 1中的组件)。
注意:基因特异引物是可选的, 可以设计为测试变种。引物是根据目标 RNA 序列设计的。使用步骤2.1 中的融合变体序列。- 不包括逆转录酶控制样本和没有 RNA 控制样本 (请参见表 1)。
- 利用商业上可用的 DNA 浓缩器自旋柱将 cDNA 从反向转录反应中分离出来。
注意:这一步骤有助于去除酶, 底漆和自由核苷酸 triphosphates (dNTPs)。 - 立即使用 cDNA PCR 反应或存储在-80 ˚C。
6. 数字 PCR
注: 此 pcr 是特定的水滴数字 pcr (见材料表)。
-
PCR 混合预防措施。
- 穿上一次性的实验室大衣和丁腈橡胶手套。
- 在专用试剂制备区使用 PCR 混合试剂。请勿在试剂制剂区处理 cDNA。
- 在工作时覆盖探头以保护它们不受光线的侵害。过量的光可以照片漂白的荧光染料附着在探针上。
- 运输混合, 覆盖和保护, 从光, 到一个单独的预放大区域之前, 将添加 cDNA。
- 添加 cDNA, 以 pcr 混合在 pcr 清洁罩位于预放大区域。
- 根据表 2, 为20µL 的最终反应量准备 PCR 混合。
- 将 pcr 混合 + cDNA 分发到 pcr 板上。
注意:建议使用板布局作为参考。 - 使用可拆卸板封口机盖板。
- 离心板简单地收集在井底的样品。
- 混合在平板振动筛在低设置十年代。
- 离心板简单地收集井底的样品。
- 拆卸板封口机。使用手动或自动雾滴生成系统进行 PCR cDNA 混合的雾滴生成。
- 对于手动滴产生, 转移20µL PCR 混合到样品井上的水滴产生墨盒。加入70µL 的液滴生成油。用橡皮垫片和转移墨盒盖上手动滴发生器, 以启动雾滴生成。跟随滴世代, 转移滴到一个新的 PCR 板材使用制造商推荐的提示。吸入和分配的水滴缓慢, 超过5至 6, 每一个, 而不接触的尖端开口的水滴墨盒或板块。
- 对于自动液滴生成, 用箔密封密封板并将其转移到液滴发生器。确保所有的提示, 墨盒和板块在开始滴产生之前到位。
- 跟随水滴的产生和转移到一个新鲜的 PCR 板, 密封与箔板封口机, 和热循环板使用设置在表 3。
- 在热循环仪运行完成后, 用滴读器读取该板。创建用于识别控件、示例、等位置的读取器软件的版面布局, 并将加载到软件中以开始读取。
7. 数据分析和审查以及成果的产生
- 使用商用软件分析板读结果。
- 导航到 "分析" 菜单以查看二维 (2D) 振幅图。
- 通过检查水滴数据来评估数据的整体质量。
- 使用 "事件" 菜单计算总接受事件编号的数据。如果每个井都少于1万个事件, 请仔细评估数据以了解其他问题。
- 检查数据的异常荧光振幅。复制样本之间的显著振幅差异和浓度差异表明, 样品处理或混合不畅。
- 在45度轴上用喷雾模式制作水滴簇的注释, 这表明质量差的水滴或有问题的样品。
- 检查阳性对照, 无逆转录酶 (无 RT), 无 RNA 控制 (NRC) 数据优先。选择所有的控制样本, 并通过2D 图检查集群质量。对于适当的阈值, 液滴簇之间的清晰分离应该是明显的。
- 对于每个检测变量, 设置基于控制井的阈值。
- 使用十字线工具在2D 地块上设置阈值, 将双负滴种群从控制基因种群中分离出来 (标记为 5 '-hexachloro 荧光素铈 phosphoramidite 探针)、y 轴和变异基因种群 (如果存在) (标有荧光素 amidite 或 6-羧基探针), x 轴。
- 向单个示例中的每个复制的副本求和。
- 以检测到的变体副本数量表示测试结果。
注意:要确定用于调用阳性或阴性样本的分析截止值, 请运行一个正常的健康捐献者样本集 (至少10个样本), 并通过最后确定的过程建立截止到任何可检测的背景信号的突变兴趣。另外, 建立控制基因拷贝所需的数量来调用一个积极或消极的结果。这种控制基因切断功能作为内部质量控制 (QC), 以评估每一个 RNA 样品的数量和质量的处理。
8. 使用细胞线验证 RT-dPCR 反应条件 (可选)
- 为了验证融合变种的检测, 使用商业上可用的细胞线表达 ROS1 或 RET 融合 mRNA 的兴趣。按如下方式进行:
- 融汇在胍的溶解溶液中, 直接从冷冻状态中的闪光冷冻细胞。即使在均匀化之前的短暂解冻也会导致 RNA 的降解和损耗。
- 使用为 rna 设计的硅膜自旋柱分离 rna。
- 使用带有 rna 特异试剂和标准的荧光计测量 rna 样品的浓度。
- 将分离的 rna 稀释成来自等离子体或其他商业来源的野生型 rna 的背景。
- 从 RNA 的反向转录到 cDNA、数字 PCR、数据分析和回顾以及在本协议中列出的结果的生成, 以确认所需的变种的检测步骤。
结果
本协议描述了一个测试系统, 用于检测 RNA 融合变体, 用于测量 NSCLC 患者血浆中的驱动突变 (图 1a)。融合 mRNA 产品从最常见的 RET 和 ROS1 重排的表达在 NSCLC 人口被确定了13,14,15,16,17。然后设计了多路 PCR 检测方法, 以在单个反应中发现 NSCLC 中每个靶的八种最常见的转录变异。ROS1轨迹中最常见的易位生成与CD74、 SDC4、 SLC34A2、 EZR或TPM3基因 (图 1B) 的 5 ' 部分的关联。RET轨迹中最常见的易位导致与KIF5B并列, 该检测涵盖六个外显子结点。包括CCDC6和TRIM33 (图 1C) 的其他RET合作伙伴。总共, 该化验涵盖约88% 的 ROS1 和99% 的 RET 改变已知发生在 NSCLC 患者人口17。
首先使用八个单独的体外rna 对检测成分的特异性进行评估, 其中包含了 ROS1 或 RET 复用检测所覆盖的融合记录的 mRNA 序列。每个 RNA 物种都对每种不同的变异检测进行了测试, 包括复用版本。这些化验没有交叉反应性, 因此在设计的多路复用化验 (未显示的数据) 中展示了100% 分析特异性。为了确定测试协议检测的下限, 从表达融合变体的细胞系中提取的总 rna 在5%、1%、0.2% 和0.04% 浓度下混合成正常 RNA 的背景。多路复用和 ROS1 变异 PCR 方法检测到多达0.2% 融合变体 (图 2A B)。此外, 未通过多路 ROS1 和 RET 分析检测出5% 个离靶细胞线衍生 RNA (表达 EML4-ALK 融合转录) 的制备, 进一步证明特异性 (图 2a B)。
对 ROS1 和 dPCR 工艺进行了精密测试. 由摩尔体外rna 组成的分析控制材料, 通过反向转录和 dPCR 对三进行三浓度 (高、中、低) 的处理。在同一天内的不同场合 (天内), 连续三天 (日间), 并与两名经营者 (互操作者)。精密测试的结果表明, 准确检测的融合记录的兴趣, 以及控制基因, GUSB, 其中包括作为内部 QC 指标 (图 2C-D)。
除了 GUSB 内部控制外, 每批临床样品都使用一组批次控制来运行。一个积极的控制是从一个分析性的体外rna 的混合物, 代表每一个融合变种测试在 RT-dPCR, 以及分析体外RNA 为 GUSB。在 rna 提取过程中, rna 被注入正常的人体血浆裂解物中, 并在整个协议中与临床样品一起处理。无逆转录酶 (无 RT) 控制是一种阴性控制, 以确认在 rna 提取工作流中没有污染物质, 并证明了 rna 引物的特异性。无 RT 控制是使用与阳性对照相同的材料生成的, 但不包括在 cDNA 合成反应中的酶。无 RNA 控制 (NRC) 是一个阴性的控制, 以确认没有污染记录在反向转录反应成分。该控制被引入到工作流中的 cDNA 合成步骤, 和水添加到反应, 而不是 RNA 模板。如果要传递准确的结果, 则两个通道中的无 RT 和 NRC 控件必须为负值。表 1列出了每个控件的反向转录反应组件。为 ROS1 (图 3 -c) 和 RET (图 3 E G) 复用分析显示了每个控件的2D 图形的示例。使用荧光素 amidite (FAM) 探针检测融合变体, 并以 y 轴表示, 而控制基因 GUSB 则使用 5 '-hexachloro 荧光素 CE phosphoramidite (十六进制) 探针检测, 并位于 x 轴上。这些批次控制在21天的过程中进行评估, 以确定检测的鲁棒性。在研究过程中执行的所有21运行中, 均观察到融合阳性液滴和 GUSB 控制基因滴, 用于 ROS1 和 RET (图 3D, H)。所有负控制 (无 RT 和 NRC) 在整个21天内产生负结果 (未显示数据)。
解决问题的能力是在临床实验室设置中运行的任何测试协议的关键组成部分。在这里, 我们提供了使用 RT dPCR 协议的子优化结果的真实世界示例。第一个例子是2D 图, 展示了无逆转录酶控制的重要性 (图表 4A)。在这个例子中, 即使由于缺乏酶而没有 cDNA 转换, 突变阳性滴也存在。这一结果很可能是由于 dPCR 底漆放大了目标基因组 DNA。在这种情况下, 设计一个内含子生成的检测将防止基因组 DNA 的扩增。另外, RNase 的 DNase 酶可以用来消除污染的 DNA, 但这并不推荐用于检测稀有靶点, 因为某些 RNA 降解可能发生在与酶的孵化过程中。下一个示例2D 绘图是在两个通道中具有正水滴的 NRC (图 4B)。这表明在 dPCR 设置中的某个点有污染。在这种情况下, 建议放弃任何可能被污染的试剂用于测试, 彻底清除所有设备, 并重新测试新的反应成分。第三个示例2D 图, 显示为沿45°线的水滴喷雾 (图 4C)。这通常是由水滴的剪切和凝聚引起的。在热循环之前小心滴处理是必不可少的, 因为水滴容易损坏。我们建议在可用时使用自动雾滴生成。如果手动转移生成的水滴, 一定要选择建议的宽孔提示, 并采用仔细的吹打技术。滴转移需要缓慢的吸入和配药, 每次发生超过5-6 秒, 这是必不可少的吸管尖端打开不接触滴墨盒或良好。在配药时, 将吸管尖端保持在液位上, 并随着水滴的排出而缓慢升高 (查看视频以供演示)。最后的2D 绘图示例演示了正和负雾滴群之间缺少分离 (图 4D)。这可能有几个原因。强 PCR 抑制剂, 如用于裂解缓冲液的洗涤剂和过量的高降解 DNA, 可能导致分离的丧失。在这种情况下, 考虑在 cDNA 合成和 dPCR 之间添加一个清理步骤 (如本协议步骤5中所述)。最后, 缺乏分离也可能是由于次最优放大条件, 同时也应考虑 PCR 步骤的优化。
图 5中的数据代表了984个真实的世界患者采样次数, 并演示了此测试工作流的快速特性。结果在72小时内, 早在48小时 (79% 例) 的样品收据和95% 的病例报告给治疗医生。总之, 使用稳定的循环 rna 采血管, 优化的 rna 提取程序从血液和 RT dPCR 运行根据一个优化的协议与适当的内部和批次控制, 可以提供一个快速测试系统与 NSCLC 相关的融合 RNA 变异的准确检测。
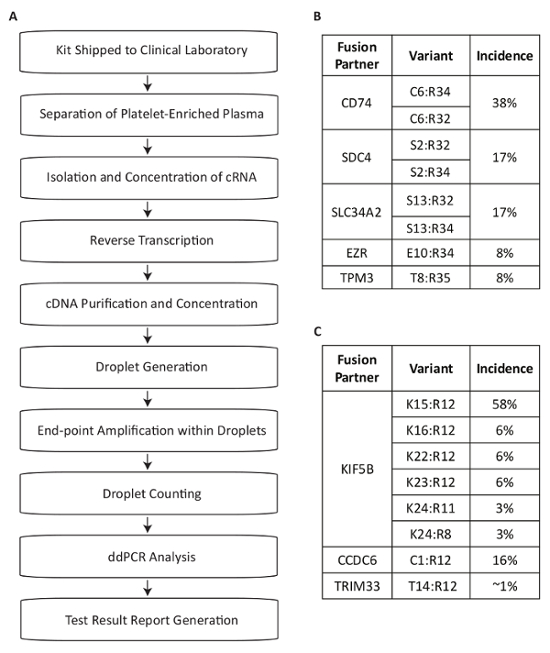
图 1: 使用特定于 NSCLC 中最常见的 RET 和 ROS1 变体的检测方法, 概述了用于融合变体探测的血液样本处理步骤.(A) 在绘制全血并将标本收集工具包中的 BCT 运送到临床实验室时, 启动样本测试。循环 RNA 从血小板丰富的血浆中的多个来源恢复, 反转转录与基因特异性启动, 并纯化, 用于 dPCR。样品使用一个商业上可用的系统来处理, 它由水滴生成 (乳液)、放大和水滴计数组成。数据使用商用软件进行分析。测试结果将被记录下来并报告给测试要求的医生。该过程设计为在72小时的时间内工作, 从样本收据到结果发布。八变种为 (B) ROS1 和 (C) RET 在复用化验之内包括。由 Biodesix 网站改编而成。请单击此处查看此图的较大版本.
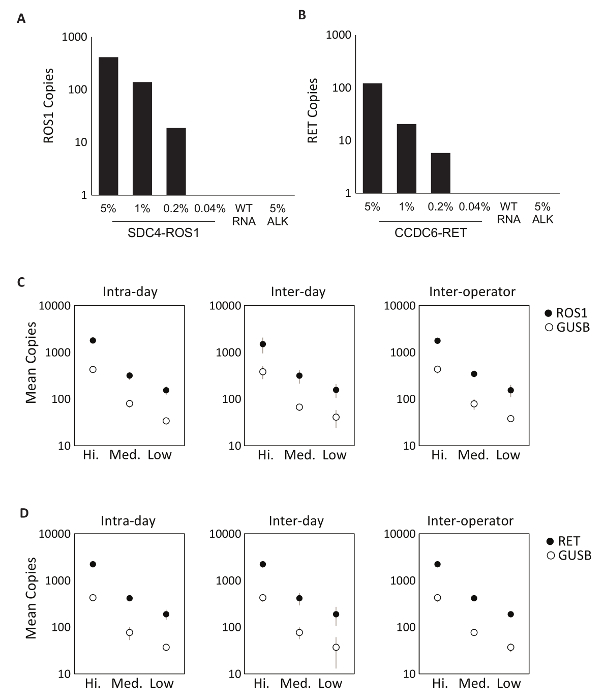
图 2: 分析验证.细胞线表达 (A) SDC4-ROS1 融合和 (B) CCDC6-RET 融合被稀释的背景下, 总人类野生型 rna (野生 rna)。每一个融合变体, 检测的限制, 建立在0.2% 的变化频率使用预先确定的标准, 每种变异检测。上述阈值之上的所有样本还包含至少21个控制基因拷贝。对野生型 RNA 背景下的 5% EML4-ALK (音译) 标准进行了测试, 以证明检测特异性, 结果证实为阴性。在高、中、低浓度下测量了分析复用 RNA 标准 (C) ROS1 和 (D) RET. 在同一天 (天内) 进行了三次以上的测试, 三次连续三天 (白天) 运行, 并与两个独立运算符 (互操作符)。显示了复制号和标准偏差的方法。由 Biodesix 网站改编而成。请单击此处查看此图的较大版本.
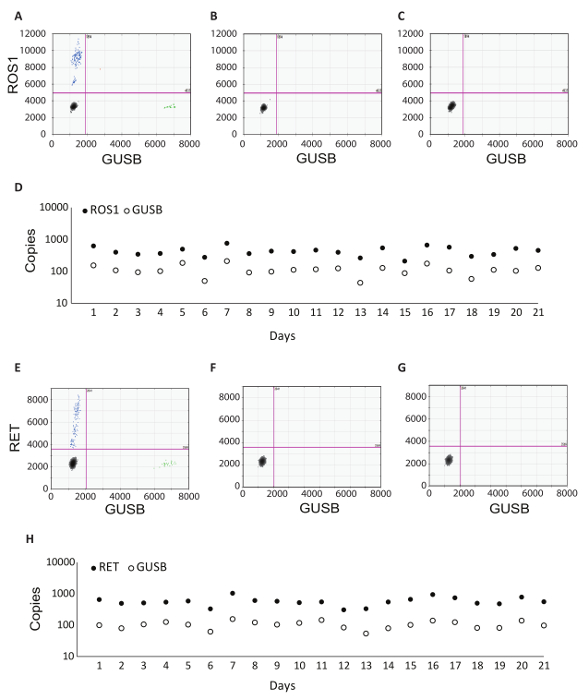
图 3: 批处理控制示例和健壮性数据.2D ROS1 复用分析 dPCR 结果为 (A) 阳性控制, (B) 无逆转录酶控制, (C) 没有 RNA 模板控制。(D) 控件连续21天运行 (不包括周末和节假日)。平均复制号 +/-标准偏差为 ROS1 正控制是 439 +/-141。没有逆转录酶, 也没有模板控件每天都运行, 这些都是阴性 (没有显示数据)。2D. dPCR 复用分析图的计算结果为 (E) 正则控制, (F) 无逆转录酶控制和 (G) 没有 RNA 模板控制。(H) 控件连续21天运行 (不包括周末和节假日)。平均拷贝 +/-标准偏差为 RET 正控制是 586 +/-182。没有显示的是没有逆转录酶和没有模板控件, 也在每天运行, 都是阴性的。由 Biodesix 网站改编而成。请单击此处查看此图的较大版本.
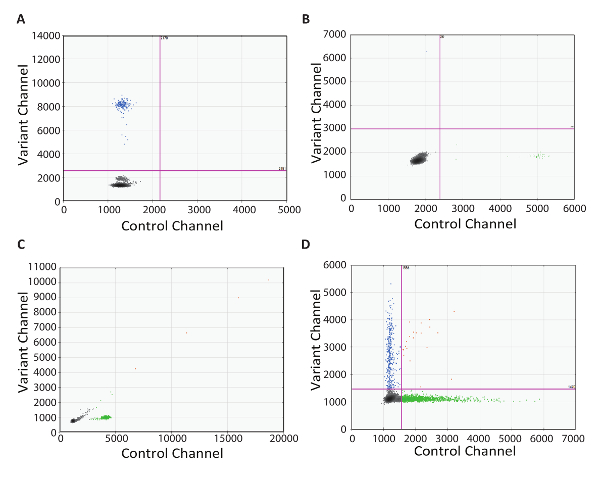
图 4: 诊断 RT dPCR.2D 图, 表示在无逆转录酶控制范围内 (A) 污染的情况下获得的次级最佳 dPCR 结果, (B) 在无 RNA 控制范围内的污染 (C) 剪切和凝聚的水滴, 和 (D) 优化的 pcr 条件较差或 pcr 抑制。请单击此处查看此图的较大版本.
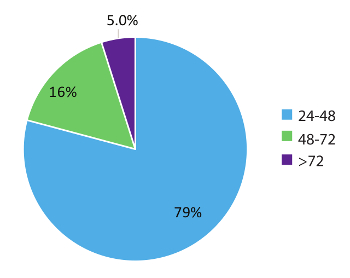
图 5: 周转时间 (达).对请求 RNA 变体 (n = 984) 的测试编译了达 (小时)。数据不包括周末、节假日和为 > 24 小时举行的样本, 原因是实验室测试请求表上的临床信息不完整。请单击此处查看此图的较大版本.
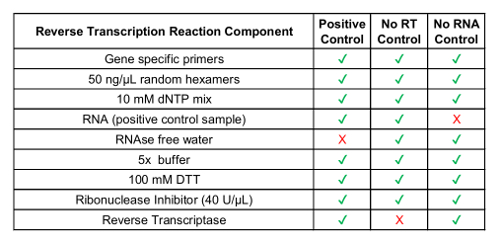
表 1: 制备过程控制用反向转录试剂。
| 组件 | 体积 |
| 2x dPCR supermix 探头 (no 2 '-脱氧尿苷 5 '-三磷酸) | 10µL |
| 20x 可变目标引物/探头集 (450 nmol/升底漆, 250 nmol/升探头) | 1µL |
| 20x 控制目标引物/探头集 (450 nmol 底漆, 250 nmol/升六角探针) | 1µL |
| 核酸酶水 | 1µL |
| Cdna | 7µL |
表 2: 准备 dPCR 的主混合料。
| 循环步骤 | 温度 | 时间 | # 周期 | 坡道率 |
| 酶活化 | 95°c | 10分钟 | 1 | ~ 2 oc/s |
| 变性 | 94°c | 三十年代 | 40 | |
| 退火/延伸 | 55°c | 1分钟 | ||
| 酶失活 | 98°c | 10分钟 | 1 | |
| 保持 (可选) | 4°c | 无限 | 1 | ~ 1 oc/s |
表 3: 热循环条件。
讨论
RET 和 ROS1 重排在一起弥补了3% 的驱动突变在 NSCLC 人口18。虽然罕见, 但这些基因改变的检测是至关重要的。非肺癌患者的这些改变可能得益于针对性的治疗, 特别是抑制异常激酶活动的结果, 从 onco 蛋白13。一些这样的疗法已经被 FDA 批准用于 ROS1 阳性的 NSCLC, 而其他一些已经被证明是有效的抗 RET 在临床试验19。
数字 PCR 技术为液体活检应用提供了最理想的灵敏度20。这项技术已被广泛应用于无细胞 DNA 的循环使用, 用于测量非 NSCLC 患者的肿瘤突变4,6,21,22,23.除了 cfDNA, 我们还开发了一项协议, 旨在强健地测量来自循环肿瘤 RNA (图 1a)10的 NSCLC 患者中最流行的融合变体。
我们建立的协议允许检测的分析限制降低到 0.2% (图 2)。虽然 dPCR 是特别具体和敏感的, 测试是有限的已知融合变种的面板被选择和多路检测在 PCR 试验。因此, 必须仔细选择融合在复用化验中, 以确保适当的覆盖范围内的肺癌患者的人群。我们成功地设计了用于 ROS1 的测试, 同时检测到八个融合变体是由 ROS1 位点的重排和99% 和88% 的 ret 和 ROS1 阳性人口分别 (图 1B-C)17。
本研究中描述的最终测试工作流包括批处理控件, 以确保结果的一致性。这些控制包括一个正分析标准和两个负控制, 它们一起确保在批处理中不会发生污染或 PCR 抑制 (图 3)。为了确保检测的健壮性, 在21天期间使用批处理控制进行了一项研究 (图 3D、H)。这些数据显示了在本协议中建立的 RNA 过程的一致性。
良好的实验室实践和适当的 RNA 处理是确保可靠和准确结果的关键组成部分。实验室空间和设备专用于使用 RNA, 每次使用后清洗设备, 使用无 RNase 试剂和消耗品, 并将 RNase 灭活喷雾应用于工作空间, 都有助于减少污染 RNases。由技术员认真处理 rna 样品, 包括专门的实验室大衣, 频繁的手套变化, 迅速通过 RNA 提取程序, 并保持样品在冰上是至关重要的保存样本完整性。一旦 RNA 被反向转录为 cDNA, 样品是在一个更稳定的形式, 不容易退化。除了支持 RNA 完整性的做法外, 还应在隔离区域保持 PCR 成分和样本, 以防止交叉污染, 从而导致假阳性结果。聚合 pcr 试剂和 pcr 母料的制备应与 pcr 模板分离, 并应非常小心地将扩增模板 (后 pcr) 与所有预扩材料 (包括试剂、RNA 和 cDNA 样本) 隔离开来。最后, 在放大前对乳化 PCR 混合物进行适当的生成和处理是保持液滴完整性和最佳 dPCR 条件的关键。这样的预防措施在执行本协议时非常关键, 以获得一致和准确的结果。所有数据应由训练有素的人员在公布结果之前进行检查, 以确保所有 QC 指标都得到满足。如果是次优结果 (图 4), 则必须由技术人员和实验室主任审查批次, 并可能需要重新处理。
dPCR 结果可以提前24小时产生, 从样品收据和95% 的样本结果在本研究所使用的测试集 (n = 984) 是报告到订购医生在不到72小时从收据 (图 5)。这个转过来的时间为医生提供了需要的分子信息在一个时间框架, 允许启动适当的治疗。这些结果通常比使用常规组织活检获得的更早。可利用类似的基于 RNA 的方法发展非肺癌和其他癌症的其他生物标志物, 并将从同样迅速的结果中获益。例如, 使用 RT dPCR 对程序性死亡配体 1 (PD-L1) mRNA 转录进行测量可以向医生通报免疫治疗的选择。对液体活检和 dPCR 在监测治疗效果方面也有越来越浓厚的兴趣。早期的迹象表明, 肿瘤的复发, 使用基因组检测的特定变种, 可以让医生调整治疗方案之前, 病人的症状的护理标准, 如成像24。这项研究中报告的协议, 由于它们的非侵入性、灵敏度、快速转接时间和成本效益而成为监测的理想选择。本文所述的化验结果在72小时内提供了从样本收据, 以最低的假阳性检测率, 这有助于快速治疗决策, 并绕过一些限制, 以组织为基础的测试4。
我们的协议和数据显示了一个可靠的测试系统, 用于鉴别低丰度 RNA 变种, 以及在临床实践中血液变异检测的潜力。对于那些没有通过快速靶向液体活检方法识别的驾驶员突变的患者, 从组织和血液中添加更广泛的基因组和蛋白质蛋白可以提供更广泛的临床信息。支持治疗计划。
披露声明
罗杰、K.A. 和 G.A.P. 是 Biodesix、罗杰和 G.A.P. 的雇员, 并持有 Biodesix 的专利申请的共同发明者, 涵盖了检测非小细胞循环遗传变异的诊断测试系统。肺癌。
致谢
我们感谢我们的合作者, 斯蒂芬. 琼斯, 查林顿, 戴安娜博士和来自数字生物学中心 (生物 Rad 公司 CA) 的萨曼莎. 库珀博士, 他们的化验设计支持;Nezar Rghei 和 Moemen 博士 Abdalla (Norgen Biotek, 加拿大) 在优化 RNA 提取协议的关键建议;和香农坎贝尔, 斯科特瑟斯顿, 杰夫 Fensterer, 香农马尔泰洛塔和 Joellyn Enos 协助的测试要求和商业监测。
材料
| Name | Company | Catalog Number | Comments |
| Ultrapure Distilled Water (DNAse, RNAse Free) (500 mL) | Life Technologies | 10977-015 | 1604071 |
| Ultrapure Distilled Water (DNAse, RNAse Free) (500 mL) | Life Technologies | 10977-015 | 1809353 |
| Nuclease-free water (molecular grade) | Ambion | AM9938 | 1604071 |
| Nuclease-free water (molecular grade) | Ambion | AM9938 | 1606077 |
| Phosphate Buffered Saline 1X, Sterile | Amresco | K812-500mL | 1446C189 |
| Phosphate Buffered Saline 1X, Sterile – 500 mL | Invitrogen | 10010023 | 1916C092 |
| RNase Zap (Life Tech) (250 mL) | Ambion | AM9780 | 353952 |
| Beta-Mercaptoethanol (BME) (250 mL) | CalbioChem | 6050 | W105B |
| OmniPur Ethyl Alcohol | CalbioChem | 4455-4L | 56054611 |
| OmniPur Ethyl Alcohol | CalbioChem | 4455-4L | 56238638 |
| Isopropyl Alcohol | VWR | 0918-4L | 2116C416 |
| TranscriptAid T7 High Yield Transcription Kit | Thermo Scientific | K0441 | 403648 |
| TranscriptAid T7 High Yield Transcription Kit | Thermo Scientific | K0441 | 288461 |
| DNase I | Thermo | K0441 | 371299 |
| QIAzol Lysis Reagent | Qiagen | 79306 | 54809699 |
| 20x TE buffer pH 8.0 | Alfa Aesar | J62388 | R13C548 |
| UltraPure Agarose | Invitrogen | 16500-100 | 552730 |
| 10x TBE buffer | Invitrogen | AM9863 | 353065 |
| Cell-Free RNA BCT | Streck | 218976 | 60110327 |
| Cell-Free RNA BCT | Streck | 218976 | 61900327 |
| Cell-Free RNA BCT | Streck | 218976 | 61480327 |
| Cell-Free RNA BCT | Streck | 218976 | 62320327 |
| Plasma/Serum Circulating and Exosomal RNA Purification Kit (Slurry Format) 50 preps | Norgen | 42800 | 585849 |
| Plasma/Serum Circulating and Exosomal RNA Purification Kit (Slurry Format) 50 preps | Norgen | 42800 | 588308 |
| Lysis Buffer | Norgen | 21205 | A5F61E |
| RNA Cleanup and Concentration Micro-Elute Kit (Norgen) 50 preps | Norgen | 61000 | 585848 |
| RNA Cleanup and Concentration Micro-Elute Kit (Norgen) 50 preps | Norgen | 61000 | 588309 |
| DNA Clean and ConcentratorTM- 5 200 preps (samples) | Zymo | D4014 | ZRC186976 |
| DNA Clean and ConcentratorTM- 5 200 preps (samples) | Zymo | D4014 | ZRC188077 |
| DNA Clean and ConcentratorTM- 5 200 preps (samples) | Zymo | D4014 | ZRC188413 |
| Collection Tubes 500 pack | Zymo | C1001-500 | N/A |
| SuperScript IV First Strand Synthesis System 200 rxn (samples) | Life Technologies | 18091200 | 391657 |
| SuperScript IV First Strand Synthesis System 200 rxn (samples) | Life Technologies | 18091200 | 392504 |
| SuperScript IV First Strand Synthesis System 200 rxn (samples) | Life Technologies | 18091200 | 448001 |
| SuperScript IV Reverse Transcriptase | Life Technologies | 18090200 | 451702 |
| Qubit HS RNA Assay Kit (500) | Life Technologies | Q32854 | 1745264 |
| Qubit assay tubes (500) | Life Technologies | Q32856 | 13416Q311 |
| ddPCR Supermix for Probes (no dUTP) | Bio-Rad | 1863023 | 64031651 |
| ddPCR Supermix for Probes (no dUTP) | Bio-Rad | 1863023 | 64063941 |
| ddPCR Supermix for Probes (no dUTP) | Bio-Rad | 1863023 | 64065740 |
| ddPCR Supermix for Probes (no dUTP) | Bio-Rad | 1863023 | 64065741 |
| ddPCR Supermix for Probes (no dUTP) | Bio-Rad | 1863023 | 64079083 |
| ddPCR Buffer Control for Probes | Bio-Rad | 1863052 | 64025320 |
| ddPCR Buffer Control for Probes | Bio-Rad | 1863052 | 64052358 |
| gBlock KIF5B-RET K15:R12 | IDT | 151004172 | 4-Oct-16 |
| gBlock KIF5B-RET K16:R12 | IDT | 151004173 | 4-Oct-16 |
| gBlock KIF5B-RET K22:R12 | IDT | 151004174 | 4-Oct-16 |
| gBlock KIF5B-RET K23:R12 | IDT | 151004175 | 4-Oct-16 |
| gBlock KIF5B-RET K24:R11 | IDT | 151004176 | 4-Oct-16 |
| gBlock KIF5B-RET K24:R8 | IDT | 151004177 | 4-Oct-16 |
| gBlock CCDC6-RET C1:R12 | IDT | 151004178 | 4-Oct-16 |
| gBlock TRIM33-RET T14:R12 | IDT | 151004179 | 4-Oct-16 |
| RET exon 8 RT Gene Specific Primer | IDT | 150554385 | 28-Sep-16 |
| 5’-CTCCACTCACACCTG-3’ | IDT | 150554385 | 28-Sep-16 |
| RET exon 11 RT Gene Specific Primer | IDT | 150554384 | 28-Sep-16 |
| 5’-GCAAACTTGTGGTAGCAG-3’ | IDT | 150554384 | 28-Sep-16 |
| RET exon 12 RT Gene Specific Primer | IDT | 150554383 | 28-Sep-16 |
| 5’-CTGCCTTTCAGATGGAAG-3’ | IDT | 150554383 | 28-Sep-16 |
| gBlock CD74-ROS1 C6:R34 | IDT | 152324366 | 15-Nov-16 |
| gBlock CD74-ROS1 C6:R32 | IDT | 152324367 | 15-Nov-16 |
| gBlock SDC4-ROS1 S2:R32 | IDT | 152324368 | 15-Nov-16 |
| gBlock SDC4-ROS1 S2:R34 | IDT | 152324369 | 15-Nov-16 |
| gBlock S13del2046-ROS1 S13del2046:R32 | IDT | 152324370 | 15-Nov-16 |
| gBlock S13del2046-ROS1 S13del2046:R34 | IDT | 152324371 | 15-Nov-16 |
| gBlock EZR-ROS1 E10:R34 | IDT | 152324372 | 15-Nov-16 |
| gBlock TPM3-ROS1 T8:R35 | IDT | 152324373 | 15-Nov-16 |
| ROS1 exon 34 RT Gene Specific Primer | IDT | 152704983 | 21-Nov-16 |
| 5’-CCTTCCTTGGCACTTT-3’ | IDT | 152704983 | 21-Nov-16 |
| ROS1 exon 35 RT Gene Specific Primer | IDT | 152704985 | 21-Nov-16 |
| 5’-CTCTTGGGTTGGAAGAGTATG-3’ | IDT | 152704985 | 21-Nov-16 |
| ALK Gene Specific Primer | IDT | 140035422 | 26-Aug-16 |
| 5’-CAGTAGTTGGGGTTGTAGTCG-3’ | IDT | 140035422 | 26-Aug-16 |
| EML4-ALK Cell line pellet | Horizon Discovery | N/A | 11-Jun-15 |
| SLC34A2-ROS1 Cell line pellet | Horizon Discovery | N/A | 11-Jun-15 |
| CCDC6-RET Cell line pellet | Horizon Discovery | N/A | 11-Jun-15 |
| Human Brain Total RNA | Ambion | AM7962 | 1703548 |
| PrimePCR ddPCR Expert Design Assay: K15:R12 | Bio-Rad | N/A | 17-Aug-16 |
| PrimePCR ddPCR Expert Design Assay: K16:R12 | Bio-Rad | N/A | 17-Aug-16 |
| PrimePCR ddPCR Expert Design Assay: K22:R12 | Bio-Rad | N/A | 17-Aug-16 |
| PrimePCR ddPCR Expert Design Assay: K23:R12 | Bio-Rad | N/A | 17-Aug-16 |
| PrimePCR ddPCR Expert Design Assay: K24:R11 | Bio-Rad | N/A | 17-Aug-16 |
| PrimePCR ddPCR Expert Design Assay: K24:R8 | Bio-Rad | N/A | 17-Aug-16 |
| PrimePCR ddPCR Expert Design Assay: C1:R12 | Bio-Rad | N/A | 17-Aug-16 |
| PrimePCR ddPCR Expert Design Assay: T14:R12 | Bio-Rad | N/A | 17-Aug-16 |
| PrimePCR ddPCR Expert Design Assay: C6:R34 | Bio-Rad /Biodesix | N/A | 6-Dec-16 |
| PrimePCR ddPCR Expert Design Assay: C6:R32 | Bio-Rad /Biodesix | N/A | 6-Dec-16 |
| PrimePCR ddPCR Expert Design Assay: S2:R32 | Bio-Rad /Biodesix | N/A | 6-Dec-16 |
| PrimePCR ddPCR Expert Design Assay: S2:R34 | Bio-Rad /Biodesix | N/A | 6-Dec-16 |
| PrimePCR ddPCR Expert Design Assay: S13del2046:R32 | Bio-Rad /Biodesix | N/A | 6-Dec-16 |
| PrimePCR ddPCR Expert Design Assay: S13del2046:R34 | Bio-Rad /Biodesix | N/A | 6-Dec-16 |
| PrimePCR ddPCR Expert Design Assay: E10:R34 | Bio-Rad /Biodesix | N/A | 6-Dec-16 |
| PrimePCR ddPCR Expert Design Assay: T8:R35 | Bio-Rad /Biodesix | N/A | 6-Dec-16 |
| (version 2) | Bio-Rad | 12003909 | 213939881 |
| PrimePCR ddPCR Expert Design Assay: ROS1 Multiplex (version 3.2) | Bio-Rad | N/A | 13-Dec-16 |
| PrimePCR ddPCR Expert Design Assay: ROS1 Multiplex (version 3.2) | Bio-Rad | N/A | 20170112v3.2 |
| PrimePCR ddPCR Gene Expression Probe Assay: GUSB, Human | Bio-Rad | 10031257 | 212851151 |
| PrimePCR ddPCR Gene Expression Probe Assay: GUSB, Human | Bio-Rad | 10031257 | 207383915 |
| PrimePCR ddPCR Gene Expression Probe Assay: GUSB, Human | Bio-Rad | 10031257 | 195995635 |
| PrimePCR ddPCR Gene Expression Probe Assay: GUSB, Human | Bio-Rad | 10031257 | 212851152 |
| PrimePCR ddPCR Gene Expression Probe Assay: GUSB, Human | Bio-Rad | 10031257 | 213949301 |
| PrimePCR ddPCR Expert Design Assay: EML4-ALK | Bio-Rad | 12003909 | 20160914 |
| PrimePCR ddPCR Expert Design Assay: EML4-ALK | Bio-Rad | 12003909 | 211383227 |
| Droplet Generation Oil for Probes | Bio-Rad | 186-3005 | 1065C220 |
| Droplet Generation Oil for Probes | Bio-Rad | 186-3005 | 64052953 |
| Droplet Generation Oil for Probes | Bio-Rad | 186-3005 | 64052358 |
| Automated Droplet Generation Oil for Probes (20x96) | Bio-Rad | 186-4110 | 1065C320 |
| Automated Droplet Generation Oil for Probes (20x96) | Bio-Rad | 186-4110 | 64052952 |
| Automated Droplet Generation Oil for Probes (20x96) | Bio-Rad | 186-4110 | 64064127 |
| DG8 Cartridges for QX100/QX200 Droplet Generator | Bio-Rad | 186-4008 | C000065883 |
| DG8 Cartridges for QX100/QX200 Droplet Generator | Bio-Rad | 186-4008 | C000084276 |
| DG8 Cartridges for QX100/QX200 Droplet Generator | Bio-Rad | 186-4008 | C000079928 |
| DG8 Cartridges for QX100/QX200 Droplet Generator | Bio-Rad | 186-4008 | C000084395 |
| DG8 Cartridges for QX100/QX200 Droplet Generator | Bio-Rad | 186-4008 | C000084634 |
| Droplet Generator DG8 Gasket | Bio-Rad | 186-3009 | 20160627 |
| Droplet Generator DG8 Gasket | Bio-Rad | 186-3009 | 20161107 |
| Droplet Generator DG8 Gasket | Bio-Rad | 186-3009 | 20161206 |
| Droplet Generator DG8 Gasket | Bio-Rad | 186-3009 | 20161216 |
| Droplet Generator DG8 Gasket | Bio-Rad | 186-3009 | 20170125 |
| Pipet Tips for Automated Droplet Generator | Bio-Rad | 1864120 | PR125340 |
| DG32 Cartridge for Automated Droplet Generator (10-96 well plates) | Bio-Rad | 186-4108 | 206894 |
| DG32 Cartridge for Automated Droplet Generator (10-96 well plates) | Bio-Rad | 186-4108 | 206893 |
| Pierceable Foil Heat Seal | Bio-Rad | 1814040 | 1409850 |
| Pierceable Foil Heat Seal | Bio-Rad | 1814040 | 100402 |
| Pierceable Foil Heat Seal | Bio-Rad | 1814040 | 145851 |
| Microseal 'B' seals | Bio-Rad | MSB1001 | BR00428490 |
| ddPCR Droplet Reader Oil | Bio-Rad | 186-3004 | 64039089 |
| ddPCR Droplet Reader Oil | Bio-Rad | 186-3004 | 64049253 |
| ddPCR Droplet Reader Oil | Bio-Rad | 186-3004 | 64049255 |
| ddPCR Droplet Reader Oil | Bio-Rad | 186-3004 | 64081870 |
| DNA Lo Bind Tube 0.5 mL | Eppendorf | 22431005 | E1629620 |
| DNA Lo Bind Tube 1.5 mL | Eppendorf | 22431021 | F16698K |
| DNA Lo Bind Tube 2 mL | Eppendorf | 22431048 | E160610I |
| 50 mL Conicals, Polypropylene (25) | Thermo | 339652 | G5ZF5W8118 |
| TempAssure PCR 8-Strips, Optical Caps, Natural, polypropylene (120) | USA Scientific | 1402-4700 | 16202 |
| For Rainin LTS Pipettors 0.5-20 µL tips | Pipette.com | LF-20 | 40155-642C4-642C |
| For Rainin LTS Pipettors 5-200 µL tips | Pipette.com | LF-250 | 40154-642C4-642B |
| Tips LTS 200 ul Filter 960/10 RT-L200F (10 boxes) | Rainin | 17002927 | 1635 |
| Pipet Tips, 10 ul TipOne RPT ultra low retention filter tip refill cassette, sterile | USA Scientific | 1181-3710 | F1175551-1108 |
| Pipet Tips, 10 ul TipOne RPT ultra low retention filter tip refill cassette, sterile | USA Scientific | 1181-3710 | F118054L-1720 |
| Pipet Tips, 100 ul TipOne RPT ultra low retention filter tip refill cassette, sterile (10x96) | USA Scientific | 1180-1740 | 0014961Q-2501 |
| Pipet Tips, 200 ul TipOne RPT ultra low retention filter tip refill cassette, sterile | USA Scientific | 1180-8710 | E116684P-1540 |
| Pipet Tips, 1000 ul XL TipOne RPT ultra low retention filter tip refill cassette, sterile (10x96) | USA Scientific | 1182-1730 | F118815P |
| 5 mL Standard Racked Gilson-fit Reference Tips | Scientific Specialties | 4411-00 | 14312 |
| Combitips advanced, 0.1 mL Biopur | Eppendorf | 003 008 9618 | F165414H |
| Combitips advanced, 0.2 mL Biopur | Eppendorf | 0030 089.626 | F166689J |
| Combitips advanced, 5 mL Biopur | Eppendorf | 0030.089 669 | F166054J |
| Combitips advanced, 50 mL Biopur | Eppendorf | 003.008.9693 | F166055I |
| Reagent Reservoir | VWR | 89094-680 | 141500 |
| Twin tec PCR Plate 96, semi-skirted, Clear | Eppendorf | 951020303 | E163697P |
| Twin tec PCR Plate 96, semi-skirted, Clear | Eppendorf | 951020303 | F165029I |
| Twin tec PCR Plate 96, semi-skirted, Clear | Eppendorf | 951020303 | F165028G |
| Twin tec PCR Plate 96, semi-skirted, Clear | Eppendorf | 951020303 | E163697P |
| Twin tec PCR Plate 96, semi-skirted, Green | Eppendorf | 951020346 | F166183K |
| Equipment Type | Equipment ID | ||
| Analytical Balance | EQP0125 | ||
| Cryogenic Freezer 1, -80oC | EQP0095 | ||
| Refrigerator 6.1 cu ft GP06W1AREF | EQP0139 | ||
| -20oC Freezer | EQP0140 | ||
| Beckman Coulter Microfuge 22R | EQP0025 | ||
| Beckman Coulter Microfuge 22R | EQP0124 | ||
| Thermo Scientific Hereaus Megafuge 8 | EQP0104 | ||
| Mini Centrifuge | EQP0131 | ||
| Mini Centrifuge | EQP0136 | ||
| Mini Centrifuge | EQP0134 | ||
| Mini Centrifuge | EQP0235 | ||
| Mini Centrifuge | EQP0216 | ||
| Thermo Scientific HeraTherm Incubator | EQP0105 | ||
| Pipette 0.1 - 2.5 μL | EQP0182 | ||
| Pipette 0.1 - 2.5 μL | EQP0072 | ||
| Pipette 0.1 - 2.5 μL | EQP0070 | ||
| Pipette 0.5-10 μL | EQP0218 | ||
| Pipette 0.5-10 μL | EQP0075 | ||
| Pipette 0.5-10 μL | EQP0169 | ||
| Pipette 0.5-10 μL | EQP0074 | ||
| Pipette 0.5-10 μL | EQP0147 | ||
| Pipette 2 - 20 μL | EQP0128 | ||
| Pipette 2 - 20 μL | EQP0160 | ||
| Pipette 2 - 20 μL | EQP0018 | ||
| Pipette 2 - 20 μL | EQP0146 | ||
| Pipette 10 - 100 μL | EQP0079 | ||
| Pipette 10 - 100 μL | EQP0181 | ||
| Pipette 10 - 100 μL | EQP0085 | ||
| Pipette 10 - 100 μL | EQP0077 | ||
| Pipette 20 - 200 μL | EQP0088 | ||
| Pipette 20 - 200 μL | EQP0087 | ||
| Pipette 20 - 200 μL | EQP0231 | ||
| Pipette 100 - 1000 μL | EQP0050 | ||
| Pipette 100 - 1000 μL | EQP0158 | ||
| Pipette 100 - 1000 μL | EQP0217 | ||
| Pipette 100 - 1000 μL | EQP0082 | ||
| Pipette 100 - 1000 μL | EQP0183 | ||
| Pipette 100 - 1000 μL | EQP0083 | ||
| Pipette 5 mL | EQP0153 | ||
| Timer | S/N 140623950 | ||
| Hamilton SafeAire VAV Fume Hood | EQP0206 | ||
| Biosafety Cabinet | EQP0205 | ||
| Biosafety Cabinet | EQP0204 | ||
| Qubit 3.0 | EQP0102 | ||
| Benchmark Digital Heat Block | EQP0108 | ||
| Benchmark Digital Heat Block | EQP0231 | ||
| Polaroid Z2300 Instant Print Digital Gel Camera with WiFi and 16GB SDHC memory card | EQP0111 | ||
| Electrophoresis Power Unit | EQP0113 | ||
| Electrophoresis Small Gel Box | EQP0116 | ||
| Maestro Transilluminator | EQP0118 | ||
| Microwave | EQP0215 | ||
| Multichannel 8-well Pipette 2 - 20 μL | EQP0207 | ||
| Multichannel 8-well Pipette 10 - 100 μL | EQP0090 | ||
| Rainin Multichannel 8-well Pipette 50 μL | EQP0094 | ||
| Rainin Multichannel 8-well Pipette 50 μL | EQP0161 | ||
| Rainin Multichannel 8-well Pipette 50 μL | EQP0162 | ||
| Rainin Multichannel 8-well Pipette 50 μL | EQP0163 | ||
| Vortex Genie 2 | EQP0052 | ||
| Vortex Genie 2 | EQP0007 | ||
| Vortex Genie 2 | EQP0132 | ||
| Vortex Genie 2 | EQP0137 | ||
| Vortex Genie 2 | EQP0135 | ||
| Air Clean PCR Workstation | EQP0203 | ||
| Air Clean PCR Workstation | EQP0096 | ||
| Air Clean PCR Workstation | EQP0148 | ||
| Air Clean PCR Workstation | EQP0097 | ||
| QX200 Droplet Generator | EQP0202 | ||
| QX200 Droplet Generator | EQP0121 | ||
| Automated Droplet Generator | EQP0179 | ||
| PX1 PCR Plate Sealer | EQP0123 | ||
| PX1 PCR Plate Sealer | EQP0186 | ||
| C1000 Touch Cycler w/96W FS RM | EQP0120 | ||
| S1000 Cycler w/96W FS RM | EQP0174 | ||
| S1000 Cycler w/96W FS RM | EQP0173 | ||
| T100 Thermal Cycler | EQP0180 | ||
| T100 Thermal Cycler | EQP0175 | ||
| QX200 Droplet Reader | EQP0194 | ||
| QX200 Droplet Reader | EQP0122 |
参考文献
- Ignatiadis, M., Lee, M., Jeffrey, S. S. Circulating Tumor Cells and Circulating Tumor DNA: Challenges and Opportunities on the Path to Clinical Utility. Clin Cancer Res. 21 (21), 4786-4800 (2015).
- Alix-Panabieres, C., Pantel, K. Clinical Applications of Circulating Tumor Cells and Circulating Tumor DNA as Liquid Biopsy. Cancer Discov. , (2016).
- Paxton, A. Is Molecular AP testing in sync with guidelines. CAP Today. , (2014).
- Sacher, A. G., et al. Prospective Validation of Rapid Plasma Genotyping for the Detection of EGFR and KRAS Mutations in Advanced Lung Cancer. JAMA Oncol. , (2016).
- Sozzi, G., et al. Quantification of free circulating DNA as a diagnostic marker in lung cancer. J Clin Oncol. 21 (21), 3902-3908 (2003).
- Oxnard, G. R., et al. Noninvasive detection of response and resistance in EGFR-mutant lung cancer using quantitative next-generation genotyping of cell-free plasma DNA. Clin Cancer Res. 20 (6), 1698-1705 (2014).
- Best, M. G., et al. RNA-Seq of Tumor-Educated Platelets Enables Blood-Based Pan-Cancer, Multiclass, and Molecular Pathway Cancer Diagnostics. Cancer Cell. 28 (5), 666-676 (2015).
- Rodriguez, M., et al. Different exosome cargo from plasma/bronchoalveolar lavage in non-small-cell lung cancer. Genes Chromosomes Cancer. 53 (9), 713-724 (2014).
- Kalluri, R. The biology and function of exosomes in cancer. J Clin Invest. 126 (4), 1208-1215 (2016).
- Mellert, H., et al. Development and Clinical Utility of a Blood-Based Test Service for the Rapid Identification of Actionable Mutations in Non-Small Cell Lung Carcinoma. J Mol Diagn. 19 (3), 404-416 (2017).
- Qin, J., Williams, T. L., Fernando, M. R. A novel blood collection device stabilizes cell-free RNA in blood during sample shipping and storage. BMC Res Notes. 6, 380 (2013).
- Chomczynski, P. A reagent for the single-step simultaneous isolation of RNA, DNA and proteins from cell and tissue samples. Biotechniques. 15 (3), 532-537 (1993).
- Kohno, T., et al. Beyond ALK-RET, ROS1 and other oncogene fusions in lung cancer. Transl Lung Cancer Res. 4 (2), 156-164 (2015).
- Takeuchi, K., et al. ROS1 and ALK fusions in lung cancer. Nat Med. 18 (3), 378-381 (2012).
- Rimkunas, V. M., et al. Analysis of receptor tyrosine kinase ROS1-positive tumors in non-small cell lung cancer: identification of a FIG-ROS1 fusion. Clin Cancer Res. 18 (16), 4449-4457 (2012).
- Tsuta, K., et al. RET-rearranged non-small-cell lung carcinoma: a clinicopathological and molecular analysis. Br J Cancer. 110 (6), 1571-1578 (2014).
- Forbes, S. A., et al. COSMIC: somatic cancer genetics at high-resolution. Nucleic Acids Res. 45 (1), 777-783 (2017).
- Salgia, R. Diagnostic challenges in non-small-cell lung cancer: an integrated medicine approach. Future Oncol. 11 (3), 489-500 (2015).
- Cagle, P. T., Raparia, K., Portier, B. P. Emerging Biomarkers in Personalized Therapy of Lung Cancer. Adv Exp Med Biol. 890, 25-36 (2016).
- Vogelstein, B., Kinzler, K. W. Digital PCR. Proc Natl Acad Sci U S A. 96 (16), 9236-9241 (1999).
- Oxnard, G. R., et al. Association Between Plasma Genotyping and Outcomes of Treatment With Osimertinib (AZD9291) in Advanced Non-Small-Cell Lung Cancer. J Clin Oncol. 34 (28), 3375-3382 (2016).
- Reckamp, K. L., et al. A Highly Sensitive and Quantitative Test Platform for Detection of NSCLC EGFR Mutations in Urine and Plasma. J Thorac Oncol. 11 (10), 1690-1700 (2016).
- Yanagita, M., et al. A prospective evaluation of circulating tumor cells and cell-free DNA in EGFR mutant non-small cell lung cancer patients treated with erlotinib on a phase II trial. Clin Cancer Res. , (2016).
- Abbosh, C., et al. Phylogenetic ctDNA analysis depicts early-stage lung cancer evolution. Nature. 545 (7655), 446-451 (2017).
- Chomczynski, P. A reagent for the single-step simultaneous isolation of RNA, DNA and proteins from cell and tissue samples. BioTechniques. 15 (3), 532-534 (1993).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。