Method Article
负染色电子显微镜方法的变化: 处理具有挑战性的系统的工具
Erratum Notice
摘要
负染色 EM 是一种强大的可视化大分子结构的技术, 但不同的染色技术可以产生不同的结果, 在样本依赖的方式。这里详细描述了几种负染色方法, 为解决具有挑战性的系统的可视化提供了一个初步的工作流程。
摘要
阴性染色电子显微镜 (EM) 允许相对简单和快速观察的大分子和大分子化合物, 通过使用对比增强染色试剂。尽管在分辨率上的限制最大为 18-20 Å, 阴性染色 em 是有用的各种生物问题, 也提供了一个快速的方法来评估样品的低温电子显微镜 (冷冻 em)。负染色工作流是直接的方法;样品被吸附在基材上, 然后涂抹一个污点, 涂上污渍, 然后晒干, 产生一层薄薄的电子致密染色, 在其中嵌入微粒。然而, 在不同的染色条件下, 单个样品的表现方式会有明显不同。这导致了大量的基质制备技术、阴性染色试剂、网格洗涤和印迹技术的发展。为每个样本确定最合适的技术必须在个案的基础上进行, 技术人员必须有机会获得各种不同的技术, 以达到最高质量的阴性染色结果。提供了两种不同基质制备方法的详细协议和三种不同的印迹技术, 并举例说明了根据所用方法显示出明显不同结果的示例。此外, 还介绍了一些常用的阴性染色试剂的制备, 以及两种新型的镧系基斑, 并讨论了各自的用途。
引言
尽管最近注意到了由于低温电子显微镜1 (冷冻 em) 的重大进展而导致的分辨率革命, 但负染色仍然是一种强大的技术, 也是电子 microscopists 工具箱的重要组成部分。在优化冷冻网格条件2之前, 阴性染色仍然是快速评估样品的最佳方法。负染色样品网格制备的高对比度和速度使其非常适合于评估样品纯度、浓度、异质性和构象灵活性3。许多生物信息结构由阴性污点重建导致, 尽管技术的决议被限制到 ~ 18 Å决议4,5,6, 并且一些样品产生更好的结果在污点比冷冻 EM 为各种各样的原因7。
在负染色 em, 感兴趣的粒子被吸附到 em 栅格的表面, 并由一个非晶的电子致密染色化合物的基质包围。在背景和感兴趣的粒子之间产生了较高的相对对比度, 粒子的电子密度小于周围的着色剂8。粒子由于其低电子散射功率相对于稠密的周围斑点而呈现为光区, 从而使电子更加散射, 并显得较暗。粒子的结构特征可以从对结果图像的详细检查中推断出来, 因为染色会穿透到任何缝隙中, 产生不规则的对比度细节9。
负染色的过程开始于准备一个支撑基板上的样品颗粒被捕获, 并支持层干染色。最常用的支撑基板是一层无定形的碳, 有时由一层薄薄的聚乙烯醇 (如Formvar) 或硝化纤维素 (如棉) 聚合物支撑。这些基板可以购买商业或准备在内部使用下面所述的协议。
在支撑基板准备好后, 可以应用样品, 多余的溶液会被涂抹掉。样品应悬挂在适当的缓冲液中进行阴性染色。最好避免使用磷酸盐缓冲剂和高盐浓度, 这会引起晶体沉淀, 从而使标本模糊不清。减少剂, 洗涤剂, 蔗糖, 甘油和高浓度的核苷酸也应避免, 因为它们也影响着色质量4。当缓冲成分不能改变时, 用水或在吸附后再用更合适的缓冲液对 EM 网格表面进行洗涤, 可以减少与缓冲区相关的工件的形成, 并普遍改善染色背景。如果怀疑有缓冲区工件, 则可以对仅限缓冲区的网格进行着色, 以确定缓冲区组件是否是所观察工件的来源。
在样品被吸附后, 涂抹和洗涤, 如有必要, 使用染色试剂。各种试剂被发现是有效的阴性污渍 (表 1), 但必须选择污渍以适合样品。一个 "光环" 的污点形成周围的粒子由于染色分子的位移的疏水区域的蛋白质和斥力的电荷基团。因此, 必须选择染色, 使任何潜在的带电基团在蛋白质上的质子状态与工作 pH 值上的污点相同。对蛋白质表面的相反电荷可以促进阳性染色效果, 虽然在它自己的权利10中, 有用的技术并不在本文的范围之内。最常用的阴性染色试剂是醋酸铀和铀甲酸酯。这些污渍有一个相对细粒度 (4-5 Å)9 , 并提供更高的分辨率图像的其他污渍, 如磷-钨 (8-9 Å粒度)9,11, 钼酸铵11, 和一些基于稀土的污点12。醋酸铀和甲酸酯也起到固定剂的作用, 在毫秒的时间尺度上保存许多蛋白质-蛋白质的相互影响13, 尽管染色的低 pH 值及其在生理 pH 值下沉淀的倾向可能对某些样品有害,14.尽管他们的效用, 铀盐也提出了后勤方面的挑战, 因为它们既是有毒和轻度放射性, 这可能需要特殊处理, 储存, 和处置要求, 这导致一些用户寻求非放射性的替代品。
有大量的方法描述的基质制备, 样品的应用, 和染色的 EM 网格。最适合使用的方法是样本依赖, 在处理新系统时很难确定。本手稿描述了两种基质制备方法和三印迹方法;侧吸, 弹5, 快速冲洗15。侧印迹是最简单的方法描述。该方法和快速冲洗法均较难实现, 但在固定前将样品的接触时间限制在支撑膜上, 并已显示为某些样品5改善了着色伪迹的形成。这份手稿的目的是提供一个初步的工作流程, 以解决的可视化挑战系统的负染色 EM。
研究方案
1. EM 网格的制备
- 碳片法
- 准备一个新劈开的云母片。
- 在云母片的一角轻轻地插入一个精密注射器或刀片, 在两层之间的几毫米。将刀具尽可能靠近纸张的垂直中心, 以产生两片近似相等的厚度。
- 小心地把云母片的两半分开。这样做可以通过眼睛, 或在解剖显微镜下。
- 切下每个新劈开的云母片的一个角落。当板料在真空释放过程中在碳蒸发器中翻过的情况下, 可以识别纸张的碳涂层侧。
- 将劈开的云母片放在一个碳蒸发器的燃烧室内, 并将新切割的表面朝上。
- 确保碳蒸发器是正确设置的碳电极适当准备。
注: 碳棒的制备方法将因碳蒸发器的规格而异。一个仪器的协议是如下直到步1.1.5。- 削尖一个碳棒与一个卷笔刀有一个尖锐的尖端, 然后擦亮它与纸巾, 以消除任何粗糙的毛刺。
- 使用细砂纸铺平了第二杆的结束, 并再次擦亮它光滑的纸巾。
- 根据制造商的指示将两个碳棒放入蒸发器。确保第一杆上的锐端与第二杆的扁平面牢固接触。
- 将一小块清洁, 干燥的滤纸部分下的云母, 如果碳厚度将是视觉测量。或者, 在云母的旁边放一个白色的磨砂显微镜, 用一小块真空油脂来测量碳的厚度。
- 根据制造商的指示, 在云母上沉积碳。
- 向下抽真空, 然后等待 10-5毫巴。将电极的电压设置为 4.0 v (根据碳棒源的不同, 可能需要5伏)。
- 通过电极运行大约3.5 秒的多个短脉冲, 在云母表面沉积 1-2 nm 厚的碳蒸发。
注: 当电流被应用到碳棒上时, 它会发出红光, 然后呈白色。不要盯着明亮的光线, 因为这会损害你的眼睛。 - 允许碳沉积在云母上, 直到达到所需的厚度, 由碳蒸发器的厚度测量仪或通过目视观察的碳沉积在滤纸或显微镜幻灯片上。确保最终的碳层厚度为5-10 纳米。
- 如果测量的碳厚度是可视化的, 比较显微镜滑块上涂有真空油脂的表面的磨砂部分, 它会随着更多的碳沉积而变暗。
注: 使用该方法时, 没有定量测定碳厚度的方法。
- 如果测量的碳厚度是可视化的, 比较显微镜滑块上涂有真空油脂的表面的磨砂部分, 它会随着更多的碳沉积而变暗。
- 排出真空室, 从碳蒸发器中除去碳涂层云母。
注: 碳包云母可以在一夜之间解决, 然后再进行后续步骤 - 使用两个水容器中的一个将碳膜漂浮在 EM 网格上: 底部有一个排水阀的容器, 这样可以排出水, 将碳层放到等待的栅格上, 或将网格设置在水下的升降平台上。表面, 在水的表面能随后上升网格到碳影片。
- 用超纯蒸馏水填充容器, 使水的表面从顶部大约5毫米。通过在表面上拖动一张或两个透镜组织来清除水的表面, 以去除漂浮的微粒。
- 放置一块干净的不锈钢网 (1 英寸2.5 英寸是一个合适的大小) 在水面下。
- 使用一对精致的镊子, 铺设干净, 干燥的 EM 网面 (根据制造商的描述) 对不锈钢网。尽可能紧密地将网格打包在一起, 但不允许它们重叠。
- 一旦网格被安排, 牢牢地抓住碳涂层云母板在一对镊子或电影开发钳。
- 将云母片引入水中。确保这是在一个非常浅的角度 (〜10度) 完成。
注意: 云母应冲破水面并潜入水中, 而碳膜应与云母分离, 浮在水面上。此步骤不应直接在网格上执行, 以避免损坏和/或污染。- 为了尽量减少碳膜的可能性, 将不会与云母片分离, 在云母片的边缘用剃刀刀片或用小剪刀切一个角, 然后把它引入水中。
- 一旦碳膜分离, 除去云母片或让它落在容器的底部。
- 使用细尖的镊子, 应用非常温和的压力和缓慢的运动指导的碳膜上方的网格。
- 根据所使用的仪器类型, 将碳片与栅格表面接触, 要么是缓慢排水, 要么提高提升环。
- 小心地提起不锈钢网 (现在与碳涂层网格) 从设备和灯芯远离一些多余的水使用一块滤纸。确保这是通过触摸过滤纸到非常边缘的钢网, 但不来接触的网格或碳膜。
- 将格子网格放置在含有干燥滤纸的培养皿中, 使其完全干燥。
注意: 这是最好的影响, 干燥过夜在室温下, 但该步骤可以加快通过把网格在一个烤箱约60° c。
- 准备一个新劈开的云母片。
- 浮动和涂层 (直接碳沉积)。此方法已在前面的16中详细介绍
- 完全填补一个干净的大玻璃碗的边缘与蒸馏水, 所以一个半月板的顶部形式。
- 应用一滴棉溶液 (硝化纤维素在乙酸戊酯) 到水的表面使用一个干净的巴斯德吸管, 使液滴扩散和干燥完全。一旦干燥一层薄薄的棉漂浮在水面上将是可见的。
- 用牙签轻轻移除棉层, 去除水面上的灰尘或其他污染。
- 应用第二个棉滴到水中, 并允许它摊开和干燥2-3 分钟。
注意: 重复步骤 1.2. 3-1. 2.4, 直到获得棉的平整和无皱纹的板材。 - 使用一对精致的镊子将 EM 栅格朝下 (根据制造商的描述) 放在浮动的棉板上。将网格紧密地组合在一个六边形数组中, 但不允许它们重叠。
注意: 如果网格放错位置或倒置, 通常最好是将其放置到位, 而不是在试图移动时损坏棉表。 - 一旦所有的网格被放置, 轻轻地把一张滤纸放在它们上面。通过毛细管作用使纸张变得饱和。
注: 任何尺寸或厚度的滤纸是适当的, 如果它完全覆盖的网格。 - 使用牙签去除任何延伸到滤纸之外的棉膜。
- 将滤纸夹在边缘, 并将其从水面剥离。
注: 网格应保持在纸张上。 - 将纸张平放在培养皿中棉, 使其完全干燥。
- 将滤纸与网格放在一个碳蒸发器的燃烧室内, 并在1.1.2 中详细介绍碳电极。
- 按照碳蒸发过程所描述的碳片法在
- 允许几秒钟之间的脉冲, 以避免过热和损坏的硝化纤维素板。
注: 如果需要的聚合物层可以删除后, 网格已被碳涂层, 虽然这一步是很少必要的。将网格碳侧放在一张滤纸上, 在纸上放几滴丙酮, 而不是在网格上。允许丙酮在网格下扩散, 溶解和吸收聚合物层。
2. 阴性染色试剂的制备
-
乙酸铀酯的制备
- 把一小卷的超纯水煮沸, 让它煮沸10分钟, 彻底德加。允许它稍微冷却, 然后用它溶化铀乙酸酯 (UA) 在 1-2% (w/v)。
注: 在通风柜中执行此过程, 并使用适当的个人防护设备。 - 解决方案冷却后, 通过0.2 µm 注射器过滤器或滤纸进行过滤。
- 存储的 UA 保护免受光和在4˚C。该解决方案是稳定的, 长达1年。
- 把一小卷的超纯水煮沸, 让它煮沸10分钟, 彻底德加。允许它稍微冷却, 然后用它溶化铀乙酸酯 (UA) 在 1-2% (w/v)。
-
从粉末中制备甲酸铀酯。此方法已在前面的8中详细介绍
- 将20毫克铀甲酸 (UF) 粉末溶于2毫升的煮沸脱超纯水 (如步骤 2.1.1) 中搅拌。
- 在继续搅拌时, 加入8µL 5 米的氢氧化钠, 溶液应改为较深的黄色, 但不应形成沉淀。
- 通过0.2 µm 注射器过滤器过滤解决方案。
- 存储防光保护的 UF 污点。如果发现有沉淀物或褐色的变色, 应丢弃污渍。该解决方案只稳定1-2 天。
-
醋酸铀铀甲酸酯的制备
- 通过加入100µL 1 M 氢氧化钠, 沉淀1毫升的 1% (w/v) UA 染色。
- 在台式离心机中, 以最大速度离心2分钟的混合物。
- 在100µL 的 5% (v/v) 甲酸中, 用剧烈的涡流去除任何上清液和溶解沉淀。
- 用900µL 超纯水将1毫升的最终体积稀释到 0.5% (v/v) 甲酸中产生 UF 染色。
- 存储防光保护的 UF 污点。如果观察到任何沉淀物或褐色的变色, 请丢弃污渍。
-
其他染色试剂的制备
-
醋酸镧的制备
- 将乙酸钐 (SmAc)、乙酸钆 (GdAc)、乙酸铥 (麦迪) 或醋酸铒 (ErAc) 在超纯水中溶解 1-2% (w/v)。
注: 如果样品在使用这些污渍时呈阳性染色或不粘附在网格上, 则可酸化, 可达 0.5% (v/v) 甲酸。阳性染色结果的样品显示为一个黑暗的对象包围的白色光环。不遵守网格将导致比预期的在网格上被观察到的分子少。
- 将乙酸钐 (SmAc)、乙酸钆 (GdAc)、乙酸铥 (麦迪) 或醋酸铒 (ErAc) 在超纯水中溶解 1-2% (w/v)。
-
钼酸铵和钨钠的制备
- 在超纯水中溶解 1-3% (w/v) 的污渍。如果需要, 使用5米氢氧化钠调整 pH 值为7.0。
-
醋酸镧的制备
3. 将样品吸附到碳基材和染色
-
用亲水性法制备样品应用网格表面
- 将栅格朝上放在辉光放电单元的显微镜滑轨上。
- 将网格至少三十年代在10毫安。
注: 辉光放电的精确方法将取决于所使用的特定设备的规格。 - 另外, 这可能是通过紫外线照射10分钟使用台式紫外线灯4。
-
侧印迹方法。此方法已在前面的8中详细介绍
- 用一对负压钳抓住网格的边缘, 并在支撑面上应用3-5 µL 样品。
- 允许样品吸附到网格表面为十年代至1分钟. 对单个样品进行优化, 必须对所吸收的时间进行优选。
- 触摸网格的边缘, 以一张滤纸, 并允许毛细管行动, 以摆脱液体。
- 可选: 清洗网格。在一张实验室胶片上放置50µL 滴超纯水或适当的挥发性缓冲液。轻轻地触碰网格的碳表面到下落并且在网格表面上掀起一小滴。触摸网格的边缘, 以一张滤纸, 并允许毛细管行动, 以摆脱液体。
- 重复此洗涤步骤, 按需要多次。
- 在一张实验室胶片上放置两50µL 滴染色试剂。
- 轻轻地触碰网格的碳表面到下落并且在网格的顶面上掀起一小滴。
注意: 如果污点迁移到网格的背面, 则应丢弃网格。 - 触摸网格的边缘, 以一张滤纸, 并允许毛细管行动, 以提取液体。执行这一染色步骤两次。
- 允许栅格在白炽灯下风干或干燥。
-
弹法
- 用一对负压钳抓住网格的边缘, 并在支撑面上应用3-5 µL 样品。
- 一只手握住镊子, 使网格在大约45°的角度朝外倾斜, 迅速弹起那只手的手腕, 以 "轻拂" 网格顶部的大部分水滴。
- 可选: 使用玻璃巴斯德吸管应用一滴洗涤液到支撑面和 "轻拍" 如在3.2.2。必要时重复。
- 使用玻璃巴斯德吸管应用一滴染色试剂到支撑面和 "轻拍" 如在3.2.2。重复1-3 次依赖于染色深度所需的可视化标本。
注意: 这不是唯一的因素, 最终染色深度的属性 (见讨论)。 - 通过触摸一块滤纸的撕裂边缘到网格的边缘来去除多余的污渍。
- 允许栅格在白炽灯下风干或干燥。
-
快速冲洗法
- 绘制30-70 µL 的污点 (通常使用 1% UA) 到200µL 吸管的尖端, 打开音量刻度盘, 绘制5µL 的空气, 然后绘制洗涤/混合试剂 (5-30 µL), 如果需要, 其次是一个小的空气间隙, 然后绘制5µL 的样品。
- 用一对负压钳夹住网格的边缘, 握住镊子, 使网格在大约45°的角度向研究人员倾斜, 将吸管尖端的整个内容从碳涂层的 EM 栅格上弹出。
- 通过触摸一块滤纸的撕裂边缘到网格的边缘来去除多余的污渍。
- 允许栅格在白炽灯下风干或干燥。
注: 对于所有方法, 可取的做法是滑动的一张滤纸的撕裂边缘沿钳, 直到它到达的网格, 因为这消除了解决方案夹在钳的两侧, 这可以拉干格到钳颌骨, 一旦他们 打开.在镊子的网格也可以放在油烟罩的边缘晾干。恒定的气流可以帮助产生更均匀的染色。
结果
所有的染色试剂在一定程度上都进行了阴性染色, 超滤产生的样品具有最大的对比度和最尖锐、最细致的颗粒。对于深入嵌入的示例 (图 1), 基于镧系的 ErAc 和麦迪产生的质量的负面染色, 由染色粒子的明显对比度和锐度判断, 与麦迪产生更清晰, 更清晰的图像比 ErAc。虽然大粒度的麦迪变得明显的高倍, 当烟草花叶病毒 (TMV) 颗粒染色1% 麦迪的〜23Å重复的 TMV 粒子17仍然是清晰可见的眼睛和作为一个经向层线在原始图像的傅立叶变换。没有任何其他的镧系染色测试, ErAc, SmAc, 或 GdAc, 能够解决这一特性。类平均值是通过从 TMV 粒子中提取重叠段来产生的, 螺旋重复是可见的。然后, 使用 RELION18对提取的段进行对齐和分类, 以更好地显示周期性特征 (图 2)。
一些样品对染色方法特别敏感, 如肌肉衍生的 C 蛋白。C-蛋白质, 由一个灵活的 Ig 和 Fn 状的域组成, 产生显着不同的图像由负染色 EM 依赖于染色方法 (图 3)。在使用侧印迹法时, 可观察到折叠环形结构, 而当被快速冲洗或轻拂法染色时, C 蛋白被观察为一系列类似于串珠的域。
| 试剂 | 浓度 | ph | 类型 |
| 钼酸铵 | 1-2% | 5–7 | 阴 |
| 醋酸铒 (ErAc) | 1–2% | 6 | 阳离子 |
| 醋酸钆 (GdAc) | 1–2% | 6 | 阳离子 |
| 钨酸甲胺 | 2% | 6–7 | 阴 |
| 乙酸钐 (SmAC) | 1% | 6 | 阳离子 |
| silicotungstate 钠 | 1–5% | 5–8 | 阴 |
| 钨钠 | 1-3% | 5–8 | 阴 |
| 乙酸铥 (麦迪) | 1–2% | 6 | 阳离子 |
| 醋酸铀 (UA) | 1–3% | 3–4 | 阳离子 |
| 铀甲酸酯 (UF) | 0.75 –1% | 3–4 | 阳离子 |
表 1: 一些常见的阴性染色试剂。

图 1: 烟草花叶病毒染色的各种负染色试剂的示例显微(A) 1% UF (B) 2.5% 麦迪(C) 2.5% ErAc。(D) 1% UA (E) 2.5% GdAc 和(F) 2.5% SmAc。刻度线为 100 nm。具有代表性的图像从多个复制与多个区域映像每个复制。请单击此处查看此图的较大版本.

图 2: 用醋酸铥染色烟草花叶病毒(a)高放大面积从照片的 TMV 染色的1% 麦迪。缩放条是 20 nm。(B)提取的 TMV 段的类平均值。(C)在面板中的图像的傅立叶变换显示层线反射在 ~ 23 Å.请单击此处查看此图的较大版本.
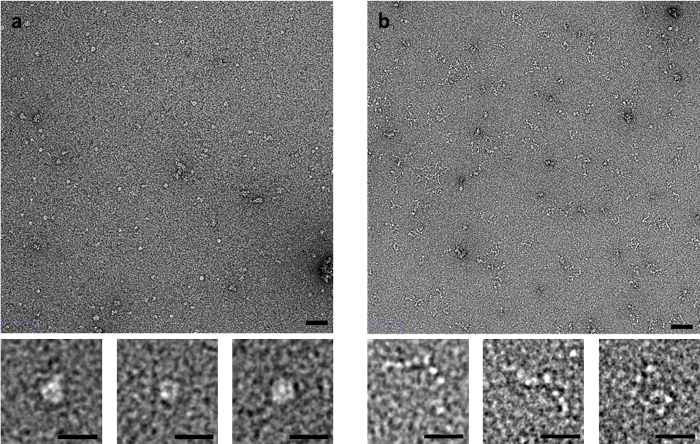
图 3: 印迹法对 c-蛋白构象的影响(A)使用侧印迹法和(B)弹法染有 UA 的 c-蛋白。上部板标尺是50毫微米, 下面板标尺是20毫微米。具有代表性的图像从多个复制与多个区域映像每个复制。请单击此处查看此图的较大版本.
讨论
这份手稿描述了多种方法的阴性染色样品的电子显微镜使用各种染色试剂, 包括两个新的镧系试剂 (麦迪和 ErAc)。阴性染色过程的许多步骤, 必须优化的个别样品, 包括选择的污渍, 必要的洗涤量, 如果有的话, 和印迹技术。因此, 这份手稿为 microscopists 开发自己的工作流程以解决具有挑战性的系统的负染色提供了基础。
污点的选择是高度样品依赖性。对低 pH 值特别敏感的样品可能会被 UA 和/或 UF 降解, 尽管这些污渍的定影特性19。在这些情况下, 镧系的污渍, 如麦迪或 ErAc 可能更合适, 虽然总 pH 的准备必须保持低于等电点的样品蛋白质, 以帮助防止阳性染色。这可以通过酸化污点与乙酸如果需要完成。特别是低 pH 敏感样品, 阴离子钨酸盐或钼酸渍可能更有效。虽然这些污渍已被发现诱导形成的工件在某些情况下, 如形成叠的脂蛋白样本20。再次, 染色的 pH 值可能需要调整, 这一次到上面的等电点的样品, 以防止阳性染色。
如果保持标本的缓冲液中有高盐或磷酸盐成分, 则在染色前清洗样品是必要的。在许多情况下, 清洗可以用超纯水进行, 但是对于更敏感的样品, 当单独暴露在水中可能会降低或发生结构变化时, 洗涤可能需要使用低离子强度的挥发性缓冲8进行。即使在严格控制的条件下, 洗涤也会导致在碳表面21上进行一些结构重排。
在样品吸附、印迹和染色的条件下, 网格的制备方法也会对观察到的现象产生显著影响。最适当的方法因而, 再, 高度样品依赖。例如, C 蛋白被观察作为一个球状环状结构, 在侧印迹染色后, 但这似乎是染色过程的一个伪迹, 当网格是用弹法 (或快速冲洗法) 准备的时 (图3).在快速冲洗方法中, 样品在固定前与碳支撑面相互作用的时间最小为15。样本在固定前也经历了从渐退半月板上吸出的少量力。这意味着, 在碳膜上或通过毛细管作用延长吸收时间后, 试样中的结构改变将会最小化。快速冲洗法也可用于试样的时间分辨分析。该样品可以与一个配体或添加剂混合在一个固定的时间内, 在应用到一个网格或只是短暂地在网格表面之前, 确定在毫秒内。
提供特定标本的最佳图像所需的染色深度再次是样本依赖2。如果污渍太浅, 分子可以被电子束破坏, 但如果污渍太厚结构特征可以丢失。染色深度受多种因素的影响, 如网格表面的亲水性、碳层的均匀度、网格的着色量、着色前的时间与网格的接触长度、印迹的范围和时间。kes 的网格完全干燥。网格将永远不会有一个均匀分布的污点横跨其整个, 因此, 适合成像的网格区域需要仔细选择。事实上, 即使在相同的条件下, 网格的质量也经常变化。一个很好的例子, 如何变化的染色深度影响的外观分子和适当的染色深度成像是由伯吉斯et al5.
尽管阴性染色是一个非常多才多艺, 快速, 简单的方法, 并不是所有的生物标本都可以通过这种方法来可视化。易碎的组件可以在 EM 网格22上的吸附、染色或烘干时折叠或拆卸。阴性染色也会导致分子的扁平化, 并诱导分子在碳支持膜上的首选取向7。
阴性染色是一个有价值的工具, 评估标本在自己的权利, 也在冷冻 EM 分析之前, 但许多物理力量的样品遇到过程中不太了解。因此, 最佳的使用方法是高样本依赖, 必须由试验和错误来确定, 而不是按照固定的协议来讲授。
披露声明
作者声明没有竞争的金融利益。
致谢
我们非常感谢彼得骑士对手稿进行有益的讨论和评论。我们要感谢尼尔 Ranson 和斯蒂芬明奇实验室的所有成员和 Astbury Biostructure 实验室的工作人员进行有益的讨论。这项工作由欧洲研究理事会 (FP7/2007-2013)/紧急救济协调员赠款协议322408资助。使用英国心脏基金会 (压 PG/13/83/30485) 提供的资源生产 C 蛋白。我们还感谢惠康信托基金支持电子显微镜在利兹 (090932/z/09/z 和 094232/z/10/z)。CS 是由惠康信托基金联合会赠款。
材料
| Name | Company | Catalog Number | Comments |
| 200 mesh copper EM grids | Sigma-Aldrich | G4776-1VL | Other materials and/or mesh sizes can also be used |
| Ammonium Molybdate | Sigma-Aldrich | 277908 | |
| Carbon evaporator | Ted Pella Inc. | 9620 | Cressington 208 or equivalent |
| Collodion solution 2% in amyl acetate | Sigma-Aldrich | 9817 | |
| Dumont #5 negative pressure tweezers | World Precision Instruments | 501202 | Or other tweezers as preferred |
| Erbium Acetate | Sigma-Aldrich | 325570 | |
| Gadolinium Acetate | Sigma-Aldrich | 325678 | |
| Mica Sheets. 75x25x0.15mm. | AGAR Scientific | AGG250-1 | |
| Microscope slides, white frosted | Fisher Scientific | 12607976 | Or equivalent |
| Parafilm | Fisher Scientific | 10018130 | Or equivalent |
| Pasteur pipette (glass) | Fisher Scientific | 10343663 | Or equivalent |
| Razor blade | Fisher Scientific | 11904325 | Or equivalent |
| Sandpaper | Hardware store | Wet and dry sandpaper with grit finer that 200 (600 suggested) | |
| Samarium Acetate | Sigma-Aldrich | 325872 | |
| Sodium Hydroxide | Sigma-Aldrich | 1.06462 | |
| Sodium Phosphotungstate | Sigma-Aldrich | P6395 | |
| Stainless Steel Mesh, 150x150 mm (cut to size). | AGAR Scientific | AGG252 | |
| Thulium Acetate | Sigma-Aldrich | 367702 | |
| Two Step Carbon Rod Sharper, for 1/4" rods | Ted Pella Inc. | 57-10 | Or equivalent for carbon evaporator used |
| Ultra pure water | |||
| Uranyl Acetate | Electron Microscopy Sciences | 22400 | |
| Uranyl Formate | Electron Microscopy Sciences | 22450 | |
| Vacuum grease | Fisher Scientific | 12719406 | Or equivalent |
| Whatman #1 Filter paper. | Fisher Scientific | 1001 090 | Or equivalent |
| Whatman #40 filter paper | Fisher Scientific | 10674122 | Or equivalent |
参考文献
- Merk, A., et al. Breaking Cryo-EM Resolution Barriers to Facilitate Drug Discovery. Cell. 165 (7), 1698-1707 (2016).
- De Carlo, S., Harris, J. R. Negative staining and cryo-negative staining of macromolecules and viruses for TEM. Micron. 42 (2), 117-131 (2011).
- Thompson, R. F., Walker, M., Siebert, C. A., Muench, S. P., Ranson, N. A. An introduction to sample preparation and imaging by cryo-electron microscopy for structural biology. Methods. 100, 3-15 (2016).
- Ha, J. Y., et al. Molecular architecture of the complete COG tethering complex. Nat Struct Mol Biol. 23 (8), 758-760 (2016).
- Burgess, S. A., Walker, M. L., Thirumurugan, K., Trinick, J., Knight, P. J. Use of negative stain and single-particle image processing to explore dynamic properties of flexible macromolecules. J Struct Biol. 147 (3), 247-258 (2004).
- Fabre, L., Bao, H., Innes, J., Duong, F., Rouiller, I. Negative-stain single particle EM of the maltose transporter in nanodiscs reveals asymmetric closure of MalK2 and catalytic roles of ATP, MalE and maltose. J Biol Chem. , (2017).
- Zhang, L., et al. An optimized negative-staining protocol of electron microscopy for apoE4 POPC lipoprotein. J Lipid Res. 51 (5), 1228-1236 (2010).
- Ohi, M., Li, Y., Cheng, Y., Walz, T. Negative Staining and Image Classification - Powerful Tools in Modern Electron Microscopy. Biol Proced Online. 6 (1), 23-34 (2004).
- Haschemeyer, R. H., Myers, R. J. . Negative Staining in Principles and Techniques of Electron Microscopy. 2, 101-147 (1972).
- Massover, W. H. Positive staining of protein molecules for electron microscopy: polyiodination of the apoferritin shell in ferritin. Ultramicroscopy. 52, 383-387 (1993).
- Harris, J. R., Bhella, D., Adrian, M. Recent Developments in Negative Staining for Transmission Electron Microscopy. Microsc Microanal. 20, 17-21 (2006).
- Hosogi, N., Nishioka, H., Nakakoshi, M. Evaluation of lanthanide salts as alternative stains to uranyl acetate. Microscopy (Oxf). 64 (6), 429-435 (2015).
- Zhao, F., Craig, R. Capturing time-resolved changes in molecular structure by negative staining. J Struct Biol. 141, 43-52 (2003).
- Cao, B., Xu, H., Mao, C. Transmission electron microscopy as a tool to image bioinorganic nanohybrids: the case of phage-gold nanocomposites. Microsc Res Tech. 74 (7), 627-635 (2011).
- Imai, H., et al. Direct observation shows superposition and large scale flexibility within cytoplasmic dynein motors moving along microtubules. Nat Commun. 6, 8179 (2015).
- Booth, D. S., Avila-Sakar, A., Cheng, Y. Visualizing proteins and macromolecular complexes by negative stain EM: from grid preparation to image acquisition. J Vis Exp. (58), (2011).
- Kendall, A., McDonald, M., Stubbs, G. Precise determination of the helical repeat of tobacco mosaic virus. Virology. 369 (1), 226-227 (2007).
- Scheres, S. H. A Bayesian view on cryo-EM structure determination. J. Mol. Bio. 415 (2), 406-418 (2012).
- Bremer, A., Henn, C., Engel, A., Baumeister, W., Aebi, U. Has negative staining still a place in biomacromolecular electron microscopy?. Ultramicroscopy. 46, 85-111 (1992).
- Garewal, M., Zhang, L., Ren, G., Kleinschmidt, J. . Lipid-Protein Interactions. Methods Mol Biol (Methods and Protocols). 974, 111-118 (2012).
- Walker, M. L., et al. Two-headed binding of a processive myosin to F-actin. Nature. 405 (6788), 804-807 (2000).
- Orlova, E. V., Saibil, H. R. Structural Analysis of Macromolecular Assemblies by Electron Microscopy. Chem Rev. 111 (12), 7710-7748 (2011).
Erratum
Formal Correction: Erratum: Variations on Negative Stain Electron Microscopy Methods: Tools for Tackling Challenging Systems
Posted by JoVE Editors on 1/30/2020. Citeable Link.
An erratum was issued for: Variations on Negative Stain Electron Microscopy Methods: Tools for Tackling Challenging Systems. An author name was updated.
One of the authors' names was corrected from:
Matthew G. Iadaza
to:
Matthew G. Iadanza
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。