需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
稳定蝇及其他 Muscoid 双翅目的实验室饲养
摘要
提出了一种饲养稳定蝇 (Stomoxys calcitrans) 的方法。该程序使用当地现有的材料, 为膳食成分, 设备和用品。
摘要
稳定的苍蝇, Stomoxys calcitrans, 是家畜, 人类, 同伴动物和野生动物的严重害虫。在过去的20年中, 农艺做法的变化导致几个国家的稳定蝇的严重暴发。这些暴发扰乱了牲畜生产和人类的娱乐活动, 导致公众要求为这种害虫增加研究和管理工作。提出了一种简单、廉价的用于实验室研究的稳定蝇的饲养方法。该程序使用当地现有的饮食成分, 设备和用品。该程序可适用于饲养其他 muscoid 苍蝇, 包括面部苍蝇 (蝇 autumnalis), 喇叭飞行 (Haematobia irritans), 和房子苍蝇 (家蝇)。该程序生产稳定的飞行蛹平均12.5 毫克和35% 鸡蛋的成年生存。大约3000只苍蝇在每个平底锅被生产。
引言
稳定的苍蝇, Stomoxys calcitrans (L), 是 hematophagous 苍蝇, 其痛苦的叮咬扰乱牲畜的放牧行为, 造成痛苦和痛苦的同伴动物和扰乱人类娱乐活动的世界各地。不成熟的稳定蝇生长在发酵的植物物质, 经常被动物粪便污染。改变农艺做法和农作物造成了作物残留物的稳定蝇的严重暴发, 澳大利亚的蔬菜1, 巴西的甘蔗2, 哥斯达黎加的菠萝3。虽然每只动物的14只稳定苍蝇被认为是经济阈值4, 但在最近的疫情中, 每只动物的2000多只苍蝇的观测结果已经达到5。这种侵扰程度将主机生产率降低到接近零, 并可能导致死亡率6。由于 agronomically 相关的暴发, 稳定的苍蝇正在接受新的兴趣和对实验室殖民地的需求急剧增加。
对于所有 holometamorphic 昆虫, 稳定的苍蝇在未成熟或幼体阶段获得生长所需的所有养分。因此, 饲养系统的一个重要组成部分是幼虫饮食或基质。稳定的蝇幼虫已经观察到在田间7的广泛基质中发展, 它们依赖于基底8,9的微生物群落。天然幼虫基质主要由分解或发酵经常被含氮废物污染的营养物质组成。
在实验室饲养中, 稳定的蝇幼虫基质通常由营养物质和添加的氮源组成。大量的材料已用于稳定的飞行幼虫饮食。第一种幼虫饮食模仿天然基质, 包括发酵燕麦秸秆和马或牛粪10,11。碳水化合物来源包括麦麸12、13、14、苜蓿膳食12、13、14和由化学专业开发的商业配方。制造商协会 (CSMA, 33% 麦麸, 27% 苜蓿膳食, 40% 啤酒酵母颗粒)13,14,15,16。氮源包括酵母悬浮液12、鱼粉和碳酸氢铵17。惰性膨胀材料通常包括燕麦壳12, 蔗渣13, 蛭石16, 木片13,18和颗粒花生壳14。
实验室饲养的一个主要目标是生产一种与 "野生型" 相似的产品, 以便实验室实验能产生反映田间人群的结果。这就要求最大限度地减少育种和选择, 以维持遗传多样性, 并使营养资源与实地的情况相媲美。次要目标是尽量减少劳动和开支。减少开支的一个主要组成部分是利用当地现有的饮食成分。为实现这些目标, 研制了稳定的飞养系统。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 收集卵子 (图 1)
- 准备好怂恿杯, 把布的一端放在500毫升的烧杯里, 里面装满了温暖的 (~ 40 °c) 的水。重叠的杯子的两侧, 并修复与橡胶带。将布料松散的一端折回杯顶。
- 将怂恿杯放在8–10天的老苍蝇笼中 2 h. 妊娠雌性稳定的苍蝇会在布料上排卵。
- 从笼中取出怂恿杯, 将怂恿布上的鸡蛋冲洗成一个小平底锅, 用挤压洗瓶。
2. 准备幼虫饲养盘
-
准备培养基 (1 饲养盘的数量)
- 将麦麸 (500 克)、木屑 (200 克) 和鱼粉 (115 克) 组合在10升塑料碟盘中, 混合均匀。
- 加入碳酸氢铵 (50 克) 到水 (~ 25 °c, 1600 毫升) 和混合, 直到溶解。
- 添加水溶液的干燥配料和混合, 以确保没有 unwetted 材料。在平底锅中的水平介质, 但不压缩。
-
添加稳定的飞卵
- 在中等长度的平底锅上作浅沟。
- 将1毫升稳定的飞卵 (8000 卵) 在沟中用蛋吸管 (图 2) 存入。
注: 通过在所需点切割一个塑料刻度吸管, 插入100网格屏幕, 再将吸管粘在一起, 制成的蛋吸管。 - 用一层薄薄的培养基盖上鸡蛋以防止脱水。
- 盖平底锅与枕头盒, 关闭与橡胶带和标签。在幼虫室放置平底锅 (23 2 °c, 30–50% RH 和 12:12 [L: D] h 光周期)。
注意: 幼虫发育需要从产卵时10–14天。
3. 蛹处理后, 幼虫在产卵和 Pupariate 13 天或14后移到培养基7–9天的边缘。
- 铲蛹, 主要位于锅的边缘周围的外壳, 形成在表面上的介质, 出和放置在一个干净的平底锅。
- 装满平底锅, 用蛹, ½¾满水。分解蛹和培养基的团簇。蛹 > 1 天老浮19, 中间水槽的麦麸和蛋白质组分。
- 去除浮动材料, 蛹和一些中等组分与漏勺并且洗涤通过一系列筛子 (#5, #7, #12, #20) 去除剩余的媒介。#12 筛收集蛹, #20 使固体废弃物进入排水管。用水槽喷雾器在筛子之间洗蛹。
- 冲洗蛹, 在 #12 筛, 成一个干净的锅。把锅装满水½。将漂浮的蛹倒入漏勺中, 允许多余的水排出。
- 将抽干的蛹放到烘干屏上, 直到干燥 (图 3)。
4. 蛹货架, 另一种收集蛹的方法是与蛹货架18
注: 货架是由一个从10升碟盘 (10.2 厘米高 x 10.2 厘米宽 x 31.9 厘米长) 的一端的塑料切割。
- 准备介质如2.1 所述。锥形介质在平底锅从2.5 厘米深的一端到7.5 厘米深。
-
将架子放在饲养盘的浅端和胶带上, 以防幼虫爬行在架子上 (图 4)。
- 饱和海绵 (~ 14.5 x 9.0 x 4.5 cm3, 再生纤维素) 并且包装它在水被浸泡的布料 (30.5 x 42 cm2, 棉花) 和地方在架子大约一个半英寸从媒介。
-
添加鸡蛋, 如2.2 所述, 并继续像以前一样。
- 每天检查平底锅以确保海绵保持湿润。
- 将蛹从货架上冲洗出来, 海绵和布料放入一个干净的盘子里, 产卵后14天倒入漏勺。
5. 质量控制
- 称量所有在平底锅中生产的蛹 (总重量)。
- 隔离100蛹, 称重并放置在9厘米培养皿中。
- 伯爵和性成人 ~ 5–8天后确定出现率和性别比例。储存培养皿与出现的成年人在一个冰箱, 以计数在以后的日期, 如果需要的话。苍蝇是奸的形状, 他们的眼睛和宽度的额轨道板20或生殖器在低放大倍数。
- 记录总重量, 重量100蛹, 并且出现成年男性和女性的数量。
6. 准备血液
- 从当地屠宰场收集新鲜牛血19升桶, 含70克柠檬酸钠三元二水合物500毫升水。大力搅拌血液5–10分钟, 返回实验室。
- 通过漏勺的血液来去除血块并分成2升的容器, 标签与收集的日期和储存在一个冰箱 (-20 °c)。
- 在需要前2天, 从冰箱中取出容器并放入冰箱。血液可用于2周, 一旦解冻, 并储存在冰箱里长达1年。
7. 成人保养
- 准备笼子, 线笼底部用屠夫纸方便清洗。
- 在每个笼子里放置50克干燥稳定的飞蛹 (~ 3500)。成人 eclose 几个小时后, 蛹处理后几天。
- 在每个笼子的顶部放一个新鲜的血液浸泡女性餐巾喂养。开始喂养24小时内成人羽化和重复每天直到产卵前的一天 (9–10天后出现)。
- 产卵后 (1 节), 把笼子放在冰箱里 4–8 h, 然后清除纸张, 用热水冲洗两侧和地板上的取食量, 用洗衣粉和氯漂白剂擦洗所有表面。用热水冲洗笼子, 让干燥。
Access restricted. Please log in or start a trial to view this content.
结果
幼虫 pupariate 10–14天和成人在产卵后14–16天出现。世代时间, 蛋到蛋, 是 ~ 24 天。2013年5月至2017年1月的饲养数据有三种不同的膨胀剂和两个菌落,如图 5所示。白杨提供了最好的产量, 3867 ±1442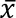 (标准偏差) 蛹重12.5 ±1.6 毫克74±19% 羽化生产2872±1294成年蝇为建立的实验室殖民地。性别比例略有偏向女性 0...
(标准偏差) 蛹重12.5 ±1.6 毫克74±19% 羽化生产2872±1294成年蝇为建立的实验室殖民地。性别比例略有偏向女性 0...
Access restricted. Please log in or start a trial to view this content.
讨论
稳定的苍蝇可以发现发展在广泛的各种基质的性质, 可以饲养在许多类型的媒体在实验室。我们用木屑和蛭石作膨胀剂。蛭石工作良好, 但使分离蛹从饲养培养基困难和昂贵 ($ 0.60/平底锅)。可能是由于增加了从培养基中分离蛹的严谨性, 羽化也降低了蛭石, 57% vs 75% 用于木屑。棉刨花可媲美蛭石, 但有时难以采购。最重要的成分似乎是植物或纤维素材料发酵和维持一个 "开放" 或良好的充气培养基和?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
我们要感谢安东尼. Weinhold 和多年来与我们合作的众多学生的技术支持, 以及改进我们的昆虫饲养程序的建议。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Diamalt | Premier Malt Products, Inc., Saddle Brook, NJ | 2540 | |
| CSMA Fly media | Purina Animal Nutrition, Arden Hills, MN | 5S6Z | |
| Thin Maxi Pad | The Tranzonic Co., Cleveland, OH, USA | 5001M | |
| Calf Manna | MannaPro, Chesterfield, MO, USA | Manna Pro | |
| Ammonium Bicarbonate | Spectrum Chemical Manufacturing Corp, Gardena, CA | A1125 | |
| Wheat bran, Coarse | Siemer Milling Company, Teutopolis, IL | ||
| Wood shavings | Tractor Supply Company, Brentwood, TN | 502770699 | |
| Fishmeal | Consumer Supply Distributing, North Sioux City, SD | F1550 | |
| Adult cages | All Aluminum Window Company, Lincoln, Ne | Custom | 45 × 45 × 45 cm, 18 × 16 mesh aluminum screen, stockinette access |
| 9 × 28 cm black cotton cloth | Robert Kaufman Fabrics, Los Angeles, CA | K040-114 | Egging cloth |
| 10 L plastic dish pans | Rubbermaid, Saratoga Springs, NY | FG2951ARWHT | Larval pans |
| Stockinette, Cotton, 12 inch x 25 yard roll | Tex-Care Medical Company, Burlington, NC | 91311-225 |
参考文献
- Cook, D. F., Dadour, I. R., Keals, N. J. Stable fly, house fly (Diptera: Muscidae), and other nuisance fly development in poultry litter associated with horticultural crop production. J. Econ. Entomol. 92 (6), 1352-1357 (1999).
- Dominghetti, T. F., de Barros, A. T., Soares, C. O., Cançado, P. H. Stomoxys calcitrans (Diptera: Muscidae) outbreaks: current situation and future outlook with emphasis on Brazil. Rev. Bras. Parasitol. Vet. 24 (4), 387-395 (2015).
- Solórzano, J. -A., Guilles, J., Bravo, O., Vargas, C., Gomez-Bonilla, Y., Bingham, G., Taylor, D. B. Biology and trapping of stable flies (Diptera: Muscidae) developing in pineapple residues (Ananas comosus) in Costa Rica. J. Insect Sci. 15 (1), 145(2015).
- Berry, I. L., Stage, D. A., Campbell, J. B. Populations and economic impacts of stable flies on cattle. Trans. Am. Soc. Agric. Eng. 26, 873-877 (1983).
- Taylor, D. B. Area-wide management of stable flies. Area-wide management of insect pests. Vreysen, J., Hendrichs, R., Cardoso Pereira, R. , in press (2017).
- Bishopp, F. C. The stable fly (Stomoxys calcitrans L.), an important live stock pest. J.Econ. Entomol. 6 (1), 112-126 (1913).
- Hogsette, J. A., Ruff, J. P., Jones, C. J. Stable fly biology and control in northwest Florida. J. Agric. Entomol. 4 (1), 1-11 (1987).
- Lysyk, T., Kalischuk-Tymensen, L., Selinger, L., Lancaster, R., Wever, L., Cheng, K. Rearing stable fly larvae (Diptera: Muscidae) on an egg yolk medium. J. Med. Entomol. 38, 382-388 (1999).
- Romero, A., Broce, A., Zurek, L. Role of bacteria in the oviposition behaviour and larval development of stable flies. Med. Vet. Entomol. 20, 115-121 (2006).
- Glaser, R. W. Rearing flies for experimental purposes with biological notes. J. Econ. Entomol. 17 (4), 486-496 (1924).
- Melvin, R. Physiological studies on the effect of flies and fly sprays on cattle. J. Econ. Entomol. 25 (6), 1151-1164 (1932).
- Doty, A. E. Convenient method of rearing the stable fly. J. Econ. Entomol. 30 (2), 367-369 (1937).
- Bridges, A. C., Spates, G. E. Larval medium for the stable fly Stomoxys calcitrans (L.). Southwest. Entomol. 8 (1), 6-10 (1983).
- Hogsette, J. A. New diets for production of house flies and stable flies (Diptera: Muscidae) in the laboratory. J. Econ. Entomol. 85 (6), 2291-2294 (1992).
- McGregor, W. S., Dreiss, J. M. Rearing stable flies in the laboratory. J. Econ. Entomol. 48 (3), 327-328 (1955).
- Goodhue, L. D., Cantrel, K. E. The use of vermiculite in medium for stable fly larvae. J. Econ. Entomol. 51 (2), 250(1958).
- Friesen, K., Berkebile, D. R., Zhu, J. J., Taylor, D. B. Augmenting laboratory rearing of stable fly (Diptera: Muscidae) larvae with ammoniacal salts. J. Insect Sci. 17 (1), 1-6 (2017).
- Berkebile, D. R., Weinhold, A. P., Taylor, D. B. A new method for collecting clean stable fly (Diptera:Muscidae) pupae of known age. Southwest. Entomol. 34 (4), 469-476 (2009).
- Champlain, R. A., Fisk, F. W., Dowdy, A. C. Some improvements in rearing stable flies. J. Econ. Entomol. 47 (5), 940-941 (1954).
- Zumpt, F. The stomoxyine biting flies of the world. , Gustav Fischer Verlag. Stuttgart. (1973).
- Wienhold, B. J., Taylor, D. B. Substrate properties of stable fly (Diptera: Muscidae) developmental sites associated with round bale hay feeding sites in eastern Nebraska. Environ. Entomol. 41 (2), 213-221 (2012).
- Friesen, K., Berkebile, D. R., Wienhold, B. J., Durso, L., Zhu, J., Taylor, D. B. Environmental parameters associated with stable fly (Diptera: Muscidae) development at hay feeding sites. Environ. Entomol. 45 (3), 570-576 (2016).
- Albuquerque, T. A., Zurek, L. Temporal changes in the bacterial community of animal feces and their correlation with stable fly oviposition, larval development, and adult fitness. Front. Microbiol. 5 (590), 1-9 (2014).
- Bailey, D. L., Whitfield, T. L., LaBrecque, G. C. Laboratory biology and techniques for mass producing the stable fly, Stomoxys calcitrans (L.) (Diptera: Muscidae). J. Med. Entomol. 12 (2), 189-193 (1975).
- Smith, J. P., Hall, R. D., Thomas, G. D. Field studies on mortality of the immature stages of the stable fly (Diptera: Muscidae). Environ. Entomol. 14 (6), 881-890 (1985).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。