需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
均匀时间分辨 Förster 共振能量转移法检测胰岛素分泌
摘要
在这里, 我们提出的均匀时间解决烦恼 (HTRF) 作为一种有效的方法来快速检测胰岛素分泌的细胞。
摘要
胰岛素分泌的检测对于阐明调控分泌物的机制以及代谢研究至关重要。虽然许多胰岛素检测已经存在数十年, 最近出现的均匀时间分辨 Förster 共振能量转移 (HTRF) 技术已经大大简化了这些测量。这是一种快速、经济高效、重现性强的光学检测方法, 依赖于具有长持久辐射的明亮显影的抗体, 这有助于时间分辨 Förster 共振能量转移。此外, HTRF 胰岛素检测也适合于高通量筛查技术的发展。在这里, 我们使用 HTRF 检测胰岛素分泌的 INS-1E 细胞, 一个大鼠胰岛素瘤衍生细胞系。这使我们能够估计胰岛素的基本水平及其对葡萄糖刺激反应的变化。此外, 我们使用这个胰岛素检测系统来确认多巴胺作为葡萄糖刺激胰岛素分泌的负调节因子 (GSIS) 的作用。类似地, 其他多巴胺 D2样受体激动剂, quinpirole 和溴隐亭, 以浓度依赖性的方式减少 GSIS。我们的研究结果突出了 HTRF 胰岛素检测格式在确定 GSIS 中多种药物的作用及其药理学特征方面的效用。
引言
对能量代谢的调节由一种主要的合成代谢荷尔蒙--胰岛素--进行微调。胰岛素是由胰β细胞合成和释放, 以响应增加的胞外葡萄糖水平。释放的胰岛素触发葡萄糖的摄取胰岛素敏感组织1,2。生理上, 这与饭后葡萄糖浓度升高有关, 其次是胰岛素分泌调节葡萄糖摄取。在葡萄糖稳态紊乱导致代谢损害达到高潮的胰岛素抵抗, 最终在2型糖尿病的发病2,3,4。
虽然胰岛素分泌已被广泛研究, 但其调控机制仍不清楚。一个重要的调查领域是通过 beta 细胞5,6,7,8, 识别出新的胰岛素分泌调节剂。这些研究需要更好地了解葡萄糖刺激与胰岛素分泌的耦合关系。因此, 准确监测和量化葡萄糖刺激胰岛素分泌 (GSIS) 水平的能力是必不可少的。然而, 迄今为止, 只有有限数量的方法可以使用胰岛素分泌细胞系和/或胰岛来量化 GSIS。一种是放射免疫 (RIA), 它利用放射性同位素标记的胰岛素和抗体。这一方法的主要局限性包括放射性材料的处理和处置造成的安全问题。此外, 这种方法是劳动密集型的, 涉及多长时间的洗涤和孵化步骤。酶联免疫吸附试验 (ELISA) 是另一种昂贵的和劳动密集型的方法, 利用抗体进行胰岛素检测。抗体亲和性和胰岛素识别效率的变化是这种方法的限制因素, 会影响结果的重现性。ELISA 和 RIA 都不是为高通量实验设计的。AlphaScreen 是一种用于检测和测量胰岛素分泌水平的均质检测方法。AlphaScreen 技术的基础是将环境氧转化为激发氧的单态态, 这种状态可以与化学发光物种发生反应, 从而产生化学发光。由于该检测是同源的, 许多与 RIA 和 ELISA 相关的洗涤步骤被消除。然而, 由于反应的性质, 信号的不稳定性是一个限制因素, 可能会影响检测的读数。(Heyduk 和同事9开发的 TR 钳, 是基于两个单独的抗体对胰岛素分子的不同表位进行绑定的另一种均匀的胰岛素测量方法。抗体每个化学上链接到双链 dna 与短互补单链 dna 悬。抗体与胰岛素的结合使它们聚集在一起, 导致双链 DNA 双工。每种抗体也与各自的捐献者或受体荧光相关联, DNA 双工的联想汇集这些显影产生 Förster 共振能量转移 (烦恼)。然而, 一个潜在的限制是 TR 钳, 取决于烦恼本身。在焦虑反应过程中, 无法迅速消散背景荧光, 可能导致实验中的背景荧光和低信噪比的水平较高。因此, 对于以高通量方式量化 GSIS 的可靠、稳健和经济高效的检测, 仍然需要存在。
生物物理学的最新进展最终导致了一种均匀时间分辨荧光能量共振转移 (HTRF) 的研究。具体来说, 虽然分析中的能量转移可以被描述为基于焦虑的, 更准确地说, HTRF 依赖于发光能量共振转移 (LRET)10 , 这是能量在供体和受体之间的非辐射传递。物种11,12,13。这一区别是重要的, 因为荧光或淬火基于焦虑交互的时间与 LRET 有很大的不同, 尽管同样类型的浇口可以用于烦恼和 LRET。此外, 稀土稀土 cryptate 化合物, 如铕或铽 cryptate 在 HTRF 中的使用产生长荧光半衰期12,14。这提供了在捐助者励磁与接受方 (即,时间分辨化验) 之间的排放量之间引入时间延迟 (µsec) 的独特优势。这个时间延迟允许在测量受体发射荧光之前有足够的时间让背景荧光消散。因此, 读数是没有非特定的荧光, 因此, 高信噪比达到 (图 1)。此外, HTRF 的均一性消除了清洗未绑定物种的洗涤步骤的需要, 使得该检测比 ELISA 法或基于 RIA 的方法要快得多。
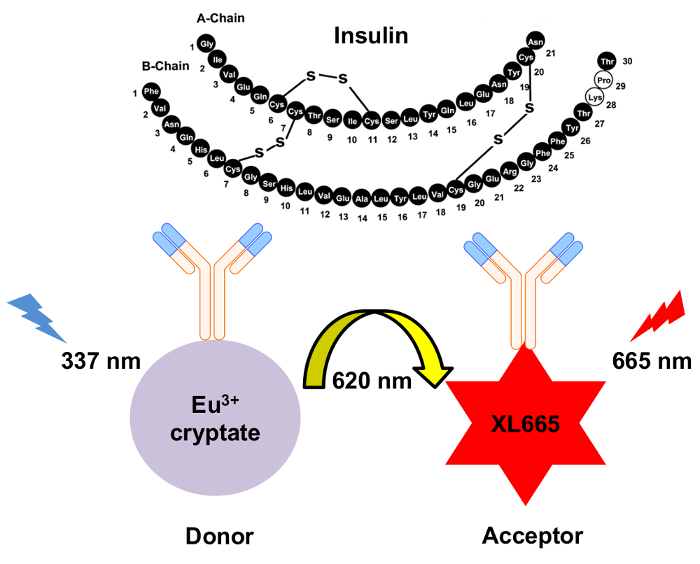
图 1: HTRF 胰岛素检测机制的示意图.两个独立产生的单克隆抗体专门识别和绑定到胰岛素在不同的地点。这些抗体是共轭的铕 cryptate 捐赠者或 XL665 受体。捐赠者的激发在337毫微米导致放射在620毫微米。由此产生的能量转移导致 XL665 以更长的波长发出, 665 nm。请单击此处查看此图的较大版本.
在这里, 我们提供了一个详细的协议, 以使用基于 HTRF 的方法来确定 GSIS 的水平, 从 INS-1E 细胞, 一个建立良好的胰岛素分泌β细胞衍生的大鼠胰岛素瘤细胞系15。此外, 该检测可用于鉴定胰岛素分泌分子调控剂的药理学特征。我们应用这种 HTRF 的胰岛素检测, 以检查多巴胺 D2样受体调节 GSIS。越来越多的研究表明, 神经递质多巴胺是 GSIS8,16,17,18,19,20的重要调节器,21,22. 多巴胺以阴性分泌/分泌方式影响 GSIS, 通过对多巴胺 D2样受体 (d2, D3, d4受体) 的反应, 在β胰腺细胞的表面表达8,16,19. 利用这一方法, 我们确认多巴胺作为 GSIS 的负调节因子的作用, 并证明多巴胺 D2样受体激动剂溴隐亭和 quinpirole 也能减少 GSIS。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. INS-1E 细胞: 维护和电镀
- 在加湿37˚C/5% CO2孵化器中维护 INS-1E 细胞, 并用 RPMI 1640 培养基补充 5% (v/v) 热灭活胎牛血清, 2 毫米 l-谷氨酰胺, 10 毫米 HEPES, 1 毫米丙酮酸钠, 100 U/毫升青霉素/链霉素溶液, 50 µM β巯基乙醇。培养细胞在10毫升完成 RPMI 1640 中等 (每板), 直到他们到达 80-90% 汇合, 当他们可以是 trypsinized 和传代或用于胰岛素分泌试验。
- 1 天:吸入介质, 用5毫升预热的 PBS 冲洗细胞一次。加入0.5 毫升胰蛋白酶 (0.025%) 稀释1:1 在0.5 毫升 PBS 胰蛋白酶处理细胞和孵育 3-4 分钟在37˚C。停用胰蛋白酶, 加入9毫升完整的培养基, 将细胞转移到15毫升离心管吹打。
- 颗粒细胞通过离心和重新悬浮细胞颗粒在大约5毫升新鲜的媒介。
- 取10µL 的重悬浮细胞, 并与10µL 台盼蓝生命染料混合, 检查细胞的活力。使用 hemocytometer 对10µL 中的活细胞和死体细胞进行计数。生存能力水平应高于90%。将新鲜培养基中的重悬浮细胞稀释至每毫升100万细胞。
- 种子0.5 毫升 INS-1E 细胞每井在聚 l-赖氨酸预涂覆的24井板, 在密度50万细胞/好。
- 2 天:去除介质 18-24 小时后电镀和添加500µL/井新鲜 RPMI 1640 媒体。将细胞孵化为另外24小时, 使细胞从先前的传代步骤中完全恢复。这个额外的时间允许细胞在组织培养板上传播。
2. 胰岛素分泌物测定 (3 天)
- 准备 KRB 缓冲器: 132.2 毫米氯化钠, 3.6 毫米氯化钾, 5 毫米 NaHCO3, 0.5 毫米 NaH2PO4, 0.5 毫米氯化镁2, 1.5 毫米 CaCl2, 0.001 克/毫升牛血清白蛋白 (BSA), pH 7.4。
- 从细胞中吸取介质, 用预热过的 PBS 冲洗两次。
- 对于葡萄糖饥饿步骤, 在37˚C/5% CO2中添加450µL/井 KRB (含 BSA), 无葡萄糖1小时。
- 在葡萄糖饥饿的步骤, 准备稀释的药物 (s) 在 KRB 含有200毫米葡萄糖 (10x 浓度)。
- 准备药物在10x 最后的集中在 KRB 补充与200毫米葡萄糖 (也10x 最后的化验葡萄糖集中)。如果药物库存 (加上10x 葡萄糖) 在亚砜, 确保亚砜的百分比保持一致的整个化验 (理想的最终百分比小于0.1% 亚砜)。
- 对于多巴胺和 quinpirole 治疗, 使用最后的检测药物浓度范围为100µM 到 100 pM (从最高到最低浓度), 最后一点的剂量反应不含药物。对于溴隐亭, 使用最后的检测浓度范围为10µM 到下午10点, 最后一点的剂量反应是无药控制。
- 葡萄糖饥饿后, 加入药物序列稀释的化验, 以产生剂量反应。
- 添加50µL/井每系列稀释到相应的水井 (总化验量500µL)。
- 对于葡萄糖刺激步骤, 孵化细胞与各自药物系列稀释 (在20毫米葡萄糖存在) 90 分钟在37˚C/5% CO2.包括一套控制井: (1) 在没有任何额外的药物和 (2) 不受药物或葡萄糖刺激的细胞 (提供基本分泌速率) 的情况下, 单独刺激20毫米葡萄糖。
- 在刺激步骤之后, 小心地取出上清液 (直接使用或存储在4˚C)。
注: 此时可引入额外的5分钟温和离心步骤 (600 x g, 1 分钟), 以去除检测上清液中的剩余细胞。
3. HTRF 测定胰岛素分泌物
- 稀释试验上清液1:10 在 KRB (不 BSA), 优选在清楚的96井板材。
- 准备胰岛素标准曲线的 HTRF 胰岛素检测 (表 1)。
| 标准库存解决方案 500 ng/毫升 | 串行稀释 | 工作 [胰岛素] ng/毫升 |
| 性病7 | 30µl 库存 + 140 µl KRB | 150 |
| 性病6 | 30µl 性病 7 + 45 µl KRB | 60 |
| 性病5 | 30µl 性病 6 + 45 µl KRB | 24 |
| 性病4 | 30µl 性病 5 + 45 µl KRB | 9。6 |
| 性病3 | 30µl 性病 4 + 45 µl KRB | 3.84 |
| 性病2 | 30µl 性病 3 + 45 µl KRB | 1.54 |
| 性病1 | 30µl 性病 2 + 45 µl KRB | 0.61 |
| 性病0 | 45µl KRB | 0 |
| 注: 性病股为500毫升 | ||
表1。串行稀释, 使胰岛素标准曲线。
- 将标准曲线样品和稀释后的测定上清液到 HTRF 板上。用 HTRF 测定分泌胰岛素的方法可以在96井或384井板中进行, 同时要记住化验量必须重新调整。使用10µL/井样品在96井白色半区域板材或5µL/井在384井白色低容量, 圆底板 (参见材料表)。
- 在1:2 捐赠者 (cryptate)/受体 (XL-665) 比率中准备抗体组合, 检测缓冲区 (参见材料表)。
注: 有关 HTRF 化验的进一步具体细节可从制造商处获得。 - 将抗体组合添加到30µL/井 (96 井板化验格式) 或15µL/井 (用于384井板化验格式) 的化验。
- 把盘子封上, 室温下孵化。
- 阅读板后2小时, 4 小时, 和/或夜间孵化与抗体使用的板读取器和适当的 HTRF 光学模块 (337 665 620 nm) (见材料表和制造商的说明)。将集成开始时间设置为60µs, 并在400µs 中集成. 使用200闪烁每井。
注: 这些参数是基于使用我们的特定读者。读数在620毫微米和665毫微米可能变化在不同的仪器之间。这是我们建议使用665/620 比率的原因之一。在计算这一比例时, 读者与读者之间的任何潜在差异都将被规范化, 并提供一致的价值, 而不管用来测量 HTRF 的仪器是什么。
4. 数据分析和规范化
- 通过外推比例荧光读数 (665 nm/620 nm) 到二阶二次多项式曲线 (图 2) 计算出检测井的胰岛素浓度。

图 2: 胰岛素标准曲线.采用已知浓度的人胰岛素储备, 生成胰岛素标准曲线。结果 HTRF 比率 (665 毫微米/620 毫微米) 被绘了反对胰岛素浓度。数据最适合于第二阶二次多项式曲线 (R2 = 0.99996)。这是一个具有代表性的标准曲线。误差线 = SEM.请单击此处查看此图的较大版本.
- 以推断的数据作为胰岛素分泌的 ng/毫升, 规范化 (胰岛素分泌反应增加配体浓度) 到% 最大胰岛素分泌物检测井的平均值 (20 毫米葡萄糖单独情况)。
- 从单个实验中使用曲线拟合 (R2) 计算板内变化。在实验中, 从实验内的重复项中派生出单个 R2值, 允许计算曲线拟合的平均值的标准误差。
- 为确定 interplate 变化, 请使用来自至少三个单独实验的数据来计算集体曲线 R2值的平均值的标准误差。
Access restricted. Please log in or start a trial to view this content.
结果
我们通过使用纯化的人胰岛素标准的预定义浓度 (图 2) 生成胰岛素标准曲线来验证我们的胰岛素 HTRF 检测。标准曲线的生成允许我们推断比例荧光读数, 从而确定分泌的胰岛素水平, 以应对药物治疗 (图 2)。曲线拟合的板内变化最小 (R2 = 0.99996 5.0 x 10-5) interplate 变化 (R2 = 0.947 @ 5.5 x 10-5
Access restricted. Please log in or start a trial to view this content.
讨论
这里描述的 HTRF 胰岛素检测提供了一个快速, 有效的系统来衡量胰岛素分泌从一个培养细胞的系统。在其最重要的优势之一, 该检测提供了低背景信号, 由于高信噪比。此外, 我们已确认 HTRF 信号在较长时间内稳定 (> 24 小时)7。然而, 由于胰岛素结合单克隆抗体在检测后快速达到束缚饱和度, 抗体结合的动力学可能会受到环境温度或胰岛素分泌水平的变化的影响。因此, 我们在多个?...
Access restricted. Please log in or start a trial to view this content.
披露声明
我们感谢尼古拉-皮埃尔 (Cisbio 生物鉴定) 的有益建议和皮埃尔 Maechler (日内瓦大学) 慷慨提供 INS-1E 细胞。这项工作得到了国防部的资助 (PR141292 授予中福), 以及匹兹堡基金会 (中福) 的 Emmerling 基金。
致谢
作者没有什么可透露的。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 96-well white half area plate | Greiner Bio-One | 82050-042 | |
| 384-well white low-volume, round-bottom plate | Corning | 15100157 | |
| Insulin High Range Kit | Cisbio Bioassays | 62IN1PEH | 10,000 test HTRF-based insulin assay kit |
| PHERAstar FSX plate reader | BMG Labtech | FSX | Plate reader adapted for HTRF-based assay readings |
| Plate sealers | Fisher Scientific | DY992 | To seal plate while antibodies incubate |
| Hemocytometer | Hausser Scientific | 3100 | |
| RPMI Medium 1640 (1x) | Gibco | 11875-093 | [+] L-glutamine |
| Trypsin 0.05% | Corning | 25-052-CI | 0.53 mM EDTA, (-) sodium bicarbonate |
| DPBS (Dulbecco's phosphate buffered saline) | Corning | 21-031-CV | Without calcium and magnesium |
| Fetal Bovine Serum | Corning | 35-010-CV | |
| HEPES | Gibco | 156-30-080 | |
| Sodium pyruvate | Gibco | 11360070 | |
| Penicillin/Streptomycin solution 100x | Corning | 30-002 CT | |
| 2-mercaptoethanol | Sigma | M1348 | |
| Trypan Blue Stain (0.4%) | Gibco | 15250-061 | |
| Dopamine hydrochloride | Sigma | 8502 | |
| Bromocriptine mesylate | Tocris | 427 | |
| (-)-Quinpirole hydrochloride | Tocris | 1061 | |
| Bovine Serum Albumin | Calbiochem | 12659 | |
| Poly-L-Lysine | Sigma | P4832 | |
| Glucose | Sigma | G7021 | |
| DMSO (Dimethyl sulfoxide) | Sigma | 276855 |
参考文献
- Taniguchi, C. M., Emanuelli, B., Kahn, C. R. Critical nodes in signalling pathways: Insights into insulin action. Nat Rev Mol Cell Biol. 7 (2), 85-96 (2006).
- Vetere, A., Choudhary, A., Burns, S. M., Wagner, B. K. Targeting the pancreatic beta-cell to treat diabetes. Nat Rev Drug Discov. 13 (4), 278-289 (2014).
- Despres, J. P., Lemieux, I. Abdominal obesity and metabolic syndrome. Nature. 444 (7121), 881-887 (2006).
- Kahn, S. E., Hull, R. L., Utzschneider, K. M. Mechanisms linking obesity to insulin resistance and type 2 diabetes. Nature. 444 (7121), 840-846 (2006).
- Barg, S. Mechanisms of exocytosis in insulin-secreting B-cells and glucagon-secreting A-cells. Pharmacol Toxicol. 92 (1), 3-13 (2003).
- Braun, M., Ramracheya, R., Rorsman, P. Autocrine regulation of insulin secretion. Diabetes Obes Metab. 14 Suppl 3, 143-151 (2012).
- Farino, Z. J., et al. Development of a rapid insulin assay by homogenous time-resolved fluorescence. PLoS One. 11 (2), e0148684(2016).
- Simpson, N., et al. Dopamine-mediated autocrine inhibitory circuit regulating human insulin secretion in vitro. Mol Endocrinol. 26 (10), 1757-1772 (2012).
- Heyduk, E., Moxley, M. M., Salvatori, A., Corbett, J. A., Heyduk, T. Homogeneous insulin and C-Peptide sensors for rapid assessment of insulin and C-peptide secretion by the islets. Diabetes. 59 (10), 2360-2365 (2010).
- Heyduk, T. Measuring protein conformational changes by FRET/LRET. Curr Opin Biotechnol. 13 (4), 292-296 (2002).
- Degorce, F. HTRF((R)): Pioneering technology for high-throughput screening. Expert Opin Drug Discov. 1 (7), 753-764 (2006).
- Degorce, F., et al. HTRF: A technology tailored for drug discovery - a review of theoretical aspects and recent applications. Curr Chem Genomics. 3, 22-32 (2009).
- Mathis, G. HTRF(R) Technology. J Biomol Screen. 4 (6), 309-314 (1999).
- Daijo, J. E., Sportsman, J. R. A time-resolved fluorescence immunoassay for insulin in rodent plasma. J Pharm Biomed Anal. 19 (3-4), 335-342 (1999).
- Merglen, A., et al. Glucose sensitivity and metabolism-secretion coupling studied during two-year continuous culture in INS-1E insulinoma cells. Endocrinology. 145 (2), 667-678 (2004).
- Ustione, A., Piston, D. W. Dopamine synthesis and D3 receptor activation in pancreatic beta-cells regulates insulin secretion and intracellular [Ca(2+)] oscillations. Mol Endocrinol. 26 (11), 1928-1940 (2012).
- Ustione, A., Piston, D. W. A simple introduction to multiphoton microscopy. J Microsc. 243 (3), 221-226 (2011).
- Ustione, A., Piston, D. W., Harris, P. E. Minireview: Dopaminergic regulation of insulin secretion from the pancreatic islet. Mol Endocrinol. 27 (8), 1198-1207 (2013).
- Rubi, B., et al. Dopamine D2-like receptors are expressed in pancreatic beta cells and mediate inhibition of insulin secretion. J Biol Chem. 280 (44), 36824-36832 (2005).
- Garcia-Tornadu, I., et al. Disruption of the dopamine d2 receptor impairs insulin secretion and causes glucose intolerance. Endocrinology. 151 (4), 1441-1450 (2010).
- Garcia-Tornadu, I., et al. New insights into the endocrine and metabolic roles of dopamine D2 receptors gained from the Drd2 mouse. Neuroendocrinology. 92 (4), 207-214 (2010).
- Lopez Vicchi, F., et al. Dopaminergic drugs in type 2 diabetes and glucose homeostasis. Pharmacol Res. 109, 74-80 (2016).
- Kalra, S., Kalra, B., Agrawal, N., Kumar, S. Dopamine: The forgotten felon in type 2 diabetes. Recent Pat Endocr Metab Immune Drug Discov. 5 (1), 61-65 (2011).
- Mahajan, R. Bromocriptine mesylate: FDA-approved novel treatment for type-2 diabetes. Indian J Pharmacol. 41 (4), 197-198 (2009).
- Caicedo, A. Paracrine and autocrine interactions in the human islet: more than meets the eye. Semin Cell Dev Biol. 24 (1), 11-21 (2013).
- Ballon, J. S., Pajvani, U., Freyberg, Z., Leibel, R. L., Lieberman, J. A. Molecular pathophysiology of metabolic effects of antipsychotic medications. Trends Endocrinol Metab. , (2014).
- Freyberg, Z., Aslanoglou, D., Shah, R., Ballon, J. S. Intrinsic and antipsychotic drug-induced metabolic dysfunction in schizophrenia. Front Neurosci. 11, 432(2017).
- de Leeuw van Weenen, E. J., et al. The dopamine receptor D2 agonist bromocriptine inhibits glucose-stimulated insulin secretion by direct activation of the alpha2-adrenergic receptors in beta cells. Biochem Pharmacol. 79 (12), 1827-1836 (2010).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。