Method Article
同源小鼠 B 细胞淋巴瘤模型对 CD19 轿车 T 细胞的临床前评价
摘要
在这里, 我们提出了一个协议, 用于生产和临床前测试小鼠 CD19 汽车 T 细胞的逆转录病毒转导和利用, 作为一种治疗同源 A20 B 细胞淋巴瘤在 BALB/c 鼠有或没有 lymphodepleting预调理。
摘要
CD19 嵌合抗原受体 (CAR) T 细胞疗法的惊人临床成功导致了两个第二代嵌合抗原受体 (汽车) 对急性淋巴细胞白血病 (ALL) 和非-霍奇金淋巴瘤 (NHL) 的批准。目前, 该领域的重点是在其他血液恶性肿瘤中效仿这些成功, 而观察到的完全反应率不那么显著。进一步工程的汽车 T 细胞或其他治疗方式的联合管理可能成功地克服障碍, 成功治疗其他癌症设置。
因此, 我们提出了一个模型, 其他人可以进行 CD19 汽车 T 细胞的临床前测试。结果在这个测试良好的 B 细胞淋巴瘤模型可能是信息汽车 T 细胞治疗一般。
该协议允许通过 MP71 反转录病毒构造和 pCL-生态包装质粒, 然后收集分泌的逆转录病毒微粒, 通过磷酸钙转染生产小鼠汽车 T 细胞, 并用重组人纤维连接蛋白片段和离心进行转导。此外, 通过流式细胞术、luminometry 和酶联免疫吸附法 (ELISA) 的应用, 验证了逆转录病毒转导的有效性, 并证实了汽车 T 细胞在体内杀死靶淋巴瘤细胞的能力。
介绍了 lymphoreplete 和 lymphodepleted 同源小鼠体内检测汽车 T 细胞的实验方案, 建立了系统淋巴瘤。抗癌活动由体内生物发光和疾病进展监测。我们展示了根除建立的 B 细胞淋巴瘤的典型结果, 当利用 1st或 2nd一代汽车结合 lymphodepleting 预调理和少数小鼠实现长期减免时, 利用汽车 Tlymphoreplete 小鼠 IL-12 表达的细胞。
这些协议可用于评估 CD19 汽车 t 细胞与不同的额外修改, 组合的汽车 t 细胞和其他治疗剂或适应使用汽车 t 细胞对不同的靶抗原。
引言
嵌合抗原受体 (CAR) T 细胞治疗已显示惊人的临床成功治疗 CD19+恶性肿瘤导致 tisagenlecleucel 复发性急性淋巴细胞白血病1和 axicabtagene 的批准ciloleucel2在2017年的累进大 B 细胞非霍奇金淋巴瘤。
癌症和免疫系统在疾病进展和治疗机制中相互作用的重要性日益得到承认3,4,5。例如, 很好地记录了肿瘤微环境 (TME) 充斥着可以抑制免疫细胞6、7、8的效应函数的因素。另外, 内源免疫细胞的启动和表位的传播可以是根除肿瘤和长期抵抗肿瘤挑战的关键9,10。这两种现象都不能在缺乏免疫系统的异种模型中得到评价。同样, 使用转基因蛋白质的系统不能准确地反映出11、12的表位分布所需的破坏免疫耐受的挑战。因此, 一个具有完全功能免疫系统的同源模型对于模拟癌症疾病进展和免疫治疗的这些重要方面至关重要。
汽车 T 细胞治疗的一个重要的警告是, lymphodepleting 预调理是必需的治疗成功13,14。这通常是在患者通过管理化疗之前, 输液的汽车 T 细胞15,16。作为一种标准方法, 为了模拟患者设置中使用的 lymphodepletion, 我们在治疗性汽车 T 细胞对 A20 B 细胞淋巴瘤的小鼠进行管理之前, 对其进行5的全身照射 (TBI), 以达到 lymphodepletion。
虽然 lymphodepleting 预调理不是一个问题, 对大多数患者来说, 化疗药物带来的毒性意味着低性能状态的患者不符合汽车 T 细胞治疗的资格。为了创建一个测试系统, 代表不符合 lymphodepletion 的患者, 我们建立了一个 lymphoreplete 同源模型, 在其中我们模型汽车 T 细胞治疗淋巴瘤。在这个模型中, 我们表明, 从汽车 T 细胞内 IL-12 的分泌可能导致根除已建立的淋巴瘤, 成功率为 25%17。此外, 我们发现内源免疫细胞参与了根除癌症。
在这里, 我们详细描述了生产小鼠汽车 t 细胞的协议, 在同源小鼠中建立淋巴瘤, 以及用或不使用 lymphodepleting 预调理的汽车 T 细胞治疗淋巴瘤。这可以用于汽车 t 细胞与其他药物的组合研究, 测试汽车 t 细胞与其他转基因或使用其他领养细胞疗法或免疫治疗策略对抗淋巴瘤。
研究方案
所有的动物实验都是在《动物 (科学程序) 法》1986和英国癌症研究指导协调委员会的主持下进行的。所有动物研究均在 CRUK 研究所进行, 并由当地动物福利和道德审查机构 (CRUK AWERB) 批准。
1. 准备工作
- 大量提取试剂 pMP71 反转录病毒构建质粒和 pCL-生态逆转录病毒包粒18。
注意: pMP71 编码 mCherry 和汽车由 FMDV2A 序列分隔。这与其他逆转录病毒结构可互换。pCL-Eco 编码插科打诨, pol 和 ecotropic 包络蛋白。 - 使用 RPMI 1640 培养基、10% FCS、1% 100x 青霉素-链霉素-谷氨酰胺 (PSG), 制备完整的 t 细胞培养基 (TCM), 用于培养小鼠 t 细胞。
注意:该溶液包含 100 IU/毫升青霉素, 100 µg/毫升链霉素和2毫米 l-谷氨酰胺), 50 微米β巯基乙醇和25毫米 4-(2-羟乙基)-1-piperazineethanesulfonic 酸 (HEPES)。 - 培养 A20 细胞在 RPMI 1640, 10% FCS 和0.05 毫米β巯基乙醇在37摄氏度, 5% CO2。
- 在完全杜尔贝科的改良鹰培养基 (DMEM) 中培养铂 e (板-e) 细胞 (DMEM 10% 胎小牛血清 (FCS), 2 毫米 l-谷氨酰胺, 1 微克/毫升嘌呤霉素和10微克/毫升灭瘟素), 37 摄氏度, 5% CO2.
注意:平板-E 细胞来源于293T 细胞和表达插科打诨、pol 和 ecotropic 包络逆转录病毒蛋白。 - 在转染前立即准备转染培养基溶液1和2。准备溶液 1 (ph 7.9) 以包含 DMEM + 10% FCS + 25 mM HEPES, 溶液 2 (ph 7.1), 以包含 DMEM + 25 mM HEPES。
- 使用无菌磷酸盐缓冲盐水 (PBS) 稀释10微克/毫升重组人纤维连接蛋白碎片溶液, 并贮存在-20 摄氏度, 直至用完。
- 无菌过滤所有介质通过0.2 微米过滤器使用前 (不包括重组人纤维连接蛋白片段)。
2. T 细胞的逆转录酶转导
- 1天: 转染准备
- 种子 7.5 x 106铂 e (板 e) 细胞在15厘米2组织培养菜在18毫升完整的 DMEM 和孵化过夜在37摄氏度, 5% CO2。
- 2天: 逆转录病毒包装细胞系转染
- 准备20.4 微克的 pcl-生态包装载体 dna, 39.6 微克的质粒 dna 编码反转录病毒汽车结构和150微升 1 M CaCl2到最终体积3毫升转染溶液2每15厘米2菜要去染。漩涡十年代和休息5分钟
- 从15厘米2碟中取出 DMEM 培养基, 并用12毫升转染溶液1替换。
注意事项更换介质时, 15 cm2道菜可以在中心干燥。这可能导致转染的平板-E 细胞的大量死亡。快速工作, 一次只从1-2 个盘子中取出介质。 - 添加3毫升转染溶液2包含脱氧核糖核酸和 CaCl2到每15厘米2盘滴, 均匀地在每个盘子。轻轻的岩石板与侧向侧运动十年代. 孵育37摄氏度, 5% CO2过夜。
- 3天: 为转导准备含有病毒的上清液
- 用18毫升完整的中药取代转染板 E 细胞的培养基并返回孵化器。
注意事项当改变媒体15厘米2菜可以在中心干燥。这可能导致转染的平板-E 细胞的大量死亡。快速工作, 一次只从1-2 个盘子中取出介质。
- 用18毫升完整的中药取代转染板 E 细胞的培养基并返回孵化器。
- 3天: 小鼠脾 T 细胞的分离与体外活化
- 从6-8 周大的 BALB 小鼠中取出脾, 如前述帕金森等。19 , 浸泡在无菌, 冰冷, PBS 在一个50毫升锥形管。
- 使用镊子将脾脏转移到1.5 毫升微量离心管, 并使用最小力的杵匀质。
- 使用1000微升移液器和 ~ 800 微升 PBS 将匀浆转化为100微米孔隙细胞过滤器, 贴在含有5毫升 PBS 的50毫升管上, 以达到单细胞悬浮液。对附加脾重复步骤2.4.2。每管不得超过3脾。
注意事项脾细胞通过过滤器可以形成块状, 如果左站立。手动旋流管间歇性地如果处理几个脾, 以避免细胞结块。在细胞过滤器的剩余片段可以进一步捣碎使用从5毫升注射器的柱塞使用最小的力。 - 最高可达20毫升与 PBS。将20毫升细胞悬浮液轻轻地放到20毫升密度梯度介质 (材料表) 中, 放入 50 ml 管中。将所产生的叠加悬浮液离心 800 x g, 20 分钟, 无制动器应用。
- 使用无菌巴斯德移液器在界面层采集细胞, 并转移至50毫升管。最高50毫升与 PBS 和离心机在 800 x g 10 分钟洗涤。放弃上清液, 在完整的中医中重新悬浮细胞。
- 使用血细胞计数器计数单元格的数量。
- 培养细胞密度为 5 x 106细胞/毫升在完整的中医与 30 ng/毫升 anti-CD3ε抗体 (克隆 145-2C11), 30 ng/毫升 anti-CD28 抗体 (克隆 37.51), 100 U/毫升重组人 IL-2 和 2 ng/毫升重组小鼠 IL-7。使用适当大小的组织培养烧瓶来获得所采集的细胞体积。
注意:抗原呈现细胞是必需的 t 细胞活化的 CD3 和 CD28 抗体, 如果使用纯化的 T 细胞是必要的涂层板与抗体, 或使用磁珠 (材料表) - 孵育鼠标脾细胞在37摄氏度, 5% CO2过夜。
- 3天: 转导板的制备
- 大衣非组织培养6孔板与2毫升10微克/毫升重组人纤维连接蛋白片段和孵化过夜在4摄氏度。
- 4天: 小鼠 T 细胞转导
- 将重组人纤维连接蛋白片段从涂层板转移到新鲜的非组织培养的6孔板上。在4摄氏度的2轮转导中孵育这些盘子。
- 将2毫升的中药添加到原始重组人纤维连接蛋白碎片涂层板的每个井中, 在室温下留出30分钟, 以阻止非特定的结合。
- 从15厘米组织培养皿中的转染的平板细胞中获得含有逆转录病毒的上清液, 并用18毫升完整的中药取代。
注意事项迅速工作, 以避免干燥的平板 E 细胞。
注意:如果使用荧光标记基因如 mCherry (图 1), 可在现阶段通过荧光显微镜检查转染的成功与否。 - 通过0.45 微米过滤器过滤含有逆转录病毒的上清液, 去除细胞碎片。从重组人纤连蛋白碎片涂层6孔板中去除中医中药, 并添加2.5 毫升含有上清液或每孔的过滤逆转录病毒 (使用完整的中药进行模拟转染)。标记每个以及添加逆转录病毒或模拟媒体。
- 在室温下离心 1200 x g 的板材30分钟。
- 当板块旋转, 收集激活的 T 细胞和计数使用血细胞计数器。
- 转导进行与 5 x 106激活脾细胞总共5毫升/井。通过离心 500 x g 5 分钟, 在单独的试管中脾细胞所需的模拟/转导数量。
- 重新暂停脾细胞的密度为 5 x 106细胞每2.5 毫升的过滤逆转录病毒-包含上清从步骤2.6.4 或中医作为一个阴性对照。将重组人 IL-2 (hIL-2) 和重组小鼠 IL-7 (mIL-7) 添加到最终浓度为 200 IU/毫升和 4 ng/毫升。
- 在步骤2.6.5 完成后, 从离心机收集6孔板, 并将2.5 毫升/井重新悬浮脾细胞放入适当的井中, 使最终容积为5毫升/井, 最终浓度为 100 U/毫升 hIL-2 和 2 ng/毫升 mIL-7。
- 在室温下离心 1200 x g 的板材90分钟。离心后, 将板材孵育37摄氏度, 5% CO2过夜。
- 5天: 转导的2轮
- 从板块收集重组人纤维连接蛋白片段, 因为这可以重新使用。重复步骤 2.6.2-2.6.5。
- 当板块旋转时, 使用巴斯德移液器从 1st轮转导中收集细胞。用2毫升 PBS 冲洗每一个油井, 然后在每个井中收集所有剩余的细胞。
注意:移液器向上和向下重新挂起沉淀细胞。收集每个控制/转导组在单独的管。 - 离心管在 500 x g 5 分钟重新悬浮细胞在2.5 毫升每井转导与 200 IU/毫升 IL-2 和 4 ng/毫升 IL-7。重复步骤 2.6.7-2.6.8。
- 从离心机中取出细胞, 孵育37摄氏度, 5% CO2 , 4 h. 收集转导细胞, 如步骤 2.7. 2-2. 7.3。
- 计数细胞, 离心在 500 x g 5 分钟, 并重新暂停在完整的中医在密度 1 x 106细胞/毫升与 100 U/毫升 hIL-2 和 2 ng/毫升 mIL-7。转移到适当大小的培养瓶和孵育在37摄氏度, 5% CO2。
- 每2天添加含有100毫升 hIL-2 和 2 ng/毫升 mIL-7 的新鲜中医培养基, 保持 1 x 106细胞/毫升的细胞密度。
注意:收获的脾细胞包含多种细胞类型。在这些文化条件下, 非 T 细胞在2-3 天的过程中消亡。在细胞培养的4天后, T 细胞的数量通常等同于0天收获的脾细胞总数。
3. 传导效率的测量
- 在4天后转导, 收集转导或非转导 T 细胞的样本 (约 3 x 105细胞)。离心细胞悬浮液 500 x g 5 分钟, 丢弃上清液, 用 PBS 和离心机一次洗涤颗粒细胞。
- 丢弃上清液, 添加100微升的 PBS 含有合适的胺活性染料 (例如, 活/死染色, 1 在100稀释) 每井。在室温下孵育15分钟, 在黑暗中。
- 用 PBS 和离心机在 500 x g 上洗涤两次, 5 分钟. 丢弃上清液, 用50微升的含有抗小鼠 CD16/CD32 抗体的流式细胞缓冲液孵育 Fc 受体阻断 (1% 100 稀释)。孵育10分钟, 在4摄氏度。
- 直接添加50微升抗体染色主混合物含有抗小鼠 CD4-BV786 和 CD8-BV711 抗体 (最终浓度为1微升/井在流式缓冲液)。在黑暗中孵育30分钟, 在4摄氏度。重复洗涤步骤3.3。重新挂起 1% PFA 缓冲液中的细胞, 并保持在黑暗中4摄氏度, 直到通过流式细胞仪进行分析。
- 使用 BV711、BV785 和 mCherry 荧光作为 CD4 和 CD8 子集的标记, 以及汽车表达式分别在 (图 2) 中, 分析具有等效合适的细胞仪的单元格。
4. 汽车 T 细胞活性的体外验证
- 种子同源靶 CD19+具有或不含荧光素酶表达的肿瘤细胞, 密度为 1 x 104细胞, 100 微升中医/以及96孔 U 底组织培养板。
- 添加 1 x 104 CD19 汽车 T 细胞/井在体积100微升/井, 以实现一个效应器目标 (E: T) 比为1:1。
注意:E: 每个汽车结构和目标细胞线应建立 T 比率。 - 单独使用 T 细胞和肿瘤细胞单独作为阴性对照和 T 细胞刺激由佛波-肉豆蔻酸乙酸酯 (PMA) (50 ng/毫升) 和 ionomycin (1 微克/毫升) 作为阳性控制干扰素伽玛 (IFNγ) 释放。共培养细胞在37摄氏度, 5% co2为 16-24 h。
- 继共培养后, 将板材离心 500 x g 5 分钟, 收集上清液, 进一步 IFNγ和 IL-12p70 ELISA 分析。
注意:这可以存储在-80 摄氏度。 - 在含有荧光素的100微升 PBS 中重新悬浮细胞颗粒 (最终浓度为1.5 毫克/毫升)。在37摄氏度下孵育10分钟的盘子。然后用合适的光度计测量每个油井的发光度。
注意:曝光时间必须针对细胞线和密度进行优化。代表性的结果如图 3a所示。通过与表达靶抗原的细胞系共培养, 可以改变汽车 T 细胞的体外细胞毒性, 以表达荧光素。由于汽车 T 细胞杀死目标细胞, 荧光素被释放, 因此 luminometry 信号的减少与细胞杀伤相关。非转导细胞通常会对靶细胞的生存能力产生影响, 尤其是在长时间潜伏期。根据制造商的 ELISA 方案, 测量上清液中小鼠 IFNγ和 IL-12p70 的浓度。代表性结果如图 3b和3c所示。通过酶联免疫吸附法分析上清液的含量, 可以测定 T 细胞与表达靶抗原细胞株的共培养活性。汽车 T 细胞与靶细胞的比值和共培养周期的长度必须优化为每个汽车结构, 目标细胞线和分析物。PMA 和 ionomycin 治疗可以作为一个积极的控制, 以确认 T 细胞的质量和他们的反应能力。
5. 评估小鼠抗癌活性
-
议定书1
- 执行100毫克/千克静脉注射 (IV) 将环磷酰胺输送到6至8周的 BALB 小鼠。这允许肿瘤植入没有显著的 lymphodepletion17 (图 4)。
注意:建立 A20 淋巴瘤可能需要超过2月的不理想的服用率。这可以通过使用环磷酰胺在淋巴瘤细胞的交付前1天得到改善。为了研究 lymphoreplete 小鼠, 我们确定了一剂环磷酰胺, 可以提高淋巴瘤的效率而不会引起 lymphodepletion。 - 第二天, 注入100µL 5 x 105同源 A20 B 细胞淋巴瘤细胞, 通过静脉注射 (IV) 注射, 将荧光素酶和绿色荧光蛋白 (GFP) 转化为小鼠。
- 允许老鼠在17天内开发系统性淋巴瘤。
- 通过体内生物发光成像系统, 确认腹腔 (IP) 注射100微升的30毫克/毫升荧光素和成像的系统性淋巴瘤的存在。
- 使用分隔符避免信号溢出到相邻的小鼠。暴露小鼠在腹侧1分钟与一个恒定大小的感兴趣的区域。
- 将相对光单位 (RLU) 显示为每秒的光子 (p/秒)。必须为每个肿瘤模型优化设置;使用可以及早发现肿瘤的曝光, 但不会导致肿瘤到达终点时饱和。
- 记录每个鼠标的总 RLU, 并具有一个大小恒定的感兴趣区域。(图 5a和b)。
- 注射单剂量 1 x 106汽车 T 细胞静脉注射到 lymphoreplete 小鼠轴承建立的淋巴瘤。
注意: (重要)必须使用剂量上报计划为每辆汽车结构建立剂量水平, 以确保汽车 T 细胞产生的任何可能的毒性都可以得到解决。虽然抗鼠 CD19 汽车 t 细胞不显示毒性, 汽车 t 细胞会引起意想不到的毒性。在多车结构和转导效率不相同的情况下, 通过将非转导 t 细胞添加到细胞制剂中, 所管理的 t 细胞总数应保持相等。 - 通过使用体内生物发光成像系统 (图 5c), 每周通过 IP 注射100微升的30毫克/毫升荧光素和成像来监测疾病进展情况。
- 密切监测小鼠的毒性和安乐死任何显示早期迹象的后肢麻痹 (HLP) 或病理肿瘤负担之前任何痛苦可能出现的小鼠。
注意:A20 淋巴瘤的毒性可包括经脑膜肿瘤侵袭后肢体麻痹。定期检查改变步态的早期迹象。同样, 大的 IP 肿瘤可能会出现, 这可能导致不舒服所示的改变行为。 - 监测小鼠存活 60-100 天 (图 5d)。实验结束后用 schedule-1 方法进行安乐死。
- 执行100毫克/千克静脉注射 (IV) 将环磷酰胺输送到6至8周的 BALB 小鼠。这允许肿瘤植入没有显著的 lymphodepletion17 (图 4)。
-
议定书2
- 通过尾部静脉注射在100微升的 PBS 每鼠200毫克/公斤环磷酰胺到6到8周的老 BALB 小鼠。
- 次日, 注射 5 x 105同源 A20 B 细胞淋巴瘤细胞,通过尾部静脉注射在100微升 PBS 中表达荧光素酶和 GFP。
- 允许小鼠开发系统性淋巴瘤约7-14 天
- 通过使用体内生物发光成像系统, 通过 IP 注射100微升的30毫克/毫升荧光素和成像来确认系统性淋巴瘤。
- 对 lymphodepletion 进行5的全身照射 (TBI) 0.02 每分钟。
注意:在汽车 t 细胞的管理之前, 接受汽车 t 细胞治疗的患者经过一系列的方案来实现 lymphodepletion, 这大大增加了过继转输转移的汽车 t 细胞的植入。这可以复制在小鼠全身照射 (TBI) (图 6)。 - 第二天, 在100微升的 PBS 中注入 1 x 106汽车 T 细胞,通过尾部静脉注射进入有肿瘤的小鼠体内。
- 7天后通过尾部静脉出血收集血液样本。
- 将红细胞裂解缓冲液添加到每个血样中, 然后按照第3节所述为流式细胞仪做准备。通过流式细胞术分析汽车 T 细胞在循环中的持久性 (图 2)。
注意:在细胞术之前添加计数珠子可以确定每毫升血液中的汽车 T 细胞数量。 - 监测疾病进展, 如步骤 5.1.5-5.1.8 (图 7) 所述。
结果
对于 T 细胞的高效转导, 需要获得新鲜的逆转录病毒微粒。用 pCL-生态生产者质粒和 pMP71 逆转录病毒质粒转染平板-E 细胞系使逆转录病毒颗粒分泌到细胞中清液中。当荧光标记基因 (如 mCherry) 被编码在逆转录病毒中时, 荧光显微镜可以证实成功的转染 (图 1)。通过转染的传感器细胞中的含有病毒的上清液, 可通过纤维连接蛋白碎片涂层板上的2轮自旋情思来 T 细胞。通过流式细胞术4天后转导可以确定转导的效率。成功转导细胞表达在逆转录病毒中编码的标记基因 (图 2)。转导效率的范围从 ~ 50-90% 的效率, 第一代受体到 ~ 10-40% 与接近逆转录病毒包装能力的汽车结构。虽然标记基因表达显示成功的逆转录病毒传导, 它是最重要的是显示汽车 T 细胞的功能, 在参与与表达靶抗原在他们的表面的细胞。修饰荧光素酶的靶细胞系可用于荧光素酶检测, 直接测试汽车 T 细胞杀死细胞的程度 (图 3A)。通过 ELISA 测定, 从汽车 t 细胞中释放出的效应细胞因子与靶细胞的共培养物, 也可作为汽车 t 细胞细胞毒性的间接测量方法 (图 3B和3C)。
在 lymphoreplete 小鼠中产生的汽车 T 细胞可以通过建立系统性 A20 淋巴瘤与100毫克/千克剂量的环磷酰胺 (静脉注射), 1 天前静脉注射 5 x 105 A20 细胞 (图 4)。使用体内生物发光成像仪进行荧光素和图像采集的 IP 注入可用于在整个过程中使用恒定的 ROI 和曝光时间来监测肿瘤负担 (图 5A-C)。汽车 T 细胞改良, 以表达 IL-12 是能够根除系统性淋巴瘤与 lymphodepleting 预调理给予无疾病生存在大约25% 的小鼠 (图 5D)。Lymphodepleting 预处理, 达到5的 TBI 1 天前, 在四个汽车 T 细胞的管理, 显著改善植入 (图 6)。在这个模型中, 第一代汽车 T 细胞能够根除系统性 A20 淋巴瘤, 通常在100% 小鼠中诱导无疾病生存 (图 7)。
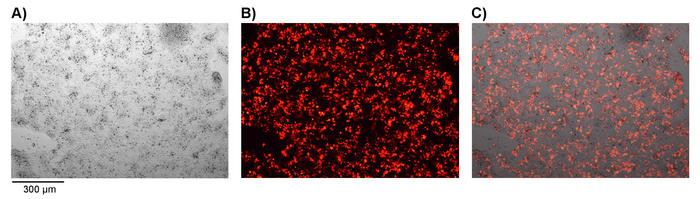
图1。成功转染平台 E 细胞的确认.用逆转录病毒车结构和 pMP71 和 pcl-生态包装载体质粒 DNA 转染的平板细胞。通过 mCherry 荧光标记基因的表达, 成功地转染。A)显示明亮的现场显微镜、 B)荧光显微镜和C)合并图像。放大倍率 = 50X。请点击这里查看这个数字的更大版本.

图2。通过流式细胞术测定转导效率.流式细胞术用于测定小鼠 T 细胞在4天后转导中的转导效率, 使用僵尸紫外线活/死、mCherry、BV711 和 BV785 分别检测活体、汽车构造、CD4 和 CD8 细胞。A)非转导、 B) mCherry αmCD19 mCD3z 和C) mCherry αmCD19 mCD3z. mIL12 显示与浇口 1) 汗衫 2) 活细胞 3) CD4 和 CD8 4) 和 5) 评估的 mCherry 阳性细胞表示汽车。请点击这里查看这个数字的更大版本.
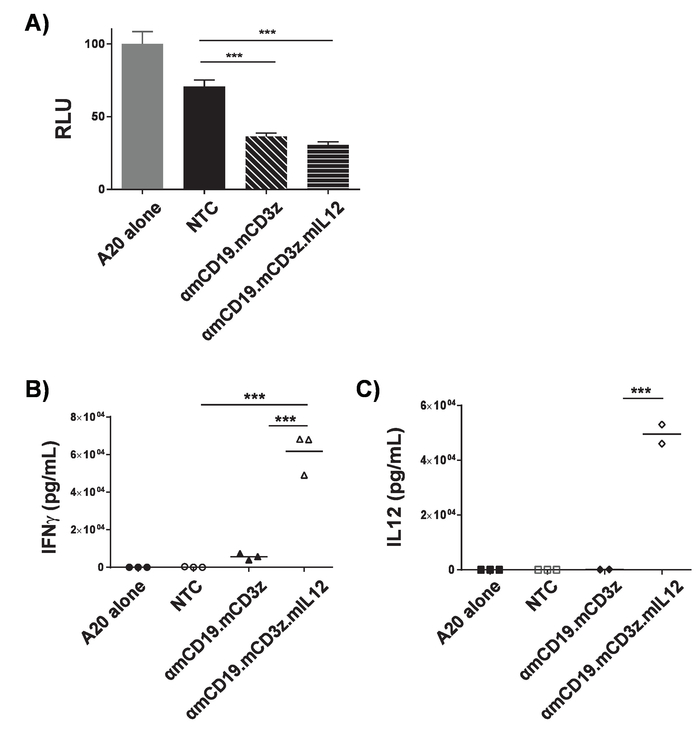
图3。汽车 T 细胞活性的验证.αmCD19 汽车 T 细胞与 A20 淋巴瘤细胞联合培养, 以表达荧光素酶 (1 x 104: 1 x 104), 16 h 在 U 底96孔板。共培养后, 细胞颗粒, 并收集上清液。A)细胞在 PBS 中被重新悬浮, luminometry 用于评估靶细胞的存活能力。在 IFNγ (B) 和 IL-12 (C) 存在的情况下, 对共培养的上清液进行了评估。汽车 T 细胞与靶细胞的比值和共培养周期的长度必须优化为每个汽车结构和目标细胞线。PMA 和 ionomycin 治疗可以作为一个积极的控制, 以确认 T 细胞的质量和他们的能力细胞响应。误差线显示 SD. 统计分析是使用单向方差计算进行的。p < 0.001)。此图已从17修改。请点击这里查看这个数字的更大版本.
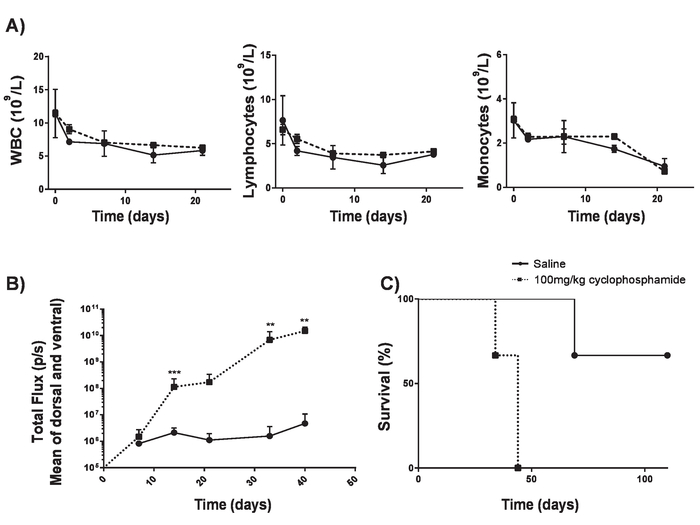
图4。无 lymphodepletion 建立 A20 淋巴瘤.环磷酰胺可提高淋巴瘤的诱导效率, 而不会引起 lymphodepletion。A) 100 毫克/千克的环磷酰胺后, 6-8 周龄的 BALB 小鼠的血计数。误差线显示 SD B)淋巴瘤负担6-8 周龄的 BALB 小鼠 IV. 100 毫克/公斤的环磷酰胺或生理盐水在-1 天和 IV 分娩 5 x 105 A20 细胞在日0测量使用光度计。C) 小鼠存活在B)。错误条形图显示 SD. 统计分析是使用2路方差计算进行的。** p < 0.01, *** p < 0.001)。这个数字已经从 Kueberuwa等修改。17.请点击这里查看这个数字的更大版本.
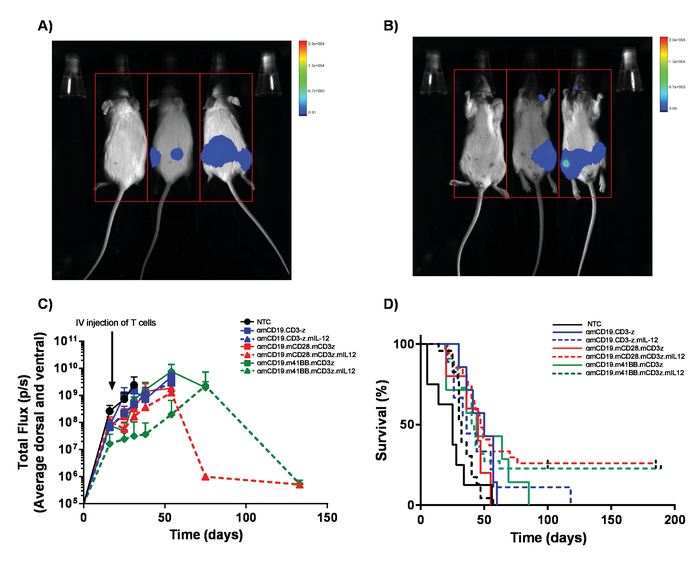
图5。监测淋巴瘤的负担和生存.A20 淋巴瘤的小鼠表达荧光素酶可获得100µL 腹腔 (IP) 注射30毫克/毫升荧光素, 并使用体内生物发光成像系统进行成像。A)小鼠在腹侧一侧暴露1分钟, 并立即翻转到影像背上, 以拾取身体两侧的肿瘤肿块(B)。c)有代表性的结果 BALB/C 小鼠的淋巴瘤负担, 接受不同的αmCD19 汽车 T 细胞没有 lymphodepletion。误差线显示扫描电镜D)相同小鼠的生存率。这个数字已经从 Kueberuwa等修改。17.请点击这里查看这个数字的更大版本.
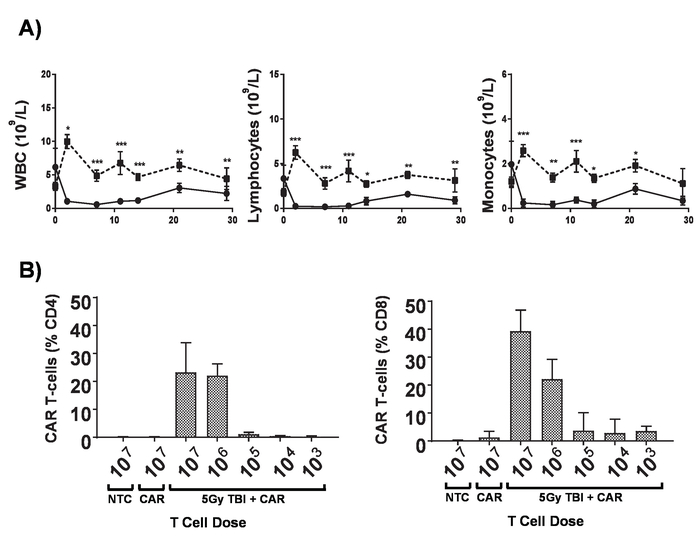
图6。lymphodepletion 的影响。a) 6-8 周龄的 BALB 小鼠接受5的 TBI 后的血计数, 剂量率为 0.02/分钟;误差线通过双向方差分析显示 SD。* p < 0.05, *** p < 0.01, *** p < 0.001。B)通过流式细胞仪监测小鼠外周血中 CD4+和 CD8+汽车 T 细胞的 mCherry 标记基因7天后管理。错误栏显示 SD。这个数字已经从 Kueberuwa等修改。17.请点击这里查看这个数字的更大版本.
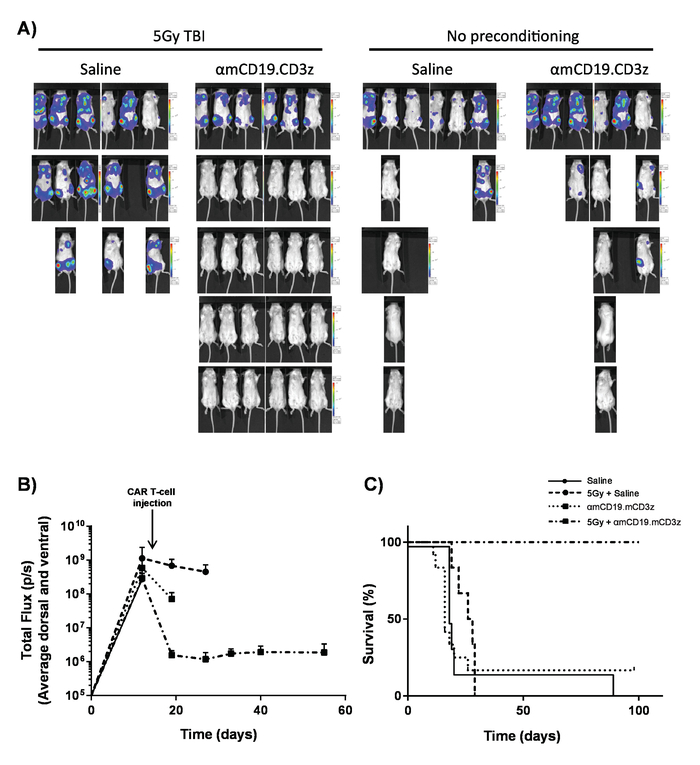
图7。汽车 T 细胞活动与 lymphodepleting 预调理.典型的结果显示, 在汽车 T 细胞管理前的前一天, 5 的 TBI 的效果。A)成像和(B)在100µL 腹腔 (IP) 注射30毫克/毫升荧光素使用体内生物发光成像系统后, 对小鼠进行成像的图形显示。误差线显示 SEM. C)相同老鼠的存活。这个数字已经被修改 fromKueberuwa等。17.请点击这里查看这个数字的更大版本.
讨论
同源鼠标模型允许测试疾病进展和治疗, 同时保持完整的免疫系统。这是最重要的, 当涉及到治疗, 与免疫系统, 特别是免疫治疗剂的互动。
这里描述的协议有两个关键的工作流, 第一个是基因修改鼠标 T 细胞, 以表达汽车。这需要7天从启动到转导的验证。伴随着汽车 T 细胞的生产是小鼠全身性淋巴瘤的建立。如果汽车 T 细胞生产失败, 或质量不足, 通常没有足够的时间来生产替换细胞之前, 老鼠屈服于淋巴瘤。因此, 研究人员使用这些模型准确地执行肿瘤剂量和疾病进展研究, 以便成功地生产用于治疗管理的汽车 T 细胞是至关重要的。
低 T 细胞转导效率的典型原因包括生产者细胞的转染效率较差, 通常是由于质粒纯度差或转染培养基 pH 值不准确所致。建议检查生产者细胞转染的效率, 然后再进行完整的协议, 差转染将限制 T 细胞转导的效率。重组人纤维连接蛋白碎片可以收集和存储在-20 摄氏度, 以供重复使用, 然而, 多次冻结解冻导致转导效率降低。快速处理小鼠脾收集后, 也非常重要的是获得高产量的可行 T 细胞。
应该指出, 这里描述的协议使用 A20 细胞表达荧光素酶。这是首选, 因为它提供的能力, 测量系统肿瘤负担的生物发光成像。然而, 在功能性免疫系统的存在, 对荧光素酶的反应可能会扭曲结果。我们以前测试过存活的老鼠对标记转基因17的免疫反应。使用无转基因的 A20 细胞复制关键实验是关键, 以验证这些在免疫细胞根除肿瘤方面没有发挥重要作用。
虽然临床药物只能在免疫缺陷小鼠体内使用, 但使用小鼠汽车 T 细胞对抗小鼠癌细胞可以使我们评估免疫系统对治疗功效或疾病进展的贡献。该协议可用于针对 B 细胞淋巴瘤或其他汽车的临床前评估, 如 IL-12 的分泌物, 如下所述。必须指出的是, 虽然免疫细胞之间的相互作用可以在同源小鼠模型中进行评估, 但它们可能无法准确地重述人体体内的相互作用。特别值得注意的是, 人类和小鼠汽车的结构可能会有下游的后果;T 细胞生长的最佳活化和细胞培养条件不同20, 靶抗原表达的组织分布可能因人和小鼠而异, 有经验的毒性可能截然不同。因此, 必须利用体内和异种模型来证实结果。
总之, 淋巴瘤的同源 lymphodepleted 和 lymphoreplete 模型概括了没有事先化疗/放疗的患者。这提供了一个模型系统, 在其中模拟临床设置, 允许测试一系列的治疗策略, 这将是重要的新的免疫治疗剂的未来浪潮。
使用预调理, 将注意到所有的老鼠通常清除淋巴瘤。在人类中, 高达90% 的完整响应率, 这是代表。然而, CD19 汽车 T 细胞治疗的挑战将取决于防止经常 CD19 的复发的高频率。在这个模型中没有观察到复发, 而且通常超过100天。对模拟在临床上看到的复发的修改可以帮助 CD19 汽车 T 细胞治疗的未来挑战。
披露声明
David Gilham 是从事汽车 T 细胞生产的 Celyad 的工作。其余的作者没有什么可透露的。
致谢
我们要感谢 Bloodwise 资助这项研究 (赠款 13031) 和 CRUK 曼彻斯特生物资源单位, 成像和细胞术和分子生物学核心设施支持这项工作。
材料
| Name | Company | Catalog Number | Comments |
| 0.2 µm syringe filter | Appleton Woods | FC121 | |
| 0.45 µm syringe filter | Appleton Woods | FC122 | |
| 1.5ml pestle and microtube | VWR | 431-0098 | |
| 100X penicillin-streptomycin-glutamine (PSG) | Gibco | 10378016 | |
| 2-Mercaptoethanol (50 mM) | Gibco | 31350-010 | |
| Blasticidine S hydrochloride | Sigma- Aldrich | 15205 | |
| Bottle Top Filter (0.2 µm) | Scientific Laboratory Supplies | FIL8192 | |
| Brilliant Violet 711 anti-mouse CD8a Antibody | BioLegend | 100759 | 1 in 100 staining dilution. Clone 53-6.7 |
| Brilliant Violet 785 anti-mouse CD4 Antibody | BioLegend | 100552 | 1 in 100 staining dilution. Clone RM4-5 |
| Calcium chloride dihydrate | Sigma- Aldrich | C7902 | |
| Cell counting beads – CountBright absolute counting beads | Molecular Probes | C36950 | |
| Cell Strainer 100μm | VWR | 734-0004 | |
| Cyclophosphamide Monohydrate | Merck | 239785-1GM | |
| Dulbecco’s Modified Eagle medium (DMEM) - High Glucose | Sigma Aldrich | D6546 | |
| Dynabeads | Gibco | 11131D | |
| Ficoll Paque Plus | GE Healthcare | GE17-1440-03 | Sold by Sigma- Aldrich |
| Flow cytometer - LSR Fortessa x20 | BD Biosciences | 658222R1 | |
| Foetal Bovine Serum | Gibco | 10270 | |
| Haemacytometer | Appleton Woods | HC001 | |
| HEPES solution | Sigma- Aldrich | H0887 | |
| IL-12 p70 Mouse Uncoated ELISA Kit | Invitrogen | 88-7121-76 | |
| IL2, Proleukin | Novartis | PL 00101/0936 | |
| in vivo bioluminescence imaging system – in vivo xtreme II imaging system | Bruker | T149094 | |
| Ionomycin Calcium Salt | Sigma- Aldrich | I0634 | |
| Live/dead stain - Zombie Violet Fixable Viability Kit | BioLegend | 423114 | 1 in 100 staining dilution |
| Luminometer - Lumistart Omega | BMG Labtech | 415-301 | |
| Murine IFN-γ ELISA kit | Diaclone | 861.050.010 | |
| Paraformaldehyde | Sigma- Aldrich | 16005 | |
| pCL-Eco | Novus Biologicals | NBP229540 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma- Aldrich | P8139 | |
| Platinum E cell line | Cell Biolabs | RV-101 | (RRID:CVCL_B488) |
| Purified NA/LE Hamster Anti-Mouse CD28 | BD Biosciences | 553294 | Clone 37.51 |
| Purified NA/LE Hamster Anti-Mouse CD3ε | BD Biosciences | 553057 | Clone 145-2C11 |
| Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block) | BD Biosciences | 553142 | 1 in 100 staining dilution. Clone 2.4G2 |
| Puromycin Dihydrochloride | Sigma- Aldrich | P8833 | |
| Recombinant human fibronectin fragment - RetroNectin Reagent | TaKaRa | T100B | |
| Recombinant Mouse IL-7 (carrier-free) | BioLegend | 577806 | |
| Red cell lysis buffer | eBioscience | 004-4333-57 | |
| RPMI 1640 Medium | Lonza | BE12-167F | |
| Trypsin - EDTA solution | Sigma- Aldrich | T3924 | |
| XenoLight D-Luciferin | Perkin Elmer | 122799 |
参考文献
- Brian, W. Food and Drugs Administration Biologics Licence Application Approval letter. , Available from: https://www.fda.gov/downloads/BiologicsBloodVaccines/CellularGeneTherapyProducts/ApprovedProducts/UCM574106.pdf (2017).
- Malarkey, M., Brian, W. Food and Drugs Administration Biologics Licence Application Approval letter. , Available from: https://www.fda.gov/downloads/biologicsbloodvaccines/cellulargenetherapyproducts/approvedproducts/ucm581259.pdf (2017).
- Liu, Y., Zeng, G. Cancer and Innate Immune System Interactions: Translational Potentials for Cancer Immunotherapy. Journal of Immunotherapy. 35 (4), Hagerstown, Md. 299-308 (2012).
- Janssen, L. M. E., Ramsay, E. E., Logsdon, C. D., Overwijk, W. W. The immune system in cancer metastasis: friend or foe. Journal for ImmunoTherapy of Cancer. 5 (1), 79(2017).
- Pandya, P. H., Murray, M. E., Pollok, K. E., Renbarger, J. L. The Immune System in Cancer Pathogenesis: Potential Therapeutic Approaches. Journal of Immunology Research. 2016, 13(2016).
- Vinay, D. S., et al. Immune evasion in cancer: Mechanistic basis and therapeutic strategies. Seminars in Cancer Biology. 35, S185-S198 (2015).
- Gajewski, T. F., Meng, Y., Harlin, H. Immune Suppression in the Tumor Microenvironment. Journal of Immunotherapy. 29 (3), 233-240 (2006).
- Munn, D. H., Bronte, V. Immune suppressive mechanisms in the tumor microenvironment. Current opinion in immunology. 39, 1-6 (2016).
- Vanderlugt, C. L., Miller, S. D. Epitope spreading in immune-mediated diseases: implications for immunotherapy. Nature Reviews Immunology. 2, 85(2002).
- Hardwick, N., Chain, B. Epitope spreading contributes to effective immunotherapy in metastatic melanoma patients. Immunotherapy. 3 (6), 731-733 (2011).
- Makkouk, A., Weiner, G. Cancer Immunotherapy and Breaking Immune Tolerance-New Approaches to an Old Challenge. Cancer research. 75 (1), 5-10 (2015).
- Jackson, S. R., Yuan, J., Teague, R. M. Targeting CD8(+) T-cell tolerance for cancer immunotherapy. Immunotherapy. 6 (7), 833-852 (2014).
- Brentjens, R. J., et al. Lymphodepletion and tumor burden govern clinical responses in patients with B-cell malignancies treated with autologous, CD19-targeted T cells. Journal of Clinical Oncology. 29 (15_suppl), 2534(2011).
- Brentjens, R. J., et al. Safety and persistence of adoptively transferred autologous CD19-targeted T cells in patients with relapsed or chemotherapy refractory B-cell leukemias. Blood. 118 (18), 4817(2011).
- Hay, K. A., et al. Kinetics and Biomarkers of Severe Cytokine Release Syndrome after CD19 Chimeric Antigen Receptor-modified T Cell Therapy. Blood. 130, 2295-2306 (2017).
- Zhang, T., et al. Efficiency of CD19 chimeric antigen receptor-modified T cells for treatment of B cell malignancies in phase I clinical trials: a meta-analysis. Oncotarget. 6 (32), 33961-33971 (2015).
- Kueberuwa, G., Kalaitsidou, M., Cheadle, E., Hawkins, R. E., Gilham, D. E. CD19 CAR T Cells Expressing IL-12 Eradicate Lymphoma in Fully Lymphoreplete Mice through Induction of Host Immunity. Molecular Therapy - Oncolytics. 8, 41-51 (2018).
- Engels, B., et al. Retroviral vectors for high-level transgene expression in T lymphocytes. Human Gene Therapy. 14 (12), 1155-1168 (2003).
- Parkinson, C. M., et al. Diagnostic Necropsy and Selected Tissue and Sample Collection in Rats and Mice. Journal of Visualized Experiments: JoVE. (54), e2966(2011).
- Kueberuwa, G., et al. CCR7(+) selected gene-modified T cells maintain a central memory phenotype and display enhanced persistence in peripheral blood in vivo. Journal for Immunotherapy of Cancer. 5, 14(2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。