Method Article
基于细胞健康监测的实时细胞成像分析对低密度脂蛋白胆固醇的吸收检测
* 这些作者具有相同的贡献
摘要
该协议提供了一种有效的方法来测量低密度脂蛋白胆固醇的吸收与实时流入率使用活细胞成像系统在不同的细胞类型。该技术提供了一个平台, 以筛选影响低密度脂蛋白流入的化合物的药理活性, 同时监测细胞形态, 从而潜在的细胞毒性。
摘要
通过低密度脂蛋白介导的内吞调节低密度脂蛋白胆固醇的吸收是代谢紊乱、心血管疾病和肾病等各种主要疾病的重要研究领域。目前, 目前还没有可用的方法来评估低密度脂蛋白的吸收, 同时监测细胞的健康。目前的研究提出了一个协议, 利用活细胞成像分析系统, 获取 ldl 流入的串行测量与同时监测细胞健康。这项新技术在四个人的细胞系 (肝、肾小管上皮和冠状动脉内皮细胞) 的四个小时的时间过程中进行了测试。此外, 该技术的敏感性是验证了著名的低密度脂蛋白摄取抑制剂, dynasore 和重组 pcsk9 蛋白, 以及低密度脂蛋白吸收启动子辛伐他汀。总之, 该方法为同时筛选药理活性和监测细胞形态提供了一个中高通量平台, 从而对调节低密度脂蛋白流入的化合物具有细胞毒性。该分析可用于不同的成像系统和分析软件。
引言
低密度脂蛋白受体 (ldlr) 介导的低密度脂蛋白内吞是一个重要的研究领域, 因为循环低密度脂蛋白胆固醇水平是心血管疾病1、肾病2以及各种炎症的核心疾病3和遗传疾病与胆固醇突变运输基因4,5,6, 7.对 ldlr 介导的胆固醇流入的研究确定了多种研究工具, 如动力抑制剂,包括化学 dynasore 8,9,10, 以及低密度脂蛋白调节蛋白质如丙醇转化酶近地利辛/克新9型 (pcsk9)11,12。
ldl-ldr 内吞途径从将细胞表面的 ldl-ldr 复合物隔离成囊蛋白涂层坑 13开始。然后通过在液泡中侵入细胞表面膜, 使 ldl-ldr 复合物在细胞内运输而形成囊泡。当形成的囊泡成熟成早期和晚期内胚层时, ph 值在晚期内胚层内下降, 导致低密度脂蛋白与其受体 14分离。过去, ldl 流入的定量方法依赖于放射性标记125i-ldl 与细胞的共同培养, 并随后从细胞中提取放射性标记的蛋白质进行定量15。然后, 使用荧光标记的低密度脂蛋白蛋白 (如 dii-ldl), 然后使用分光光度计或平板读取器 15, 16 提取用于荧光读数的蛋白质,从而取代了这种方法。荧光标记的低密度脂蛋白也被用于荧光活化细胞分选 (facs), 用于分析低密度脂蛋白和细胞表面低密度脂蛋白结合17的内化。虽然这些方法允许在治疗后收集数据, 但在治疗期间监测细胞的可行性是不可能的。
晚期内生细胞中的酸性 ph 值允许使用 ph 激活的荧光低密度脂蛋白探针, 如 phrodo red 半数致死, 内化 18,19后会发光。此属性允许在活细胞中进行 ldl 吸收评估的连续时间过程。因此, 该协议在活细胞分析中使用 hrodo 红低密度脂蛋白荧光成像, 对低密度脂蛋白的吸收进行连续测量, 同时监测细胞健康状况。结果表明, 在三个不同的人细胞系 (人类肝癌 (hepg2) 细胞、人肾上皮细胞 (hk2) 和人冠状动脉内皮细胞 (hcaec) 中, 这种新技术经过了4个小时的测试, 具有可靠性。).这些细胞系对 ldl 清除20、21、22、23、24、25、26、27 具有重要的临床意义, 肾病 28,29,30, 31, 和心脏病 32,33, 分别。除了监测低密度脂蛋白的流入, 该协议结合了两种著名的低密度脂蛋白摄取抑制剂, dynasore 水合物和重组 pcsk9 蛋白, 以及低密度脂蛋白表达和低密度脂蛋白吸收, 辛伐他汀的司他汀诱导剂。dynasore 和重组 pcsk9 都通过不同的途径来减少低密度脂蛋白的吸收。
dynasore 是一种小分子抑制剂动力学 10 , 通过阻断 ldl-ldr 复合物10,34的 clathrn 依赖性内吞, 降低了 ldl 的吸收。另一方面, 重组 pcsc9 是肽酶 s8 家族的成员, 它与 ldlr 结合在一起, 通过阻断所需构象变化从内化复合物中释放 ldl, 抑制其对细胞表面的回收利用35,36.细胞表面 ldlr 密度的降低最终导致细胞的低密度脂蛋白吸收减少。他汀类药物, 虽然直接阻断 3-羟基-3-甲基谷蛋白辅酶 (hmg-coa) 还原酶, 从而胆固醇生物合成, 也知道提高 ldlr25,38的表达, 导致增加低密度脂蛋白的吸收。通过 dynasore 和/或重组 pcsck9 检测到 hk2、hepg2 和 hcaec 三个临床相关人类细胞系中低密度脂蛋白流入的显著减少, 以及 hpg2 细胞中低密度脂蛋白的吸收显著增加, 从而验证了该协议的敏感性。辛伐他汀在4小时的时间过程中, 对细胞形态/健康进行监测。总之, 该方法提供了一个中至高通量平台, 同时筛选调节活细胞中低密度脂蛋白吸收的化合物的药理活性和细胞毒性。
研究方案
1. 24 井板中的播种细胞
- 将培养基从细胞中吸走, 用5毫升的 dubelco 磷酸盐缓冲盐水 (dpbs) 清洗细胞, 并吸入 dpbs。对于100毫米盘子中的 hepg2 细胞, 使用0.25% 的 trypsin/edta 1.5 ml, 对于 hk2 细胞或 hcaec, 使用0.05% 的 trypsin/edta 溶液分离细胞。
- 在37°c 的孵化器中孵育板 4分钟, 或直到细胞分离。在4分钟孵育后, 为 hepg2 和 hk2 或3毫升的胰蛋白酶中和溶液中和溶液中和3毫升, 为 hcaec 细胞添加3毫升的完整培养基, dpbs 加5% 的胎牛血清 (fbs), 中和胰蛋白酶。
- 将细胞以 250 x g 的速度转移到15毫升的锥形管和离心机中 5分钟, 吸气介质, 并在完整的培养基中重新悬浮细胞颗粒。
- 通过40μm 网状过滤器轻轻过滤细胞悬架, 以分解细胞团块。不要通过过滤器清洗细胞。
- 数一数细胞, 并以优化的密度将其装上板。例如, 在24井板中, 每口腿 hg2 细胞 5, 000个细胞或 hk2 细胞井或 hcaec 井每井 10, 000个细胞可获得最佳结果。
- 在37°c 下将板材连夜培育, 使细胞附着在一起。
- 第二天, 将细胞培养基改为细胞系的基础培养基 (不含 fbs) 加上5% 的脂蛋白缺乏血清 (lpds) 或低 (2%)fbs 介质取决于治疗方法 (见 1.7)。然后, 继续孵育 2 4小时, 让细胞挨饿。在24孔板中使用每口井的总介质500μl。
- 以以下三种方式对细胞进行处理: 添加 10μg/ml 的 rpcsck9 (或车辆), 将细胞送回37°c 孵化器 1小时, 加入 40μm dynore 水合物 (或车辆, 二甲基亚硫醚), 并将细胞送回37°c 孵化器10分钟, 或添加1μm 辛伐他汀 (或车辆, 二甲基亚硫醚), 并将细胞返回37°c 孵化器12、18或24小时。使用具有 5% lpds 的培养基进行 rpcsk9 或 dynasore 处理。低使用 (2%)fbs 培养基或培养基, 含有5% 的 lpds 辛伐他汀治疗方法。
注: 在长期实验中, 或在短期实验分析之前, 可以在培养基改变用于脂蛋白饥饿 (步骤 1.6) 时, 或在短期实验分析之前, 用所需的化合物处理细胞。或者, 可以根据实验的类型和目的选择定制的治疗时间。 - 接下来, 在每口井中加入5μl 的 phrodo 红标记 ldl (1 mg/ml 库存), 以获得10μgml 的最终浓度。然后, 小心地从井中取出气泡。
2. 活细胞分析
- 添加贴有标签的 ldl 后, 立即将板材放入活细胞分析系统孵化器 (见材料表), 并允许板材平衡 15分钟, 以减少板材中的冷凝。
- 同时, 打开软件, 通过增加拿着盘子的容器来安排扫描。使用红色和相位通道, 每口井每隔 1小时, 每隔10秒拍摄4个小时的图像。
- 创建用于数据处理的板块图。
- 单击"属性"选项卡. 选择板块地图。在"化合物" 选项卡中输入细胞类型和处理方法。
- 单击 "区域" 选项卡, 选择每组复制, 然后另存为区域。
3. 设置分析参数
- 实验运行完成后, 在软件中创建一个映像集, 以训练计算机量化计数集中包含的每个参数。
- 在软件中, 打开板视图, 然后在"分析作业实用程序"框中选择"创建" 或 "添加到图像集合"。
- 选择"新建图像集合", 键入图像集合的名称, 然后通过选中通道旁边的框选择 "红色" 和"相位通道"。
- 选择5个更多的图像, 并通过添加到当前图像集合添加到图像集合。
- 创建单元格的处理定义。表 1包括此 ldl 流入协议的 hepg2、hk2 和 hcae 细胞处理定义的参数。
- 在 "分析作业实用程序" 框中, 选择 "新建处理定义"。从下拉菜单中选择2.1.2 步骤中命名的图像集合。从表1中输入单元格类型的参数。
- 在 "预览" 框中, 使用下拉菜单选择 "全部预览"。
- 在"分析蒙版" 框中, 选中"融合蒙版"和"红色对象蒙版"框, 以查看分析中包含的区域, 以获取处理定义。请参见图 1。
- 滚动图像集合, 以确保单元格和 ldl 包含在掩码中。选择"文件"并保存处理定义。
- 分析实验运行中的图像集。
- 在板视图中打开实验。在 "分析作业实用程序" 框中, 选择 "启动新分析作业"。选择保存的处理定义。
- 命名分析作业, 选择分析的时间范围, 突出实验井进行分析。单击 "启动"按钮。
4. 分析和数据处理
- 分析作业完成后, 导出数据:
- 选择已完成的分析, 然后按"查看"。在 "实用程序" 菜单中, 选择 "计量图导出"。
- 在 "区域" 菜单中, 选择 "所有道井", 然后在 "组" 菜单中, 作为一个组获取每组井的平均值, 然后选择 "复制", 并导出每个井的单个值, 选择"无"。
- 在 "红色对象度量" 菜单中, 选择 "红对象综合强度" (rcu xμm 2/图像)。此参数指示红信号强度 (rcu) 乘以每个井的所有图像中红色信号面积 (以μm2表示) 的总和, 这与细胞的总低密度脂蛋白吸收相对应。
- 单击 "数据导出" 按钮。选中将数据向下分解为单个图像。数据将自动复制到剪贴板上, 并可粘贴到新的电子表格文件中。
- 在 "相位对象度量"菜单中, 选择"融合 (百分比)"。选中将数据向下分解为单个图像。单击 "数据导出" 按钮。数据将自动复制到剪贴板上, 并可复制到包含 "总红对象集成强度数据" 的电子表格文件中。
- 用下面的公式将百分比汇流的转换应用到总面积。
总相位面积 (μm2/图像) = 融合 (%) x (图像高度 (像素) x 分辨率) x (图像宽度 (像素) x 分辨率)
注: 融合 (%) 参数表示每个图像的相位区域的百分比汇合度, 对应于每个井中单元格的区域。导出后, 应将此指标转换为每个图像的总相位区域。通过参考图像通道下的容器属性, 可以找到与上述公式一起用于每个实验容器的相位通道的图像规格 (图像高度、宽度和分辨率)。 - 对总红对象综合强度归一化到总相位区域, 4.1.6 使用以下公式对每个图像进行计算, 以消除整个油井细胞密度的可变性。
- 将每个图像的总红物体综合强度 (rcu xμm 2/图像)值除以其相应的总相位面积 (μm2 2/图像) , 以获得每个图像的 ldl 吸收 (rcu)值。
- 然后, 平均每口井所有图像的低密度脂蛋白吸收 (rcu)数据, 以获得每口井的平均低密度脂蛋白吸收, 然后平均所有复制井的低密度脂蛋白吸收值, 以获得组均值。这些数据是最终的低密度脂蛋白吸收值, 可用于使用所选软件进行说明和统计分析。
结果
活细胞成像可在三个人体细胞系的胆固醇影响研究中对细胞健康进行可靠的监测
我们在三个人细胞系中验证了我们的检测方法, 其中胆固醇稳态调节发挥着主要的病理生理作用, 包括人类肝癌 (hepg2) 细胞、人肾上皮细胞 (hk2) 和人冠状动脉内皮细胞(hcaec)。我们使用活细胞成像系统在4小时的时间内进行低密度脂蛋白吸收检测, 每隔1小时进行一次连续测量。我们的研究结果表明, 所有测试的细胞类型都与这一新技术兼容, 并产生曲线, 表明在以 4.33 h 作为最终终点的流入研究期间连续吸收低密度脂蛋白 (图 2)。图 2所示的流入数据是通过将 rcu xμm2·images 中每个图像的总红物体综合强度 (rcu xμm22 图像中的每个图像的总红色物体综合强度) 归一化获得的 (μ中每个图像的相位对象区域)m2/图像), 以消除细胞密度在整个井的可变性。此外, 为了验证低密度脂蛋白流入法筛选影响低密度脂蛋白胆固醇吸收的化合物的灵敏度, 我们使用了两种已知的抑制低密度脂蛋白流入的阳性对照, 即 dynasore 和 rpcsck9, 以及一种已知诱导低密度脂蛋白的阳性对照吸收, 辛伐他汀。正如我们的结果所证实的, 在对 dynasore 和 rpcsk9 进行治疗后, 所有三个测试的人体细胞系 (hepg2、hk2 和 hcaec) 在4小时的时间内都显示出 ldl 流入量显著减少 (图 2a-c)。例如,图 2a显示, 与 dmso 处理的细胞相比, 在 dynasore 治疗过程中, hepg2 细胞的低密度脂蛋白流入量有所减少;而作为 dynasore 控制车辆控制的 dmso 与未经处理的对照组相比, 对 ldl 流入无显著影响。此外, 我们的研究结果显示, 在辛伐他汀治疗后, hepg2 细胞的低密度脂蛋白吸收显著增加 (图 3), 这支持了这种方法检测低密度脂蛋白流入的显著变化的敏感性。在约4.5 小时的时间点, 这是低密度脂蛋白吸收研究的一个典型的时间点, 低密度脂蛋白流入显著减少与 dynasore 或 rpcsck9 处理, 并增加辛伐他汀治疗 (图 4)。
使用活细胞成像进行低密度脂蛋白吸收研究的一个主要优点是, 该系统提供了每个井中细胞的实时图像, 可用于监测所检测化合物的潜在细胞毒性。图 5-7显示了在初始时间点 (0.33 h) 和最终终点 (4.33 h) 被调查的三个细胞系的代表性图像, 作为 ldl 净流入的视觉参考。这些图像证实了 dynasore 或 rpcsk9 处理后细胞的正常形态, 表明了这些化合物的有效性和安全性。
活细胞分析通过各种治疗方法提供可靠的串行定量胆固醇影响测量
在活细胞成像系统中使用此协议的一个主要优点是能够在整个时间过程中收集数据, 并比较多个时间点的 ldl 流入, 而不仅仅是传统上所做的最后一个时间点。使用该协议, 我们能够计算出在终端时间点以及整个时间过程中1小时间隔的 ldl 流入中的百分比约简。表 2总结了在使用 40μm dynasore 进行10分钟预处理或使用 10μgml rpcsck9 进行1小时预处理后, 三个测试的人体细胞系的低密度脂蛋白流入量减少情况。在 4.33 h 作为最后的研究终点, 在40μm 的情况下使用 dynasore 进行治疗, 可使 hepg2 细胞、hk2 细胞和 hcaec 中的低密度脂蛋白流入分别减少53%、68% 和 54% (表 2a-c) , 用 rpcsck9 在10μgml 时进行治疗可使低密度脂蛋白减少55%流入 hk2 细胞(表 2b)。除了像传统的检测方法那样量化终端时间点之外, 我们还能够对减少实验每个时间点的处理引起的低密度脂蛋白流入进行定量分析。例如,表 2b显示, 与未经处理的细胞相比, hk2 细胞中的 rpcsck9 治疗在1.33 小时减少了 79%, 在2.33小时减少了 67%, 在治疗后的3.33 小时减少了59%。该方案为治疗后低密度脂蛋白流入的定量分析提供了可靠的方法。
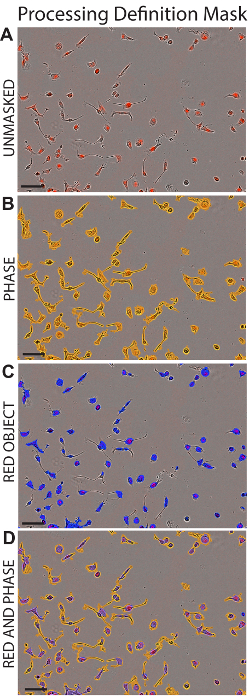
图 1: 处理定义蒙版.在应用适当的处理定义后, 描绘了 h2 细胞的代表性图像 (详见表 1)。显示的面积 Maskapplied 细胞没有掩蔽 (a), 相位蒙片 (b), 红色对象蒙版 (c), 或同时应用相位和红色对象掩码 (d)。刻度栏 = 100μm. 请点击这里查看此图的较大版本.
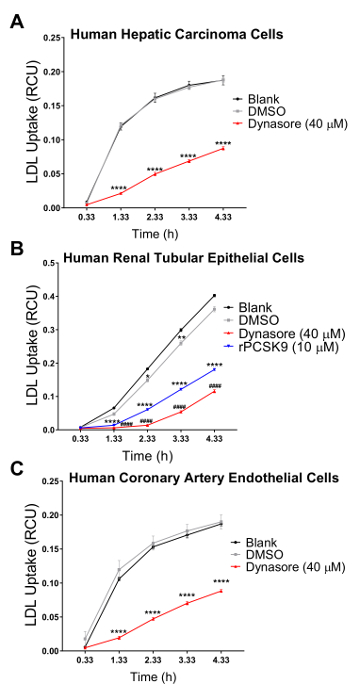
图 2: 在4.33 小时的时间内, 使用活细胞成像系统减少低密度脂蛋白的吸收.活细胞分析系统用于测量人肝癌 (hepg2) 细胞 (a)、人肾小管上皮细胞 (hk2) 和人冠状动脉内皮细胞 (c)中的低密度脂蛋白流入。这些细胞用 dynasore (运行前 10分钟) 或 rpcsck9 (运行前 1小时) 作为阳性对照处理。dmso 被用作 dynasore 治疗的交通工具。阳性对照显著降低了所有3个细胞系的低密度脂蛋白流入。通过将总红物体综合强度 (rcuxμm 2/图像) 归一化为总相位物体面积 (μm2/图像) 得到 ldl 流入值.数据为平均值±sem. n = 6 wells group。数据代表了2或3个独立实验。p & lt; 0.0001 vs. 空白, ## # p & lt; 0.0001 vs dmso, 使用双向 anova。请点击这里查看此图的较大版本.
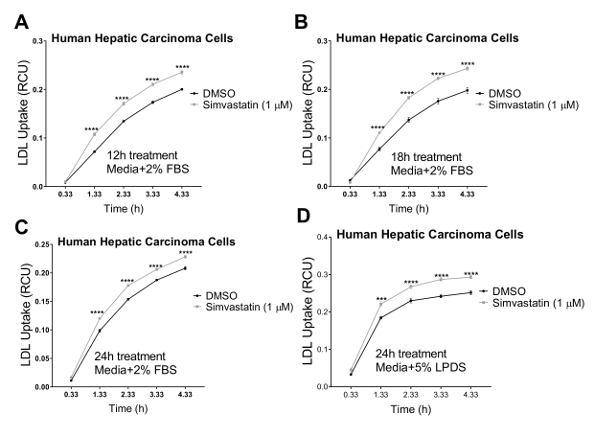
图 3.在 4.33 h 的时间内, 使用活细胞成像系统增加低密度脂蛋白的吸收.活细胞分析系统用于测量人肝癌 (hepg2) 细胞中的低密度脂蛋白流入。使用含有 2% fbs 的培养基, 使用辛伐他汀治疗 12小时 (a)、18小时 (b) 或 24小时 (c) 后, 低密度脂蛋白的吸收显著增加。24小时时间点也是用含有 5% lpds 的介质 (不含 fbs) 进行的。dmso 被用作负控制。通过将总红物体综合强度 (rcu xμm 2 图像) 归一化为总相位物体面积 (μm 2 图像) 得到 ldl流入值。数据为平均值±sem. n = 6 wells group。数据代表了一个独立的实验。p & lt; 0.0001 对 dmso, 使用学生的 t 测试。请点击这里查看此图的较大版本.
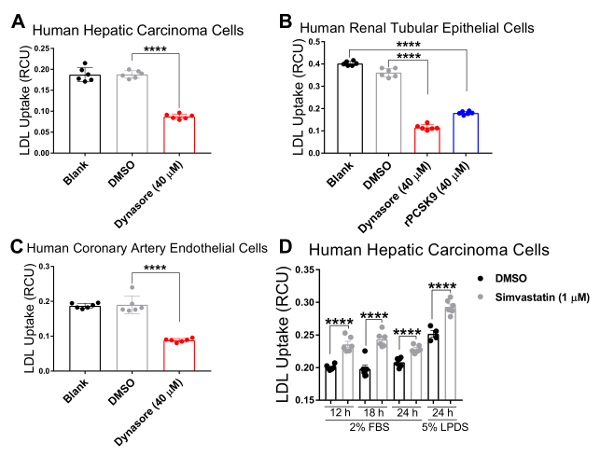
图 4.在4.3 小时的时间点上, 低密度脂蛋白提升剂显著减少低密度脂蛋白流入.低密度脂蛋白摄入量显著降低人肝癌 (hepg2) 细胞 (a)、人肾小管上皮细胞 (hk2) (b) 和人冠状动脉内皮细胞 (c) 在低密度脂蛋白吸收治疗后的摄入量抑制剂 Dynasore 10分钟或 rpcsck9 1小时。辛伐他汀在12小时、18小时或24小时治疗后, hepg2 细胞的低密度脂蛋白流入量显著增加 (d)。数据为平均值±sem. n = 6 wells group。数据代表了2或3个独立实验。p & lt; 0.0001 使用双向方差分析。请点击这里查看此图的较大版本.
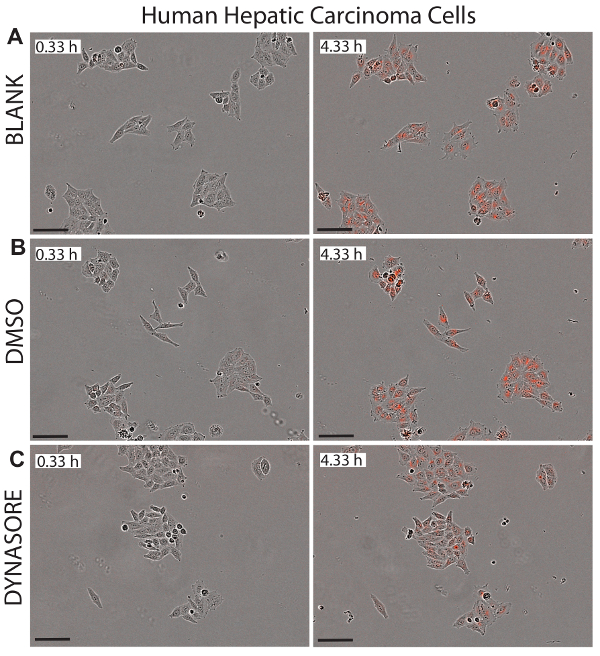
图 5.通过低密度脂蛋白升高剂 dynasore 减少了肝细胞癌 (hepg2) 细胞中的低密度脂蛋白流入.在 0.33 h (左面板) 和 4.33 h 端点 (右面板) 显示细胞健康状态时, 描述了 hepg2 细胞的相对象和红色物体的代表性图像。40μm dynasore 被称为降低低密度脂蛋白胆固醇吸收的阳性对照 (c)。图像是以10倍的放大倍率拍摄的。刻度栏 = 100μm. 请点击这里查看此图的较大版本.

图 6.通过低密度脂蛋白提升剂 dynasore 和 rpcsck9 减少低密度脂蛋白在人肾小管上皮细胞 (hk2) 中的流入.在 0.33 h (左面板) 和 4.33 h 端点 (右面板) 上描绘的 h2 单元的相位对象和红色对象的代表性图像显示单元格的健康状态。采用 40μm dynasore (c), 或 10μgml rpcsk9 (d), 用于降低低密度脂蛋白胆固醇的吸收, 作为阳性对照。图像以10倍的放大倍率拍摄。刻度栏 = 100μm. 请点击这里查看此图的较大版本.
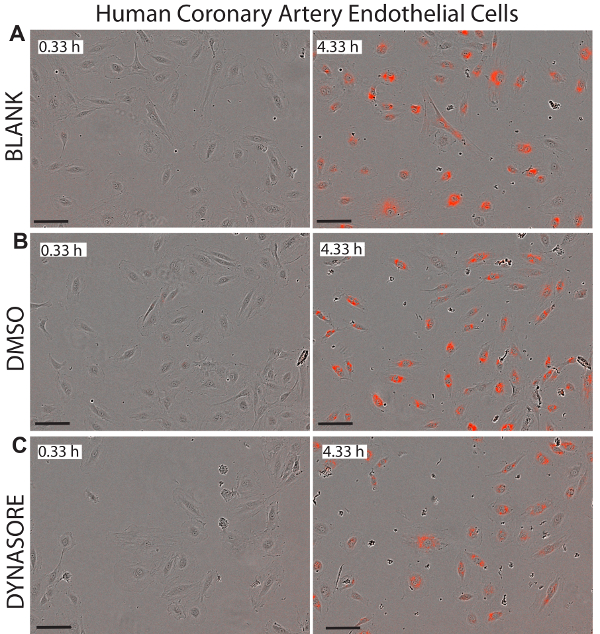
图 7.利用低密度脂蛋白降升剂 dynasore 减少了 ldl 在人冠状动脉内皮细胞 (hcaec) 中的涌入.在 0.33 h (左面板) 和 4.33 h 端点 (右面板) 上描绘的 hcaec 的相位对象和红色对象的代表性图像显示了单元格的健康状态。40μm dynasore 被称为降低低密度脂蛋白胆固醇吸收的阳性对照 (c)。图像是以10倍的放大倍率拍摄的。刻度杆 = 100μm. 数据为平均值±sem. n = 6 wells group。数据代表了2或3个独立实验。请点击这里查看此图的较大版本.
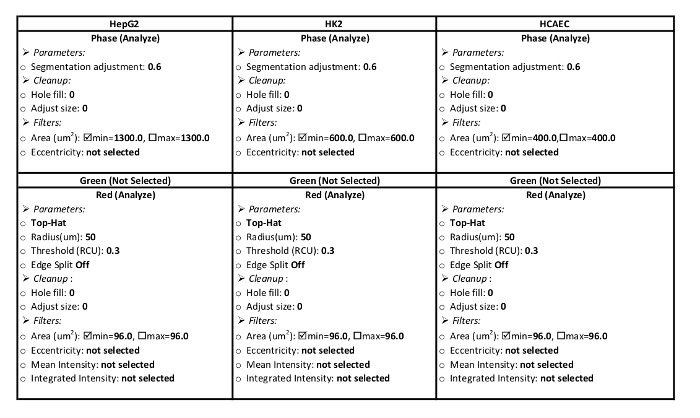
表 1: 处理定义参数.这些参数是本协议中使用的分析系统所特有的。应设置参数来分析红色通道中的红色区域和相位通道中的细胞区域。给出了 hepg2、hk2、hcae 细胞系的参数设置。
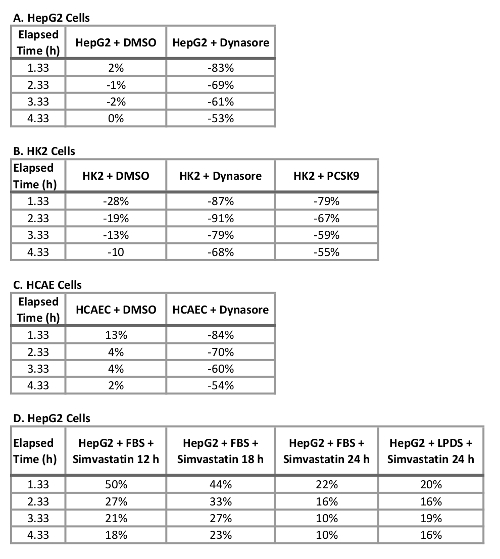
表 2: 经 dynasore、rpcsck9 或辛伐他汀处理的 hepg2、hk2 和 hcae 细胞低密度脂蛋白流入在4.3 小时内的百分比变化.(a) hepg2 细胞、(b) hk2 细胞、(c) hcae 细胞和 (d) hepg2 细胞。
讨论
在目前的协议中, 我们展示了活细胞成像作为一种新的和更有效的方法来测量实时低密度脂蛋白吸收在一个过程中的各种人类细胞系。人类肝癌 (hepg2) 细胞通常用于研究筛查降低胆固醇的疗法21,22,23,24,25, 26, 39,40。因此, 我们选择这种细胞类型来测试活细胞成像系统的能力, 用于低密度脂蛋白流入研究。我们的研究结果表明, hepg2 细胞与这一新技术兼容, 并产生类似 sigmoid-s 的曲线, 表明在流入试验期间连续吸收低密度脂蛋白, 直到 4.33 h 作为最终终点 (图 2a和图 3)).
胆固醇的稳态在各种肾病的病理生理学中起着重要作用。事实上, 肾脏组织中胆固醇的积累是导致慢性肾病的主要导致肾纤维化的因素, 也是28、29、30、31种肾病的主要病理。因此, 我们研究了我们的方法在人肾上皮细胞 (hk2) 作为一个流行和可靠的细胞系在肾脏病学领域。我们的数据还支持了活细胞成像系统的可行性, 以测量 h2 细胞中的低密度脂蛋白流入。如图 2b 所示, h2 细胞在整个流入研究期间 (4小时) 线性吸收低密度脂蛋白胆固醇。
由于胆固醇代谢在动脉粥样硬化的发展和进展中的重要性 32,33,41, 心血管疾病的主要原因, 这反过来又是世界第一杀手42, 我们的目标是验证我们的方法在动脉粥样硬化相关的细胞类型。我们使用人冠状动脉内皮细胞 (hcaec), 因为这些是最早暴露在动脉粥样硬化患者冠状动脉腔中的胆固醇侮辱的细胞类型之一。我们的数据如图 2c所示, 这种 ldl 流入方法也有效地与 hcaec 一起工作。生成的图是类似于 hepg2 细胞的 sigmoid-n 状曲线。
为了验证这种改进的低密度脂蛋白流入方法在筛选影响低密度脂蛋白胆固醇吸收的化合物方面的有效性和敏感性, 我们使用了三种对照, 即低密度脂蛋白降升剂 dynasore 和 rpcsck9, 以及低密度脂蛋白流入激活剂辛伐他汀。在这里, 我们在检测涌入之前, 对上述细胞系 (hepg2、hk2 和 hcaec) 进行了优化浓度的 dynasore 或 rpcsck9。我们的结果表明, 所有三个测试的细胞系对治疗的反应是显著减少 ldl 流入在4小时的时间过程中 (图 2)。例如, 在 4.33 h 作为最后时间点的情况下, 以40μm 的时间对 dynasore 进行治疗, 可使 hepg2 细胞、hk2 细胞和 hcaec 中的低密度脂蛋白流入分别减少53%、68% 和 54% (p<0.0001;图 2a-c和表 2a-c)。此外, 10μgml 的 rpcsck9 使 hk2 细胞 (p<0.0001 的低密度脂蛋白流入量显著减少 55%;图 2b和表 2 b)。此外, 我们的研究结果表明, 辛伐他汀治疗 hepg2 细胞可显著增加低密度脂蛋白的吸收 (图 3), 支持这种方法检测低密度脂蛋白流入的显著变化的敏感性。本协议不包括在 hepg2 和 hcaec 细胞中使用 rpcsk9 进行治疗的研究, 因为 rpcsk9 被用作一种额外的控制治疗, 结果有据可查, 但少量购买的成本很高。因此, rpcsck9 仅用于在 h2 单元中验证此协议。
活细胞成像分析, 以及功能和及时测量低密度脂蛋白流入, 允许持续监测细胞的健康和形态。这一优势可以有效地检测应用化合物的潜在细胞毒性, 使这种方法成为同时监测药理活性和细胞毒性的理想技术。图 5-7显示了在最后终点 (4.33 h) 测试的三个细胞系的代表性图像, 作为治疗对净低密度脂蛋白流入的影响的视觉参考, 并显示了测试后细胞的健康形态治疗。我们建议对每口井的所有图像进行目视检查, 以确保细胞在研究期间的健康形态。例如, 在未显示的数据中, 当检测使用 80μm dynasore 处理的 hepg2 细胞图像时, 我们观察到细胞脱离的迹象, 因为细胞的边缘似乎正在从板上抬起, 这表明细胞脱离的浓度较高。迪纳索尔此外, 高浓度的辛伐他汀 (3-10μm) 也导致形态改变, 表明诱导凋亡, 据报告, 高剂量的司他汀45。该方案用于在20-80μm 的情况下对 dynasore 治疗进行滴定, 辛伐他汀在 0.5-10μm 浓度下进行滴定, 然后使用细胞图像分析细胞的健康状况, 并确定处理的潜在毒性。不同浓度。结果表明, 染料使用 40μm, 辛伐他汀使用1μm 作为最佳浓度。
最后, 我们建议, 如果要使用这种方法测试另一条细胞系, 则进行细胞密度滴定研究, 以确定每口井的最佳细胞数量, 从而获得一致的结果。我们的细胞密度优化研究表明, 在24孔板中, 10, 000 细胞/井可使 hk2 和 hcae 细胞获得一致的低密度脂蛋白流入结果。需要注意的是, 对于使用活细胞成像系统的 ldl 流入检测, 需要在井上均匀分布的非融合细胞单层, 因为细胞团块可能会导致最终归一化 ldl 流入值的错误。其原因是, 为了实现流入数据的规范化, 使用相位对象区域作为细胞密度的度量, 并且当单元团形成时, 此参数可能会受到不利影响。我们观察到 hepg2 细胞在密度高于5000细胞井时有形成团块的倾向, 导致不一致的流入结果;因此, 我们在一个24孔板中使用了每口 5, 000个细胞, 作为 hepg2 细胞的最佳密度。
总之, 我们的方法提供了一个中高通量平台, 筛选同时调节低密度脂蛋白流入的化合物的药理活性和细胞毒性。这种方法可以很容易地适应与其他荧光标记配体进入溶酶体隔间, 以评估配体的实时吸收。虽然该协议提供了 inucyte 实时成像和分析系统的规范, 但该协议可适用于其他成像系统, 如 cellomics。
披露声明
提交人声明, 他们没有相互竞争的经济利益。
致谢
这项工作得到了以下向阿盟提供的赠款的支持: 国家卫生研究所 (r56hl132209 和 1R01HL140468 68) 和迈阿密心脏研究所。ky 是美国心脏协会博士奖学金 (18pre3360070) 的获得者。迈阿密-米勒医学院46、47、48的 emmanuel thomas 博士为 hepg2细胞提供了亲切的治疗。
材料
| Name | Company | Catalog Number | Comments |
| pHrodo Red-LDL | ThermoFisher Scientific | L34356 | |
| HepG2 cells | E. Thomas Lab, U. Miami | HB-8065 | |
| MEM | Sigma | M0325 | |
| Sodium Pyruvate | Sigma | P5280 | |
| L-Glutamine 200 mM solution | Sigma | G7513 | |
| FBS | Atlas Biologicals | FP-0500-A | |
| HK2 cells | ATCC | CRL-2190 | |
| Keratinocyte SFM media kit | Gibco | 17005-042 | |
| Primary Coronary Artery Endothelial Cells | ATCC | PCS-100-020 | |
| Vascular Cell Basal Medium | ATCC | PCS-100-030 | |
| Endothelial Cell Growth Kit-VEGF | ATCC | PCS-100-041 | |
| Human Lipoprotein Deficient Serum | Millipore | LP4 | |
| PBS | Sigma | D8537 | |
| Trypsin-EDTA (0.25%) | Gibco | 25200056 | |
| Trypsin-EDTA (0.05%) | Gemini Bio-Products | 400-150 | |
| Trypsin Neutralizing Solution | ATCC | PCS-999-004 | |
| 24 well plate | Falcon | 353226 | |
| 40 μM mesh cell strainer | VWR | 10199-654 | |
| 15 mL conical tubes | VWR | 89039-666 | |
| 50 mL conical tubes | VWR | 89039-658 | |
| Trypan Blue Staining (0.4%) | Life Technologies | T10282 | |
| Counting Slides | Bio-Rad | 145-0011 | |
| Incucyte Zoom | Sartorius | Zoom | Imaging and analysis platform |
| Dynasore Hydrate | Sigma | D7693 | |
| PCSK9 Recombinant Protein | Cayman Chemicals | 20631 |
参考文献
- Baigent, C., et al. Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90,056 participants in 14 randomised trials of statins. Lancet. 366 (9493), 1267-1278 (2005).
- Trevisan, R., Dodesini, A. R., Lepore, G. Lipids and renal disease. Journal of the American Society of Nephrology. 17 (4), 145-147 (2006).
- Tall, A. R., Yvan-Charvet, L. Cholesterol, inflammation and innate immunity. Nature Reviews Immunology. 15 (2), 104 (2015).
- Dedoussis, G. V., Schmidt, H., Genschel, J. LDL-receptor mutations in Europe. Human Mutation. 24 (6), 443-459 (2004).
- Sasaki, K., et al. ATP-binding cassette transporter A subfamily 8 is a sinusoidal efflux transporter for cholesterol and taurocholate in mouse and human liver. Molecular Pharmaceutics. , (2018).
- Storch, J., Xu, Z. Niemann-Pick C2 (NPC2) and intracellular cholesterol trafficking. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids. 1791 (7), 671-678 (2009).
- Jansen, P. J., et al. Absence of ApoE upregulates murine brain ApoD and ABCA1 levels, but does not affect brain sterol levels, while human ApoE3 and human ApoE4 upregulate brain cholesterol precursor levels. Journal of Alzheimer's Disease. 18 (2), 319-329 (2009).
- Girard, E., et al. The dynamin chemical inhibitor dynasore impairs cholesterol trafficking and sterol-sensitive genes transcription in human HeLa cells and macrophages. PLoS One. 6 (12), 29042 (2011).
- Robinet, P., et al. Dynamin is involved in endolysosomal cholesterol delivery to the endoplasmic reticulum: role in cholesterol homeostasis. Traffic. 7 (7), 811-823 (2006).
- Macia, E., et al. Dynasore, a cell-permeable inhibitor of dynamin. Developmental Cell. 10 (6), 839-850 (2006).
- Benjannet, S., et al. NARC-1/PCSK9 and its natural mutants: zymogen cleavage and effects on the LDLR and LDL-cholesterol. Journal of Biological Chemistry. , (2004).
- Qian, Y. -. W., et al. Secreted PCSK9 downregulates low density lipoprotein receptor through receptor-mediated endocytosis. Journal of Lipid Research. 48 (7), 1488-1498 (2007).
- Brown, M. S., Goldstein, J. L. A receptor-mediated pathway for cholesterol homeostasis. Science. 232 (4746), 34-47 (1986).
- Goldstein, J. L., Brown, M. S. History of discovery: the LDL receptor. Arteriosclerosis, Thrombosis, and Vascular Biology. 29 (4), 431 (2009).
- Stephan, Z. F., Yurachek, E. C. Rapid fluorometric assay of LDL receptor activity by DiI-labeled LDL. Journal of Lipid Research. 34 (2), 325-330 (1993).
- Fisher, T. S., et al. Effects of pH and low density lipoprotein (LDL) on PCSK9-dependent LDL receptor regulation. Journal of Biological Chemistry. 282 (28), 20502-20512 (2007).
- Atrahimovich, D., Khatib, S., Sela, S., Vaya, J., Samson, A. O. Punicalagin induces serum low-density lipoprotein influx to macrophages. Oxidative Medicine and Cellular Longevity. 2016, (2016).
- Xu, M., et al. δ-Tocopherol reduces lipid accumulation in Niemann-Pick type C1 and Wolman cholesterol storage disorders. Journal of Biological Chemistry. 112, (2012).
- Bonilla, D. L., et al. Autophagy regulates phagocytosis by modulating the expression of scavenger receptors. Immunity. 39 (3), 537-547 (2013).
- Guo, M., et al. Apelin-13 Decreases Lipid Storage in Hypertrophic Adipocytes In vitro Through the Upregulation of AQP7 Expression by the PI3K Signaling Pathway. Medical Science Monitor : International Medical Journal of Experimental and Clinical Research. 20, 1345-1352 (2014).
- Guillemot, J., Asselin, M. C., Susan-Resiga, D., Essalmani, R., Seidah, N. G. Deferoxamine stimulates LDLR expression and LDL uptake in HepG2 cells. Molecular Nutrition & Food Research. 60 (3), 600-608 (2016).
- Javitt, N. B. Hep G2 cells as a resource for metabolic studies: lipoprotein, cholesterol, and bile acids. The FASEB Journal. 4 (2), 161-168 (1990).
- Mullen, P. J., Lüscher, B., Scharnagl, H., Krähenbühl, S., Brecht, K. Effect of simvastatin on cholesterol metabolism in C2C12 myotubes and HepG2 cells, and consequences for statin-induced myopathy. Biochemical Pharmacology. 79 (8), 1200-1209 (2010).
- McNutt, M. C., et al. Antagonism of secreted PCSK9 increases low density lipoprotein receptor expression in HepG2 cells. Journal of Biological Chemistry. 284 (16), 10561-10570 (2009).
- Scharnagl, H., et al. Effect of atorvastatin, simvastatin, and lovastatin on the metabolism of cholesterol and triacylglycerides in HepG2 cells. Biochemical Pharmacology. 62 (11), 1545-1555 (2001).
- Scharnagl, H., et al. The effects of lifibrol (K12. 148) on the cholesterol metabolism of cultured cells: evidence for sterol independent stimulation of the LDL receptor pathway. Atherosclerosis. 153 (1), 69-80 (2000).
- Chan, J. C., et al. A proprotein convertase subtilisin/kexin type 9 neutralizing antibody reduces serum cholesterol in mice and nonhuman primates. Proceedings of the National Academy of Sciences. 106 (24), 9820-9825 (2009).
- Ding, W., et al. Osteopontin deficiency ameliorates Alport pathology by preventing tubular metabolic deficits. JCI Insight. 3 (6), (2018).
- Herman-Edelstein, M., Scherzer, P., Tobar, A., Levi, M., Gafter, U. Altered renal lipid metabolism and renal lipid accumulation in human diabetic nephropathy. Journal of Lipid Research. 55 (3), 561-572 (2014).
- Su, H., et al. Lipid Deposition in Kidney Diseases: Interplay Among Redox, Lipid Mediators, and Renal Impairment. Antioxidants & Redox Signaling. 28 (10), 1027-1043 (2018).
- Agrawal, S., Zaritsky, J. J., Fornoni, A., Smoyer, W. E. Dyslipidaemia in nephrotic syndrome: mechanisms and treatment. Nature Reviews Nephrology. 14 (1), 57 (2018).
- Babiak, J., Rudel, L. L. Lipoproteins and atherosclerosis. Baillieres Clinical Endocrinology and Metabolism. 1 (3), 515-550 (1987).
- Wang, H. H., Garruti, G., Liu, M., Portincasa, P., Wang, D. Cholesterol and Lipoprotein Metabolism and Atherosclerosis: Recent Advances in Reverse Cholesterol Transport. Annals of Hepatology. 16 (1), 28-42 (2018).
- Preta, G., Cronin, J. G., Sheldon, I. M. Dynasore-not just a dynamin inhibitor. Cell Communication and Signaling. 13 (1), 24 (2015).
- Horton, J. D., Cohen, J. C., Hobbs, H. H. Molecular biology of PCSK9: its role in LDL metabolism. Trends in Biochemical Sciences. 32 (2), 71-77 (2007).
- Abifadel, M., et al. Mutations in PCSK9 cause autosomal dominant hypercholesterolemia. Nature Genetics. 34 (2), 154 (2003).
- Goldstein, J. L., Brown, M. S. Regulation of the mevalonate pathway. Nature. 343 (6257), 425 (1990).
- Dong, B., Wu, M., Cao, A., Li, H., Liu, J. Suppression of Idol expression is an additional mechanism underlying statin-induced up-regulation of hepatic LDL receptor expression. International Journal of Molecular Medicine. 27 (1), 103-110 (2011).
- Song, K. H., Kim, Y. H., Im, A. -. R., Kim, Y. H. Black Raspberry Extract Enhances LDL Uptake in HepG2 Cells by Suppressing PCSK9 Expression to Upregulate LDLR Expression. Journal of Medicinal Food. , (2018).
- Chan, J. C., et al. A proprotein convertase subtilisin/kexin type 9 neutralizing antibody reduces serum cholesterol in mice and nonhuman primates. Proceedings of the National Academy of Sciences of the United States of America. 106 (24), 9820-9825 (2009).
- Tabas, I., Williams, K. J., Borén, J. Subendothelial lipoprotein retention as the initiating process in atherosclerosis: update and therapeutic implications. Circulation. 116 (16), 1832-1844 (2007).
- Benjamin, E. J., et al. Heart disease and stroke statistics-2017 update: a report from the American Heart Association. Circulation. 135 (10), 146-603 (2017).
- Brown, M. S., Goldstein, J. L. The SREBP pathway: regulation of cholesterol metabolism by proteolysis of a membrane-bound transcription factor. Cell. 89 (3), 331-340 (1997).
- Horton, J. D., Goldstein, J. L., Brown, M. S. SREBPs: activators of the complete program of cholesterol and fatty acid synthesis in the liver. The Journal of Clinical Investigation. 109 (9), 1125-1131 (2002).
- Tavintharan, S., et al. Reduced mitochondrial coenzyme Q10 levels in HepG2 cells treated with high-dose simvastatin: A possible role in statin-induced hepatotoxicity. Toxicology and Applied Pharmacology. 223 (2), 173-179 (2007).
- Thomas, E., et al. HCV infection induces a unique hepatic innate immune response associated with robust production of type III interferons. Gastroenterology. 142 (4), 978-988 (2012).
- Thomas, E., Liang, T. J. Experimental models of hepatitis B and C-new insights and progress. Nature Reviews Gastroenterology & Hepatology. 13 (6), 362 (2016).
- Yoneda, M., et al. Hepatitis B Virus and DNA Stimulation Trigger a Rapid Innate Immune Response through NF-κB. The Journal of Immunology. , 1502677 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。