需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
荧光显微镜对聚焦超声的刺激
摘要
低强度脉冲超声刺激 (lipus) 是一种非侵入性机械刺激的方式内源性或工程细胞具有较高的空间和时间分辨率。本文介绍了如何将 lipus 应用于荧光显微镜, 以及如何最大限度地减少超声路径上的声阻抗不匹配, 以防止不需要的机械文物。
摘要
通过聚焦穿透软组织的低强度超声脉冲, lipus 代表了一种很有前途的生物医学技术, 可以远程和安全地操作神经发射、激素分泌和基因重新编程的细胞。然而, 由于缺乏生物物理机制, 目标组织能够感知和响应 lipus, 这一技术在医疗应用中的翻译工作目前受到阻碍。识别这些机制的一个适当方法是使用光学生物传感器与 lipus 相结合, 以确定潜在的信号通路。然而, 将 lipus 应用于荧光显微镜可能会引入不需要的机械人工制品, 因为存在反射、吸收和折射声波的物理界面。本文介绍了一个循序渐进的过程, 将 lipus 集成到商业上可用的直立荧光显微镜上, 同时最大限度地减少沿声学路径的物理界面的影响。描述了一个简单的程序来操作单元超声传感器, 并将传感器的焦点带入目标焦点。利用钙成像技术测量的人胶质母细胞瘤细胞中, 通过 lips 诱导的钙瞬变技术说明了 lipus 的应用。
引言
许多疾病需要某种形式的侵入性医疗干预。这些程序往往费用高昂, 风险大, 需要恢复期, 从而给保健系统增加负担。非侵入性治疗方式有可能为传统外科手术提供更安全、更便宜的替代品。然而, 目前的非侵入性方法, 如药物治疗或经颅磁刺激往往受到组织渗透、时空分辨率和不必要的非目标效应之间权衡的限制。在这方面, 聚焦超声是一种很有希望的非侵入性技术, 有可能操纵组织内部深处的生物功能, 具有较高的时空准确性和有限的非目标效应。
聚焦超声刺激包括在生物体深处的精确位置提供声学能量。根据声学脉冲参数, 这种能量可以有多种医学用途。例如, 食品药品监督管理局已批准使用高强度聚焦超声 (hifu) 对前列腺肿瘤、引起震颤的大脑区域、子宫肌瘤和导致疼痛的神经端进行热消融1.hif 介导的微泡空化也被用来短暂地打开血脑屏障, 以便有针对性地提供系统管理的治疗方法2。用于 hfu 应用的空间峰值脉冲平均强度 (isppa) 和空间峰值时间平均强度 (ispta) 通常在几个 kw cm-2 以上, 并产生几十兆帕的脉冲压力。这些强度值远远高于 fda 批准的 isppa和 isppa限制的诊断超声, 190 w 厘米-2和 720 mw 厘米-2, 分别为3。相反, 最近的研究表明, 在诊断超声强度限制 (lipus) 范围内或接近范围内的非破坏性脉冲超声刺激可以有效地远程和安全地操纵神经射击4, 5,6,7,8, 激素分泌9,10和生物工程细胞11。然而, 细胞感知和对超声反应的细胞和分子机制仍不清楚, 排除了 lipus 的临床翻译。因此, 在过去几年中, 超声刺激的人造膜、培养细胞和动物的研究获得了揭示 lipus12,13 调节的生物物理和生理过程的势头. 14,15。
声音是由通过物理介质传播的振动组成的。超声波是一种频率高于人类听觉范围 (即超过20千赫) 的声音。在实验室环境中, 超声波通常由压电传感器产生, 这些传感器包含一种材料, 该材料在特定高频带宽中振荡的电场时振动。有两种类型的传感器: 单元件传感器和传感器阵列。单元件压电换能器具有一个曲面, 作为一个聚焦透镜, 因此将声能集中到一个被称为焦点区的定义区域。单元件传感器比传感器阵列更便宜、更易于操作。本文将重点介绍单元素传感器。
聚焦单元件传感器的焦距大小取决于声学透镜的几何特性及其声学频率。为了使用单个元件传感器实现毫米大小的焦距, 通常需要 mhz 范围内的超声波频率。不幸的是, 在空气等稀薄介质中传播时, 这样频率的声波会非常迅速地衰减。因此, 需要在更密集的材料 (如水) 中生成和传播到样品中的 mhz 超声波。这是将 lipus 模式集成到显微镜中的第一个挑战。
第二个挑战是沿着声路最大限度地减少具有不同声阻抗 (材料密度和声速的乘积) 的材料之间的物理接口。这些接口可以反射、折射、散射和吸收声波, 因此很难量化有效传递到样品的声能量量。它们还可能产生不需要的机械制品。例如, 反射产生的垂直于声学不匹配阻抗接口会产生反向传播波, 从而干扰向前传播的波。沿着干涉路径, 波在称为节点的空间的固定区域相互抵消, 并在称为反节点的交替区域进行求和, 从而产生所谓的驻波 (图 1)。实验者必须能够在体外控制或消除这些实验接口, 因为它们可能在体内不存在。
光学记者荧光测量是一种众所周知的实时询问透明生物样品的方法, 没有物理干扰。因此, 这种方法是 lipus 研究的理想选择, 因为在声纳区域存在的任何物理探针都会引入机械人工制品。该协议描述了 lipus 在商业荧光显微镜上的实现和操作。
研究方案
1. 透明透明聚酯薄膜上的生长细胞
- 使用垂直压钻在标准35毫米培养盘底部钻12毫米孔大小。慢慢移动钻头, 并戴上护目镜。使用刀片取出连接在盘子底部的塑料碎片, 在侧面形成光滑的表面 (图 2)。
- 在菜品的外底面涂上一层薄薄的海洋级环氧树脂或胶水。
- 将聚酯薄膜 (2.5 微米厚) 放在盘子的外底面上, 并用力按压, 以确保环氧胶在薄膜和厚塑料表面之间均匀地扩散。用手指以离心方式轻轻拉膜, 形成平坦的表面 (图 2)。
- 当环氧胶干燥后, 用95% 乙醇对聚酯底部的盘子进行短暂的漂洗, 并将盘子和盖子的内表面置于强 254 nm uv 激发源下进行消毒。调整持续时间和强度, 提供约 330 mj 厘米-2的紫外线剂量, 以完全销毁大多数类型的微生物。使用 1, 000μw cm-2 uv 照明, 这种能量大约相当于 5分钟的持续时间。
- 在小管 (50-100μl) 中提供的细胞外基质蛋白混合物 (empm), 并在无菌条件下将其存储在-20°c 或更低的温度下。
- 在无菌环境中 (例如,在生物安全柜内), 用所需的培养基稀释冷冻的 empm 库存, 使其达到1:100。在冰上工作, 防止在室温下进行 empm 聚合。快速将100μl 的中混合物涂在聚酯薄膜上。将盖子放在盘子上, 以保持无菌。
- 在37°c 的细胞培养 co2 孵化器中孵育 empm 涂层聚酯底盘6-12。
- 孵育后, 吸入多余的培养基, 并直接在所需密度的细胞中播种表面。在无菌条件下工作, 保持无菌。
2. lipus 实施
- 将水箱放置在垂直显微镜的目标下, 工作体积大, 在传输路径中没有照明硬件。
- 使用市场上可用的光学元件, 将样品支架置于目标下方, 将传感器支架置于样品支架下方。对于后续的样本搜索和超声对齐, 请将这两个支架安装在翻译阶段。
- 将翻译阶段的运动部件和执行器放置在水箱外或水线上方, 以避免水的损坏。仅使用非腐蚀性材料, 如阳极氧化铝或不锈钢浸入式光学机械部件。
- 在使用浸入式换能器之前, 请先将去离子化和脱气的水填充水箱。水线应与样品支架的水平平面一致 (图 3)。
注: 在高电场的情况下, 去离子水可以防止电耦合。脱气也会防止声波的散射和改变。每次实验后使用泵或阀门排水, 使水线低于换能器的位置。此外, 经常更换或过滤水, 并根据需要清理水箱, 以避免微生物的生长。
3. 斜声激励
- 使用市售的光学元件, 将传感器定位在相对于光学路径的倾斜位置。这将确保任何反射波都将被定向离开样本 (图 3和图 4)。
4. 驾驶换能器
注: 超声波换能器将振荡的电能转化为压电材料的机械膨胀收缩。这种转换以热能的形式产生能量损失。因此, 虽然换能器确实具有峰值输入电压限制, 但它们也具有功率限制, 以避免对压电元件的热损坏: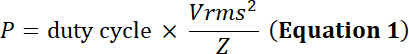
以占空比电模拟的时间的相对部分, p电源 (在瓦特), vrms输入根平均平方电压 (在伏特) 的供选择的电压和z电子阻抗 (在欧姆中)。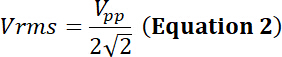
将峰值到峰值输入电压施加到传感器上。
- 使用商业函数发生器创建包含所需频率、每个脉冲的循环次数和脉冲重复频率的正弦波形式。然而, 相对较高的 vpp 需要有效驱动标准的超声波传感器往往需要增加一个功率放大器来放大输出 (即, 增加 vpp的振幅) 的功能。
注: 例如, 传感器制造商表示给定传感器的功率限制为 35 w。在占空比为50% 并通过 50 db/100 w放大器放大的输入周期为 500 mv 的正弦峰值到峰值输入电压 (v in) 是否在该传感器的功率限制范围内?- 要回答这个问题, 请计算放大后的电压。对于射频 (rf) 功率放大器, 放大因子 (db) 定义为:
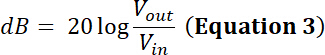
因此, 放大电压具有振幅输出 vpp (vpp = v输出) 的: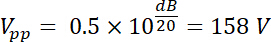
使用公式1和 2, 并使用50ω作为电阻, 此电压产生的相应功率为: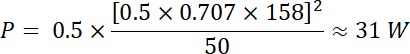
因此, 这种刺激在传感器的功率范围内。 - 使用上面的示例, 计算与传感器制造商提供的功率和电压限制相对应的波形参数 (vpp、频率、脉冲持续时间和脉冲重复频率)。请务必遵守这些限制, 以避免损坏传感器和其他连接的仪器。
- 要回答这个问题, 请计算放大后的电压。对于射频 (rf) 功率放大器, 放大因子 (db) 定义为:
- 选择在与超声传感器兼容的频率范围内工作的功能发生器。将函数发生器的频率调整为传感器的额定峰值频率。
- 使用函数发生器的突发模式创建所需持续时间和重复频率的正弦电压脉冲。将峰值电压调整到所需的值。确保脉冲持续时间比两个连续脉冲之间经过的时间短。
- 通过将函数发生器的输出连接到示波器的输入, 检查波形是否与所需信号相对应。
- 将函数发生器的输出连接到功率射频放大器的输入 (图 4)。确保刺激参数在传感器制造商的范围内。
5. 光束对齐
- 选择与超声换能器的频率和强度兼容的频率范围和声强的水听器。
- 小心地将水听器探头的尖端放在目标视野内与样品位置相对应的位置上 (图 4)。
- 确保探头和传感器都浸入脱离子和脱气的水中。不要用水以外的任何物理物体撞击水听器的尖端, 因为这会改变水的涂层并影响测量。
- 通过直观地将传感器的声轴定位到水听器探头, 对传感器进行总预对齐。确保传感器表面与水听器尖端之间的距离与传感器的焦距大致相对应。
- 将水听器输出连接到示波器的一个信号输入。将同步触发器从函数生成器连接到另一个示波器输入。在示波器上同时显示这两个信号。
- 在低占空比和低振幅下, 用很少的超声波循环驱动传感器, 以避免损坏探头。请咨询水听器制造商的安全操作条件, 以避免损坏水听器提示。
- 根据超声波从传感器表面到水听器的行程时间, 调整 s/除法旋钮。同步触发器后, 在示波器上查找水听器信号。
- 使用电动或手动 xyz 级慢慢驱动传感器。将传感器放置在与最大水听器信号相关的位置 (图 4)。
注: 如果未检测到任何信号, 则可能是声脉冲的强度太低, 或者光束被物体不对齐或散射。定期检查水听器和换能器在视觉上是预对齐的, 并且路径中除了聚酯薄膜之外, 路径中是否没有气泡或物理物体。如果仍未检测到信号, 请将输入电压少量增加, 以增加水听器信号的振幅。
6. 超声脉冲压力和强度的测定
- 在光束对齐的情况下, 测量示波器上的水听器输出峰值振幅, 以实现各种电压驱动传感器。确保不要超过水听器制造商建议的压力限制。
- 使用水听器制造商提供的校准方法, 将这些测量值转换为压力和/或声学强度值。
注: 声学强度可以通过压力来确定, 反之亦然, 使用公式:
与i声学压力 (在 w m-2), p声学压力 (在 pa), 传播材料的密度 (1, 000 公斤 m-2 为水) 和c声速在传播媒介 (为水, c =1, 500 米-1)。 - 使用这些测量值创建校准曲线。
注: 压力与电压和强度与电压曲线的关系分别呈线性和抛物线形状。 - 使用相应的校准曲线确定所需驱动电压的压力和/或强度值。
7. 钙敏/lipus 活细胞荧光成像
- 将细胞的培养基替换为所需的成像缓冲液, 其中含有5μm 的细胞钙敏感染料 (例如,氟-4 am)。在37°c 的二氧化碳孵化器中孵育培养皿1小时。
- 用相同的缓冲液小心清洗细胞, 不含染料。
- 将盘子放在样品架上。使用蓝光照明 (490 nm) 激发细胞, 并调整激发强度和相机曝光, 以避免过度漂白或像素饱和。
- 使用所需的图像采集设置执行延时成像。使用浸入目标以获得更好的图像质量和较长的工作距离, 以减少不需要的反射 (参见图 4)。
结果
图 5是使用钙成像多路复用的 lipus 实验的一个例子。在标准培养基中 (辅以10% 血清和1% 抗生素) 的 empm 涂层聚酯薄膜上培养胶质母细胞瘤细胞 (a-172), 并以钙敏感荧光记者氟-4 am 孵育。使用10倍浸入透镜对细胞进行成像, 并使用白色 led 光源进行照明, 并使用标准 gfp 滤光片集收集荧光灯。lipus 是通过手动驱动脉冲波形为 158 v 峰值振幅、0.1 ms 脉冲持续时?...
讨论
聚焦超声的一个主要优点是能够以高时空精度向生物样品非侵入性地传递机械和热能或热能。其他旨在机械刺激细胞的技术通常采用侵入性物理探针 (如细胞戳), 或需要高能激光束与异物 (如光推子) 相互作用。磁加热可以加热生物样品中的特定空间位置, 但需要存在外来磁性纳米粒子。另一方面, 使用红外或微波激发17、18、19可以?...
披露声明
作者没有什么可透露的。
致谢
我们感谢米哈伊尔·夏皮罗博士和尼基塔·雷兹尼克博士进行了富有成果的讨论。这项工作得到了西方卫生科学大学启动资金和国家卫生研究院 r21ns101384 赠款的支持。
材料
| Name | Company | Catalog Number | Comments |
| upright microscope with large working volume | Thorlabs | CERNA | |
| upright microscope with large working volume | Scientifica | SliceScope | |
| optomechanical components | Thorlabs | n/a | |
| needle hydrophone | ONDA Corporation | HNP/C/R/A/T series + AH/G pre-amplifier | |
| needle hydrophone | Precision Acoustics | n/a | |
| fiber optic hydrophone | ONDA Corporation | HFO series | |
| fiber optic hydrophone | Precision Acoustics | n/a | |
| oscilloscope | Keysight Technology | DSOX2004A (4-channels 70MHz) | |
| function generator | Keysight Technology | 33500B (20MHz single-channel) | |
| RF power amplifier | Electronic Navigation Industries (ENI) | 325LA, 525LA, 240L, 350L, A075, 2100L, 3100LA | |
| RF power amplifier | Electronics & Innovation (E&I) | ||
| immersion ultrasound transducer | Olympus | focused immersion transdcuers | |
| immersion ultrasound transducer | Benthowave Instrument | HiFu transducer BII-76 series | |
| immersion ultrasound transducer | Precision Acoustics | Piezo-ceramic or HiFu transducers | |
| immersion ultrasound transducer | Ultrasonic-S-lab | HiFu transducers made to order | |
| high-density Matrigel | Corning | VWR 80094-330 | |
| Mylar film 2.5 microns | Chemplex | CAT.NO:107 |
参考文献
- Elhelf, I. A. S., et al. High intensity focused ultrasound: The fundamentals, clinical applications and research trends. Diagnostic and Interventional Imaging. 99 (6), 349-359 (2018).
- Toccaceli, G., Delfini, R., Colonnese, C., Raco, A., Peschillo, S. . Emerging strategies and future perspective in neuro-oncology using Transcranial Focused Ultrasound Technology. , (2018).
- Duck, F. A. Medical and non-medical protection standards for ultrasound and infrasound. Progress in Biophysics and Molecular Biology. 93 (1-3), 176-191 (2007).
- Legon, W., et al. Transcranial focused ultrasound modulates the activity of primary somatosensory cortex in humans. Nature Neuroscience. 17 (2), 322-329 (2014).
- Tyler, W. J. The mechanobiology of brain function. Nature Reviews: Neuroscience. 13 (12), 867-878 (2012).
- Tyler, W. J. Noninvasive neuromodulation with ultrasound? A continuum mechanics hypothesis. Neuroscientist. 17 (1), 25-36 (2011).
- Tufail, Y., et al. Transcranial pulsed ultrasound stimulates intact brain circuits. Neuron. 66 (5), 681-694 (2010).
- Tyler, W. J., et al. Remote excitation of neuronal circuits using low-intensity, low-frequency ultrasound. PloS One. 3 (10), e3511 (2008).
- Suarez Castellanos, I., et al. Calcium-dependent ultrasound stimulation of secretory events from pancreatic beta cells. Journal of Therapeutic Ultrasound. 5, 30 (2017).
- Suarez Castellanos, I., Jeremic, A., Cohen, J., Zderic, V. Ultrasound Stimulation of Insulin Release from Pancreatic Beta Cells as a Potential Novel Treatment for Type 2 Diabetes. Ultrasound in Medicine and Biology. 43 (6), 1210-1222 (2017).
- Ibsen, S., Tong, A., Schutt, C., Esener, S., Chalasani, S. H. Sonogenetics is a non-invasive approach to activating neurons in Caenorhabditis elegans. Nature Communications. 6, 8264 (2015).
- Prieto, M. L., Firouzi, K., Khuri-Yakub, B. T., Maduke, M. Activation of Piezo1 but Not NaV1.2 Channels by Ultrasound at 43 MHz. Ultrasound in Medicine and Biology. 44 (6), 1217-1232 (2018).
- Kubanek, J., et al. Ultrasound modulates ion channel currents. Scientific Reports. 6, 24170 (2016).
- Prieto, M. L., Omer, O., Khuri-Yakub, B. T., Maduke, M. C. Dynamic response of model lipid membranes to ultrasonic radiation force. PloS One. 8 (10), e77115 (2013).
- Sato, T., Shapiro, M. G., Tsao, D. Y. Ultrasonic Neuromodulation Causes Widespread Cortical Activation via an Indirect Auditory Mechanism. Neuron. 98 (5), 1031-1041 (2018).
- O'Brien, W. D. Ultrasound-biophysics mechanisms. Progress in Biophysics and Molecular Biology. 93 (1-3), 212-255 (2007).
- Shapiro, M. G., Homma, K., Villarreal, S., Richter, C. P., Bezanilla, F. Corrigendum: Infrared light excites cells by changing their electrical capacitance. Nature Communications. 8, 16148 (2017).
- Shapiro, M. G., Homma, K., Villarreal, S., Richter, C. P., Bezanilla, F. Infrared light excites cells by changing their electrical capacitance. Nature Communications. 3, 736 (2012).
- Shapiro, M. G., Priest, M. F., Siegel, P. H., Bezanilla, F. Thermal mechanisms of millimeter wave stimulation of excitable cells. Biophysical Journal. 104 (12), 2622-2628 (2013).
- Hwang, J. Y., et al. Investigating contactless high frequency ultrasound microbeam stimulation for determination of invasion potential of breast cancer cells. Biotechnology and Bioengineering. 110 (10), 2697-2705 (2013).
- Nakano, M., et al. Genetically encoded ratiometric fluorescent thermometer with wide range and rapid response. PloS One. 12 (2), e0172344 (2017).
- Donner, J. S., Thompson, S. A., Kreuzer, M. P., Baffou, G., Quidant, R. Mapping intracellular temperature using green fluorescent protein. Nano Letters. 12 (4), 2107-2111 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。