Method Article
重组融合蛋白在荧光蛋白酶检测平台中的应用及其凝胶内再生
摘要
在这里, 我们提出了一个最近开发的蛋白酶分析平台的详细程序, 利用 n-端六利三烷基-马氏体结合蛋白和荧光蛋白融合重组基板附着在镍硝基三乙酸表面酸性磁性琼脂糖珠。并对十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离的测定样品进行了凝胶分析。
摘要
蛋白酶由于其在生物的几种生物学途径和发病机制中的重要作用而被密集地研究酶;因此, 它们是重要的药物靶点。我们开发了一个基于磁性琼脂-珠的检测平台, 用于研究蛋白溶解活性, 该平台是基于重组融合蛋白底物的使用。为了证明该检测系统的使用, 本文以人体免疫缺陷病毒1型 (hiv-1) 蛋白酶为例, 提出了一个协议。所介绍的检测平台可有效地用于蛋白酶的生化表征, 包括诱变、动力学、抑制或特异性研究中的酶活性测量, 可适用于高通量底物筛选或可适应其他蛋白水解酶。
在此检测系统中, 应用底物中含有 n-末端六角蛋白 (他的 6) 和麦芽结合蛋白 (mbp) 标记、烟草蚀刻病毒 (tev) 和 hiv-1 蛋白酶的裂解位点以及 c-末端荧光蛋白。在大肠杆菌细胞中有效地生产基板, 并可使用镍 (ni)-螯合物涂层珠进行纯化。在测定过程中, 含珠基板的蛋白水解裂解会导致荧光裂解片段的释放, 这些碎片可以通过荧光法测量。此外, 可通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳 (sds-page) 对裂解反应进行分析。还描述了一种检测成分的凝胶内再生方案, 因为荧光蛋白的部分再生使其能够基于分子量和荧光进行检测。
引言
蛋白质水解酶属于最密集的研究酶组, 因为它们在代谢途径和工业应用中也很重要。它们在病毒性疾病、凝血调节、癌症、心血管和神经退行性疾病中的关键作用, 使蛋白酶成为药物发现领域的突出目标。因此, 对所关注的蛋白酶 (pr) 的底物特异性的详细表征和抑制剂分析至关重要, 最好是通过快速、经济高效和坚固的生化检测1,2来完成, (三)有什么问题吗?
目前, 绝大多数应用于药物发现领域的复合分析的体外蛋白酶检测都是均匀的、基于荧光肽的、高通量筛选 (hts) 兼容的平台4。此外, 标记肽不仅适用于图书馆筛选, 而且为确定选定基板上的酶动力学参数提供了很好的工具。在其他情况下, 在无法标记基板的情况下, 基于分离的检测可以提供一种可能的解决方案来评估蛋白溶解反应3的动力学特性。
一般来说, 体外蛋白酶检测是基于两种类型的底物的使用: 短肽或整个蛋白质。在这些情况下, 如果短肽序列的裂解充分反映了裂解特性, 则适用以下标准方法: (i) 检查标准蛋白质底物, 如氧化胰岛素 b 链, (ii) 测试市售的其他蛋白酶的底物, (iii) 筛选由组合化学产生的合成和荧光标记的肽文库, 或 (iv) 使用遗传方法, 例如生物显示技术 5, 6。除了传统的分类外, 还可以使用其他新的平台来生成底物 (例如, 蛋白质衍生肽文库的形成7或特殊的遗传方法亚型, 如重组融合)基于蛋白质的底物8,9,10,11,12)。
上述各种基板和检测方法都有其各自的优势和局限性, 目前仍需要开发结合和改进已知平台优势的检测格式。在这里, 我们描述了一种基于分离的荧光蛋白酶检测协议, 该协议利用重组底物。这些融合蛋白由他的6和 mbp 标记融合到一个控制裂解位点的 tev pr, 其次是与 c 末端荧光蛋白 (fp) 直接连接的基板感兴趣的序列 (图 1a)。在 "克隆盒" 中, 可以通过对表达质粒的单一结扎反应来克隆感兴趣的裂解位点的 dna 序列编码, 而此前, 质粒已经通过限制性内切酶进行了线性化。
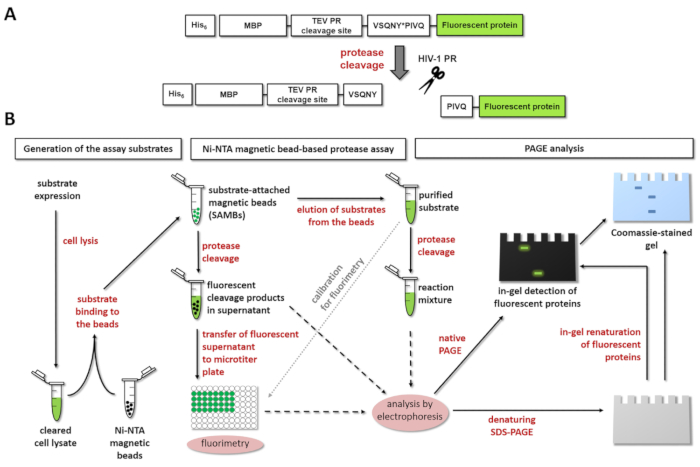
图 1:荧光蛋白酶测定的原理.(a) 显示了人体免疫缺陷病毒1型 (hiv-1) 蛋白酶对荧光底物及其裂解的示意图。箭头表示 hiv-1 蛋白酶 (vsqny * pivq) 的基质/衣壳裂解位点序列内的裂解位置。(b) 如工作流程图所示, 荧光基板可用于分析基于 ni-nta 磁珠的分析和聚丙烯酰胺凝胶电泳的酶反应。请点击这里查看此图的较大版本.
尽管使用类似的重组蛋白亚层进行的蛋白质溶解检测--含有亲和性标签、蛋白溶解裂解位点和荧光蛋白--已经被描述为8,9,10, 该系统这里提出的打算整合和改进这些方法的优势。一个重要的区别是, 该检测平台中的融合蛋白底物配备 mbp, 以提高蛋白质溶解度13 , 并包含一个控制裂解位点的 tev prr。此外, 基板含有新一代荧光蛋白, 这些蛋白质具有高度稳定和单体形式, 以防止基板聚集。除了先前公布的 mTurquoise2 和 mTurquoise2 融合表14的应用外, 我们还展示了使用含有单分子增强黄色荧光蛋白 (m界定) 荧光标记的重组底物所给出的结果。在此, 我们证明了该系统与其他荧光蛋白的兼容性, 并代表了一些一般类型的结果, 可以通过蛋白酶检测获得。
重组融合蛋白在大肠杆菌BL21(DE3) 细胞中表达, 并以镍-硝基三乙酸 (ni-nta) 包覆磁琼脂-珠附着形式作为检测的底物。c 端裂解产物通过感兴趣的蛋白酶从珠子表面释放到上清液中。从磁珠中分离上清液 (含酶和裂解产物) 后, 可以测量荧光, 以确定酶的裂解特性。与前面描述的方法不同, 在这里介绍的系统中, 基板和 c 端裂解产品的数量是根据详细的基板校准过程进行唯一量化的。通过对检测样品的 sds-page 分析, 可以支持该检测系统;随后的荧光凝胶可视化可在电泳后或非变性荧光组分的凝胶再生后立即应用, 分别为 14。
"克隆盒式磁带" 的灵活性和结构允许在结构中插入各种序列的时间和经济高效的方式, 从而促进基板库的生成。由于所有的检测步骤都是自动和 hts 兼容的, 该系统可以特别吸引, 例如, 蛋白酶特异性测量和诱变研究, 也可以有效地用于工业蛋白酶抑制剂筛选和抗病毒药物的发展, 以及。
酶动力学参数 (k猫, km)可以通过所开发的基于分离的分析来确定;因此, 它可能适合进行单独的酶动力学测量, 如时间过程, 底物依赖, 和抑制研究。这证明重组融合蛋白底物为常用的合成寡肽底物提供了很好的替代品, 由于它们与多蛋白底物的高度相似性, 它们代表了自然发生的物质。更准确地进行酶-底物相互作用。
研究方案
1. 亚基编码表达式质粒的产生
- 利用 pci 和 nhei 限制性内切酶对 pdest-mbp-fp 表达质粒进行线性化处理。关于 pdest-hs 6-mbp-fp 一代, 见 bozóki 等人.
- 在微离心管中加入1500-2000 微克的pdest-th-th-f-他的6-mbp-fp 表达质粒, 每个 pci 和 nei 限制内切酶, 10x 缓冲液 10μl (见材料表) 和无核酸酶水 (nfw) 到100μl。
- 在37°c 下将反应混合物培养1小时。
- 在反应混合物中加入20μl 的 6x dna 紫色加载染料, 用1% 琼脂糖凝胶电泳分离裂解产物。应用 1 kb dna 阶梯作为标准。
- 在含有20μr 绿色溶液的20毫升的 tae 缓冲液 (40 mm tris, 20 mm 醋酸, 1 mm edta, ph 8.5) 中冲洗凝胶 15分钟, 并使用锋利的工具将线性化质粒的带从琼脂糖凝胶中取出。
注: 在使用深读蓝色透射光导 (drbt) 照射凝胶时, 线性化的 pdest-hel6-mbp-fp 质粒在 7-8 kb 左右显示为离散明亮的波段。 - 根据制造商的说明, 使用凝胶提取试剂盒从凝胶切片中纯化线性化表达质粒。
- 将基板序列插入线性化的 pdest-e 6-mbp-fp 表达质粒中.
- 退火正向 (fwd) 和反向 (rev) 大肠杆菌优化寡核苷酸引物编码的基板序列的利益。
注: 退火引物的侧面将与 paci 和 nhei 限制内切酶裂解位点相对应的内聚端 (图 2)。- 将 150 ng 线性化表达质粒与 200 ng 的 fwd 和 200 ng 的 rev 寡核苷酸引物混合在 0.2 ml 聚合酶链反应 (pcr) 管中, 加入 nfw 将体积调整到17μl。
- 在65°c 下将混合物生也就是 2分钟, 然后在4°c 下至少加氢2分钟。
- 通过结扎将退火引物插入线性化质粒。
- 在含有线性化质粒和退火引物的混合物中加入2μl 的 t4 连接酶缓冲液 (10倍) 和1μl 的 t4 连接酶。
- 在16°c 下将结扎混合物孵化16小时。
- 退火正向 (fwd) 和反向 (rev) 大肠杆菌优化寡核苷酸引物编码的基板序列的利益。

图 2: 寡核苷酸引物编码的蛋白溶解性裂解位点序列.正向和反向引物编码 vsqny * pivq 裂解站点序列的 hiv-1 pr。在补充寡核苷酸引物退火后, 短双链 dna 含有粘性末端, 与帕切和 nhei 限制性内切酶相对应。请点击这里查看此图的较大版本.
- 通过5μl 的结扎混合物转化 100μl BL21(DE3) 有能力的细胞, 并将细胞扩散到含有氨匹西林的溶酶汤 (lb) 琼脂板上。
注: 荧光蛋白将在相同的开放阅读框架与 n 端融合标签, 只有在成功的结扎。在转化后的几天内, 菌落 (包含感兴趣的插入裂解部位的表达质粒编码) 将显示可见荧光, 甚至不使用 drbt。 - 从描绘的菌落中制备甘油库存。
- 将离散菌落清洗到含有5μl 的含有氨匹西林的 lb 介质的50毫升离心管中 (最终浓度为 100μg/ml)。
- 在37°c 下孵化 8小时, 同时在220转/分的情况下连续晃动;然后, 在室温下以 1, 000 x克离心5分钟收获细胞。
- 轻轻悬浮在80% 甘油溶液的1毫升中的细胞 (用蒸馏水稀释), 并在悬浮液中加入500μl 的 10 mL mgcl 2 溶液.
- 将悬浮液转移到冷冻管, 并将库存存放在-70°c。
- 通过 dna 测序验证生成的质粒的序列。
- 在50毫升离心管中加入10μl 的甘油库存 (在步骤1.7 中制备) 到含有100μml 氨匹西林的 lb 介质的5ml 中。
- 在37°c 下将悬浮液孵化 16小时, 在220转/分的情况下连续晃动;然后, 在4°c 下, 以 2, 000 x 克离心10分钟的速度收获细胞。
- 根据制造商的说明, 用质粒微制备试剂盒 (见材料表) 从细胞颗粒中分离表达质粒, 并使用纯化的质粒进行 dna 测序。
注: 对于测序, 可使用 5 '-gatgagccggcccgcagg-3 ' (正向) 和 5 '-gcagggatggggggg-3 ' (反向) 寡核苷酸引物。
2. 荧光基板的表达
- 准备起动的文化。
- 在50毫升离心管中加入10μl 的甘油库存 (在步骤1.7 中制备) 到含有100μml 氨匹西林的 lb 介质的5ml 中。
- 在37°c 下将悬浮液培养 15小时, 同时在220转/分的情况下连续晃动。
- 将细菌培养 (5 毫升) 转移到含有100μgml 安匹西林的新鲜 lb 培养基在500毫升无菌 erlenmeyer 烧瓶中。
- 在37°c 时将细胞生长到600纳米波长的 0.6-0.8 的吸收率, 同时以220转/分的速度连续晃动。
注: 如果要在步骤2.5 中应用四环素处理, 则不建议将细胞生长到600纳米以上的吸收率。 - 在 1 mm 最终浓度中加入异丙基β-d-1-硫代丙基丙基丙基苷 (iptg), 诱导蛋白质表达。
- 如果不使用四环素处理, 在37°c 孵育3小时, 同时在220转/分连续晃动, 并继续使用步骤2.6 的协议。如果应用四环素治疗, 请继续使用 2.5.1 2.5.3 步骤的协议。
注:大肠杆菌细胞产生的一些 fp 的成熟时间可能较长 (见以前的工作)16,17;在这些情况下, 可以选择通过四环素处理来抑制蛋白质的转化, 以提高底物溶液的荧光产率。- 在37°c 下将细胞悬浮液孵化 2小时, 在220转/分持续晃动;然后, 加入四环素溶液 (最终浓度为 200μg ml)。
- 根据所选荧光蛋白在37°c 的成熟时间进行细胞培养, 而在220转/分时连续晃动。
- 转移培养物的 2 x 25 毫升, 以清洁50毫升的离心管, 并在4°c 下以 4, 000 x 克的离心法收获细胞15分钟。
- 丢弃上清液, 并将细菌细胞颗粒储存在-70°c 至少1小时。
注: 含有所表示的荧光基板的细胞显示可见荧光, 并使用甚至不使用 drbt。
3. 细胞破坏
- 将冷冻细胞颗粒放在冰上, 让其解冻15分钟。
- 加入2毫升裂解缓冲液 (50 mL nah 2 po4,300 mL nocl, 10 mL 咪唑, 0.05% tween 20, ph 8) 到颗粒中, 悬浮细胞。
- 在悬浮液中加入10μl 的新鲜制备的苯甲磺酰氟化苯 (pmsf) 蛋白酶抑制剂溶液 (8.7 mg/ml, 溶于乙醇)。
- 在悬浮液中加入2毫克溶菌酶和20个单位的 dnase 并将其悬浮。
- 在冰上孵化悬浮液 15分钟, 偶尔会对其产生涡流。
- 将悬浮液的 2 x 1 毫升转移到 1.5 ml 的微离心管上, 并将悬浮液绕入 3分钟, 在10秒的超声和5秒的静息中旋转。
- 在室温下, 以 10, 000 x g离心管 20分钟;然后, 小心地从每个管中取出荧光上清液 (清除细菌细胞裂解液), 并将其转移到新的微离心管。
注: 含有荧光基板的已清除裂解物在使用 drbt 的情况下甚至不使用 drbt 时显示可见荧光, 并且可在4°c 下储存长达2周。不要冻结它。在蛋白酶分析中, 可直接用于样品制备 (见4.1 节), 也可用于底物纯化 (步骤 4.5.1)。
4. ni-nta 磁珠蛋白酶检测
注: 由于分析平台的灵活性, 它可以优化到许多不同类型的研究。由于这个原因, 并由于选择的酶的活性率的差异, 一些分析参数 (其中表示) 不能明确描述, 但需要优化到个人的目标和实验设计。作为指导, 某些类型的研究的参数在特定步骤中表示。
- 样品制备
- 亚链连接磁珠的产生
- 将装有新的或回收的 (见第4.7 节) 的新型或回收的新型微离心管放入磁性颗粒集中器 (mpc) 中。
注: 应用的珠子悬架的数量将根据实验设计进行设置。我们在每个实验中使用了1毫升的磁珠溶液 (5%, v/v)。 - 珠子可粘附在微离心管的壁上和/盖上;因此, 将 mpc 倒置在每个方向, 以确保所有的珠子都被收集。
- 取下上清液并丢弃它。
- 用裂解缓冲液清洗珠子。
- 在珠子上加入1.8 毫升的裂解缓冲液, 并从 mpc 中取出封闭的管。
- 通过摇晃和/或翻转管, 将管子中的珠子挂起, 直到样品完全均匀。
- 将管子放回 mpc, 并将其倒置以收集珠子。
- 打开管子, 丢弃上清液。
- 在珠子上加入 1.0-1.8 ml (在步骤3.7 中准备), 并从 mpc 中取出管。
- 将封闭的管倒置, 直到珠子完全均匀, 并在室温下由旋转器缓慢旋转管30分钟。
- 将其放入 mpc, 并从珠子和盖子中取出清除后的细胞裂解物。
注: 清除的细胞裂解物可能会被丢弃或保存以供进一步使用 (请参阅步骤3.7 后的说明)。 - 在附底杆的磁珠 (samb) 中加入1% 的 tween 20 (ph 值 7)。
注: 使用甚至不使用 drbt 时, samb 显示可见荧光。
- 将装有新的或回收的 (见第4.7 节) 的新型或回收的新型微离心管放入磁性颗粒集中器 (mpc) 中。
- 洗脸池
- 将带有 samb 悬浮液的管放入 mpc, 并丢弃上清液。
- 用每个缓冲液清洗 samb 3倍: i) 1.8 ml 的1% 特温 20 (ph 值 7);ii) 1.8 毫升洗涤缓冲液 (50 mL nah 2po 4, 300 mL nscl, 5 mL 咪唑, 0.05% tween 20, ph 值 7);iii) 1.8 ml 裂解缓冲液 (50 mL nah2po 4, 300mm ncl, 0.05% tween 20, ph 值 7)。
注: 有关清洗过程, 请参阅步骤4.1.1.4。裂解缓冲液可根据实验需要进行更换, 但建议检查 ni-nta 磁珠手册以确定兼容性。
- samb 库存解决方案的准备
- 在洗涤的 samb 中添加一个裂解缓冲液, 以创建 samb 库存解决方案。
注: 加入缓冲液后, 请勿将管子倒置或翻转。裂解缓冲液的体积取决于单独的实验设计, 必须根据磁珠的数量 (见步骤 4.1.1.1) 和步骤4.1.4.2 中使用的体积来计算。对于2毫升管, 应用体积高达 1, 900μl (见表 1)。samb 库存溶液的建议磁珠密度为 2%-10% (v/v)。学习类型 裂解缓冲液体积 (μl) 与 s 相关的测量 (图 4) 1600 时间过程测量 (图 5a) 1600 抑制研究 (图 5b) 1900年 ph 依赖研究 (图 6) 1400
表 1: 用于准备不同类型测量中的 samb 库存解决方案的裂解缓冲液的体积。 - 从 mpc 中取出闭合的管。立即使用 samb 库存解决方案, 或将其存放在4°c 下, 最长可达24小时。
- 在洗涤的 samb 中添加一个裂解缓冲液, 以创建 samb 库存解决方案。
- 使用 samb 库存解决方案生成检测样品
注: 这部分分析的细节在很大程度上取决于单个实验设计 (样本类型见表 2)。样品类型 笔记 反应样品 (r) -用于评估裂解特性
-在裂解缓冲液中同时含有酶和底物基板空白样品 (b) -用于评估自发基板离解 (请参见步骤 4.6.2)
-仅包含裂解缓冲液中的基板基板控制样品 (c) -用于分离基板浓度 (请参阅步骤 4.6.3)
-在洗脱缓冲液中只包含基板
表 2: 镍-nta 磁珠基蛋白酶检测的样品类型。- 为检测样品准备2毫升低蛋白结合微离心管。
注: 也可使用其他低蛋白结合塑料制品。使用圆形或平底管, 以确保 samb 的自由移动。请参见表 3中建议的管数。学习类型 R B C 与 s 相关的测量 (图 4) 5 5 2 时间过程测量 (图 5a) 6 6 2 抑制研究 (图 5b) 7。 7。 1 ph 依赖研究 (图 6) 5 5 1
表 3: 所证明的研究中每种样品所需的2毫升微型离心管的数量。 - 暂停 samb 库存溶液, 直到均匀性, 并将反应中要分析的底物量立即转移到样品瓶中。推荐体积为 25-300μl, 但要根据单独的实验设计进行设置 (表 4)。
注: 检查是否在管道底部测量了所有 samb。samb 可能粘附在试管壁上, 这可能会扭曲检测结果。如果要按顺序测量不同的体积, 请开始使用最高的体积进行引用, 并尝试最大限度地减少移液器和移液器前吸头的变化。学习类型 R B C 与 s 相关的测量 (图 4) 25–50–100–150–250 25–50–100–150–250 25 时间过程测量 (图 5a) 25 25 25 抑制研究 (图 5b) 1120 1120 1120 ph 依赖研究 (图 6) 100元 100元 100元
表 4: 在所证明的研究中, 在每种样品类型的样品瓶中测量的 samb 溶液体积。 - 将含有脂肪型 samb 悬浮液的样品管放入 mpc, 并稍微来回移动 mpc。
- 小心地从 samb 中取出上清液并将其丢弃。
- 从 mpc 中取出管, 并将计算出的反应缓冲液 (裂解或洗脱缓冲液 [100 mm edta, 0.05% tween 20, ph 值 7]]) 小心地添加到 samb。
注: 根据单独的实验设计计算缓冲体积 (表 5)。对于2毫升管, 推荐的反应混合物的最终体积 (在此步骤中添加的反应缓冲液的体积 + 步骤中添加的溶液体积 4.2.3) 为 50-150μl. 确保所有 samb 都在添加的缓冲液中清洗。在基板控制 (c) 样品的情况下, 使用洗脱缓冲液代替裂解缓冲液。对于抑制研究, 建议在此步骤中添加选择的抑制剂。学习类型 反应缓冲液的体积 (μl) 与 s 相关的测量 (图 4) 68μl 裂解缓冲液 时间过程测量 (图 5a) 68μl 裂解缓冲液 抑制研究 (图 5b) 677.3 μl 裂解缓冲液 + 0.7μl 抑制剂库存解决方案 * ph 依赖研究 (图 6) 99.5μl 裂解缓冲液 * *
表 5: 已证明的研究中的反应缓冲量.* 在二甲基亚硫醚中溶液;安普兰韦库存溶液 (从 1 nm 到1μm 浓度不等) 被应用于抑制研究 (见图 5b)。* * 应用裂解缓冲液的 ph 值范围为 ph 6.0-8.5。 - 关闭管子的盖子。现在样品已经准备好进行检测了。
注: 样品可在4°c 下储存长达 24小时, 但只有在制备后立即使用 samb 库存解决方案的情况下, 该储存才适用 (请参阅步骤 4.1.3.2)。
- 为检测样品准备2毫升低蛋白结合微离心管。
- 亚链连接磁珠的产生
- 蛋白溶解反应的启动
- 根据实验需要制备蛋白水解酶溶液。
注: 建议使用裂解缓冲液溶解和稀释酶。以前已经公布了关于艾滋病毒-114和 tevprs 18的纯化协议。 - 设置热振荡器的搅拌速率 (600 转/分) 和孵育温度 (表 6)。
学习类型 孵化温度 (°c) 与 s 相关的测量 (图 4) 37。 时间过程测量 (图 5a) 37。 抑制研究 (图 5b) 37。 ph 依赖研究 (图 6) 30
表 6: 不同研究类型的孵化温度.对于 hiv-1 pr, 建议使用 37°c, 而 tev pr 建议30°c。 - 在反应样品中加入酶溶液, 用于蛋白溶解反应的初始化。
注: 在基板空白 (b) 和 c 样品的情况下, 分别添加裂解缓冲液 (酶缓冲液) 和洗脱缓冲液。体积将根据个别实验需要计算 (表 7)。对于2毫升管, 建议的反应混合物的最终体积 (一步中添加的反应缓冲液的体积 4.1.4.5 + 在此步骤中添加的溶液的体积) 为50-150μl。学习类型 酶溶液/酶缓冲液的体积 (μl) 与 s 相关的测量 (图 4) 2 时间过程测量 (图 5a) 2 抑制研究 (图 5b) 2 ph 依赖研究 (图 6) 0。5
表 7: 在已证明的研究中, 在测定样品初始化过程中添加的酶溶液/酶缓冲液的体积。 - 轻轻移动管子, 小心地搅拌珠子, 并立即将管材放入已经晃动的温度。
注: 手动样品终止 (见第4.3 节) 比启动需要更多的时间;因此, 建议在反应启动之间至少有2分钟的注册延迟。 - 根据实验设计对样品进行孵化 (表 8)。
学习类型 孵化时间 (分钟) 与 s 相关的测量 (图 4a) 7。 与 s 相关的测量 (图 4b) 1120 时间过程测量 (图 5a) 0–25–5–10–15–20 抑制研究 (图 5b) 10 ph 依赖研究 (图 6) 60
表 8: 在不同的测量中应用于检测样品的孵化时间。
- 根据实验需要制备蛋白水解酶溶液。
- 蛋白溶解反应的分离
- 在孵育结束前 30秒, 将样品从振动台中取出, 然后迅速旋转。
- 将管子放在 mpc 上, 让它站立 15秒, 并稍微来回移动 mpc。
- 打开盖子, 小心地将上清液转移到盘子或新管上。
注: 不要用移液器的尖端触摸浓缩的珠子。收集到的 c 样品和高裂解度 r 样品的上清液, 在使用 drbt 的情况下, 甚至没有 drbt, 都可能显示出可见的荧光。
- 荧光检测
- 将分离的样品上清液的 2 x 30μl 转移到黑色的半面积微板上。
- 使用适当的激发和发射过滤器测量荧光。
注: 测量裂解缓冲液和洗脱缓冲液的基本荧光, 以及。需要根据测量到的荧光蛋白选择过滤器组合 (表 9)。荧光蛋白 励磁过滤器 (nm) 排放过滤器 (nm) mturqiouse2 355/40 460/25 梅伊弗 544/ 5.90/ mapple 544/ 5.90/
表 9: 用于检测不同荧光蛋白的激发和发射过滤器。
- 校准
注: 要在步骤4.6.1 生成校准曲线, 需要测量不同浓度下裂解或荧光-缓冲溶解的纯化基板的荧光强度值。- 纯化荧光基板。
注: 为了进行纯化, 可以在蛋白酶分析后收集基板空白 (b) 样品的 samb, 或者也可以制备新的 samb 悬浮液 (见4.1.1 和4.1.2 部分)。- 将悬浮在1毫升裂解缓冲液中的 samb 管 (2%-10%; v/v) 放置到 mpc 中, 并通过将 mpc 向各个方向倒置来收集磁珠。
- 打开管子 , 从管子和盖子上取下缓冲液。
- 从 mpc 中取出管, 并在 samb 中添加400-600μl 洗脱缓冲液。
- 在室温下用旋转器缓慢旋转闭合管5分钟。
- 将管子放在 mpc 上, 并通过将 mpc 倒置来收集珠子。
- 取出含有纯化的完整荧光基板 (洗脱) 的上清液, 并将其转移到新的低蛋白结合微离心管中。
注: 在使用 drbt 的情况下, 或者甚至不使用 drbt 时, el张显示清晰可见的荧光。
- 使用两个 0.5 ml 10k 超滤设备执行并行缓冲交换。
- 测量每个超滤装置中制备的洗脱液 (200-300μl) 的一半体积。
- 在每个离心步骤后, 分别用洗脱缓冲液和裂解缓冲液稀释第一和第二超滤装置中的浓缩洗脱液。
- 回收后, 将在不同缓冲液中求解的浓缩样品调整为相同体积, 在 120-200μl 之间。
注: 现在裂解缓冲液-解决基板的蛋白质含量与洗脱缓冲液-溶解基板相同;因此, 如果用于测量蛋白质浓度的方法干扰 edta, 则无需4.5.3 步骤确定后者的蛋白质含量。
- 通过测量280纳米的吸收率, 确定溶解在洗脱或裂解缓冲液中的底物的蛋白质含量。
注: 其他方法 (如布拉德福德或双氯苯酸 (bca) 检测) 也可用于测量蛋白质浓度, 但可能干扰 edta (存在于洗脱缓冲液中) 或荧光基板的吸收性需要考虑。建议在步骤4.5.4 中应用的底物溶液的初始蛋白质含量在 0.4-2.0 mg/ml 之间, 以便在适当的范围内生成校准曲线。关于灭绝系数, 见表 10 。衬 底 分子量
(大)灭绝系数
(m-1 厘米-1, 在280纳米水中测量)他的6-mbp-vsqny * pivq-mturquoise2 72101。7 96845 他的6-mbp-karvl * aeam-mturquoise2 72042。7 95555 他的6-mbp-vsqny * pivq-meyfp 72367。1 94325 他的6-mbp-vsqny * pivq-mapple 72145。9 105200
表 10: 不同重组荧光融合蛋白底物的分子量和消光系数。 - 准备一个双重连续稀释至少八个步骤, 无论是从洗脱-从裂解----从裂解----解决的基板溶液中----分别使用洗脱或裂解缓冲液进行稀释。
- 将每个稀释点的30μl 转移到黑色的半面积微板上。
- 使用荧光计测量荧光, 使用步骤4.4.2 中应用的设置。
注: 测量裂解和洗脱缓冲液的基本荧光。
- 纯化荧光基板。
- 对检测的评估
- 绘制校准曲线。
- 根据步骤4.5.3 中确定的蛋白质含量, 计算纯化底物溶液的浓度 (以 mm 为) (在步骤4.5.4 中使用)。
- 通过应用稀释缓冲液 (裂解缓冲液或洗脱缓冲液) 的基本 rfu 值, 校正串行稀释点的相对荧光强度值 (rfu)。
- 根据裂解或神经-缓冲求解的纯化基板的摩尔浓度绘制校正后的 rfu 值, 并执行线性回归 (强制截距为零)。
注: 高 r2值 (˃ 0.97) 表明荧光与荧光蛋白浓度之间存在良好的线性关系。在这种情况下, 回归线的斜率可用于评估检测组分在被检测范围内的浓度, 步骤4.6.2 和4.6.3。实验误差和数据点分布可能会影响校准的可靠性;因此, 可以借助放大图进行图形评估 (如图 3所示), 以检查 r2 和斜率值是否受数据的影响.
- 计算反应样品中 c 端荧光裂解产物的含量。
- 使用相应 b 样本的 rfu 值更正每个 r 样本的 rfu 值。
- 通过将修正后的 rfu 值除以基于裂解-缓冲的校准曲线的斜率来计算反应样品中的裂解产物浓度 (以 mm 为单位) (请参见步骤 4.6.1.3)。
- 计算反应样品中应用的底物浓度。
- 使用基本洗脱缓冲区的 rfu 值更正 c 样本的 rfu 值。
- 通过将 c 样品上清液中洗脱的底物 (mm) 的修正 rfu 值除以基于洗脱-缓冲区的校准曲线的斜率来计算其在 c 样品中的浓度 (请参见步骤 4.6.1.3)。
- 根据以下公式, 确定用于在步骤4.1.4.2 中创建检测样品的 samb 库存溶液的底物浓度 (mm):
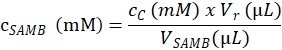
在这里, csamb 是在4.1.3 部分制备的 samb 库存溶液的摩尔浓度;cc 是在4.6.3.3 的步骤计算的 c 样品中洗脱的基板的摩尔浓度;vr 是反应缓冲液在步进中的加入所产生的体积4.1.4.5 和步进中的酶缓冲液 4.2.3;vsamb 是 c 样品中 samb 库存溶液的体积 (步骤 4.1.4.2)。 - 根据 samb 库存溶液 (mm) 的摩尔浓度, 根据在步骤4.1.4.2 的每个反应样品管中测量的体积 (μl) 计算每个 r 样品中基板的摩尔浓度。
- 执行数据处理。
注: 数据分析取决于实验的目的。该视频展示了一个例子, 用于数据处理的亚基依赖动力学研究的 hiv-1 pr 使用他的 6-mbp-vsqny * pivq-mturquois2 基板。初始速度值根据 c 端子裂解片段的数量计算, 并根据所应用的基板浓度绘制。动力学参数是通过米基利斯-门滕非线性回归分析确定的。
- 绘制校准曲线。
- 磁珠的回收利用
注: 在进行检测后, 可以收集和回收磁性琼脂糖珠。- 用 mpc 收集使用过的磁珠, 丢弃上清液。
- 用 1.8 ml 的以下缓冲液清洗珠子, 按给定的顺序: 再生缓冲液 a (0.05% tween 20, 0.5 m naoh)、再生缓冲液 b (0.05% tween 20)、再生缓冲液 c (0.05% tween 20、100 mm edta、ph 8)、再生缓冲液 b、再生缓冲液 d (再生缓冲液 d)0.05% 特温 20, 100 mm nso4, ph 值 8), 再生缓冲液 b, 再生缓冲液 e (0.5% 特温 20, 30% 乙醇, ph 7)。
注: 有关清洗过程, 请参阅步骤4.1.1.4。
- 用 1.8 ml 的以下缓冲液清洗珠子, 按给定的顺序: 再生缓冲液 a (0.05% tween 20, 0.5 m naoh)、再生缓冲液 b (0.05% tween 20)、再生缓冲液 c (0.05% tween 20、100 mm edta、ph 8)、再生缓冲液 b、再生缓冲液 d (再生缓冲液 d)0.05% 特温 20, 100 mm nso4, ph 值 8), 再生缓冲液 b, 再生缓冲液 e (0.5% 特温 20, 30% 乙醇, ph 7)。
- 将回收的珠子存放在4°c 的再生缓冲液 e 中。
- 用 mpc 收集使用过的磁珠, 丢弃上清液。
5. 页面分析
-
样品制备
注: 在进行 ni-nta 磁珠基检测后, 可以通过 page 对检测上清液进行分析。在这种情况下, 请跳过步骤5.1.1 和5.1.2。然而, 也可以分析纯化的荧光底物溶液和/或其裂解片段后, 溶液消化与感兴趣的蛋白酶。在这种情况下, 请继续执行步骤5.1.1。- 根据步骤4.5.1 准备纯化的荧光基板溶液。
- 执行溶液中的消化。
- 在 0.5 ml 10k 超滤装置中用裂解缓冲液和样品交换洗脱缓冲液, 并将样品消化到 1.5 ml 微离心管中。
注: 在 page 分析中, 我们对每个基板进行了68μl 的报价, 但可以根据单独的实验设计优化样品管的数量和要增加的基板溶液的体积。 - 在样品中加入酶溶液。
注: 在 page 分析中, 我们应用了由 bozóki 等人14岁描述的 2μl hiv-1 pr,但体积可以根据单独的实验设计进行优化。建议使用裂解缓冲液溶解和稀释酶。 - 根据实验设计对样品进行孵化。
注: 在 page 分析中, 我们在37°c 下对反应混合物进行了45分钟的孵育, 但需要根据实验设计确定孵育时间和温度。 - 通过执行步骤5.1.3 来终止反应。
- 在 0.5 ml 10k 超滤装置中用裂解缓冲液和样品交换洗脱缓冲液, 并将样品消化到 1.5 ml 微离心管中。
- 准备好样品以供页。
注: 含有荧光的底物样品可以通过非变性或变性方法为 page 制备。对于非变性或变性条件的使用, 请分别按照步骤5.1.3.1 或5.1.3.2。- 准备一个非变性样品: 将样品的30μl 与6μl 的6x 非变性样品负载缓冲液混合 (300mm tris, 20% 甘油, 0.05% 的溴酚蓝色, ph 6.8)。
- 准备变性样品: 将样品30μl 与6μl 的6x 变性样品负载缓冲液混合 (300 mm tris, 20% 甘油, 0.05% 溴酚蓝, 12% sds, 100 mm β-硫醇, ph 6.8), 并在95°c 加热样品10分钟。
-
sds-page 分析
注: (可选) 如果只分析非变性 (在步骤5.1.3.1 中准备) 的样本, 也可以执行本机 page。在这种情况下, 请跳过第5.3 节。- 准备 sds-聚丙烯酰胺凝胶 (使用14% 的分离和4% 的堆叠凝胶), 并在罐内填充电泳缓冲液 (2.5 mm tris, 19.2 mm 甘氨酸, 0.01% sds)。
- 将样品 (5.1.3.1 或5.1.3.2 步骤制备) 添加到聚丙烯酰胺凝胶的井中, 并在 120 v 电压下进行电泳。
- 从运行模块中取出凝胶盒, 并将凝胶放入洗涤槽中。
注: 非变性样品已经在凝胶中可见, 即使是肉眼或 drbt。
-
荧光蛋白的凝胶再生与检测
注: 要检测 drbt 上变性样品 (步骤5.1.3.2 中制备) 中的荧光蛋白, 需要从凝胶中取出 sds, 对蛋白质进行部分重新命名。- 在凝胶中加入 ~ 100 毫升的蒸馏水, 并将凝胶冲洗至少30分钟。
注: 为了改进 sds 的去除, 请每10分钟更换一次水, 或冲洗最多60分钟。 - 通过使用 drbt 或紫外线成像来显示荧光蛋白。
- 在凝胶中加入 ~ 100 毫升的蒸馏水, 并将凝胶冲洗至少30分钟。
-
凝胶的常规库莫西染色
- 用库马西明亮的蓝色染料染色凝胶, 以显示非荧光蛋白。
结果
图 1a显示了具有代表性的荧光重组蛋白基板的示意图结构, 该基板可由 hiv-1 pr 在其特定的裂解位点序列中进行处理。图 1 b显示了基板的生产及其在蛋白酶检测中的可能应用, 包括 ni-nta 磁珠基检测和/或 page。
为了通过荧光法获得可靠的数据, 需要一个校准程序, 以确定荧光基板和裂解产品的数量。为此, 需要测量不同缓冲条件下不同基材的荧光强度值, 并与其在检测浓度范围内的浓度相关联 (图 3)。校准曲线的斜率值可用于确定检测样品中基板和裂解产物的数量。校准曲线的斜率独立于插入基板的裂解位点序列 (表 11), 有可能用于融合到同一类型荧光蛋白的一系列基板。显示了所有线性回归的放大图, 以扩大较低的浓度范围 (图 3)。需要注意的是, 需要仔细进行校准, 因为可靠的校准需要适当的数据点分布。因此, 应用了双重串行稀释来制备样品进行校准, 因为 r2 值表明只有在有足够数量的数据点的情况下, 荧光蛋白浓度和荧光浓度才有良好的相关性已被用来覆盖整个浓度范围。此外, 实验误差会极大地影响校准的准确性;因此, 对回归线进行图形评估也可能是必要的。
蛋白酶测定可以进行各种酶测量, 包括检查底物浓度对反应速度的影响 (图 4 a)。通过非线性回归, 数据可用于确定酶动力学参数 (例如, v最大值和km)。珠子悬浮液和分散体不足以及反应终止不当可能会导致次优结果 (图 4b), 这不适合计算可靠的酶动力学值。
产品形成与时间的依赖可以通过测定来确定 (图5a) (例如, 在裂解反应参数的优化过程中)。还可以研究抑制剂存在的酶活性 (图 5b), 以测定活性酶浓度和抑制常数。使用相同的方法, 其他抑制剂的效果也可以通过检测筛选。
蛋白酶分析在研究 ph 值对酶活性的影响时也很有用。图 6a以 tev pr 为例, 表示酶活性与 ph 值的依赖性, tev pr 具有较宽的最佳 ph 值范围 (ph 值 6-9)。如果研究酶活性的 ph 依赖性 (或需要测量具有酸性 ph 最佳值的酶), 则有必要考虑重组底物与珠子的亲和力结合可能会在略带酸性的 ph 值下受到限制。基板与珠子的分离升高 (图 6b) 可能会导致检测结果失真。为了考虑微珠的自发基板离解, 需要用 b 样品的测量值进行校正。
图 7显示, 非变性荧光蛋白可以根据其颜色在凝胶中进行区分, 使用蓝光透射 (图 7a)。如果有必要测定亚层裂解碎片的分子量, 也可以使用变性条件进行样品制备, 因为荧光蛋白可以在凝胶中部分再生, 并且可以通过紫外线照射检测(图 7b) 或由库马西染色 (图 7B)。如果对 r 样品进行分析, 则只有 c 端裂解产物可见 (图 7c), 而 n 端裂解碎片和未裂解的基板仍连接在珠子上。有时, 尽管使用非变性条件 (图 7c), 但蛋白质可能会部分变性 (图 7c), 而非变性蛋白更丰富, 也可在样本中检测到变性形式。这种现象并不影响蛋白溶解裂解的检测, 但需要考虑在定量密度测量的非变性样品的情况下。
虽然详细的描述只显示了基于 2 ml 管的检测, 但该检测方法可适用于96孔板基系统 (图 8), 该系统已在我们的实验室中成功测试 (未显示)。96孔板适应格式与荧光和电泳分析完全兼容, 所获得的数据也可以在本文所述方法的基础上进行评价。
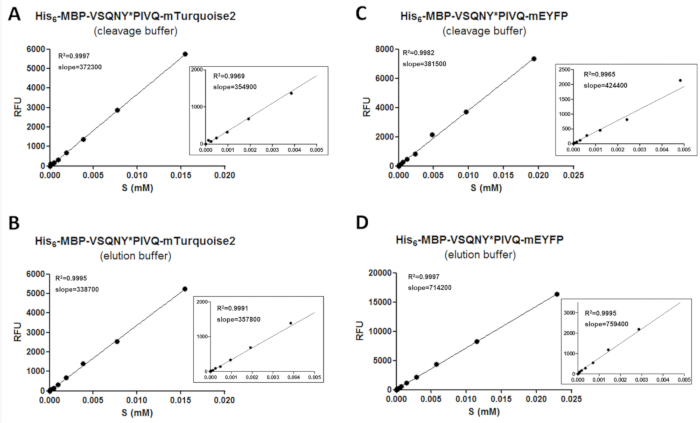
图 3:校准曲线.以两个重组底物熔融到不同的 c 端荧光标记的重组底物为例, 证明了代表性的基板校准曲线: (a和b) 他的 6-mbp-vsqny * pivq-mturquoisois2 和 (c和 d) 他的6-mbp-vsqny * pivq-meyfp。放大图还显示了在 0-0.005 mm 基板浓度范围内数据点的线性回归。请点击这里查看此图的较大版本.
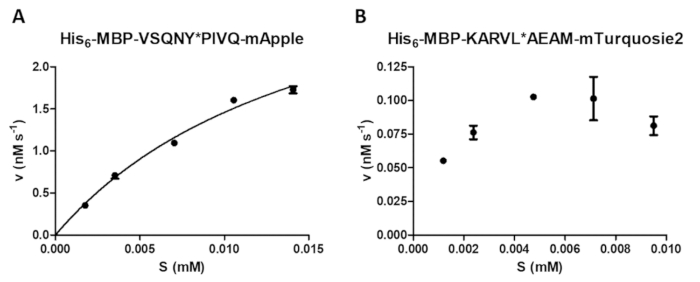
图 4: 酶动力学参数的测定.亚基相关动力学测量是通过 hiv-1 pr 进行的 (最终活性浓度为 41.2 nm)。根据基板浓度绘制了初始速度值, 并进行了米基利斯-门滕非线性回归分析。误差线表示 sd (n = 2)。(a) 以他的6-mbp-vsqny * pivq-mapple 融合蛋白底物为例, 给出了一个具有代表性的最佳结果。(b) 他的 6-mbp-karvl * aeam-mturquoiseis2 基板也显示了一个典型的次优结果, 由于 samb 库存溶液的均质化不足, 在基板浓度的设置上存在问题, 而相对较高的误差是由不正确的反应终止引起的。请点击这里查看此图的较大版本.
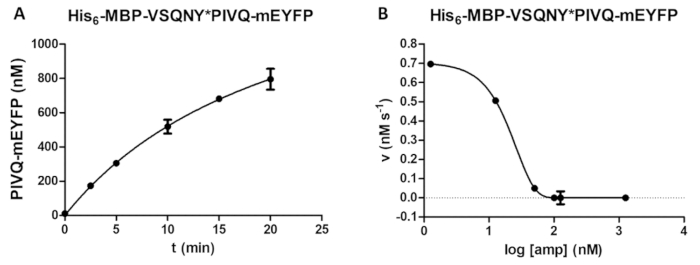
图 5: 时间过程和抑制研究.(一)他的6-mbp-vsqny * pivq-meyfp 重组融合蛋白底物 (最终浓度为 0.326 mm) 由 hiv-1 pr (最终活性浓度为 41.2 nm) 切割, 并测定了荧光 pivq-meyfp 蛋白溶解片段的释放情况。执行时间过程分析。测量是在五个不同的时间点进行的。误差线表示 sd (n = 2)。(b) 他的 6-mbp-vsqny * pyvq-meyfp 被用作底物 (在 0.0015 mm), 以确定氨酸对 hiv-1 pr 活性的抑制作用 (总浓度为 163.8 nm)。通过绘制数据, 可以评估半最大抑制浓度 (ic50), 也可以根据抑制曲线计算应用 hiv-1 pr 的活性酶浓度 (最终活性浓度为 41.2 nm)。误差线表示 sd (n = 3)。请点击这里查看此图的较大版本.
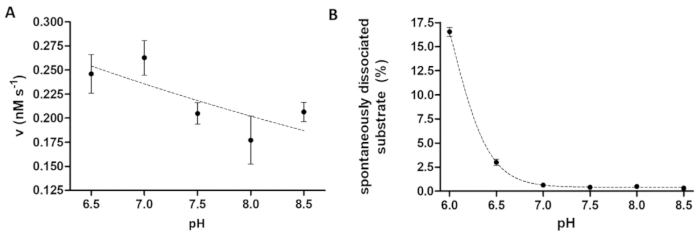
图 6: 研究酶活性和自发底物离解对 ph 值的依赖性.(a) 他的6-mbp-vsqny * pyvq-mturquoise2 底物 (0.033 mm) 用于测量裂解缓冲液中的 tev pr 酶活性 (最终总浓度为 91.42 nm) 设置为不同的 ph 值, 范围为 6.5. 8.5。误差线表示 sd (n = 2)。绘制的数据已在14日公布。(b) 根据基板空白样品的相对荧光强度值, 利用裂解缓冲液研究了他的6-mbp-vsqny * pivq-mturquois-2 基板 (0.033 mm) 与磁珠的自发离解ph 值不同, 介于6.0-8.5 之间。绘制的数据已在14日公布。请点击这里查看此图的较大版本.
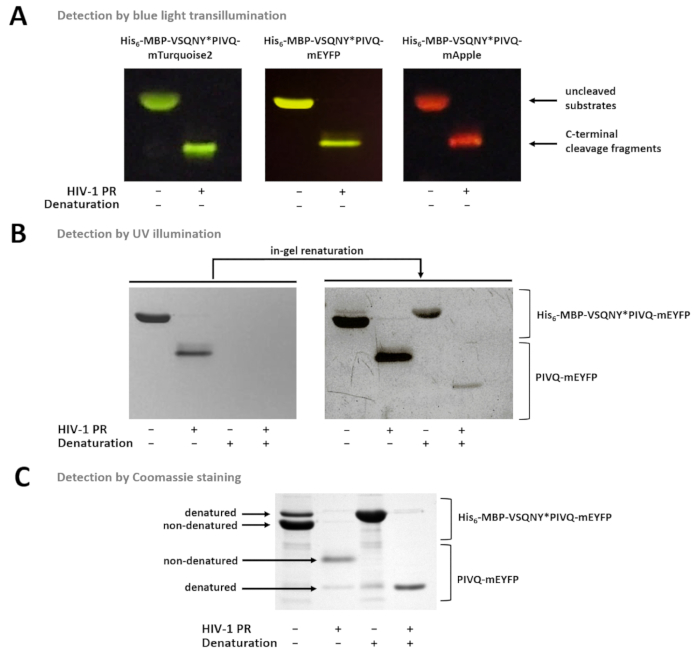
图 7: 用不同的方法检测凝胶中的蛋白质.(a) 采用 sds-page 后蓝光透射法, 对非变性样品制备后的未分离和 hiv-1 pr-1 消化融合蛋白底物进行了可视化。裂解反应是通过溶液中的消化进行的。(b) 在 page 之后, 只有非变性蛋白质可以通过紫外线照射在凝胶中检测到, 而在被删除 sds 后, 以前变性的荧光蛋白就会部分重新命名并检测到。本样品采用镍-nta 磁珠法的上清液制备。(c) 在凝胶再生后, 可用于蛋白质检测。凝胶中存在的 sds 可能会导致原生蛋白的部分变性, 但在原生样品中, 非变性形式更为丰富。本样品采用镍-nta 磁珠法的上清液制备。请点击这里查看此图的较大版本.

图 8: 96 孔板的检测平台的适应.(a) 该检测不仅可以在2毫升管中进行, 也可以在96孔板的井中进行。在这里, 我们展示了应用的原理图表示的分析, 以研究一个虚构的蛋白酶的特异性, 使用一系列的荧光基板, 其中可能包含野生类型 (wt) 或突变 (突变-1 到突变-4) 裂解的站点序列。为了处理磁珠, 实验中将使用96英寸兼容的磁粉集中器 (mpc)。所有指定的卷都与一口井有关。为了比较不同基材的裂解效率, 可以根据反应样品的底带-空白修正 rfu 值的百分比来评估基板的转化率, 同时考虑到相关的底带空白修正 rfu 值。基板控制样品为100。 (b) 荧光测定后, 也可以通过 page 对测定样品的分离上清液进行分析, 在非变性和变性样品的情况下, 可直接或凝胶内重构后对荧光蛋白成分进行分析。准备工作。每个图还说明了三种不同的检测样品类型: c = 底物控制、b = 底物空白和 r = 反应。基板控制样品在洗脱缓冲液中, 基板空白和反应样品在裂解缓冲液中。请点击这里查看此图的较大版本.
| 缓冲区 | 荧光蛋白 | 坡度的 cv% (%) |
| 洗 脱 | mturquoise2 | 6.04 |
| 9.11 | ||
| 洗 脱 | mapple | 10.92 |
| 12.68 |
表 11: 基板校准曲线斜率的方差系数 (cv%) 值.为了测试重组蛋白基板的荧光是否依赖于插入的裂解部位, 校准由一系列的 mapploise2 和 mturquois-2 熔融基板进行 (每个基板有六个变种, 包含不同的裂解部位序列的 hiv-1 蛋白酶), 无论是在洗脱和裂解缓冲液。我们发现, 在所有情况下, 坡度的 cv% 值都低于 15, 这意味着可以使用单个基板校准来评估包含相同荧光标记的基板变种所执行的不同测量。
讨论
由于对蛋白水解酶进行了密集的工业和学术研究, 并不断需要相应快速且负担得起的与 hts 兼容的蛋白酶检测平台, 我们开发了一种基于磁珠的荧光蛋白酶测定。该检测方法是基于重组融合蛋白的使用, 可以是广泛使用的合成肽底物的新替代品。
在已发展的检测格式中, 融合蛋白底物被固定在镍螯合磁性琼脂糖珠的表面上。基板附件由 n 端提供他的核聚变蛋白的6个亲和标记, 直接融合到 mbp 标记中, 以方便折叠并提高基板13的水溶性.mbp 之后是 tev pr 的裂解位点和感兴趣的蛋白酶。前者可作为检测中的控制裂解位点, 而后者则可通过蛋白酶进行处理进行研究。裂解部位是可互换的;可将感兴趣的裂解位点的短 dsdna 序列编码插入表达质粒的柔性 "克隆盒" 中。重组融合蛋白在 c 端含有高度稳定的单体荧光蛋白标记, 从而能够检测到在蛋白溶解裂解释放的酶释放、荧光 c 端裂解产物的端点。图 1a)。在不同缓冲液中求解的纯化荧光完整基板也用于校准, 以评估基板和裂解产物的摩尔浓度。此外, 在荧光测定后, 也可以通过 sds-page 对检测成分进行分析。原生 (非变性) 和变性荧光蛋白都可以在凝胶中显示, 在电泳后或随后的凝胶再生后, 分别。这种额外的过程与传统的库马西明亮的蓝色污渍相结合, 可以有效地用于验证检测结果 (图 1b)。
检测过程包括简单、易于执行的低容量格式步骤, 这些步骤可以完全适应高通量自动环境。然而, 独立于手动或使用自动化系统进行检测, 检测的以下部分被认为是至关重要的, 在执行过程时需要特别注意。i)磁珠溶液的均匀性.在整个检测过程中, 无论是在净化还是清洗步骤中, 都必须使用均匀的磁珠溶液。特别是蛋白酶检测的可靠性在很大程度上取决于对附底磁珠 (samb) 库存溶液的正确引用。为了提高悬浮液和分散的有效性, 建议将珠子浓度设置在2% 至 10% (v/v) 之间。在样品制备过程中, 使用补充非离子洗涤剂 (如 triton x-100 或 tween 20) 的缓冲液, 最高可达 2%, 也可能会降低磁珠与塑料表面的粘附。如果将珠子悬浮液小心地涂在小瓶的底部, 而不是涂在样品管的壁上, 则可以避免珠子粘附在样品瓶的壁上。磁珠在酶反应过程中的均匀性也是至关重要的, 在孵育过程中, 磁珠以600转/分的速度连续晃动样品, 可以确保磁珠的均匀性。珠子被适当地分散在圆形或平底塑料制品中, 而不建议使用 v 底小瓶。图 4b中表示了由不正确的珠子均质引起的次优结果。ii) 反应样品的终止。 该方法的另一个优点是, 酶反应可以终止, 而不使用热变性处理或任何潜在的干扰化学剂15。通过使用传统的磁粉集中器, 只需将磁珠与反应混合物分离即可实现端接。当去除的反应缓冲液中含有活性酶和产生的 c 末端荧光裂解产物时, 未裂解的底物仍然附着在珠子上。由于反应缓冲液中存在活性酶, 因此需要仔细执行分离过程, 以进行可靠的端点检测。在将样品瓶放入集中器之前, 建议采用短旋转离心。将管材放入集中器后, 提供至少15秒的珠子收集。分离器的来回轻微移动可能有助于珠子的收集。请考虑, 在手动执行的分离过程中, 终止通常比开始反应需要更多的时间。因此, 如果需要将相同的孵育时间应用于所有样品, 则建议在启动之间延迟约2分钟。
所述蛋白溶解法的原理相对简单;然而, 该系统的多功能性是由灵活和稳定的基板结构保证。只有通过亲和性珠子与应用条件、试剂和添加剂的相容性, 才能限制检测的个别优化。根据制造商的协议, 我们还发现, 基板与 ni-nta 珠子表面的亲和力结合在 ph ≤6.515 时显著减弱。因此, 建议将基板空白样品与反应样品平行应用, 在评价结果时需要考虑基板的自发离解率。
在这种情况下, 由于使用了与珠子不兼容的成分或 ph 值较低, 无法进行磁珠基检测, 因此也可以应用纯化后的重组基板的溶液中消化。在这些情况下, 反应混合物可以通过电泳进行分析, 蛋白质可以根据所述协议在凝胶中可视化。为了研究蛋白质的蛋白质溶解活性, 溶液中的消化和凝胶检测的蛋白质也可能是荧光法的替代工具。设计的基板系统的一个新颖之处在于, 变性 sds-page 后应用凝胶内再生步骤。虽然原生 (非变性) 荧光蛋白在电泳过程中保留荧光, 但在变性时, 荧光性质被废除 (图 7b)。然而, 变性蛋白的荧光可以部分恢复从凝胶中去除 sds。因此, 使用变性条件分离反应成分, 不仅可以进行荧光鉴定, 而且可以识别基于分子量的分子量。与库莫西染色凝胶的分析相比, 荧光凝胶检测的另一个优点是, 根据荧光在凝胶中可以很容易地识别荧光蛋白 (见图 7)。如果在含有非荧光污染物或彼此分子量非常相似的蛋白质的样品中进行裂解反应, 这一点可能很重要。
使用类似设计的底物的蛋白酶检测已经在之前公布了 8,9, 10, 虽然这些情况下感兴趣的裂解位点也位于亲和力标签和荧光蛋白, 这里介绍的检测系统不仅重复了所描述的想法, 而且结合了以前平台的不同优势, 并完成了这些优点与进一步的改进: (i) 使用 mbp 融合合作伙伴, ii)存在一个 tev pr 控制裂解站点, iii) 使用新设计的单体 fp, 和 iv) 应用一个独特的基板校准程序。该检测本身特别设计用于以安全、时间和经济高效的方式进行酶特异性和动力学研究, 而无需昂贵的仪器。该方法旨在成为工业和学术研究目的的适当和负担得起的工具。由于表达质粒的 "克隆盒式" 的灵活性, 该系统可适用于快速、廉价的重组基板库生成。本文所描述的方法是一种可行的工具, 实现底物特异性, 酶诱变, 抑制研究, 也提供了一个替代工具, 执行酶动力学。该检测平台 (从细菌细胞破坏到动力学参数的确定) 可适应基于 hts 和自动化的环境, 并有可能应用于工业蛋白酶抑制剂筛选和/或抗病毒药物发展。此外, 竞争蛋白溶解检测的适应性也在我们实验室的未来范围内。在这种竞争分析中, 两个不同的子层--每个子层都包含与不同的 c 端荧光标记融合在一起的不同裂解部位--打算在同一裂解反应中同时使用, 以研究所研究的偏好给定目标序列的酶。此外, 在半胱氨酸蛋白酶的情况下, 使用一系列具有改良裂解位点序列的底物, 还在优化使用96孔板适应的检测表 (图 8) 进行突变筛选。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了 2.3.2-15-2001-00044 "pharmprot" 合作项目的部分支持, 并得到了匈牙利人的能力部高等教育机构卓越方案的资助。德布森大学生物技术专题项目。提交人感谢逆转录病毒生物化学实验室的成员在检测过程中提供的科学帮助, 并感谢他们在拍摄过程中的耐心 (特别是对 norbert k开发区, krisztina joónématúz 和 vanda toldi,出现在视频的背景中)。作者还要特别感谢 gedeon richter plc., 特别是 zoltán urbányi 博士允许 beáta bozóki 作为客座研究员在生物化学和分子生物学系的工作。提交人还要感谢德布森大学多媒体和电子学习技术中心的 györgy zsadányi、balázs tögyi、balázs pöstényi 和 zoltán király 在音频和视频方面提供的专业协助。生产。
材料
| Name | Company | Catalog Number | Comments |
| 10K Amicon tubes | Merck-Millipore | UFC501096 | |
| 2-Mercaptoethanol (β-ME) | Sigma-Aldrich (St Louis, MO, USA) | M6250 | |
| 40% Acrylamide/Bis solution 37.5:1 | Bio-Rad | 1610148 | |
| Acetic acid | Merck | 100063 | |
| Agarose | SERVA | 11404.04 | |
| Alpha Imager HP gel documentation system | ProteinSimple | ||
| Ammonium persulfate (APS) | Sigma-Aldrich (St Louis, MO, USA) | A3678 | |
| Ampicillin sodium salt | Sigma-Aldrich (St Louis, MO, USA) | A9518 | |
| Beckman Coulter Allegra X-22 centrifuge | Beckman Coulter | 392185 | |
| Black half-area plates | Greiner bio-One | 675086 | |
| Bromophenol blue | Sigma-Aldrich (St Louis, MO, USA) | B0126 | |
| CutSmart buffer (10x) | New England Biolabs | B7204S | For plasmid linearization (step 1.1.1) |
| Dark Reader transilluminator | Clare Chemical Research | DR-45M | |
| DNase I | New England Biolabs | M0303L | |
| Dynamag-2 magnetic particle concentrator | Thermo Fischer Scientific | 12321D | |
| Escherichia coli BL21(DE3) competent cells | Thermo Fischer Scientific (Invitrogen) | C600003 | |
| Ethanol | Merc-Millipore | 100983 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich (St Louis, MO, USA) | 798681 | |
| Gel Loading Dye, Purple (6X) | New England Biolabs | B7024S | |
| Glycerol | Merck | 356350 | |
| Glycine | Sigma-Aldrich (St Louis, MO, USA) | G7126 | |
| High-Speed Plasmid Mini Kit | GeneAid | PD300 | |
| Imidazole | Sigma-Aldrich (St Louis, MO, USA) | 56750 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fischer Scientific (Invitrogen) | AM9464 | |
| Jouan CR 412 centrifuge | Jouan | CR412 | |
| Labinco LD-76 Rotator | Labinco | 7600 | |
| Luria-Bertani (LB) broth | Sigma-Aldrich (St Louis, MO, USA) | L3022 | |
| Lysozyme | Sigma-Aldrich (St Louis, MO, USA) | L6876 | |
| Magnesium chloride | Scharlau | MA0036 | |
| MERCK eurolab ultrasonic bath | MERCK | USR54H | |
| Millifuge Eppendorf spin centrifuge | Millipore | CT10 | |
| Mini-PROTEAN 3 Electrophoresis Cell | Bio-Rad | ||
| N,N,N′,N′-Tetramethylethylenediamine (TEMED) | Sigma-Aldrich (St Louis, MO, USA) | T9281 | |
| NanoDrop 2000 | Thermo Fischer Scientific | ||
| NheI-HF restriction endonuclease | New England Biolabs | R3131L | |
| Nickel(II) sulfate (NiSO4) | Sigma-Aldrich (St Louis, MO, USA) | 656895 | |
| Ni-NTA magnetic agarose beads | Qiagen | 36113 | |
| Orbital shaker | Biosan | OS-20 | |
| PacI restriction endonuclease | New England Biolabs | R0547L | |
| PageBlue Protein Staining Solution | Thermo Fischer Scientific | 24620 | |
| Phenylmethanesulfonyl-fluoride (PMSF) | Sigma-Aldrich (St Louis, MO, USA) | P7626 | |
| Protein Lobind Micro-centrifuge tubes | Eppendorf | 22431102 | |
| QIAquick Gel Extraction Kit | QIAGEN | 28704 | |
| Snijders Press-to-Mix shaker | Gemini | 34524 | |
| Sodium-acetate trihydrate | Sigma-Aldrich (St Louis, MO, USA) | S7670 | |
| Sodium-chloride | Sigma-Aldrich (St Louis, MO, USA) | S9888 | |
| Sodium-hydroxide | Sigma-Aldrich (St Louis, MO, USA) | S5881 | |
| SYBR Green I Nucleic Acid Gel Stain | Thermo Fischer Scientific | S7563 | |
| T4 DNA ligase | Promega | M180A | |
| Thermo shaker | Biosan | TS-100 | with SC-24 accessory block |
| Tris | Sigma-Aldrich (St Louis, MO, USA) | T1503 | |
| Tween 20 | Sigma-Aldrich (St Louis, MO, USA) | P2287 | |
| WALLAC VICTOR2 1420 multilabel counter | Wallac Oy, Turku, Finland |
参考文献
- Meldal, M. Smart Combinatorial Assays for the Determination of Protease Activity and Inhibition. Molecular Informatics. 24 (10), 1141-1148 (2005).
- Rao, M. B., Tanksale, A. M., Ghatge, M. S., Deshpande, V. V. Molecular and biotechnological aspects of microbial proteases. Microbiology and Molecular Biology Reviews. 62 (3), 597-635 (1998).
- Zhang, G., Sittampalam, G. S., et al. Protease assays. The Assay Guidance Manual. , (2012).
- Woelcke, J., Hassiepen, U., Chen, T. Fluorescence-based biochemical assay formats. A Practical Guide to Assay Development and High-Throughput Screening in Drug Discovery. , (2010).
- Richardson, P. L. The determination and use of optimized protease substrates in drug discovery and development. Current Pharmaceutical Design. 8 (28), 2559-2581 (2002).
- Diamond, S. L. Methods for mapping protease specificity. Current Opinion in Chemical Biology. 11 (1), 46-51 (2007).
- Schilling, O., Overall, C. M. Proteome-derived, database-searchable peptide libraries for identifying protease cleavage sites. Nature Biotechnology. 26 (6), 685-694 (2008).
- Askin, S. P., Morin, I., Schaeffer, P. M. Development of a protease activity assay using heat-sensitive Tus-GFP fusion protein substrates. Analytical Biochemistry. 415 (2), 126-133 (2011).
- Chaparro-Riggers, J. F., Breves, R., Michels, A., Maurer, K. H., Bornscheuer, U. A GFP based assay for the determination of hydrolytic activity and substrate specificity of subtilisins under washing conditions. Journal of Molecular Catalysis B: Enzymatic. 35, 74-77 (2005).
- Patel, D., Frelinger, J., Goudsmit, J., Kim, B. In vitro assay for site-specific proteases using bead-attached GFP substrate. Biotechniques. 31 (5), 1194-1198 (2001).
- Branchini, B. R., et al. Sequential bioluminescence resonance energy transfer-fluorescence resonance energy transfer-based ratiometric protease assays with fusion proteins of firefly luciferase and red fluorescent protein. Analytical Biochemistry. 414 (2), 239-245 (2011).
- Zhou, C., Yan, Y., Fang, J., Cheng, B., Fan, J. A new fusion protein platform for quantitatively measuring activity of multiple proteases. Microbial Cell Factories. 13 (1), 44 (2014).
- Fox, J. D., Waugh, D. S. Maltose-binding protein as a solubility enhancer. Methods in Molecular Biology. 205, 99-117 (2003).
- Bozóki, B., et al. A recombinant fusion protein-based, fluorescent protease assay for high throughput-compatible substrate screening. Analytical Biochemistry. 540-541, 52-63 (2018).
- Mótyán, J. A., Miczi, M., Bozóki, B., Tözsér, J. Data supporting Ni-NTA magnetic bead-based fluorescent protease assay using recombinant fusion protein substrates. Data in Brief. 18, 203-208 (2018).
- Balleza, E., Kim, J. M., Cluzel, P. Systematic characterization of maturation time of fluorescent proteins in living cells. Nature Methods. 15, 47-51 (2018).
- Hebisch, E., Knebel, J., Landsberg, J., Frey, E., Leisner, M. High variation of fluorescence protein maturation times in closely related Escherichia coli strains. PLoS One. 8, e75991 (2013).
- Kapust, R. B., et al. Tobacco etch virus protease: mechanism of autolysis and rational design of stable mutants with wild-type catalytic proficiency. Protein Engineering, Design and Selection. 14, 993-1000 (2001).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。