Method Article
尿道感染小鼠模型产生的单细胞内细菌群落的分离, 用于下游单细胞分析
摘要
该方案描述了一种从尿路感染的小鼠模型中分离单个感染膀胱上皮细胞的简单方法。
摘要
在这篇文章中, 我们概述了一个程序, 用于分离个别细胞内细菌群落从已被实验感染在泌尿道。该方案大致可分为三个部分: 感染、膀胱上皮细胞采集和口腔微移液, 以分离个别受感染的上皮细胞。分离的上皮细胞含有可行的细菌细胞, 几乎不污染细胞外细菌, 使其成为下游单细胞分析的理想选择。从感染开始到获得单一细胞内细菌群落所需的时间约为8小时。该协议的部署和使用成本低廉, 我们预计, 它也可以在其他感染模型中用于从细胞混合物中分离单个受感染的细胞, 即使这些受感染的细胞是罕见的。然而, 由于口腔微移液的潜在风险, 不建议对高度传染性的药物采用这种程序。
引言
尿路感染 (Uti) 是最常见的细菌感染之一。据估计, 40-50% 的妇女在一生1中至少会经历一次尿路感染 (uti)。UTI 的主要药物之一是尿致病性大肠杆菌(upec), 占不复杂 uti2的70% 以上。此外, 在患有 UTI 的人中, 约有四分之一的人将反复感染, 往往是由同一毒株引起的, 尽管进行了适当的抗生素治疗3。UTI 的高发病率给医疗系统带来了沉重的负担, 在美国每年花费超过20亿美元.此外, 使用抗生素治疗 Uti 也导致抗生素耐药率上升, 这是一个主要的公共卫生问题5。
因此, 已经作出了很大的努力, 以了解机制, upec 感染尿路, 以及其能力引起反复感染6,7,8.特别是, 小鼠感染模型被用来检查有助于 UTI8的细菌和宿主特征。这种小鼠模型的优点是适用于从人类患者中分离出的未经修饰的临床菌株。这种模式还导致发现了对 UTI 的建立非常重要的潜在可药物细菌途径, 例如1型 pilus9和铁采集系统10。
与这些研究 uti 早期事件的成功相比, 对经常发生的 UTI 的机制仍然缺乏了解 11.一种假设是, UPEC 逃避抗生素治疗, 并通过在膀胱上皮细胞内形成细胞内细菌群落 (Ibc), 导致膀胱反复感染。在小鼠感染模型和人类 uti 患者中, 无论是在 12,13 例, 都已发现中型散货箱。小儿 uti 患者尿液样本中存在 ibc 与复发率较高有关 14,15。然而, 分离中型散货箱并研究其中的细菌已被证明是技术上具有挑战性的, 因为它们的稀缺性;据估计, 受感染的小鼠膀胱通常只有10-100 中型散货箱16。此外, 膀胱上皮细胞相对较大 (50-120μm)17, 因此, 鉴于典型的流式细胞仪喷嘴的直径为70μm 或 100μm, 因此部署荧光辅助细胞分选 (facs) 具有挑战性。因此, 像膀胱上皮细胞这样大的细胞通常在流式细胞仪之前通过过滤来切除, 以避免堵塞液体。
我们的实验室最近描述了一种从膀胱18的刮伤上皮细胞等混合物中分离稀有受感染细胞的通用和经济的方法。为了有效地隔离中型散货箱, 我们使用了传统的口腔移液。口腔微移液是一种技术, 长期以来一直被用于微操作单个细胞和胚胎的下游分析19,20,21,22, 23,24,25. 传统的大液体流液 (毫升) 的口移液往往是实验室相关事故的原因, 在传统胚胎学之外, 许多研究界正确地回避了这一技术。单细胞应用。我们的协议灵感来自于这种技术的单细胞版本19,20, 通过在研究人员和样本之间提供大量的空气缓冲 (和 gt;2 毫升) 来减轻风险, 而不是转移的液体体积 (& lt;1μL)。这种方法还利用了口腔微移液提供的精细控制, 这转化为转移的低最终体积的周围溶液和高纯度的分离细胞。该技术使用廉价的材料 (和 lt;$50), 因此应该能够在所有实验室实施。
此可视化协议描述了我们的 IBC 隔离技术, 为帮助其他寻求复制此技术的研究人员提供了参考。研究人员将需要使用荧光解剖显微镜 (或类似设备), 该显微镜可用于在活体成像过程中显示单个上皮细胞和荧光细菌, 并有一个开放和可接触的微移液成像阶段(有关所使用的显微镜的详细信息, 请参阅材料表, 但也可以使用其他等效仪器模型)。虽然该协议将侧重于 UTI 小鼠模型中的中型散货箱, 但类似的方法应适用于在其他感染模型中从细胞悬浮液中分离感染细胞。
研究方案
这里描述的所有动物处理方法都得到了新加坡基因组研究所动物护理和使用机构委员会 (IACUC) 和新加坡科学、技术和研究机构生物资源中心的批准。
1. 鼠标感染
-
玻璃毛细血管的制备
- 点燃明火源 (本森燃烧器或酒精燃烧器)。
- 用双手紧紧地捏两端, 握住玻璃毛细管, 然后将管的中间均匀加热, 直到玻璃变软。沿其轴线轻轻来回旋转毛细管, 以帮助均匀加热玻璃。
- 从热源中取出玻璃毛细管, 立即将双手拉开, 同时保持对管两端的抓地力。拉扯的毛细血管的理想的最后长度是3-5 厘米长比未拉扯的毛细血管, 以确保适当的内径分离单个膀胱上皮细胞。
注意事项:在一段时间内, 油管仍然非常热, 所以在热安全的表面上放在毛细管一边冷却几分钟, 然后再继续下一步。 - 检查玻璃毛细管的中间是否变窄 (图 1a), 以及管道内部是否仍然是空心的 (图 1b)。对于中型散货箱的隔离, 可使用200-400μm 的孔尺寸。
- 用一只手拿起拉毛细管的一端。用另一只手拿着一对钳子, 用它在最窄的地方拿起拉的玻璃毛细管。确保钳子有足够的力量来紧紧地抓着毛细血管, 而不会压碎它。
- 使用一个快速扭转运动的手举行钳子, 以捕捉拉毛细管在最窄的点, 以创建一个口微移毛细管。
请注意:使用手指而不是钳子也是可以接受的, 只要使用足够的保护, 防止玻璃碎片。 - 重复步骤 1.1.2-1.1.6 至少4倍以上, 以产生足够的备用微移液毛细血管, 并提供一系列直径, 用于 IBC 隔离。如果预计有一个以上的感染组, 为每增加一个感染组准备5个额外的微移液毛细血管。
注意事项:不要忘了关闭明火。 - 将拉拔的毛细血管放入100毫米 Petri 培养皿中, 并将该培养皿暴露在紫外线辐射下 30分钟, 以消毒毛细血管。
- 紫外线灭菌后, 将培养皿上的盖子更换, 并在室温下将培养皿与毛细血管一起存放。
-
感染前导管的制备
- 按照 Hung等8 和 con弗等人的描述, 至少在感染前一天准备治疗导尿管 。
-
荧光尿致病性大肠杆菌培养的制备
- 根据既定方案生长选定的荧光表达泌尿源性细菌株。
请注意:菌株和荧光体的选择在很大程度上取决于单个实验室中的显微镜和菌株。在本例中, 我们使用了从 UTI89 衍生出的菌株, 这是一种临床分离株, 最初来自复发性膀胱炎患者。这种菌株 slc-638 携带质粒 (Pslc-77), 表达 vsfGFP-9 和卡那霉素耐药性 18。SLC-638 在37°c 的 LB 肉汤中生长, 辅以50μgml 卡那霉素。 - 流株 slc-638 在 Luria Bertani (LB)-琼脂板上补充50μgml 卡那霉素。在37°c 下隔夜生板。
- (可选)在选择菌落之前, 请查看解剖显微镜上的平板, 以确认荧光标记的表达。
- 使用细菌接种回路, 将所选择的菌落转移到一个125毫升的锥形烧瓶, 以10毫升的 LB 肉汤补充50μgl 卡那霉素。在37°c 下静态培育烧瓶24小时。
- 从烧瓶中提取10Μl 培养物, 并在 lb 肉汤中稀释 10ml, 并在新鲜的125毫升烧瓶中补充50μgml 卡那霉素 (1:1000 稀释), 从而对该烧瓶中的细菌进行亚培养。在37°c 下静态地培育第二个烧瓶, 再长24小时。
- 在 5, 000 x g和4°c 下5分钟的细菌培养。
- 在 OD600 0.5 下分解上清液并在冷 pbs 中重新悬浮细菌颗粒。
请注意:虽然不同的培养可能不同, 但通常为1毫升的静态培养, 约为4-5 毫升的 od600 = 0.5 细菌培养。每个菌株所需的细菌接种总量可按如下方式计算: 每个小鼠需要 50μl, 填充针头需要50μl。建议额外增加 10-20 (最低 50Μl) 的接种剂, 以考虑注射器中的死体积。 - 使用剩余的细菌混合物来确定感染滴度, 如 Hung 等人8号报告中所述。
请注意:通过将细菌混合物存储在 4°c, 此步骤可能会延迟几个小时。
- 根据既定方案生长选定的荧光表达泌尿源性细菌株。
-
泌尿道感染的小鼠模型
- 按照 Hung 等人组织第8条描述的方法对小鼠进行感染, 并在第1.3 节中培养的每株荧光大肠杆菌进行一个实验组。
请注意:关于视觉协助, 也见 Con弗等人26。 - 注意对鼠标或保持架进行细菌接种的时间。
- 对整个实验组重复感染。
请注意:感染导管可用于同一组中的所有小鼠。 - 重复步骤 1.4.1-1.4.3 计划的每个实验组, 确保为每个组准备一个新的导管和新的润滑剂凝胶。
请注意:对于大量动物的实验, 最好将动物分成五组, 并错开感染, 使每个组的感染间隔约30分钟至1小时。这将为以下步骤 (第2节和第3节) 提供足够的时间。
- 按照 Hung 等人组织第8条描述的方法对小鼠进行感染, 并在第1.3 节中培养的每株荧光大肠杆菌进行一个实验组。
2. 膀胱上皮细胞采集以获得细胞悬浮液
-
收集和倒置小鼠膀胱
- 准备三个50毫升锥形管充满45毫升的70% 乙醇, 用于手术设备的消毒。
- 在2.1.1 步步准备的两个管子里, 放一把剪刀和一把钳子。将两对钳子 (一对优选较窄, 并具有圆形尖端, 用于膀胱倒置) 放入第三管。
请注意:第一管中的工具将用于外部区域, 第二管中的工具将用于膀胱采集, 最后一管中的两对钳子将用于膀胱倒置。 - 在感染后 6小时, 根据该机构建立的 IACUC 协议对受感染的小鼠实施安乐死。
请注意:我们的 IACUC 协议要求在小鼠处于麻醉状态 (异氟醚) 时通过宫颈脱位进行安乐死。 - 将动物平放在背上, 用一个充满70% 乙醇的喷雾瓶对它们的腹部进行消毒。
- 使用第一根管子的钳子和手术剪刀 (步骤2.1.2 准备), 在尿道开口上方约1厘米处的皮肤上做一个小的横向切口。将切口对角线伸向小鼠上肢, 沿小鼠的整个前部创建一个 v 形切口, 露出腹膜的内容物。确保在此过程中, 剪刀不会穿过鼠标的肠道 (图 2a, b)。
- 切换到第二组工具 (在步骤2.1.2 中准备)。使用剪刀的刀片或钳子的轴, 轻轻地向下推在老鼠骨盆区域附近的脂肪垫。
请注意:这一步使膀胱向外突出, 并确保收获的能见度。 - 用一对钳子抓住暴露在外的膀胱在先端 (图 2c)。
- 用钳子牢牢抓膀胱先端, 用手术剪刀将膀胱从动物的其他部位 (割伤尿道和输尿管) 中解救出来。不要释放抱着膀胱的钳子。
- 从剪刀切换到从第三个锥形管 (从步骤 2.1.2) 的较窄的圆形钳, 将圆形钳的一个轴的尖端插入膀胱的开口, 在上一步中刚刚被切割 (图 2d)。用圆钳的尖端安全地插入膀胱的开口, 释放夹住膀胱先端的一对钳子, 并将其返回到第二个锥形管。
- 使用第三管的第二对钳子, 轻轻地将膀胱 "由内而外", 首先将膀胱口的外端从圆形钳上拉开 (图 2d, 箭头 1), 并引导它在另一个尖端。(图 2d, 箭头 2)。
请注意:这个动作可以比作从一只脚上摘下一只袜子, 把它拉到另一只脚上。- 在倒置过程中, 保持第一对圆钳几乎完全关闭。这提供了足够的运动自由, 以拉膀胱从第一轴的圆形钳, 但也使第二轴的圆形钳更接近第一个, 并允许膀胱很容易转移。这一步的最终结果是, 膀胱最终应该被倒置, 并在第一对钳子的第二轴的尖端 (图 2e)。
- 使用第二对钳子, 轻轻地将倒置的膀胱从钳子的尖端哄成1毫升的冷 PBS。
请注意:(可选)现在是拍摄整个倒置、受感染膀胱的图像的适当时机, 以观察中型散货箱的一般频率和分布 (如果有的话)。
- 对实验组中的每个膀胱重复步骤 2.1.1-2.1.10 (最多五个动物)。
-
膀胱上皮细胞刮伤
- 使用两对干净的钳子, 轻轻刮倒膀胱的外部 (这是内部上皮细胞层)。当刮擦收益和上皮细胞被释放到 PBS 溶液中时, 周围的 PBS 应该会出现云。
- (可选)视觉上证实膀胱刮擦使用解剖显微镜将细胞释放到溶液中。图 3A、B)。PBS 应该出现多云肉眼, 和刮伤的个别膀胱上皮细胞可以看到10倍的放大倍率。
- 对步骤2.1 中的每个收获的膀胱重复步骤 2.2.1-2.2.2。
3. 细胞内细菌群落 (IBC) 隔离: 中型散货箱的口腔移液
请注意:本节所述的所有方法都经过了机构风险评估。口移液具有摄入正在转移的溶液的固有风险。此协议使用的纳米卷在很大程度上减轻了这一风险, 我们建议协议的所有用户注意此处和讨论中列出的预防性和实践说明。
-
在细胞被刮入 PBS 后, 设置口腔微移液装置 (图 3c)。
- 将拉玻璃毛细管的较厚的一端 (未拉端) 插入吸气管的橡胶插头 (白色端)。
- 将1毫升移液器尖端的窄端插入吸气管的另一个开口 (红色) 端, 确保配合紧密。
- 将2毫升吸气移液器的窄端插入1毫升移液器尖端的开口、宽端, 再次确保紧密配合。
请注意:由此产生的设置允许研究人员从吸气移液器的更宽、开口的一端发出移液器口, 从设备另一端的毛细管狭窄端产生温和的吸力。 - 使用含有新鲜去离子水的100毫米 Petri 培养皿测试最后的口腔微移液装置。在吸气移液器的开口端轻微的吸力 (类似于通过吸管喝饮料) 应增加毛细血管中的液体水平, 但不会导致去离子水溢出到吸气管中。用一只手控制毛细管, 同时用另一只手调整培养皿的位置。
请注意:单次 IBC 的吸嘴所需的吸力在研究人员中会有所不同。然而, 建议每个尝试这种技术的研究人员从弱吸力开始, 如果没有液体从毛细血管上流动, 慢慢增加吸力。没有必要有比吸吸管喝更大的力量。如果毛细管在3.1.4 的测试中似乎没有拾取液体, 则有可能是毛细管或吸气管被闭塞, 需要更换。进一步建议所有新的研究人员首先使用消毒水控制口腔移液装置中的吸力。此外, 请注意, 口腔移液装置所占用的体积的控制是通过使用研究人员的舌头。舌头可以很好地调整应用吸力的强度, 也可以起到紧急停止的作用。 - 在成功地吸收液体后, 通过轻轻吹到吸气移液器的开口端, 测试将液体排出毛细管的能力。确保在排出液体的过程中不会产生气泡, 以防止在第3.5 步中污染中型散货箱。
请注意:与吸力一样, 研究人员将 IBC 排出离心管的正压强度在研究人员中也会有所不同。建议新加入本协议的研究人员在实际感染前几天练习步骤3.1。实施口腔微移液的一个建议是, 使用口微移液装置, 练习将少量的灭菌水与几滴食品染料 (用于可见性) 混合。
- 将刮过的细胞悬浮液置于解剖显微镜下, 并将其识别为大型荧光集料 (图 3a、b)。理想的放大倍率范围为20-40x。将玻璃毛细管的细端浸入新鲜的 PBS 管中, 为 1秒, 通过毛细管作用减少不需要的体积的吸收。
- 通过显微镜观察, 识别感兴趣的 IBC, 并慢慢地将毛细管的开口端朝向 IBC。使用玻璃毛细管的细端清除每个 IBC 附近的额外细胞, 以防止两个或两个以上细胞的吸入, 或分解较大的细胞集合。
- 在观察显微镜时, 在口腔微移液装置的远端 (吸气移液器) 上施加非常小的吸力, 引导 IBC 进入玻璃毛细管。
- 拿起中型散货管后, 将毛细管移动到一个空的 1.5 mL 离心管, 并施加轻微的正压, 将液滴和中型散银排出离心管 (图 3d)。
- 在进入下一个膀胱之前, 在当前膀胱需要尽可能多的中型散货箱上重复步骤 3.3-3.6。经常更换吸气移液器和毛细血管, 以防止唾液堆积。
注意事项:在使用传染性 (或临床) 细菌菌株时, 不断监测毛细血管中的溶液水平。不要让液体的液位从毛细管边缘溢出到吸气管中。如果发生这种情况, 请立即切换到不同的吸气管, 并放弃以前的设置。 - 对所有收获的囊重复步骤 3.2-3.6, 或直到为实验组收集了足够数量的生物样本。
- (可选)重复步骤3.6 和 3.7, 直到所有实验组 (或小鼠) 都被安乐死, 并从每个组中采集了足够的生物样本。
结果
除了通过解剖显微镜确认收集管中存在单个孤立的 IBC (图 3d) 外, 也可以通过共聚焦显微镜来确认分离的 ibc 的纯度。如图 4a 所示, 分离的细胞应同时染色大肠杆菌和尿拉普金, 并且是中型散货箱的预期大小 (50-120μm)17。此外,大肠杆菌染色不存在于周围的液体。根据我们的数据, 使用此技术分离的细胞中, 90% 以上是 Bcc18。分离后, 单个 IBC 中细菌细胞的存在和活力可以通过菌落形成单元 (CFU) 枚举 (图 4b) 或定量聚合酶链反应 (qpcr) 来确认基因组等价物 (图 4图 4c还表明, 使用同一协议分离的未感染的上皮细胞没有可量化的细菌数量。根据这些数据, 我们估计单个 IBC 中的 Cfu 范围在尿路感染的小鼠模型中是 10-10-103. 单个 IBC 隔离的主要目标之一是执行下游分析, 如 RNA 测序。为了验证我们的分离方法能够从中型散货箱中的细菌中获得 RNA 进行分析, 我们对三个基因 (16S、 Cyob和frda) 进行了定量逆转录聚合酶链反应 (qrt-pcr) 定量测定。单独隔离和汇集的中型散货箱的范围 (图 4d)。图 4所示的所有数据都是在 Duraiswamy 等人的许可下改编的。我们的 IBC 隔离协议的示意图见图 5, 该示意图转载于 Duraiswamy 等人。

图 1: 拔毛毛细血管保持狭窄的开口.(A) 手拉毛细管的样本显示在黑色背景上进行对比。从下到上, 显示了一种未拉扯的毛细血管, 一种没有被拉到足够程度的毛细血管, 一种可用于单个膀胱上皮细胞采集的毛细血管, 以及一种被拉得太薄 (从而被分成两片) 的毛细血管。在图像底部放置一个15厘米的尺子以进行刻度。在图中, 红色箭头显示了用于抢断可用毛细管的估计点。(B) 用解剖显微镜拍摄的图像, 以确认拉扯的毛细管 (底部) 的空心内径。一个未拉的毛细血管位于上方, 以显示两个毛细血管的相对大小差异。刻度栏 = 4.0 mm. 请点击此处查看此图的较大版本.
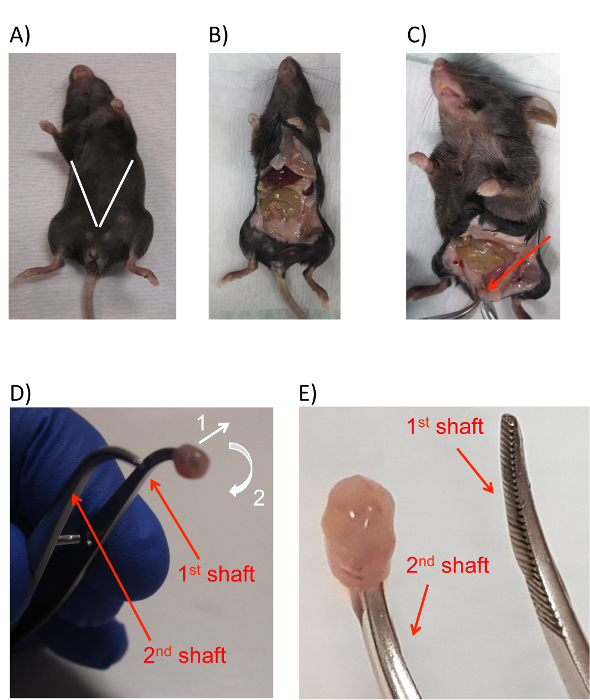
图 2: 处理小鼠膀胱上皮细胞.(A) 添加白线的鼠标图像, 以指示切口的估计位置和角度, 以暴露小鼠腹腔和膀胱。(B) 切口后暴露的小鼠腹腔的图像。(C) 从脂肪垫之间突出的暴露膀胱 (红色箭头) 的图像。(D) 将钳子的尖端插入管腔的小鼠膀胱的图像, 并有箭头表示倒置膀胱所需的运动方向。膀胱首先稍微向外拉, 然后在钳子的第一个轴周围和关闭。这两个动作的运动方向由编号为1和2的白色箭头指示。(E) 显示插入钳的第二轴的倒置膀胱的最终位置的图像。钳子的轴在 D 和 E 面板中都用红色箭头和文本标记。请点击这里查看此图的较大版本.
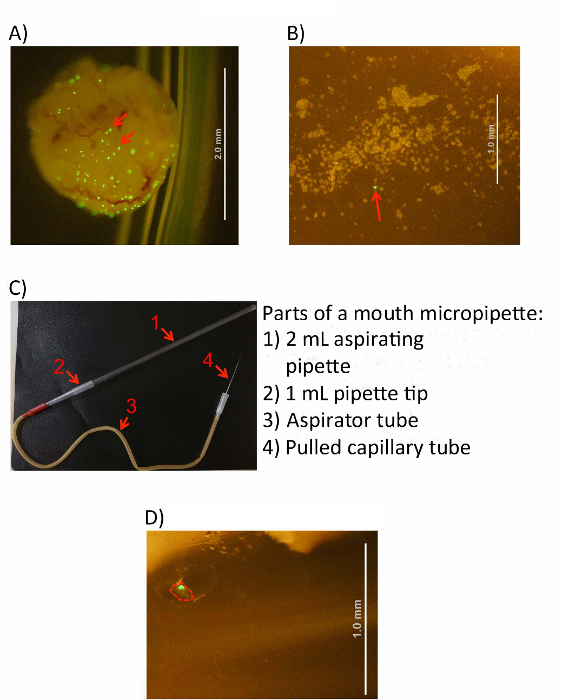
图 3: Ibc 从膀胱细胞中收获.(A) 在细胞刮擦之前, 在冷 pbs 溶液中感染和倒置膀胱。(B) 在显微镜下看到的显示刮伤的膀胱细胞的图像。在这两张图片中, 中型散货箱都可以被识别为大型绿色荧光聚集体 (请参见红色箭头)。(C) 已完成口微移液装置的图像。吸气移液器、移液器尖端、抽吸管和拉毛细管与右侧所示的编号箭头进行识别。(D) 1.5 ml 收集管中单个隔离 ibc 的图像 (用红色概述)。缩放条 (如所示) 由面板 a、B 和 D 中的白线表示,请点击此处查看此图的较大版本.
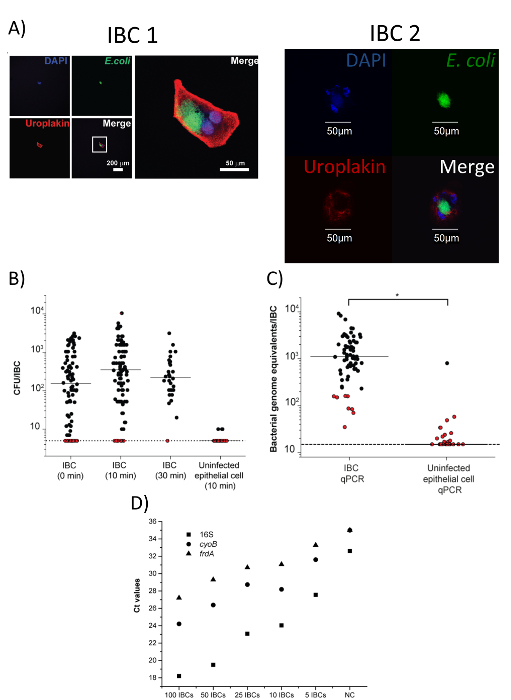
图 4: 收获的中型散货箱是纯的, 可用于下游分析.经 Duraiswamy 等人18 人许可, 对这一数字作了修改。(A) 两个分离的 gfp 阳性细胞的图像, 这些细胞被抗尿普拉金和抗大肠杆菌抗体染色。第一个单元格 (IBC 1) 左侧有单个通道 (低放大倍率) 的图像, 右侧有高放大合并图像。第二个单元格 (IBB2) 显示在合并通道和单个通道中的高放大倍率。比例栏如图所示。DNA 被 4 ', 6-二胺-2-苯丁胺 (DAPI) 染色, 并在蓝色通道中表示。抗大肠杆菌被染色与荧光素异硫氰酸酯 (fitc) 结合并在绿色通道中表示的二级抗体。抗尿拉普林被染色与四甲基罗丹明异硫氰酸酯 (TRITC) 结合的二级抗体, 并在红色通道中表示。(B) 从分离的中型散货箱中细菌性 cfu。Ibc 立即进行处理, 或在0.1% 的 Triton-X 中孵育10或 30分钟, 显示从 n = 3个独立实验中分离出的单个中型散货箱的聚集 CFU 计数。检测的限度 = 0.7 日志10 Cfus/ibc。在检测极限上绘制的红点表示没有发现菌落的样品。所有含 ibc 样品无显著性差异 (p > 0.05, 曼诺-惠特尼试验);未感染的上皮细胞与 IBC (10分钟) 数据有显著差异 (p < 0.001, 曼恩-惠特尼试验)。(C) 在0.1% 的三丁基-x (*, p < 0.0001, mannd-whitney 试验, n = 4) 中, 在 10分钟孵育10分钟后, 对单个中型散货箱和未感染的上皮细胞中的细菌进行 qpcr 定量。检测限度 = 1.18 日志10细菌基因组等效 ibc。红点表示在 b. (d) 面板中的滴定过程中没有发现菌落的样品, 对 16S rrna、 Cyob和frda基因进行了定量, 以对不同数量的单独分离和汇集的中型散货箱进行定量 (n = 1 实验;点表示3个技术复制的平均值)。NC = 无 DNA 阴性控制。请点击这里查看此图的较大版本.
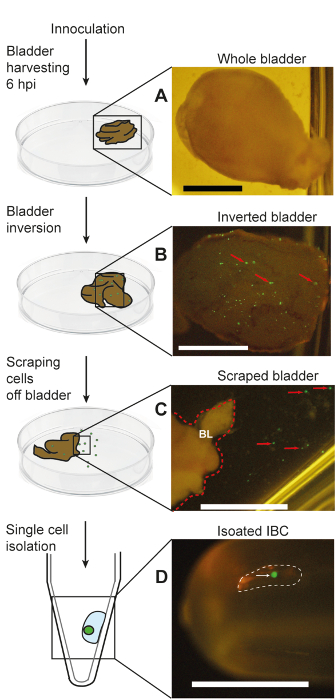
图 5: 一个示意图及其相关照片, 表示通过口腔微移液从受感染的小鼠膀胱中分离中型散货箱.这一数字转载于 Duraiswamy 等人.(A) 收获的整个膀胱;(B) 倒置的整个膀胱, 暴露表达 IBC 的 gfp;(C) 在邻近的缓冲液中悬浮的刮膀胱边缘的特写镜头;(D) 将单个隔离的 ibc 移液入管中。面板 b 中的红色箭头表示膀胱腔表面 gfp 阳性 Ibc 的例子。C 面板中的红色虚线表示倒置膀胱的右边框 (表示为 "BL");C 组中的红色箭头表示明显的单个 gfp 阳性上皮细胞已被刮掉在膀胱表面。面板 d 中的白色虚线表示含有隔离 IBC 的微管子微升液滴, 该液滴由白色箭头表示。刻度条 = 2 毫米. 请点击这里查看此图的较大版本.
讨论
我们所描述的协议允许将单个 Ibc 与 UTI 的小鼠模型隔离开来。该协议分离出含有活细胞内细菌的中型散货箱, 通过培养 CFU 可以验证。该协议导致来自中型散货箱的细胞内细菌很少受到细胞外细菌的污染, 从而可以进一步鉴定 IBC 中的细菌和宿主细胞 (图 4c)。我们还表明, 单个 ibc 中的细菌可用于下游应用, 如 qpcr (图 4c), 这表明我们的技术可用于处理中型散货箱进行其他体外分析。通过汇集从多达5个中型散货箱中采集的细菌, 我们进一步证明了我们对三个细菌基因进行 qRT-PCR 分析的能力, 表明我们可以从我们分离的中型散货箱中的细菌中提取高质量的 RNA (图 4d)。综合来看, 我们所显示的数据表明, 使用这种隔离技术可以对单个中型散货箱进行全基因组 RNA 分析 (如 RNA 测序)。
在这个协议中, 我们关注的是6小时的时间点, 因为那是 ibc 数字在感染了 UTI8927的黑色6只老鼠的膀胱中达到峰值的时候。此外, 我们还使用了静态细菌培养系统来提高 UTI89 中1型皮鲁斯表达的水平。1型皮鲁斯的表达对大肠杆菌附着和感染膀胱上皮细胞至关重要 28。然而, 这种说法受到严格监管 , 环境线索被认为会改变 30.为了保持一致的感染表型和足够数量的中型散货箱, 我们建议在使用以前测试过的大肠杆菌时, 使用2x24h 静态细菌培养 (从 hung 等人8号稍微修改一下) 和6小时感染时间点菌株, 如 nu14 和 uti8928,29。然而, 这些变量可能需要在其他 UTI 菌株或其他小鼠菌株中进行调整, 以便从每次感染中获得理想数量的 Ibc。
虽然 Hung 等人8 组的协议只使用雌性小鼠, 但其他确定的确定雄性小鼠尿路感染的协议已有31条。在该模型中, 雄性小鼠的膀胱炎也遵循 IBC 途径。由于雄性和雌性小鼠的膀胱大小相似, 我们预计我们的 IBC 隔离协议也可以用于受感染的雄性小鼠。
该协议中使用的相对简单的技术也确保了它可以部署在大多数实验室。该协议涉及的关键步骤之一是拉动玻璃毛细血管, 以创建用于选择感兴趣的细胞类型的微毛细血管。这一步骤允许在创建的微毛细血管直径方面具有灵活性, 因此该方法可以扩展到多种不同的目标细胞类型。然而, 由于在创建这些毛细血管的固有差异, 必须注意确保最终直径在可用的范围内。如果毛细血管太窄, 它们无法拾取感兴趣的单元格, 但如果它们被设置得太宽, 则可以在一次尝试中选择多个单元格。此外, 在毛细管拉扯过程中使用明火会带来燃烧和火灾的固有风险, 因此, 试图制造微毛细血管的研究人员应注意防止此类事件的发生。为了减少制造这些毛细血管所涉及的变异性和明火风险, 研究人员可以使用传统的微移液器拉拔机, 例如用于电生理实验的机器 (例如 pc-100、Narishige 集团)。由于这些机器利用重力或机器人平台来拉动毛细血管, 它们可以进行定制, 以满足感染模型的需要。然而, 广泛的微型移液器拉拔机的可用将意味着个别研究人员将需要经过一些试验和错误, 以确定适当的最终毛细管直径与本协议使用。
该协议利用表达荧光标记的细菌来直观地识别 IBC。因此, 这种技术受到研究人员基因改造传染性生物体的能力的限制。特别是 upec, ibc 形成菌株, 如 cft073 和 nu14 已成功地转化为 gfp表达质粒 32,33,34;因此, 这些应该可以在同一协议中使用。根据小鼠膀胱面积 (70 毫米2)35、单个上皮细胞的长度 (50-120μm)17和单个膀胱16中的中型散货箱频率, 对中型散货箱发生率的保守估计约为千分之一(或 0.1%)。这一估计显示了我们的细胞隔离协议在针对罕见事件方面的效用。通过我们的协议进行细胞选择的精度和可以被提取的广泛的毛细管直径表明, 该协议可以用来从体内和体外的其他感染模型中分离细胞内细菌。事实上, 我们已经成功地使用了这种技术来分离受感染的培养膀胱上皮细胞 (数据未显示)。
该协议中技术上更具挑战性的步骤之一是倒置膀胱, 以暴露上皮细胞进行刮擦。我们发现, 也有可能在膀胱上做一个切口, 将其刮掉。但是, 在切开过程中, 应适当注意减少对膀胱上皮细胞的损害;理想情况下, 应使用一个单一的削减, 以拉开膀胱开放。此外, 应在冷 PBS 中进行切割, 以防止在整个过程中意外丢失细胞或膀胱组织。
该协议中的中型散货箱口移液提供了对细胞选择过程的更大控制, 并限制了与细胞一起转移的溶液的最终体积。精细的控制和解决方案与研究人员嘴的大量分离也最大限度地提高了研究人员的安全性, 因为传输的体积在纳米管到微升范围内。相反, 我们使用现代微型移液器的经验是, 它倾向于将更多的周围液体和细胞与 IBC 转移, 有可能导致细胞外腔内细菌的污染。其他实验室22、23、24 也报告了我们的发现, 即口腔移液比其他单细胞隔离方法提供了更高的性能。除了单细胞隔离外, 口腔移液甚至被用于神经元25的单细胞电穿孔, 这进一步证明了受过训练的研究人员可以通过该技术实现的效用和微小控制。然而, 安全是最重要的, 我们建议根据所使用的病原体可能采取的额外措施: (一) 在研究人员和生物材料之间扩大空气缓冲液, 例如使用吸气体积较大的移液器 (例如, 5 毫升), 或 (ii) 在吸气移液器中添加物理过滤器, 如棉绒, 作为额外的屏障。
在风险评估导致口腔移液风险仍然太大的情况下, 可以将商业上可用的机器人设置 (如用于纳米注射的机器人设置) 与我们技术的其他部分结合起来, 为从混合人群中分离受感染的细胞。需要注意的是, 我们使用机器人微机械手的经验表明, 与口腔移液相比, IBC 隔离率有所下降, 因为膀胱上皮细胞大小的实验中差异很大, 这对用户来说具有挑战性。一个机器人手臂, 以确定需要拿起单个中型散货箱所需的力量。然而, 对于那些使用高度传染性疾病因子的人来说, 它仍然是一个可行的选择, 尽管费用较高。
披露声明
作者没有什么可透露的。
致谢
这项研究得到了新加坡总理办公室国家研究基金会在其 NRF 研究研究金计划下的支持。NRF-RF2010-10);新加坡卫生部国家医学研究委员会 (NMRC/cirg 1358 2013);和新加坡基因组研究所/科学、技术和研究机构 (A * STAR)。
材料
| Name | Company | Catalog Number | Comments |
| 1.5 mL eppendorf tube | For static bacterial culture and OD measurement | ||
| 100% ethanol | For Alcohol Burner | ||
| 15 mL conical tube | For static bacterial culture and OD measurement | ||
| 1 mL Tuberculin Syringe | BD Biosciences | 302100 | |
| 3% Bacterial Agar | For static bacterial culture and OD measurement | ||
| 70% ethanol | For static bacterial culture and OD measurement | ||
| Aesculap anatomic forceps | Braun/Kruuse | BD222R | For initial dissection of mouse (skin, fascia) |
| Alcohol Burner | Wheaton | 237070 | |
| Aspirating pipette | BD Biosciences | 357558 | |
| Aspirator tube | Sigma-Aldrich | A5177 | |
| Bacterial loops | For static bacterial culture and OD measurement | ||
| Benchtop centrifuge | Eppendorf | 5424 | Any centrifuge for 1.5ml eppendorf tubes |
| Conical flasks | For static bacterial culture and OD measurement | ||
| Digital camera for microscope | Olympus | DP71 | For image capture and harvesting of IBCs. Any other fluorescent microscope with a GFP channel will suffice |
| Glass Capillaries | Kimax | 6148K07 | |
| Iris Scissors STR SS 110MM | Braun | BC110R | |
| Isoflurane (Isothesia) | Henry Schein Animal Health | 29405 | |
| Kanamycin Sulfate | Calbiochem | 420311 | For static bacterial culture and OD measurement |
| LB broth (Miller) | Thermo/Gibco | 10855021 | For static bacterial culture and OD measurement |
| Light source unit for microscope | Olympus | LG-PS2 | For image capture and harvesting of IBCs. Any other fluorescent microscope with a GFP channel will suffice |
| Lubricant | KY | Any similar commercial medical lubricant will suffice | |
| Macro fluorescence microscope | Olympus | MVX10 | For image capture and harvesting of IBCs. Any other fluorescent microscope with a GFP channel will suffice |
| Micropipette + micropipette tips | For static bacterial culture and OD measurement | ||
| PBS 1x | For static bacterial culture and OD measurement | ||
| Pipette controller + Pipettes | For static bacterial culture and OD measurement | ||
| Polyethylene Tubing | BD Intramedic | 427401 | |
| Precision Glide needle 30 G | BD Biosciences | 305107 | Possibly under new catalogue number (305106) |
| Splinter forceps curved | Braun | BD312R | |
| Spray bottle (for ethanol) | For static bacterial culture and OD measurement | ||
| Square cuvettes | Elkay | 127-1010-400 | For static bacterial culture and OD measurement |
| Sterilgard III Advance Safety Cabinet | Baker | SG403 | Any biosafety cabinet with a UV irridiator |
| Sterilin 90mm Standard Petri Dish | Thermo | 101VR20 | Any sterile petri dish |
| Stevens, vascular and tendon scissors, curved, delicate, 110 mm | Braun | OK366R | Recommended for harvesting of bladder |
| Surgical Scissors STR S/B 105MM | Braun | BC320R | |
| Tabletop Centrifuge | Eppendorf | 5810R | Any refridgerated centrifuge for 15ml conicals |
| WPA C08000 cell density meter | Biowave (Biochrom) | 80-3000-45 | For static bacterial culture and OD measurement |
参考文献
- Barber, A. E., Norton, P. J., Spivak, A. M., Mulvey, M. A. Urinary Tract Infections: Current and Emerging Management Strategies. Clinical Infectious Diseases. 57 (5), 719-724 (2013).
- Flores-Mireles, A. L., Walker, J. N., Caparon, M., Hultgren, S. J. Urinary tract infections: epidemiology, mechanisms of infection and treatment options. Nature Reviews Microbiology. 13, 269-284 (2015).
- Foxman, B. Recurring urinary tract infection: incidence and risk factors. American Journal of Public Health. 80, 331-333 (1990).
- Foxman, B., Barlow, R., D'Arcy, H., Gillespie, B., Sobel, J. D. Urinary tract infection: self-reported incidence and associated costs. Annals of Epidemiology. 10 (8), 509-515 (2000).
- Zowawi, H. M., et al. The emerging threat of multidrug-resistant Gram-negative bacteria in urology. Nature Reviews Urology. 12, 570-584 (2015).
- Silverman, J. A., Schreiber, H. L., Hooton, T. M., Hultgren, S. J. From physiology to pharmacy: developments in the pathogenesis and treatment of recurrent urinary tract infections. Current Urology Reports. 14, 448-456 (2013).
- Sivick, K. E., Mobley, H. L. T. Waging war against uropathogenic Escherichia coli: winning back the urinary tract. Infection and Immunity. 78, 568-585 (2010).
- Hung, C. -S., Dodson, K. W., Hultgren, S. J. A murine model of urinary tract infection. Nature Protocols. 4, 1230-1243 (2009).
- Cusumano, C. K., et al. Treatment and prevention of urinary tract infection with orally active FimH inhibitors. Science Translational Medicine. , (2011).
- Alteri, C. J., Hagan, E. C., Sivick, K. E., Smith, S. N., Mobley, H. L. T. Mucosal Immunization with Iron Receptor Antigens Protects against Urinary Tract Infection. PLoS Pathogens. , (2009).
- Mysorekar, I. U., Hultgren, S. J. Mechanisms of uropathogenic Escherichia coli persistence and eradication from the urinary tract. Proceedings of the National Academy of Sciences of the United States of America. , (2006).
- Hunstad, D. A., Justice, S. S. Intracellular lifestyles and immune evasion strategies of uropathogenic Escherichia coli. Annual Review of Microbiology. 64, 203-221 (2010).
- Rosen, D. A., Hooton, T. M., Stamm, W. E., Humphrey, P. A., Hultgren, S. J. Detection of intracellular bacterial communities in human urinary tract infection. PLoS Medicine. , (2007).
- Robino, L., et al. Detection of intracellular bacterial communities in a child with Escherichia coli recurrent urinary tract infections. Pathogens and Disease. 68 (3), 78-81 (2013).
- Robino, L., et al. Intracellular bacteria in the pathogenesis of Escherichia coli urinary tract infection in children. Clinical Infectious Diseases. 59 (11), 158-164 (2014).
- Schwartz, D. J., Chen, S. L., Hultgren, S. J., Seed, P. C. Population dynamics and niche distribution of uropathogenic Escherichia coli during acute and chronic urinary tract infection. Infection and Immunity. 79, 4250-4259 (2011).
- Keshtkar, A., Keshtkar, A., Lawford, P. Cellular morphological parameters of the human urinary bladder (malignant and normal). International Journal of Experimental Pathology. 88, 185-190 (2007).
- Duraiswamy, S., Chee, J. L. Y., Chen, S., Yang, E., Lees, K., Chen, S. L. Purification of Intracellular Bacterial Communities during Experimental Urinary Tract Infection Reveals an Abundant and Viable Bacterial Reservoir. Infection and Immunity. , (2018).
- Kurimoto, K., Yabuta, Y., Ohinata, Y., Saitou, M. Global single-cell cDNA amplification to provide a template for representative high-density oligonucleotide microarray analysis. Nature Protocols. 2, 739-752 (2007).
- Tang, F., et al. Deterministic and stochastic allele specific gene expression in single mouse blastomeres. PLoS One. , (2011).
- Wells, J. M., Melton, D. A. Early mouse endoderm is patterned by soluble factors from adjacent germ layers. Development. 127, 1563-1572 (2000).
- Guo, H., et al. Profiling DNA methylome landscapes of mammalian cells with single-cell reduced-representation bisulfite sequencing. Nature Protocols. 10 (5), 645-659 (2015).
- Zhao, R., et al. The establishment of clonally derived chicken embryonic fibroblast cell line (CSC) with high transfection efficiency and ability as a feeder cell. Journal of Cellular Biochemistry. , (2018).
- Tang, F., et al. RNA-Seq analysis to capture the transcriptome landscape of a single cell. Nature Protocols. 5 (3), 516-535 (2010).
- Wiegert, J. S., Gee, C. E., Oertner, T. G. Single-Cell Electroporation of Neurons. Cold Spring Harbor Protocols. , (2017).
- Conover, M. S., Flores-Mireles, A. L., Hibbing, M. E., Dodson, K., Hultgren, S. J. Establishment and Characterization of UTI and CAUTI in a Mouse Model. Journal of Visualized Experiments. (100), 52892(2015).
- Justice, S. S., et al. Differentiation and developmental pathways of uropathogenic Escherichia coli in urinary tract pathogenesis. Proceedings of the National Academy of Sciences of the United States of America. 101 (5), 1333-1338 (2004).
- Mulvey, M. A., et al. Induction and Evasion of Host Defenses by Type 1-Piliated Uropathogenic Escherichia coli. Science. 282 (5393), 1494-1497 (1998).
- Zhang, H., Susanto, T. T., Wan, Y., Chen, S. L. Comprehensive mutagenesis of the fimS promoter regulatory switch reveals novel regulation of type 1 pili in uropathogenic Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 113 (15), 4182-4187 (2016).
- Gally, D. L., Bogan, J. A., Eisenstein, B. I., Blomfield, I. C. Environmental regulation of the fim switch controlling type 1 fimbrial phase variation in Escherichia coli K-12: effects of temperature and media. Journal of Bacteriology. 175 (19), 6186-6193 (1993).
- Olson, P. D., Hruska, K. A., Hunstad, D. A. Androgens Enhance Male Urinary Tract Infection Severity in a New Model. Journal of the American Society of Nephrology. 27 (6), 1625-1634 (2016).
- Garofalo, C. K., et al. Escherichia coli from Urine of Female Patients with Urinary Tract Infections Is Competent for Intracellular Bacterial Community Formation. Infection and Immunity. 75 (1), 52-60 (2007).
- Berry, R. E., Klumpp, D. J., Schaeffer, A. J. Urothelial cultures support intracellular bacterial community formation by uropathogenic Escherichia coli. Infection and Immunity. 77 (7), 2762-2772 (2009).
- Holden, N., Totsika, M., Dixon, L., Catherwood, K., Gally, D. L. Regulation of P-fimbrial phase variation frequencies in Escherichia coli CFT073. Infection and Immunity. 75 (7), 3325-3334 (2007).
- Jost, S. P. Postnatal growth of the mouse bladder. Journal of Anatomy. 143, 39-43 (1985).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。