需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
特征对斑马鱼磁场敏感性的影响评价
摘要
我们描述了一种行为协议, 该协议旨在评估斑马鱼的性格如何影响它们对水流和弱磁场的反应。性格相同的鱼根据其探索行为而分离。然后, 观察了在不同磁条件下, 在低流速游泳隧道中的流变定向行为。
摘要
为了使自己适应自己的环境, 动物整合了广泛的外部暗示, 这些暗示与几个内部因素相互作用, 如个性。在这里, 我们描述了一个行为协议, 旨在研究斑马鱼个性对其对多种外部环境线索的定向响应的影响, 特别是水流和磁场。该方案旨在了解当周围的磁场改变方向时, 主动或反应斑马鱼是否显示不同的流变力阈值 (即鱼开始向上游游动的流速)。为了识别具有相同个性的斑马鱼, 在一个与一个狭窄的开口相连到明亮的一半的鱼缸的黑暗半处引入了鱼。只有积极主动的鱼探索新颖、明亮的环境。反应性鱼不会离开水箱的黑暗部分。采用低流速游泳隧道确定流变阈值。我们描述了在地球磁场强度范围内控制隧道内磁场的两个设置: 一个是控制沿流动方向 (一维) 的磁场, 另一个是允许对磁场进行三轴控制。在不同磁场下, 鱼在经历隧道流速逐步增加的情况下拍摄。关于方向行为的数据通过视频跟踪程序收集, 并应用于逻辑模型, 以便确定流变阈值。我们报告从浅滩斑马鱼收集的代表性结果。具体而言, 这些情况表明, 只有反应性、谨慎的鱼在磁场方向变化时, 才会显示流变系统阈值的变化, 而主动的鱼不会对磁场的变化做出反应。该方法可应用于许多水生物种的磁敏和流变行为的研究, 包括单生或浅滩游泳策略。
引言
在本研究中, 我们描述了一种基于实验室的行为协议, 该协议的范围是研究鱼的个性对水流和磁场等外部方向线索的定向响应的作用。
动物的定向决定是由权衡各种感官信息的结果。决策过程受动物导航能力 (如选择和保持方向的能力)、其内部状态 (如喂养或生殖需求)、移动能力 (如运动生物力学) 和其他几个方面的影响。外部因素 (例如, 一天中的时间, 与具体情况的相互作用)1。
内在状态或动物个性在取向行为中的作用往往是鲜为人知或没有探索的 2。在社会水生物种的定位研究中, 还出现了其他挑战, 这些物种往往表现为协调和极化的群体运动行为3。
水流在鱼类的定向过程中起着关键作用。鱼类通过称为流变轴4的无条件响应定向到水流, 这种反应可以是正的 (即面向上游), 也可以是负的 (即下游方向的), 并用于若干活动, 从觅食到尽量减少精力充沛的开支5,6。此外, 越来越多的文献报道说, 许多鱼类使用地磁场进行定向和导航7、8、9.
对鱼的流变和游泳性能的研究通常是在流动室 (水槽) 中进行的, 在那里, 鱼接触到流动速度的逐步增加, 从低速到高速, 通常直到耗尽 (称为临界速度)10, 11个。另一方面, 以前的研究通过观察动物在静水 12、13 的竞技场上的游泳行为, 研究了磁场在定向中的作用。在这里, 我们描述了一种实验室技术, 使研究人员能够研究鱼的行为, 同时操纵水流和磁场。在我们之前的研究中, 首次将这种方法用于浅滩斑马鱼 (Danio rerio), 得出的结论是, 对周围磁场的操纵决定了流变阈值 (即在它把鱼放在上游.这种方法是基于使用一个缓慢流动的水槽室结合设置, 以控制在水槽中的磁场, 在地球的磁场强度范围内。
图 1概述了用于观察斑马鱼行为的游泳隧道。隧道 (由直径为7厘米、长度为15厘米的非反射丙烯酸圆筒组成) 连接到控制流量14的设置上。在此设置中, 隧道中的流量范围在0到9之间。
为了操纵游泳隧道中的磁场, 我们使用两种方法: 第一种是一维的, 第二种是三维的。对于任何应用, 这些方法都可以操纵地磁场, 以获得规定体积的水中的特定磁场条件--因此, 本研究中报告的磁场强度值包括地磁场。
关于一维方法15, 磁场是沿着水流方向 (定义为 x 轴) 操作的, 使用环绕在游泳隧道周围的螺长管。这连接到一个动力装置, 并产生均匀的静态磁场 (图 2a)。同样, 在三维接近的情况下, 含有游泳隧道的体积中的地磁场也使用电线线圈进行了修改。然而, 为了在三维空间中控制磁场, 线圈设计了三个正交赫尔姆霍兹对 (图 2b)。每个 Helmholtz 对由两个沿三个正交空间方向 (x、 y和z) 定向的圆形线圈组成, 并配备了在闭环条件下工作的三轴磁强计。磁强计的工作领域强度与地球的自然场相当, 它位于接近的几何中心的线圈集 (游泳隧道的位置)。
我们实施上述技术来检验这样的假设, 即组成浅滩的鱼的个性特征会影响它们对磁场16 的反应。我们测试的假设是, 具有主动和反应人格的17,18 人在暴露于水流和磁场时的反应不同。为了验证这一点, 我们首先使用既定的方法对斑马鱼进行排序, 以分配和分组主动或反应性的17、19、20、21个人.然后, 我们评估斑马鱼游泳的流变行为, 在浅滩游泳只由反应性个体或由只有主动的个人在磁水槽槽, 我们提出作为样本数据。
排序方法是基于主动和反应性个体探索新环境的不同倾向21。具体而言, 我们使用的坦克分为明亮和黑暗面17,19, 20,21 (图 3)。动物适应了黑暗面。当进入光明的一面是开放的, 主动的个人往往会迅速离开黑暗的一半的坦克, 探索新的环境, 而反应性的鱼不会离开黑暗的坦克。
研究方案
以下议定书已得到意大利那不勒斯第二大学动物护理和使用机构委员会的批准 (2015年)。
1. 动物饲养
- 使用至少200升的坦克, 在每个坦克中举办至少50名男女人员的浅滩。
请注意:鱼缸中的鱼的密度必须是每2升或更低的一只动物。在这种情况下, 斑马鱼将表现出正常的浅滩行为。 - 设置维护条件如下: 温度在 27–28°c;电导率在 & lt;500 μS;pH 值 6.5–7.5;3号 & lt;0.25 mg/L;和光: 黑暗的光周期在10h:14h。
请注意:混合人口和分离的主动和反应人口都必须使用相同的持有条件。
2. 斑马鱼的人格选择
- 用与维修罐相同的水准备个性选择罐 (图 3) 并将其放置在安静的房间中。
- 将摄像机放置在水箱上方或侧面。将相机连接到计算机, 其显示器位于与坦克没有视觉接触的区域。
- 从维修槽中随机选择9条鱼, 并使用无结网将其转移到个性选择槽的黑暗面。
请注意:尽量将与鱼缸和鱼的相互作用限制在尽可能短的时间内。避免噪音和快速移动。如有必要, 用储罐中的水将动物转移到小体积运输罐 (约2升) 中。为了避免动物暴露在空气中, 使用250毫升的烧杯, 轻轻诱导动物进入烧杯。尽量减少捕获时间, 避免收集多个鱼, 因为它可能会对动物造成物理损害, 不要在网中持有超过几秒钟的鱼, 因为这些因素可能会增加压力。在转移到实验槽之前, 必须将鱼作为脂肪状鱼。这限制了在下面的实验22中, 不同的食物寻求行为倾向会影响个体行为的可能性。在一天中的同一时间进行复制实验。这最大限度地减少了实验组的行为的变异性所造成的可能的生理节律23。 - 适应1小时后, 打开滑动门。
请注意:从洞中出来, 在10分钟内探索坦克明亮一面的个人, 被认为是主动的 21。 - 10分钟后, 轻轻地将主动的个人从储罐中取出, 并将其转移到主动维护罐。
- 15分钟后, 收集留在黑暗盒子中的鱼, 被认为是反应性的 21, 并将其转移到反应性维护槽。
请注意:在 10分钟21分后丢弃移动到水箱明亮一侧的鱼。一次用9条鱼进行个性测试, 直到收集到第5节所述测试所需的主动和反应鱼的数量。可以使用相同的方法定期检查主动和被动人格的一致性。
3. 使用一维磁场操作设置磁场27
- 打开电源设备 (图 2a)。
- 将盘绕隧道放置在执行流变协议的位置 (第5节), 但将其与游泳设备断开连接 (图 2 a)。将与高斯/tesl温特连接的磁探头放置在隧道内, 并验证需要哪种电压才能获得沿隧道主轴选择的磁场值。
请注意:由于电磁阀的磁性能, 隧道内的磁场相当均匀;这可以通过缓慢地水平和垂直移动探头来检查。 - 断开探头的连接, 并将流动隧道连接到游泳装置。
- 从流变协议开始 (第5节)。
4. 使用三维磁场操作设置磁场27
- 打开 CPU、DAC 和线圈驱动程序 (图 2b)。
- 在三个轴 (x、y 和 z) 中的每一个上设置选定的磁场。
- 将隧道放置在赫尔姆霍兹对集合的中心。
- 从流变协议开始 (第5节)。
5. 流动室斑马鱼流变的试验
- 使用两侧和底部遮挡的2升鱼缸将一到5条鱼转移到流动隧道。
- 打开泵, 将隧道中的流速设置为 1.7 cm2。
请注意:这种缓慢流动的水将使隧道中的水保持氧气, 并将促进动物的恢复。 - 让动物适应游泳隧道1小时。
- 开始对隧道中鱼类的行为进行视频记录。
请注意:我们使用了带有遥控器 (例如蓝牙) 的摄像机 (例如, Yi 4K action), 并将视频保存为. mpg (30 帧)。 - 根据所选择的实验方案 (本研究中的 1.3 mm;图 4)。
请注意:对于这个协议, 我们使用了低流速, 对于斑马鱼来说, 流量从0到 2.8 BL (体长)/不等。这些流速在较低的流速范围内, 诱导斑马鱼连续定向游泳 (占临界游泳速度的 3%-15% [Ucrit])24。使用低流量 (遵循布雷特的协议25) 与该物种在水流存在的情况下的具体行为特征有关。斑马鱼倾向于沿着房间的主轴游泳, 即使在水流的情况下也会频繁转弯, 并倾向于上游和下游 24,26。这种行为受到水流率的影响, 在相对较高的速度 (& gt;8 bls)26时, 当动物不断向上游游泳 (完全正的流变反应)。垂直和横向位移是非常罕见的。 -
对动物的形态测量 (性别和总长度 [TL]、叉长 [FL] 或 BL) 在形态测量室中的鱼的图片。
- 选择适当的图片。
- 在 ImageJ 中打开图片。
- 注意动物的性别 (雄性斑马鱼细长, 往往是黄色的, 而雌性则比较圆润, 往往有蓝色和白色的颜色)。
- 单击"分析 ≫ 设置比例", 并使用隧道的整个水平长度作为参考, 将图像的比例设置为厘米。
- 单击"分析 ≫ 测量" 并记录动物的线性长度。
- 计算它的体重 (BW)。
请注意:BW 是根据以前在实验室中建立的性 Fl-bw 关系或元数据计算的。整个过程避免了对动物的操纵压力。
6. 视频跟踪
- 使用跟踪器4.84 视频分析和建模工具打开视频文件。
请注意:如有必要, 请使用透视和径向失真滤波器纠正任何视频失真。 - 单击上面菜单中的坐标系, 并将长度单位设置为厘米, 将时间单位设置为秒。
- 单击"文件 ≫ 导入>视频",然后打开 "跟踪器 4.84" 中的视频之一。
- 单击 "坐标轴" 并设置参考系统, 以跟踪鱼的位置随着时间的推移, 与 x 轴沿隧道。将原点设置在下游结束墙的低角 (在出水口)。
- 点击"跟踪 > 新>质量点, 并开始一次跟踪一条鱼。跟踪鱼在每个流速下花费的每个步骤的最后5分钟。
- 在五帧间隔 (0.5秒) 手动推进视频, 并在每个上下游转弯处 (UDt;图 5中的红点) 和每个下游上游转弯处 (dut;图 5中的蓝点) 标记动物的时间和位置。
请注意:使用鱼眼的位置作为参考的鱼的位置。使用点质量跟踪动物的位置。排除在跟踪任何期间的非定向游泳 (即机动时间)。 - 在每个跟踪会话的末尾, 从软件窗口右下角的表中选择 x 值和时间值。右键单击数据, 然后单击 "将数据 > 完全精度"。
- 保存模板电子表格文件上所有车削位置的时间值和 x 值, 以计算整个上游时间 (UDts 和 DUts 之间所有间隔的总和) 和整个下游时间 (DUts 和 UDt 之间间隔的总和), 以及这些值的流变指数 (按百分比计算) (RI%)每个流程步骤 (参见图 5)。
请注意:流变学行为是量化的总定向时间的比例, 鱼花面对上游 (游泳或很少冻结 [即, 他们仍然停留在隧道底部]27).此比例定义为 RI% (图 5)。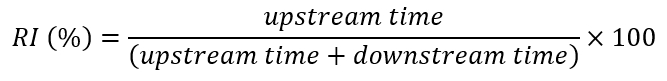
结果
作为样本数据, 我们提供的结果是, 使用图 2 a 所示的设置 (见协议第3节),控制主动和反应性浅滩16上水流方向的磁场。这些结果表明, 所描述的协议如何能够突出不同性格的鱼类在对磁场反应上的差异。这些试验的总体概念取决于这样的发现, 即磁场相对于水流的方向会影响浅滩斑马鱼14的流变阈值。因此, 由于磁场?...
讨论
本研究中描述的协议使科学家能够量化水生物种的复杂方向反应, 这是由两个外部线索 (水流和地磁场) 和动物的一个内部因素 (如人格。总的概念是创造一个实验设计, 允许科学家分离不同个性的个体, 调查他们的定位行为, 同时单独或同时控制外部环境线索。
本研究中描述的协议, 连同流变指数 (RI) 的数学定义, 是在初步观察了斑马鱼在游泳隧道中的行为后设计的。当放置在?...
披露声明
作者没有什么可透露的。
致谢
这项研究得到了那不勒斯大学费德里科二世物理系基础研究创立和生物系的支持。作者感谢 Cl何迪亚·安杰利尼博士 (意大利国家应用微积分研究所) 的统计支持。作者感谢 Martina Scanu 和 Silvia Frassinet 在收集数据方面提供的技术帮助, 并感谢部门技术人员 F. Cassese、G. Passeggio 和 r. rocco 在设计和实现实验设置方面提供的娴熟帮助。我们感谢劳拉·根蒂勒在视频拍摄期间帮助进行了实验。我们感谢迈阿密大学的戴安娜·罗斯·乌德尔拍摄了亚历桑德罗·克雷斯基的采访声明。
材料
| Name | Company | Catalog Number | Comments |
| 9500 G meter | FWBell | N/A | Gaussmeter, DC-10 kHz; probe resolution: 0.01 μT |
| AD5755-1 | Analog Devices | EVAL-AD5755SDZ | Quad Channel, 16-bit, Digital to Analog Converter |
| ALR3003D | ELC | 3760244880031 | DC Double Regulated power supply |
| BeagleBone Black | Beagleboard.org | N/A | Single Board Computer |
| Coil driver | Home made | N/A | Amplifier based on commercial OP (OPA544 by TI) |
| Helmholtz pairs | Home made | N/A | Coils made with standard AWG-14 wire |
| HMC588L | Honeywell | 900405 Rev E | Digital three-axis magnetometer |
| MO99-2506 | FWBell | 129966 | Single axis magnetic probe |
| Swimming apparatus | M2M Engineering Custom Scientific Equipment | N/A | Swimming apparatus composed by peristaltic pump and SMC Flow switch flowmeter with digital feedback |
| TECO 278 | TECO | N/A | Thermo-cryostat |
参考文献
- Nathan, R., et al. A movement ecology paradigm for unifying organismal movement research. Proceedings of the National Academy of Sciences. 105 (49), 19052-19059 (2008).
- Holyoak, M., Casagrandi, R., Nathan, R., Revilla, E., Spiegel, O. Trends and missing parts in the study of movement ecology. Proceedings of the National Academy of Sciences. 105 (49), 19060-19065 (2008).
- Miller, N., Gerlai, R. From Schooling to Shoaling: Patterns of Collective Motion in Zebrafish (Danio rerio). PLoS ONE. 7 (11), 8-13 (2012).
- Chapman, J. W., et al. Animal orientation strategies for movement in flows. Current Biology. 21 (20), R861-R870 (2011).
- Montgomery, J. C., Baker, C. F., Carton, A. G. The lateral line can mediate rheotaxis in fish. Nature. 389 (6654), 960-963 (1997).
- Baker, C. F., Montgomery, J. C. The sensory basis of rheotaxis in the blind Mexican cave fish, Astyanax fasciatus. Journal of Comparative Physiology A: Sensory, Neural, and Behavioral Physiology. 184 (5), 519-527 (1999).
- Putman, N. F., et al. An Inherited Magnetic Map Guides Ocean Navigation in Juvenile Pacific Salmon. Current Biology. 24 (4), 446-450 (2014).
- Cresci, A., et al. Glass eels (Anguilla anguilla) have a magnetic compass linked to the tidal cycle. Science Advances. 3 (6), 1-9 (2017).
- Newton, K. C., Kajiura, S. M. Magnetic field discrimination, learning, and memory in the yellow stingray (Urobatis jamaicensis). Animal Cognition. 20 (4), 603-614 (2017).
- Langdon, S. A., Collins, A. L. Quantification of the maximal swimming performance of Australasian glass eels, Anguilla australis and Anguilla reinhardtii, using a hydraulic flume swimming chamber. New Zealand Journal of Marine and Freshwater Research. 34 (4), 629-636 (2000).
- Faillettaz, R., Durand, E., Paris, C. B., Koubbi, P., Irisson, J. O. Swimming speeds of Mediterranean settlement-stage fish larvae nuance Hjort’s aberrant drift hypothesis. Limnology and Oceanography. 63 (2), 509-523 (2018).
- Takebe, A., et al. Zebrafish respond to the geomagnetic field by bimodal and group-dependent orientation. Scientific Reports. 2, 727 (2012).
- Osipova, E. A., Pavlova, V. V., Nepomnyashchikh, V. A., Krylov, V. V. Influence of magnetic field on zebrafish activity and orientation in a plus maze. Behavioural Processes. 122, 80-86 (2016).
- Cresci, A., De Rosa, R., Putman, N. F., Agnisola, C. Earth-strength magnetic field affects the rheotactic threshold of zebrafish swimming in shoals. Comparative Biochemistry and Physiology - Part A: Molecular and Integrative Physiology. 204, 169-176 (2017).
- Tesch, F. W. Influence of geomagnetism and salinity on the directional choice of eels. Helgoländer Wissenschaftliche Meeresuntersuchungen. 26 (3-4), 382-395 (1974).
- Cresci, A., et al. Zebrafish “personality” influences sensitivity to magnetic fields. Acta Ethologica. , 1-7 (2018).
- Benus, R. F., Bohus, B., Koolhaas, J. M., Van Oortmerssen, G. A. Heritable variation for aggression as a reflection of individual coping strategies. Cellular and Molecular Life Sciences. 47 (10), 1008-1019 (1991).
- Dahlbom, S. J., Backstrom, T., Lundstedt-Enkel, K., Winberg, S. Aggression and monoamines: Effects of sex and social rank in zebrafish (Danio rerio). Behavioural Brain Research. 228 (2), 333-338 (2012).
- Koolhaas, J. M. Coping style and immunity in animals: Making sense of individual variation. Brain, Behavior, and Immunity. 22 (5), 662-667 (2008).
- Dahlbom, S. J., Lagman, D., Lundstedt-Enkel, K., Sundström, L. F., Winberg, S. Boldness predicts social status in zebrafish (Danio rerio). PLoS ONE. 6 (8), 2-8 (2011).
- Rey, S., Boltana, S., Vargas, R., Roher, N., Mackenzie, S. Combining animal personalities with transcriptomics resolves individual variation within a wild-type zebrafish population and identifies underpinning molecular differences in brain function. Molecular Ecology. 22 (24), 6100-6115 (2013).
- Toms, C. N., Echevarria, D. J., Jouandot, D. J. A Methodological Review of Personality-related Studies in Fish: Focus on the Shy-Bold Axis of Behavior. International Journal of Comparative Psychology. 23, 1-25 (2010).
- Boujard, T., Leatherland, J. F. Circadian rhythms and feeding time in fishes. Environmental Biology of Fishes. 35 (2), 109-131 (1992).
- Plaut, I. Effects of fin size on swimming performance, swimming behaviour and routine activity of zebrafish Danio rerio. Journal of Experimental Biology. 203 (4), 813-820 (2000).
- Tierney, P., Farmer, S. M. Creative Self-Efficacy Development and Creative Performance Over Time. Journal of Applied Psychology. 96 (2), 277-293 (2011).
- Plaut, I., Gordon, M. S. swimming metabolism of wild-type and cloned zebrafish brachydanio rerio. Journal of Experimental Biology. 194 (1), (1994).
- Kalueff, A. V., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10 (1), 70-86 (2013).
- Tudorache, C., Schaaf, M. J. M., Slabbekoorn, H. Covariation between behaviour and physiology indicators of coping style in zebrafish (Danio rerio). Journal of Endocrinology. 219 (3), 251-258 (2013).
- Uliano, E., et al. Effects of acute changes in salinity and temperature on routine metabolism and nitrogen excretion in gambusia (Gambusia affinis) and zebrafish (Danio rerio). Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology. 157 (3), 283-290 (2010).
- Palstra, A. P., et al. Establishing zebrafish as a novel exercise model: Swimming economy, swimming-enhanced growth and muscle growth marker gene expression. PLoS ONE. 5 (12), (2010).
- Bak-Coleman, J., Court, A., Paley, D. A., Coombs, S. The spatiotemporal dynamics of rheotactic behavior depends on flow speed and available sensory information. The Journal of Experimental Biology. 216, 4011-4024 (2013).
- Brett, J. R. The Respiratory Metabolism and Swimming Performance of Young Sockeye Salmon. Journal of the Fisheries Research Board of Canada. 21 (5), 1183-1226 (1964).
- Quintella, B. R., Mateus, C. S., Costa, J. L., Domingos, I., Almeida, P. R. Critical swimming speed of yellow- and silver-phase European eel (Anguilla anguilla, L.). Journal of Applied Ichthyology. 26 (3), 432-435 (2010).
- Spence, R., Gerlach, G., Lawrence, C., Smith, C. The behaviour and ecology of the zebrafish, Danio rerio. Biological Reviews. 83 (1), 13-34 (2008).
- Engeszer, R. E., Patterson, L. B., Rao, A. A., Parichy, D. M. Zebrafish in the Wild: A Review of Natural History and New Notes from the Field. Zebrafish. 4 (1), (2007).
- Gardiner, J. M., Atema, J. Sharks need the lateral line to locate odor sources: rheotaxis and eddy chemotaxis. Journal of Experimental Biology. 210 (11), 1925-1934 (2007).
- Thorpe, J. E., Ross, L. G., Struthers, G., Watts, W. Tracking Atlantic salmon smolts, Salmo salar L., through Loch Voil, Scotland. Journal of Fish Biology. 19 (5), 519-537 (1981).
- Bottesch, M., et al. A magnetic compass that might help coral reef fish larvae return to their natal reef. Current Biology. 26 (24), R1266-R1267 (2016).
- Boles, L. C., Lohmann, K. J. True navigation and magnetic maps in spiny lobsters. Nature. 421 (6918), 60-63 (2003).
- Dingemanse, N. J., Kazem, A. J. N., Réale, D., Wright, J. Behavioural reaction norms: animal personality meets individual plasticity. Trends in Ecology and Evolution. 25 (2), 81-89 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。