Method Article
构建用于扩展视场单分子成像的高倾角扫描磁贴显微镜的指南
摘要
详细介绍了如何建立高倾斜的扫描瓷砖 (HIST) 显微镜及其在单分子成像中的应用。
摘要
单分子成像极大地促进了我们对生物学研究中分子机制的理解。然而, 在厚细胞和组织中获得大的视场、高对比度图像一直是一项挑战。在这里, 我们引入高度倾斜的扫描瓷砖 (HIST) 显微镜, 以克服这个问题。为了产生一个拉长的激发光束, 通过快速的 galvo 反射镜在一个大的成像区域上进行扫描, 实现了一对圆柱形透镜。使用了 4f配置来定位光学元件。一个科学的互补金属氧化物半导体相机检测到荧光信号, 并通过与光束清扫同步的动态共聚焦缝隙阻断了焦距外的背景。我们提出了一个逐步建设 HIST 显微镜与所有基本组件的指导。
引言
单分子荧光成像在揭示超微结构、动力学和生物分子1, 2,3的数量的许多生物学研究中发挥着重要作用。然而, 研究细胞或组织内的单分子一直是一个挑战。共聚焦显微镜提供了较高的切片能力4, 但由于高激发强度或成像速度较慢, 严重的光漂白, 不适合单分子成像。Widefield 显微镜使用较弱的照明, 但由于信号与背景的比率 (SBR)5的缺点。而光片显微镜则能表现出良好的切片和较低的光漂白6;然而, 现有的数值孔径 (NA) 在很大程度上受到正交放置目标7要求的限制。或者, 它需要特殊的照明器和样品室8,9。
由于这些原因, 高倾斜层压光学片 (HILO) 显微镜已被广泛用于三维单分子成像10。当斜梁遇到两个介质 (例如玻璃和水) 的界面时, 光束会根据 Snell 定律进行折射。重要的是, 折射光束变得更薄, 其厚度被描述为 dz = rp (), 其中 R 是斜梁的直径, 是透射光束的折射角。这个简单的实现产生了良好的切片能力。然而, 这种关系表明, 薄照明 (即高切片能力) 需要一个小 R 和/或一个大的。例如, 当 R = 20μm 和 = 72 度时, 可以获得 dz = 6.5μm。由于增加折射角以成像细胞内部深处以避免总内部反射存在实际限制, 因此照明直径与光束厚度有很强的耦合。因此, HILO 成像显示了一个相对较小的视场 (FOV), 极大地限制了其在多细胞成像中的应用。
最近, 我们已经克服了这个问题的高度倾斜扫瓦 (HIST) 显微镜, 其中 FOV 解耦光束厚度在一个非常简单的方式11。首先, 在一个方向拉长的光束是通过一对圆柱形透镜产生的。这种光束被称为瓷砖, 产生 dz ~ 4μm 的薄照明, 而其 FOV 为 130 x 12μm2。然后, 瓷砖被扫过样品使用旋转的 galvo 镜子。同时, 荧光图像被记录在科学的互补金属氧化物半导体 (sCMOS) 相机上, 该相机通过在可调谐共聚焦缝隙检测的滚动快门模式下工作, 有效地过滤出焦距以外的背景。通过这种方式, HIST 显微镜使单分子成像具有比 HILO 成像更大的视野 (~ 130 x 130 微米2) 和更薄的照明。我们应用这项新的成像技术, 在细胞中使用单个探针或在小鼠脑组织中使用少量探针检测 RNA 转录, 这对研究基因表达和疾病具有巨大的潜力。与其他方法不同, HIST 只使用单个高数值孔径目标, 而不使用额外的照明器或远程检测目标, 并且与倒置显微镜完全兼容。这些优势以及大型 FOV 和高对比度将使 HIST 显微镜成为生物学和医学领域的一个突出工具。我们提供有关 HIST 显微镜仪器的详细说明, 以及如何测试和校准其性能, 如下所示。
研究方案
1. 设置显微镜、激光和对准工具
- 在制造显微镜之前, 准备所有必要的部件, 包括光学、光学机械和电子产品, 如材料表中列出的那样。
- 准备一个显微镜体, 主要由两部分组成: 具有 rms 螺纹端口的目标支架和安装在铝块上的压电级 (图 1a)。
注: 定制显微镜体用于方便和灵活的仪器12。任何市售的显微镜体都可用于 HIST 显微镜。 - 将多条激光线组合在一起, 并将其与单模光纤耦合
- 在光学台上安装405、561、638 nm 激光, 并通过偏振分束器和远通双色镜将光束组合在一起, 如图 1b 所示。确保所有激光束都通过对齐器上的针孔。插入半波板进行功率调整。
注: 佩戴保护眼睛的安全护目镜, 并使用波束块吸收不需要的激光束。 - 安装光纤耦合透镜 (f = 4.5 mm) 和带保持架系统的 z 轴转换器中的光纤适配器。
- 将多模光纤 (MMF, 直径 62.5μm) 连接到光纤适配器。调整每一对转向镜和 z 转换器, 直到每个激光的耦合效率高于95%。输出光束具有接近高斯形状的轮廓, 具有散斑图案。
- 取下多模光纤并连接单模光纤 (SMF)。与 MMF 类似, 可微调并最大限度地提高三种激光器的耦合效率。
- 在光学台上安装405、561、638 nm 激光, 并通过偏振分束器和远通双色镜将光束组合在一起, 如图 1b 所示。确保所有激光束都通过对齐器上的针孔。插入半波板进行功率调整。
- 组装准直光源, 用于激励和检测路径中的光束对齐。该器件由连接到 SMF、光纤适配器、无色透镜 (f = 60 mm)、虹膜和管间隔器 (图 1 c) 的临时相干光源 (561nm) 组成。使用剪切干涉仪调整光纤适配器与镜头之间的距离, 以确保准直。
- 准备光束对齐工具 (图 1d)。这是一对铝柱与针孔在 2 "高度从光学表的表面, 这允许快速和精确的光束对齐。
- 组装双针孔系统, 该系统由两端的两个 O1 "地面玻璃对齐盘和两个 O1" 透镜管 (底部的开槽) 组成, 如图 1e所示。
2. 设置检测路径
- 拿出目标, 安装准直光源。调整物镜 (M1) 的旋钮在目标支架下方, 使显微镜的输出光束在高度上与光学表大致平行, 并与表上的螺纹孔对齐。有关每个光学元件的详细位置, 请参见图 2 。
- 插入多波段双色镜 (DM) 并反射光束90度。使用虹膜的最大尺寸, 并确保光束通过双色镜的中心, 而不进行剪裁。
- 使用通过双色镜的漏电光束来指导检测路径的对齐。将 sCMOS 摄像机放入光束中, 并确保光束使用两个反射镜 (M2 和 M3) 击中相机芯片的中心。
- 在距离相机约300毫米的地方插入管状镜头 (TL; f = 300 毫米)。
- 卸下准直光源, 调整管镜头与相机之间的相对距离, 直到摄像机清楚地解决天花板上的图案。
- 在管透镜前插入多波段通滤波器 (BF), 用于多色荧光成像。
3. 设置激励路径
- 在目标支架上重新安装准直光源。放置折镜 (M4), 将显微镜的光束输出重定向90度。迭代调整二色镜和折镜的旋钮, 直到光束穿过光束对齐工具中的针孔。
- 分离准直光源并将其安装在桌子上, 其中光束指向显微镜体。使用光束对准工具和双针孔系统对齐光束。
- 插入镜头 L4 (f = 400 毫米;直径 = 2 ") 到距离目标支架约400毫米的光路。安装物镜, 调整 L4 沿光轴的位置, 直到天花板上形成完美的艾瑞圆盘图案。
注: 插入镜头时, 通过镜头的光束位置应保持不变。镜头 L4 有一个 SM2 螺纹, 使其能够很容易地与60毫米 SM2 螺纹保持架板分离。 - 拧下目标, 然后用开放的虹膜重新安装准直光源。用名片追踪显微镜下的光束输出。在光束最小且距离 L4 约400毫米的地方安装镜像 M5, l4 是共轭图像平面 (cIP)。
- 安装镜像 M6 并反射光束90度。使用光束对齐工具迭代调整 M5 和 M6。
- 在距离 M5 约150毫米的地方插入镜头 L3 (f = 150 毫米)。使用剪切干涉仪来确保输出光束的准直。
- 暂时带走 L4 并沿着光束追踪, 以找到 L3 的焦点位置。在这一点上放置一个单轴加维罗镜, 这是一个共轭的后焦平面 (cBFP)。向 galvo 反射镜供电0伏, 并旋转 galvo 反射镜的支架, 使其反射光束90度。
- 放置折镜 M7。正确放置 L2 (f = 100 毫米) 与步骤3.6 相同。
- 从对象支架上取下准直光源。安装准直透镜 L1 (f = 100 毫米)、光纤适配器和虹膜。将单模光纤连接到适配器, 并通过成像系统发送光束。
- 重新插入 L4 并微调系统, 直到天花板上出现完美的艾瑞磁盘图案。
4. 设置圆柱形镜片
- 在 L1 后插入圆柱形透镜 (CL1, f = 400 mm), 并确保圆柱形透镜沿 x 轴聚焦光束。
- 将另一个圆柱形透镜 (CL2, f = 50 mm) 插入光束路径。使用剪切干涉仪确保输出光束进行准直。
注: 两个圆柱形镜头之间的距离为 450 mm。输出光束的压缩比为 8, 天花板上形成了一个拉长的椭圆形气盘图案。
5. 测试磁贴成像
- 准备3D 水凝胶样品。将20纳米压深子珠与水凝胶溶液混合, 其中由12% 的丙烯酰胺组成: 双丙烯酰胺 (29:1)、0.2% (v/v) TEMED 和 0.2% (w/v) 硫酸铵 (w/v)。如其他地方所述, 将混合溶液的50μl 注入流动室11。10分钟后, 3D 水凝胶样品即可进行成像。
- 将样品放在样品支架上。打开 638 nm 激光, 调整功率和 lt;1 mW 进行样品激发。
- 运行相机控制软件。在相机获取设置面板中, 选择 "触发模式下的内部",然后单击 "免费运行模式中的视频"。
- 当0伏电压应用于 galvo 反射镜时, 请稍微调整相机的位置, 使图像位于相机的中心。
- 旋转镜面 M5 的水平旋钮, 实现高度倾斜的照明。
注: 随着照明角度的增加, 随着光束变薄, 水凝胶图像会变得比 Epi 图像更清晰。但是, 图像保持几乎相同的位置。 - 记录磁贴图像。计算有效照明宽度11。例如,图 3显示了12微米的有效照明宽度。
6. HIST 成像
- 准备与端子块连接的数据采集板。通过电线连接 P0.0 的 USER 1 BNC 连接器。使用 USER 1 作为数字输出, 用于 sCMOS 摄像机的外部触发。将模拟输出 AO0 连接到 galvo 镜像驱动程序。
- 使用定制程序从 P0.0 生成 TTL 脉冲序列 (图 4a), 并将周期时间设置为400毫秒和 t _ on = 2 ms. 通过数字示波器检查来自 user 1 BNC 终端的生成脉冲, 然后将 bnc 电缆连接到相机外部触发端口。
注: 本文中使用的控制软件可根据要求提供。在不同相机帧速率下进行成像时, 应相应调整周期时间。 - 开始通过定制的程序扫描一个大镜子。将 V最小值调整为-500 mv , 将 v 最大值调整为 500 mv, 以实现完整的 fov 成像。请注意, 在此操作中, 3D 水凝胶样本仍然显示高背景类似于 Epi 照明。
- 更改相机采集设置。
- 在 "在触发器模式下选择外部", 在 "光扫描加" 下拉菜单中选择"向下 (顺序) ", 如图 4b 所示。
注: 在此设置中, 除非打开触发信号, 否则相机不会拍摄图像。 - 单击 "扫描速度控制" 以控制窗口高度和线条曝光时间控制, 并将值分别设置为180 行和28 ms。
注: 当瓷砖宽度(weff) 为180行 (12 微米), 每行 (tint) 的积分时间为28毫秒时, 将线路 (td) 之间的延迟时间确定为 td = t int/wef/w 。2, 048 像素, 总采集时间为 2, 048 x T d + tint = 346 毫秒, 相当于约 2.9 fps.
- 在 "在触发器模式下选择外部", 在 "光扫描加" 下拉菜单中选择"向下 (顺序) ", 如图 4b 所示。
- 稍微调整 V最大值和 v分钟,以获得更清晰的图像。
- 通过打开3d 堆栈 on 并指定堆栈的数量和步长, 使用自定义程序获取3d 堆栈图像。
结果
例如, 用 Atto647N 标记的单链 DNA 在三维水凝胶中被成像, 激发波长为 638 nm。在凝胶聚合过程中, DNA 通过丙烯酸矿的浓度锚定到水凝胶网络中。图像是在表面上方5μm 处拍摄的, 如图 5a 所示。与 Epi 图像相比, HIST 图像的背景比更少, epist 图像的信噪比计算为 1.9±0.7, 而 Epi 几乎无法检测到大多数单个分子点。
用 4个 FISH 探针进行单分子 RNA 荧光原位杂交 (smFISH)。图 5b在成像缓冲液中显示带有亚历克沙福陆647标记的eef2 (真核翻译伸长因子 2) 的 ffish 图像 (请参阅我们以前关于样品制备11的工作)。在相当于5μm 厚度的 20个 z 堆栈上进行了最大强度投影。与 Epi 图像相比, HIST 图像不仅提高了 SBR, 而且照明更加均匀。在 Epi 成像中, 曝光时间为400毫秒, 而 HIST 成像的集成时间为32毫秒, 两者在目标之前的照明功率均为 7.5 mW。Epi 和 HIST 的成像速度为 2.5 fps。

图 1.显微镜体、激光和对准工具.(A) 目标和样本持有人。(B) 激光系统照片。LP, 长通双色镜;/2, 半波板;PBS, 偏振分束器。(C) 准直光源。(D) 具有两个可插入针孔的梁对齐工具。(E) 双针孔系统。请点击这里查看此图的较大版本.
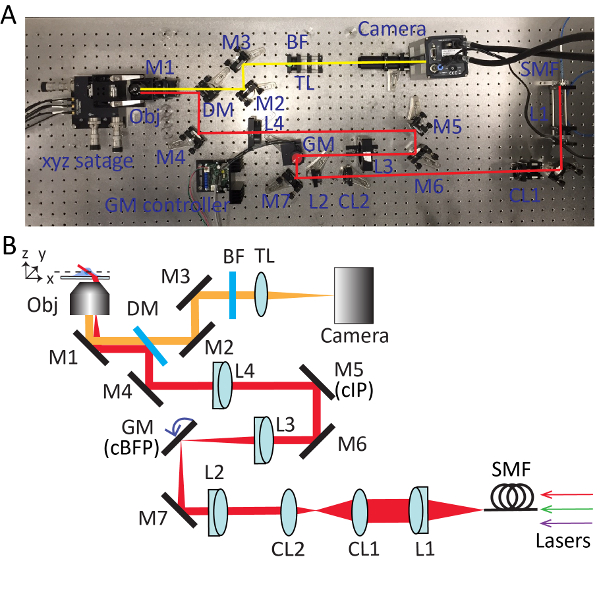
图 2.高倾斜扫描瓷砖 (HIST) 显微镜的详细设置.照片 (a) 和原理图 (b) 的 hist 显微镜系统。BF、多波段通滤波器;CL1-2, 圆柱形镜片;DM, 二色镜;通用、加尔沃镜子;高炉、带通滤清器;M1-7, 镜子;L1-4, 镜片;SMF, 单模光纤;TL、管透镜;cIP, 共轭图像平面;cBFP, 共轭后焦平面。请点击这里查看此图的较大版本.
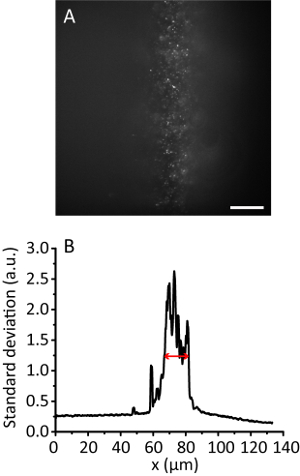
图 3.压缩比为8的平铺照明.(A) 三维水凝胶中20纳米珠子的荧光图像。刻度条, 20μm. (b) 沿 y 方向的标准偏差投影, 平滑10个数据点。红色箭头表示有效的照明宽度为12微米. 请点击此处查看此图的较大版本.
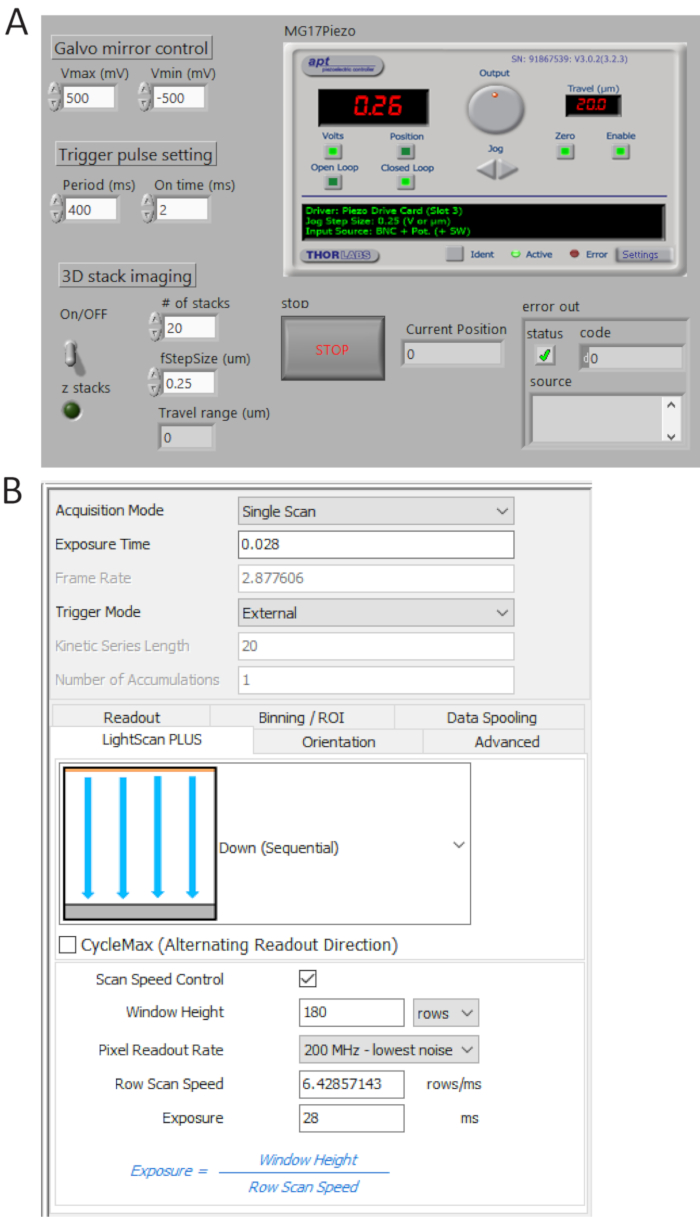
图 4.控制和成像软件前面板.(A) 定制的 labview 程序同步控制 galvo 反射镜的扫描、scmos 摄像机的开始采集和压电级的运动。(B) 相机采集设置控制面板。请点击这里查看此图的较大版本.
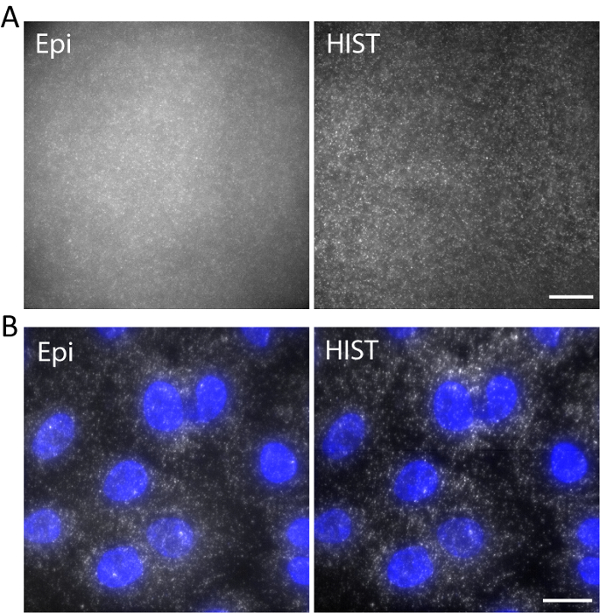
图 5。(A) Atto647N 标记 Dna 的图像, 在三维水凝胶中, 具有 epi 和 hist 照明。(B) 利用 EPI 和 hist 显微镜对 A549 细胞使用 4个 fish 探针的eef2图像。DAPI 染色显示为蓝色。刻度条, 20μm. 请点击这里查看这个数字的更大版本.
讨论
此协议中有两个关键步骤。第一个是在步骤3.3 中正确放置 L4, 确保入射光束穿过镜头的中心, 并在天花板上形成一个完美的艾瑞圆盘图案。L4 的位置决定了所有其他光学元件的位置, 包括 M5、L3、GM 和 L2。第二个关键步骤是同步过程。要拒绝焦点外背景, 有效检测宽度等于磁贴宽度的活动像素应与光束扫描同步。因此, 有必要测量瓷砖光束 (步骤 5.6) 的有效照明宽度, 并在步骤6.4 中相应地设置摄像机参数。
当使用非常大的 FOV 进行成像时, 所提出的方法显示, 与另一侧相比, 一侧的背景增加。这是由于不同成像位置的照明角度稍有变化。实现第二个半镜而不是 M5 通过同步调整位置和扫描角度11来缓解以前所表明的这一问题。而不是现成的无色双片, 远心扫描镜头也将是有帮助的。然而, 对于成像面积和 lt;8,080 μm 2,单半镜扫描就足够了。HIST 显微镜具有成像深度的限制, 但是, 当使用12微米的瓦束和 NA 1.45 油浸没物镜11进行成像时, 它能够获得良好的 SBR。
在该协议中, 我们使用8的光束压缩比来制作磁瓦光束。在 HIST 显微镜下, 可以使用更薄的照明来实现更高的 SBR, 这可能对单分子组织成像有很强的功能。然而, 在这种情况下, 光漂白效应应考虑到增加的激发强度, 而电流光束压缩比显示, 在三维成像中, 与 Epi11相比, 光漂白效果有所降低。与具有两个正交放置目标的光片显微镜相比, HIST 显微镜易于实现, 并与传统样品制备相兼容。HIST 显微镜增强 SBR 和大型 FOV 适用于研究多细胞中单个生物分子的相互作用和动力学, 可进一步用于超分辨率成像和单分子跟踪。
披露声明
中佛罗里达大学已提交专利申请, 涵盖本文所述的工作。
致谢
这项工作得到了国防高级研究计划局 (HR00111712666) 和国家科学基金会 (1805200) 的支持。我们感谢迈克尔·塞尔格在 Andor 技术慷慨地借出的 sCMOS 相机。
材料
| Name | Company | Catalog Number | Comments |
| 1" Achromatic doublet | Thorlabs | AC254-060-A-ML | Collimator |
| 1" Achromatic doublet | Thorlabs | AC254-100-A-ML | L1,L2 |
| 1" Achromatic doublet | Thorlabs | AC254-300-A-ML | TL |
| 1" Broadband Dielectric Mirrors | Thorlabs | BB1-E02-10 | M1~M7 |
| 1" Cylindrical Lenses | Thorlabs | LJ1363RM-A | CL1 |
| 1" Cylindrical Lenses | Thorlabs | LJ1695RM-A | CL2 |
| 1" square kinematic mount | Edmund Optics | 58-857 | For dichroic mirror mounting |
| 1" Threaded Cage Plate | Thorlabs | CP02 | For holding other lenses |
| 2" Achromatic doublet | Thorlabs | AC508-150-A-ML | L3 |
| 2" Achromatic doublet | Thorlabs | AC508-400-A-ML | L4 |
| 2" Threaded Cage Plate | Thorlabs | LCP01 | For holding L4 |
| 2" Threaded Cage Plate | Thorlabs | LCP01T | For holding L3 |
| 2% Bis Solution | Bio Rad | 64085292 | hydrogel component |
| 20 nm fluorescent beads | Thermo Fisher | F8782 | For testing imaging |
| 30 mm Cage Right-Angle Kinematic Mirror Mount | Thorlabs | KCB1 | For objective & camera mounting |
| 30mm Cage System Iris | Thorlabs | CP20S | |
| 3-Axis NanoMax Stage | Thorlabs | MAX311D | |
| 40% Acrylamide Solution | Bio Rad | 64148001 | hydrogel component |
| 405 nm laser | Cobolt | Cobolt 06-MLD | |
| 50x TAE buffer | Bio-Rad | 161-0743 | hydrogel component |
| 561 nm laser | Cobolt | Cobolt 06-DPL | |
| 638 nm laser | Cobolt | Cobolt 06-MLD | |
| Ammonium persulfate | Sigma | A3678-25G | hydrogel component |
| Beam alignment tool | custom made | ||
| BNC terminal blocks | Natural Instruments | BNC-2110 | |
| Cage plate with M9 x 0.5 internal threads | Thorlabs | CP1TM09 | For holding aspheric lens |
| Cage System Rods | Thorlabs | SR series | |
| Cell culture & smFISH | See a reference [11] | ||
| Double side tape | Scotch | 515182 | Flow chamber |
| Epoxy | Devcon | 14250 | Flow chamber |
| Galvo mirror | Thorlabs | GVS211 | GM |
| Galvo System Linear Power Supply | Thorlabs | GPS011 | |
| Half wave plate | Thorlabs | WPH10M-405/561/633 | Power adjustment |
| long-pass dichroic mirror | Chroma | T550lpxr | For combining lasers |
| Microscope slides | Fisherbrand | 12549-3 | Flow chamber |
| Mikroskopische Deckglaser | Hecht Assistent | 990/5024 | Flow chamber |
| Mounted Frosted Glass Alignment Disk | Thorlabs | DG10-1500-H1-MD | For double pinhole system |
| Mounted rochester aspheric lens | Thorlabs | A230TM-A | |
| Multi-band dichroic mirror | Semrock | Di03-R405/488/561/635-t3 | DM; 3 mm thickness |
| Multi-band filter | Semrock | FF01-446/523/600/677-25 | BF |
| Multimode fiber | Thorlabs | M31L02 | MMF |
| N,N,N',N'-tetramethyl ethylenediamine | Sigma | T7024-25ML | hydrogel component |
| NI-DAQ board | Natural Instruments | PCI-6733 | |
| Ø1" Kinematic Mirror Mount | Thorlabs | KM100 | For holding mirrors |
| Objective lens | Olympus | PLANAPO N 60X | 60X 1.45NA oil |
| Pedestal Base Clamping Forks | Newport | 9916 | |
| Pedestal Pillar Posts | Thorlabs | RS1P8E | |
| Piezo controller | Thorlabs | BPC303 | |
| Polarized beam splitter | Thorlabs | PBS251 | For combining lasers |
| RMS-SM1 adapter | Thorlabs | SM1A3TS | For objective lens |
| Rod holder | custom made | ||
| Rotation cage mount | Thorlabs | RSP1/CRM1/CRM1P | For HWP & cylindrical lens mounting |
| sCMOS camera | Andor | Zyla-4.2P-CL10 | |
| Shearing interferometer | Thorlabs | SI100 | Beam collimation test |
| Single mode fiber | Thorlabs | P5-405BPM-FC-2 | SMF |
| SM1 Lens Tubes | Thorlabs | SM1S25 | For double pinhole system |
| SM1 Slotted Lens Tube | Thorlabs | SM1L30C | For double pinhole system |
| Stage mount | custom made | ||
| threaded fiber adapter | Thorlabs | SM1FC | |
| Z-Axis Translation Mount | Thorlabs | SM1Z | Fiber coupling |
参考文献
- Sigal, Y. M., Zhou, R., Zhuang, X. Visualizing and discovering cellular structures with super-resolution microscopy. Science. 361, 880-887 (2018).
- Lerner, E., et al. Toward dynamic structural biology: Two decades of single-molecule Forster resonance energy transfer. Science. 359, (2018).
- Raj, A., van Oudenaarden, A. Single-Molecule Approaches to Stochastic Gene Expression. Annual Review of Biophysics. 38, 255-270 (2009).
- Wilson, T. Resolution and optical sectioning in the confocal microscope. Journal of microscopy. 244, 113-121 (2011).
- Sase, I., Miyata, H., Corrie, J. E., Craik, J. S., Kinosita, K. Real time imaging of single fluorophores on moving actin with an epifluorescence microscope. Biophysical Journal. 69, 323-328 (1995).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical Sectioning Deep Inside Live Embryos by Selective Plane Illumination Microscopy. Science. 305, 1007-1009 (2004).
- Cella Zanacchi, F., et al. Live-cell 3D super-resolution imaging in thick biological samples. Nature Methods. 8, 1047 (2011).
- Galland, R., et al. 3D high- and super-resolution imaging using single-objective SPIM. Nature Methods. 12, 641 (2015).
- Gustavsson, A. K., Petrov, P. N., Lee, M. Y., Shechtman, Y., Moerner, W. E. 3D single-molecule super-resolution microscopy with a tilted light sheet. Nature Communications. 9, 123 (2018).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells. Nature Methods. 5, 159-161 (2008).
- Tang, J., Han, K. Y. Extended field-of-view single-molecule imaging by highly inclined swept illumination. Optica. 5, 1063-1069 (2018).
- Han, K. Y., Kim, S. K., Eggeling, C., Hell, S. W. Metastable Dark States Enable Ground State Depletion Microscopy of Nitrogen Vacancy Centers in Diamond with Diffraction-Unlimited Resolution. Nano Letters. 10, 3199-3203 (2010).
- Sinkó, J., Szabó, G., Erdélyi, M. Ray tracing analysis of inclined illumination techniques. Optics Express. 22, 18940-18948 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。