Method Article
利用血脑肿瘤屏障在盘中进行活体有效载荷传递预测
摘要
针对中枢神经系统肿瘤的药物靶向是一项重大挑战。在这里, 我们描述了一个协议, 以产生一个体外模拟血脑肿瘤屏障使用小鼠和/或人类细胞, 并讨论其与中枢神经系统肿瘤靶向在体内的相关性。
摘要
血脑屏障 (BBB) 本质上具有高度选择性, 是生理条件下大脑稳态的关键。然而, 在脑肿瘤的背景下, BBB 的分子选择性也通过阻断外周管理的化疗的传递来保护肿瘤细胞。针对恶性脑瘤的新药 (包括纳米颗粒) 的开发, 理想的情况是需要使用临床前动物模型来研究药物的转染和抗肿瘤效果。为了符合3R 原理 (细化、减少和替换), 减少实验设置中实验室动物的数量, 并对大型抗肿瘤药物库进行高通量筛选, 我们开发了一种可在体外的人和使用内皮细胞、星形胶质细胞和患者衍生的胶质母细胞瘤球体的三层培养物模拟血脑肿瘤屏障 (BBTB)。为了提高可扩展性和重现性, 商业细胞系或不朽细胞已在量身定制的条件下使用, 以便形成类似于实际 BBB 的屏障。在这里, 我们描述了一个方案, 以获得 BBTB 模仿培养内皮细胞与星形胶质细胞在特定的细胞密度在插入物。例如, 这种 BBTB 模拟可用于通过内皮和星形胶质屏障的纳米颗粒通道的定量和共聚焦成像, 以及对同一检测方法中肿瘤细胞靶向的评价。此外, 我们还表明, 所获得的数据可以用来预测临床前动物模型中纳米粒子的行为。从更广泛的角度来看, 这种体外模型可以适应其他神经退行性疾病, 以确定新的治疗分子通过 BBB 和/或补充大脑有机体, 直接评估的疗效药物。
引言
神经血管单元由神经元、星形胶质细胞和 BBB 组成, 由周细胞、星形胶质细胞、内皮细胞和形成大脑微血管的相关基底膜之间的复杂连接形成。这种紧密的细胞壁是由连续的、不形成的血管形成的, 可以很好地调节离子和分子 (包括激素、营养物质或药物) 的运动, 也可以调节循环细胞1的运动.通过高分子量分子 BBB (如治疗抗体、药物结合物或纳米化合物) 的低转 xos化极大地限制了包括恶性在内的神经系统疾病药物发现的进展。胶质瘤2。事实上, 口服或静脉注射的化疗药物到达大脑实质往往在不够低的浓度, 以诱发抗肿瘤作用, 或根本无法通过 BBTB 到达肿瘤细胞3。几项临床前和临床研究没有涉及 bbtb 渗透问题, 但试图暂时破坏 bbtb, 例如使用有重点的超声波4、5,或通过直接原位规避 bbtb。6.然而, 这些技术都无法抵消不可避免的肿瘤扩张或复发。因此, 在开发新型抗胶质瘤疗法时, 应将通过 BBTB 进行扩散视为成功提供治疗药物的关键方面之一.
由于 BBTB 内细胞相互作用的复杂性, 在研究分子从血液到大脑的过程中, 对实验动物进行体内研究似乎是显而易见的选择。然而, 在体内的大规模方法是相对复杂的建立, 因此, 不允许在合理的时间内, 以合理的成本, 对分子进行高通量筛选。更重要的是, 动物试验必须遵循3R 道德准则, 定义为 (i) 完善、(二) 减少, 并与目前情况相关, 三) 以替代议定书取代 (例如, 在 vitroin silico 方法中)。因此, 在体外重现 BBTB 似乎是一种有趣和有吸引力的可能性, 但它也构成了一项复杂的任务, 受到各种限制的挑战。许多试图用来自犬、猪、小鼠甚至人类起源的培养的原代细胞或细胞系重新建立这个复杂的隔间的文章已经出版 (rahman 等人8人和 helms 等人9人回顾了这一尝试)。这些模型包括三维微流体系统10、bbb 在芯片上 11、12和基于刀片系统中经典共培养的大量变种。然而, 目前的微流体和芯片系统要么不适合快速、高通量的药物验证研究13、14 , 要么目前与脑肿瘤药物输送研究不兼容。此外, 对155个已公布的模型使用原代细胞、诱导多能干细胞 (iPSC) 或商业细胞系的评价表明, 它们的测量和结论8存在研究间差异的趋势。这种实验室间重现性的缺乏可能与 (一) 非规范化培养条件有关, 例如细胞培养容器中的基底膜基质蛋白的可选涂层, ii) 亚培养和使用的增加含有血清的培养基, 包括细胞系15的遗传和表型修饰的主要驱动因素, 或 (iii) 在可重现的情况下, 在一道菜中再现了星形胶质和内皮成分之间的正确平衡。尽管使用永生细胞或商业细胞系建立体外 BBB 模型缺乏一些特性相比, 类似的模型, 只使用原代细胞, 我们表明, 正确的组合细胞显示非常可与其他参考模型16、17的已发表研究结果相比较。最终, 缺乏一个强大和可重复的模型来研究治疗化合物通过 BBTB 的通过脑肿瘤促使我们开发这里描述的方法。
由于我们的目标是利用该模型预测临床前动物模型中纳米粒子的体内传递, 我们首先利用含有与小鼠星形胶质细胞接触的含有小鼠内皮细胞的插入物来验证 BBTB 模型。除此之外, 我们还优化了模型, 以使用某些人体细胞系。一旦稳定, 细胞屏障被转移到培养与患者衍生的胶质母细胞瘤球体或商业胶质瘤细胞系。此后, 纳米颗粒的细胞化和肿瘤细胞靶向可以通过共聚焦显微镜观察, 并通过随着时间的推移采集样本进行量化。重要的是, 使用 BBTB 模拟物获得的结果可以可靠地预测纳米粒子在体内的行为, 支持在临床前验证之前使用 BBTB。
研究方案
这些动物实验得到了芬兰南部地区动物实验委员会的批准 (ESAVI/6285/04.10.07/2014)。
1. 建立 BBTB 模拟
请注意:细胞培养培养基和补充剂详见材料表。
- 星形胶质细胞的制备
请注意:以下卷适用于10厘米的培养皿或 T75 细胞培养瓶。- 在无菌细胞培养引擎盖下, 用5毫升无菌磷酸盐缓冲盐水 (PBS) 仔细清洗培养的星形胶质细胞。使用真空泵轻轻丢弃 PBS, 加入2毫升的细胞离解试剂 5分钟 (在37°c时, 见材料表) 分离细胞。在显微镜下检查细胞脱离。不要超过5分钟的孵育, 以限制对细胞的压力。
- 在血管中加入10毫升无菌完整星形胶质细胞培养基 (ABM +), 以抑制细胞离解试剂的活性。使用无菌血清学移液器将分离细胞从容器转移到无菌的15毫升管。在室温下 (rt) 离心细胞悬浮液在 250 rcf (加速: 9 rcf s, 减速: 5 rcf) 下, 将电池悬浮液离心3分钟。
- 同时, 准备插入物 (见材料表): 使用无菌钳, 将大脑一侧的刀片向上 ( 图 1B) 放在无菌6井板的盖子上 (图 1b)。事先验证板材是否可以倒置在刀片上, 而无需在此过程中触摸或移动刀片。
请注意:适当的插入物位置允许星形胶质细胞悬浮液夹在膜和井底之间。 - 一旦离心, 小心地从细胞悬浮液中丢弃上清液;通过轻轻地将球团重新悬浮在管壁上, 使其重新悬浮在 abm + 的1毫升中,将星形胶质细胞颗粒重新悬浮。避免细胞过度移液, 以限制细胞的压力。在400μl 的 ABM + 插入中计数细胞并将细胞悬浮密度调整为 1.5 x 10 5 细胞。
- 将细胞悬浮液放置在插入膜的脑侧 (图 1B) 中间, 非常小心地使用毛细管力, 用无菌的移液尖端将其传播开来.避免直接接触, 因为膜特别脆弱。
- 以插入的脑子边仍然, 安置6井板材回到插入物。这确保了细胞悬浮液被困在膜和井的实际底部之间 (图 1c)。避免细胞悬浮液中的气泡, 因为它将防止星形胶质细胞在膜上的均匀扩散。
- 将盘子和插入物, 大脑侧向上, 在孵化器中 (在37°c, 5%co 2), 以允许细胞粘附至少 2小时 (小鼠永生星形胶质细胞) 和长达 6小时 (人类原发星细胞)。
请注意:由于刀片是倒置的, 在显微镜下无法显示细胞粘附。因此, 建议在一段时间内培育一个单独的常规细胞培养容器, 并控制血管中的细胞粘附。仔细操作膜是必须的, 因为当膜损坏时, 结果将是不可靠的。 - 在孵育时间结束时, 验证种子区外是否没有细胞悬浮液泄漏, 如果刀片漏水, 则丢弃刀片。将6孔板恢复到其正常位置, 插入物现在会有血液侧向上 (图 1a)。在每口井中添加2.6 毫升的 ABM +。将2.5 毫升的完整星形胶质培养基注入每个插入物中, 并将其放入孵化器中 (在37°c, 5% co2) 中。
- 内皮细胞的制备
请注意:对于小鼠大脑微血管内皮细胞 (bEND3), 细胞必须达到100% 融合, 以确保最大细胞接触在实验当天触发最佳紧密结合蛋白表达。这不适用于人脐静脉内皮细胞 (HuAR2T), 因为星形胶质细胞的存在是这些细胞紧密结合蛋白表达所必需的。- 按照前面对星形胶质细胞的描述进行 (步骤1.1.1 和 1.1.2.)。一旦离心, 小心地丢弃上清液;通过将细胞悬浮液缓慢地移入管壁, 使其在管壁上循环液达 5倍, 将内皮细胞颗粒重新悬浮在完整的内皮细胞培养基 (ebm +) 的1毫升中。避免细胞过度移液, 以限制细胞的压力。在没有血清 (EBM--) 和血管内皮生长因子 -a (vegf-a) 的内皮细胞培养基中, 对细胞悬浮密度进行计数, 并将细胞悬浮液密度调整为 2 x 10 5 细胞。
- 取出含有插入物的板, 小心地从血液侧丢弃培养基, 并将其替换为2.5 毫升的内皮细胞悬浮液。将钢板送回孵化器 (在37°c, 5% 的 co2), 让它过夜, 让内皮细胞粘附在膜上。
- 第二天, 通过将3毫升预热的无血清星形胶质培养基 (abm-) 转移到每口井, 制备无菌的6孔板。通过使用无菌钳处理刀片, 小心地从血液侧丢弃内皮完整培养基, 将插入物放入含有 abm-的新板中, 并添加 2.5 mL 的 ebm。
请注意:Ebm-的使用对于内皮屏障的建立至关重要 (请参阅讨论部分)。 - 将刀片放在孵化器中 (在37°c, 5%co2) 中, 以最小的物理干扰和温度变化进行 5天, 从而产生内皮基底膜、星形胶质细胞与内皮细胞, 并最终, BBTB 模仿形成。在胶质瘤细胞培养物转移当天更换培养基 (请参阅第1.4 节)。
- 衡量 BBTB 模拟渗透率 (可选)
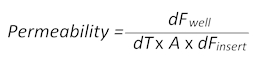
- 随着时间的推移, 小分子量荧光染料钠荧光素 (Na-Fl) 从血液到大脑一侧的被动扩散插入物允许根据以下公式计算渗透率值:
在这里, Df井是在一定时间点测量的荧光值减去细胞培养介质的自体荧光值, dt是以秒为单位的时间, a 是以平方厘米为单位的屏障表面,并且 dF插入物是在同一时间点减去中等自荧光值时测量的荧光值)。 - 从 BBTB 的血液和大脑侧面收集100μl 的培养基, 并将每个培养基转移到一个单独的平底、黑色96孔板, 用于随后的荧光测量。使用普通介质作为空白, 以纠正自动荧光。
- 在 ebm 中每口 Na-Fl (50μm) 中准备2.5 毫升。将 Na-Fl 溶液预热至37°c。将插入物血液侧的介质替换为包含 Na-Fl 的介质. 一旦更换介质, 立即启动计时器。
- 在5、30、60和120分钟时, 从插入物的血液和大脑侧仔细收集100μl 的介质, 将每个样品转移到黑色96井板的分离井中。
- 因此, 更换从插入物中收集的介质, 以保持双方之间的体积平衡。将刀片放回每个样品采集之间的孵化器中, 以最大限度地减少温度变化。
- 使用滤光片设置为 480/560 nm (分别为激发和发射) 的板式读取器对采集到的样品中的荧光进行量化。
请注意:在5分钟的时间点上,大脑一侧的荧光几乎无法检测到。与空白值相比, 值较高表示刀片膜或屏障的损坏泄漏;因此, 将这些排除在进一步分析之外。BBTB 的预期 Na-Fl 渗透率值应在10-5 -6-6之间 (表 1)。
- 随着时间的推移, 小分子量荧光染料钠荧光素 (Na-Fl) 从血液到大脑一侧的被动扩散插入物允许根据以下公式计算渗透率值:
- 胶质瘤细胞的制备
请注意:虽然患者衍生的胶质母细胞瘤球体在这里使用, 下面的协议可以很容易地适应粘附, 商业上可用的胶质母细胞瘤细胞, 如 U-87MG。- (可选) 用于免疫荧光成像, 每口在含有2毫升聚 d-赖氨酸的6孔板中放置多达4个圆形无菌硼硅酸盐盖板 (o 0.9 厘米) (0.01%)。在室温下孵化30分钟。
- 同时, 使用无菌血清学移液器, 将肿瘤球体从细胞培养血管小心地转移到15毫升的无菌管中。在 250 rcf 离心肿瘤球体3分钟。
- 丢弃上清液, 在 bfgme-egf-胶质瘤细胞培养基中轻轻重新悬浮球体, 并对细胞进行计数。将细胞密度调整到 gbm 中的大约10个4个球素 (105 cellss/ml)。
- 将聚 d 赖氨酸从井中丢弃, 用无菌 PBS 冲洗3倍。将板与肿瘤球状悬浮液的 3 mL/well 种子, 并在肿瘤细胞悬浮液上用 BBB 模拟转移插入物。
- 隔夜孵化 (在37°c与 5%co2), 以允许平衡之间的血液和脑肿瘤侧的检测。第二天, 用 ebm 取代血液侧的培养基--用感兴趣的分子药物补充。如上一节所述, 样品会随着时间的推移收集, 以便直接量化。细胞固定在荧光成像的精确时间点 (请参阅2.1 和2.2 节)。
2. BBTB 的高分辨率共聚焦成像
注: 4% 的甲醛 (pfa, ph 7.4, 每 BBTB 复制6毫升) 总是在 pbs 中新鲜制备的。把它放在冰上。
注意事项:PFA 具有致癌性。使用丁腈手套处理 PFA, 并在化学烟罩下准备溶液。
-
紧密结合蛋白的 BBTB 内皮表达
- 用冰凉 PBS 冲洗膜的两侧 (3x 5分钟, 2.5 Ml/插入物, 3 Ml/well)。丢弃 PBS, 并分别在井内和插入中加入3毫升和 2.5 mL 的冰凉 4% PFA。在冰上加氢 10分钟, 丢弃 PFA (根据机构的危险化学品处置),并在 rt (2.5 Ml/插入物, 3 ML/insert) 用 pbs 冲洗3x。
请注意:一旦修复, 样品可以储存在 PBS (2.5 mll 插入, 3 ML/insert) 在4°c下一周。 - 使用棉签擦拭插入物的大脑一侧, 并取出星形胶质细胞。使用锋利的手术刀, 小心地将膜切割成四个相等的部分, 使两个垂直的切割, 形成一个交叉。接下来, 将手术刀插入膜连接到插入壁的位置, 然后用另一只手旋转刀片, 以释放四个样品。使用精细的推拿器, 小心地将每个样本转移到一个24孔板, 其中含有200μl 的 pbs井, 血液侧在每口井。
- 用10% 的胎牛血清在 PBS 中阻止膜 (RT, 200μl· well 30分钟)。在200μl 的阻塞溶液中制备1D抗体溶液, 用于紧密连接蛋白的免疫染色 (图 1d) (zonula ietyden-1, claudin-5; 请参阅材料表)。(可选) 通过在每个紧密连接抗体溶液中添加针对血小板内皮细胞粘附分子 (PECAM1 或 CD31; 请参阅材料表) 的抗体来验证内皮细胞的身份。丢弃阻滞液, 在4°c下与原发抗体" o n" 孵育。
- 第二天, 丢弃原发抗体, 用200μl 的 PBS (3倍, 5分钟 RT) 冲洗。用适当的物种特定的氟结合二级抗体 (1:500 稀释, 200Μl/well, 在阻滞溶液中稀释; 请参阅材料表) 在 rt 中培养2小时。
- 丢弃继发抗体, 用200μl 的 PBS 冲洗 (3倍, RT 5分钟)。在纯蒸馏 h2 o (dH 2o; 200μlwell) 中, 使用1μ G/ml 的最终浓度为 1μg/ml, 使用 4 ', 6-二胺-2-苯二酚(DAPI)溶液去除 pbs 并反染色细胞核; 请参阅材料表).在 RT 中培养 7分钟, 取出 DAPI, 用 Dh2o (200μl/well) 清洗膜3x。
- 将安装介质的滴放在玻璃显微镜幻灯片上 (见材料表)。使用精细的推子, 小心地将膜从井里拿出来, 保持方向, 去除Dh2o 的多余部分, 并将其放置在安装介质的落差上。在膜顶部添加另一滴安装介质, 并用硼硅酸盐盖板玻璃仔细覆盖。确保没有被困住的气泡。将样品存放在4°c, 远离光线, 直到共聚焦显微镜观察。
请注意:星形胶质瘤染色可以通过将24孔板中的膜块与大脑一侧向上进行, 并使用选定的星形胶质抗体 (例如, 针对胶质纤维酸蛋白 [GFAP]) (图 1E)).
- 用冰凉 PBS 冲洗膜的两侧 (3x 5分钟, 2.5 Ml/插入物, 3 Ml/well)。丢弃 PBS, 并分别在井内和插入中加入3毫升和 2.5 mL 的冰凉 4% PFA。在冰上加氢 10分钟, 丢弃 PFA (根据机构的危险化学品处置),并在 rt (2.5 Ml/插入物, 3 ML/insert) 用 pbs 冲洗3x。
-
BBTB 荧光染色检测纳米颗粒转胞
- 执行活细胞溶酶体标记 (例如, 使用荧光探针[见材料表])。将溶酶体荧光染料在预热 EBM-(2.5 mll 插入物) 的工作浓度为 50 nM 或在预热 ABM-(3 mlwell) 中的 75 mM 稀释, 用于内皮细胞和星形胶质细胞的溶酶体标记。将细胞加氢 45分钟 (在37°c, 5% co2);然后, 用冰凉 PBS 冲洗 3x (2.5 Ml/插入物, 3 Ml/well)。
- 丢弃 PBS, 并分别在井口和插入物中加入3毫升和 2.5 mL 的冰凉 4% PFA。将其在冰上加氢 10分钟, 将其丢弃 PFA, 并用 PBS 冲洗细胞 3x (RT, 2.5 Ml/插入物, 3 Ml/well)。
请注意:一旦修复, 样品可以存储在 PBS (2.5 mll 插入, 3 ML/insert) 在4°c 下一个星期。 - 在 Dh2o (1 Ml/插入物, 1 mlwell) 中, 使用 DAPI 溶液去除 PBS 并反染色细胞核。在 RT 中将其培养 7分钟, 取出 DAPI, 用 dH2o(2.5 Ml/插入物, 3 mlwell) 清洗膜3x。
- 小心地切割膜, 去除多余的 Dh2o, 并将其放置在玻璃显微镜幻灯片上的安装介质 (见材料表) 上。在膜的另一侧添加另一滴安装介质, 并用硼硅酸盐盖板玻璃仔细覆盖。避免被困气泡。将样品存放在4°c, 并保护样品不受光线照射, 直到共聚焦显微镜成像。
-
肿瘤细胞的荧光染色
- 使用精细的推子, 小心地将含有肿瘤球体的圆形盖板转移到一个24孔的板上, 里面装满了冰凉的 p b s。在预热 GBM-(200μl\ well) 中, 使用 75 nM 的荧光溶酶体探针进行活细胞溶酶体标记。将样品孵化 45分钟;然后, 用冰凉 PBS (200μl· well) 冲洗它们的3倍。
- 丢弃 PBS, 每口添加200Μl 的冰凉 PFA。在冰上加氢 10分钟, 丢弃 PFA, 并用 PBS 冲洗样品 3倍 (RT)。
请注意:一旦固定, 样品可以在4°c 的 PBS (200μl) 中存储一周。 - 在Dh2o (200μlwell) 的最终浓度为1μgml 的情况下, 使用 dapi 溶液去除 pbs 并反染色细胞核。在 RT 中将其加氢 7分钟, 取出 DAPI, 用 Dh2o (200μl/well) 清洗盖板 3x.
- 使用精细的推拿器, 取出盖板, 去除多余的 Dh2o, 并将其放置在玻璃显微镜幻灯片上的安装介质 (见材料表) 上。避免堵塞任何气泡。将样品存放在4°c, 并保护样品不受光线照射, 直到共聚焦显微镜观察。
3. 活体比较研究
- 钠荧光素通过 BBB 扩散的原位记录
- 在生理溶液中制备50μl 的 50 nm Na-Fl 溶液。静脉注射时, 将溶液保持在37°c。
- 将小鼠麻醉, 并在 pbs 中注射腹腔注射酮胺/氯胺鸡尾酒 (300Μl 的 100 mg/kg 氯胺酮和10mgskg 的木糖)。一旦深部麻醉建立, 将动物放在加热垫, 以保持其体温。
请注意:已经10周大的海军女性医学研究所 (NMRI) 裸体免疫功能低下的小鼠被用来获取图 2中的数据。然而, 该协议适用于免疫能力和免疫功能低下的小鼠。麻醉剂镇痛方法由科学家决定.然而, 吸入麻醉, 如异氟醚不建议, 因为它显著增加 BBB 通透性18。 - 将鼠标放在立体定向框架上 (见材料表), 用精细的剪刀对头皮进行纵向切口, 然后用精细的推子轻轻扩张结缔组织, 露出头骨。使用圆形运动与精细的微钻, 从左或右顶骨取出一个0.3 毫米的头骨圆形一块。在钻孔过程中, 并在取出颅骨块时, 要格外小心, 以避免损伤潜在的脑膜组织和血管。
- 在暴露的组织上放置一滴生理溶液。使用两对细钳, 小心地取出脑膜组织进入大脑皮层。脑组织不应该与空气直接接触。
请注意:脑膜损伤引起的轻微出血可以停止使用血液海绵 (请参阅材料表)。 - 一旦脑膜组织被切除, 皮层完全暴露, 在皮层和直径0.5 毫米硼硅酸盐盖板之间夹住一滴生理溶液。用一滴氰基丙烯酸酯胶 (请参阅材料表) 用针头在覆盖物周围粘合, 以固定观察区域。让胶水干燥1分钟。
- 为尾部静脉注射准备植入导管 (图 2a)。使用 Rochester-Ochsner 钳打破 25 G 针的尖端, 并将尖端插入10厘米长的 PE20 聚氨酯管 (请参阅材料表) (图 2 a)。
- 将导管插入小鼠的侧尾静脉, 使用斗牛犬夹子操作和插入导管 (请参阅材料表) (图2b)。用一滴氰基丙烯酸酯胶固定插入的针头。在取出斗牛犬夹子之前, 让胶水干燥20秒。小心地将导管的另一端连接到连接到包含 Na-Fl 溶液的注射器的 25 G 针上 (图 2b)。
- 请注意:不要用斗牛犬夹子夹紧尾巴;它仅用于精确的导管处理。适当的导管插入可以通过血液回流到透明导管中得到确认。
- 将动物置于立体显微镜下 (参见材料表)。使用绿色通道 (480 nm) 中的低低自荧光, 将重点放在包含相对较大血管的区域 (由于该波长的血红蛋白吸收光, 它们显得较深) 和较小的毛细血管 (图 2c)。在注入荧光染料之前, 请短暂开始延时采集, 以获得背景荧光的测量结果。
请注意:或者, 延时记录可以替换为 T0 和任何其他预定时间点的快照图片。 - 以缓慢和连续的速度注入解决方案, 或者使用自动输液系统。在血液中检测到的 Na-Fl 荧光应保持稳定 (血液中的半衰期: 286分钟), 这样就可以通过颅窗记录 BBB 扩散几分钟。一旦采集完成, 仔细取出导管, 通过宫颈脱位对动物进行安乐死。
- BBB 通透性的体内测定
请注意:值是从任何图像处理软件 (如 Image-processing) 获得的, 允许测量感兴趣的自定义区域 (ROI) 内的荧光信号强度。- 使用注释工具, 在血管外、脑组织中绘制一个矩形的 ROI, 距离充满 Na-Fl 的任何可见血管约 5μm. 请注意 ROI 的尺寸和在 T0 时测量的荧光强度, 这在该 ROI 中,用作组织自体荧光的空白。在不取代 ROI 的情况下, 快速前进到注射后时间点 (例如, 当整个溶液被注入动物时, 快速前进到最后一个记录的帧), 并记下在 ROI 范围内测量的精确时间和荧光值 (图 2C)。
- 在可见血管上移动 ROI (图 2c), 并注意血液中的 t0 自荧光值。在不取代投资回报率的情况下, 快速前进到步骤3.2.1 中定义的相同时间点。并注意在 ROI 范围内测量的荧光值 (图 2c)。
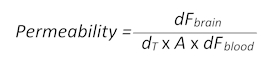
- 使用以下公式 (根据第1.3 节改编) 来确定 BBB 渗透率:
- 在这里, df大脑是荧光强度值减去大脑中的 t0 空白值, dt是以秒为单位的采集时间点, a 是近似的血管表面积, 以 gi 面积为平方厘米, 和df血迹是荧光强度值减去血液中的 T0 空值。
注: BBB 的预期渗透率值应在10-6 mm s 范围内 (表 1)。
- 组织处理在小鼠大脑荧光纳米颗粒检测中的研究
- 植入植物患者衍生的胶质母细胞瘤球体 (5 x 10 4个细胞在5Μl 的无菌 pbs) 麻醉6周大的雌性 nmri 裸鼠在黄体。在以下立体定向坐标处定位这个大脑区域, 从 Bregma 开始: 前后肌 + 0.5 毫米, 从左到右 + 2.5 毫米, dorsoventral + 3 毫米, 允许脑瘤生长2周。
- 静脉注射纳米颗粒 (100μg 在100μl 的无菌生理溶液中), 并允许它们循环 8小时. 用100μl 无菌生理溶液静脉注射对照小鼠。
- 通过宫颈脱位对小鼠进行安乐死, 并迅速收集大脑, 以便在干冰 (-50°c 时 1分钟) 的异戊烷中进行快速冷冻。将大脑存放在- 80°c, 直到组织处理。
- 用微生物切割日冕脑部分。通过在皮层上形成的疤痕找到颅内植入物, 并将该区域的9μm 厚的部分切割到相应的显微镜幻灯片上 (见材料表)。
- 将固定在冰凉 PBS 中固定在幻灯片上的大脑部分浸泡 (2倍 5分钟), 然后将其固定在冰凉的 4% PFA 中 (5分钟)。在 PBS 中清洗幻灯片 (每次 3x 5分钟 RT)。将幻灯片水平放置, 并将含有10% 胎儿牛血清的阻滞溶液置于 PBS 中覆盖整个表面的组织部分 (RT 1小时, 500μll 幻灯片) 上。以250μl 阻断溶液/滑块的形式制备 CD31 抗体 (请参阅材料表)。将阻滞溶液替换为抗体, 并在4°c 下在加湿腔中孵育。
- 第二天, 将幻灯片浸入 PBS (3次 5分钟 RT) 中, 并将其与相应的氟结合二级抗体 (1:500 在250μl 的 PBS 中2小时在 RT) 孵育。在 PBS 中冲洗 3x (在 RT), 并使用 DAPI 溶液在 Dh2o (250μlse幻灯片) 的最终浓度为1μgml 时对细胞核进行反染色。在 RT 中对样品进行7分钟的孵化, 取出 DAPI 溶液, 用 Dh2o 清洗幻灯片 3x.
- 在每个组织部分, 添加一滴安装介质 (请参阅材料表), 并用盖板固定样品。避免堵塞气泡。将样品存放在4°c, 并保护样品不受光线照射, 直到共聚焦显微镜观察。
结果
小鼠 BBTB 模拟的共聚焦成像显示了紧结蛋白 zonula 闭塞-1 (ZO-1) 和 claudin-5 在 bEND3 中的表达和细胞定位。与 bEND3 单层培养相比, 内皮细胞和星形胶质细胞之间的接触明显诱导了 ZO-1 和 claudin-5 向内皮细胞触点的迁移 (图 1D)。利用免疫荧光染色来显示血管脑侧的 gfap 表达星形胶质细胞, 可以观察和研究星形胶质细胞的过程以及通过膜与内皮细胞接触的端脚 (图 1E)).星形胶质细胞-内皮细胞接触是众所周知的促进和稳定收紧细胞屏障, 并与较低的渗透率 BBB19。据此, 我们观察到, 在单孔的情况下, 小鼠 BBTB 模拟 Na-Fl 的渗透率大幅下降, 在单孔的情况下, 可大幅下降到 6.74 (±3.01) x 10-6 厘米.因子敲除 (HIFko) 星形胶质细胞 (表 1)。不朽的 HuAR2T 形成了高度渗透的细胞屏障 (104.92±27.1 x 10-6 厘米,表 1).与小鼠模型类似, 当 HUAR2T 细胞与人类原代星形胶质细胞共同培养时, 我们测量到 bbtb 对 Na-Fl 的渗透率明显较低, 即 7.4 (±14.32) x 10-6 厘米 (表 1)。
在小鼠和人类 BBTB 模拟中, 患者衍生的胶质母细胞瘤球体的存在导致的通透性值仅与内皮细胞-星形胶质细胞共培养相比略有增加 (表 1)。这种现象是观察到几个, 但不是所有的病人胶质瘤球体模型。这可能是由于 VEGF-A 是由这些病人衍生的细胞中的一些分泌的。
为了比较体外 BBTB 模拟物与体内 BBB 的渗透率值, 我们通过植入裸鼠的颅内窗口对 Na-Fl 的实时扩散进行了成像。使用荧光立体显微镜, 从主要皮膜血管产生的血管毛细血管的 Na-Fl 扩散记录在探针的全身注射之前、期间和之后 (图 2c)。随着时间的推移, 测量循环血液和脑皮质实质的微分荧光值, 使我们能够计算裸鼠 BBB 对 Na-Fl 的近似渗透率值 (5.57±2.19 x 10-6 厘米, 表 1)。
为了说明这种 BBTB 模拟如何用于可视化化合物从血液侧到大脑一侧的过程, 我们比较了直径为患者衍生的胶质母细胞瘤球体的直径110纳米 (NP110) 和 o 350 nm (NP350)。然后将体外获得的结果与体内转胞结果进行比较。在所介绍的例子中, 纳米颗粒表面涂覆了肿瘤靶向肽 Coop20 , 并加入了荧光染料 (fitc), 以方便可视化。我们用溶酶体染料标记细胞, 并用 DAPA 24h 标记细胞, 在 BBTB 的血液侧添加 fitc 纳米颗粒后, 在不同的水平 (如血液侧、膜、脑侧) 中模拟并获得了共聚焦显微镜,和患者胶质母细胞瘤球体) (图 3 a)。NP110 相关的荧光信号与内皮细胞、星形胶质细胞和肿瘤细胞中的溶酶体共用。此外, 在内皮细胞和星形胶质细胞之间检测到 Np110, 通过插入物的膜孔 (图 3 a)。
通过测量从血液和大脑侧采集的样本中的荧光, 对 Np110 的通道进行了量化。将这些渗透率值与 为 o 350 纳米纳米纳米纳米纳米纳米粒子 (np350) 确定的渗透率值进行了比较。结果表明, 只有 NP110 能够通过 BBTB 模拟 (图 3b)。NP350 保持在 BBTB 模拟的血液侧, 这导致这些纳米颗粒的渗透率较低。
为了突出 BBTB 模拟与体内模型相比的相关性, 裸鼠通过静脉注射 NP110 或 NP350 纳米颗粒, 涂覆肿瘤靶向肽 coop, 并与红色荧光染料 (TRITC) 结合检测。在几个时间点收集的组织显示, 8小时后, bbb 渗透性纳米颗粒已经外露到脑实质, 而留在循环中的非渗透纳米粒子主要从体内的全身循环中清除。因此, 我们收集了大脑, 并量化了注射后每平方毫米8h 纳米粒子的数量。根据体外发现, NP110, 而不是 NP350, 成功外渗到大脑实质 (图 3C)。大脑中纳米粒子位置的高放大成像显示, NP110 在毛细血管外的脑实质中均匀分布, 并成功地归属于植入的胶质母细胞瘤细胞 (图 3D)。尽管 NP350 表现出相同的肿瘤靶向部分 (CooP), 但无法外渗到脑实质中, 只在脑血管的腔侧检测到 (图 3E), 类似于体外获得的结果.
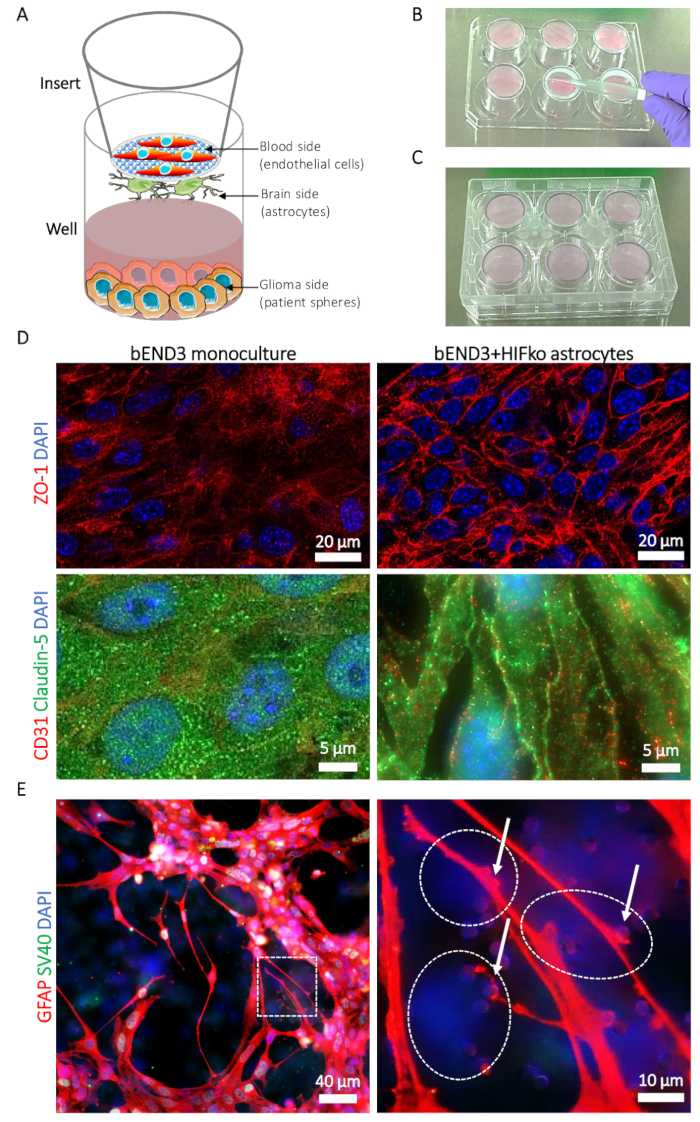
图 1: 血脑肿瘤屏障 (BBTB) 模型的描述.(A) 不同细胞类型位置的示意图表示。(B) 说明插入物在6井板盖上的位置和刀片膜脑侧星形胶质细胞的播种技术.(C) 6 井板放置的说明, 允许星形胶质细胞粘附。(D) 紧密结合蛋白 zonula 闭塞蛋白-1 (zo-1, 上列, 红色) 和 claudin-5 (下排, 绿色) 的免疫荧光显微镜。将蛋白质表达与仅在 BBTB 血侧作为单培养 (左柱) 或小鼠永生化 hifko 星形胶质细胞 (右柱) 培养的小鼠大脑微血管内皮细胞 (bend3) 进行比较。细胞核与 DAPI (蓝色) 进行反染色。(E) 免疫荧光微图显示在 BBTB 脑侧培养的 hifko 星形胶质细胞中的胶质纤维酸性蛋白 (gfap, 红色)。高放大倍率图像显示星形胶质细胞的过程和端脚 (箭头) 通过膜孔 (右面板) 与内皮细胞接触。通过免疫荧光染色, 验证了用于细胞永生化的 simian 病毒40大 T 抗原 (SV40 大t, 绿色) 的 HIFko 星形胶质细胞的身份。内皮细胞既不表达 GFAP, 也不表达 SV40 大 T, 因此, 可以通过膜的透明, 相对的一侧部分观察到, 作为只 dapi 染色的细胞 (虚线)。细胞核与 DAPI (蓝色) 进行反染色。请点击这里查看此图的较大版本.
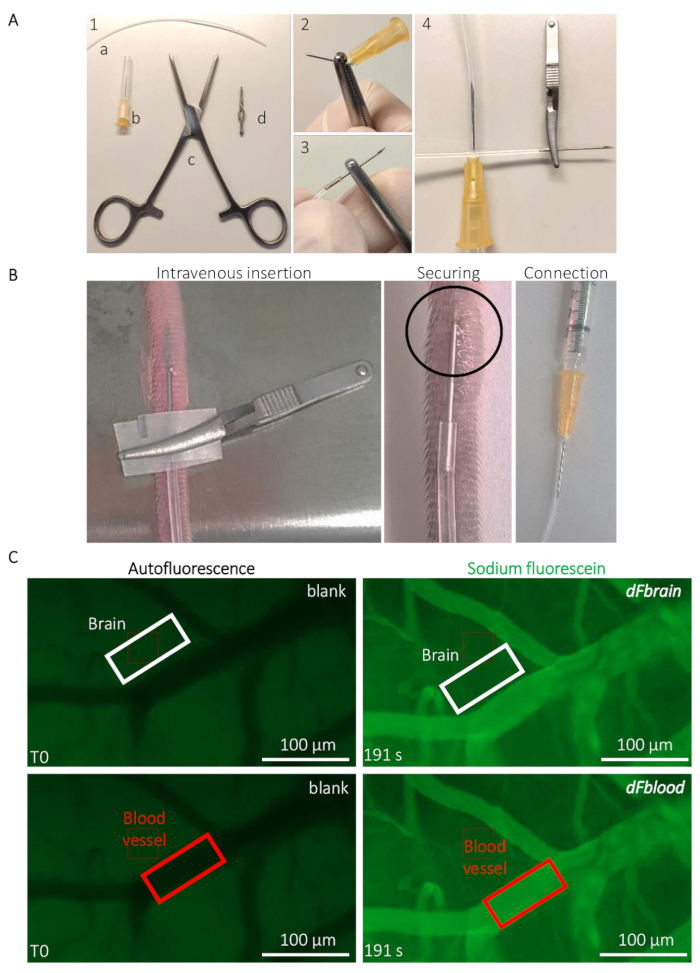
图 2:小鼠 BBB 通透性的术期内活度测定.(A) 植入尾静脉导管的制备。(1) 工具和设备如下: (a) pe20 聚乙烯管 (b) 两个 25 g 针 (c) rochester-ochsner 钳, (d) 一个小型斗牛犬钳。(2) 用钳子用几个扭力取出 25 g 针, 并 (3) 小心地插入管中。(4) 管的另一侧连接到另一个 25 g 针。(B) 导管植入的指导和定位, 通过小鼠的尾静脉注入钠-荧光素溶液。圆圈区域表示放置一滴氰基丙烯酸酯胶以固定导管的区域。斗牛犬夹子用于处理导管, 并在导管固定后取出。(C) 确定钠-荧光素渗透率值的代表性成像和定量方法。在钠荧光素输注 (左柱) 之前, 在大脑 (顶板、白色矩形) 和血管区域 (底板、红色矩形) 上的感兴趣区域 (ROI) 范围内测量自荧光空白。在钠荧光素输注 (右柱) 期间, 在两个 Roi 中测量荧光强度, 从而计算 BBB 渗透率。请点击这里查看此图的较大版本.
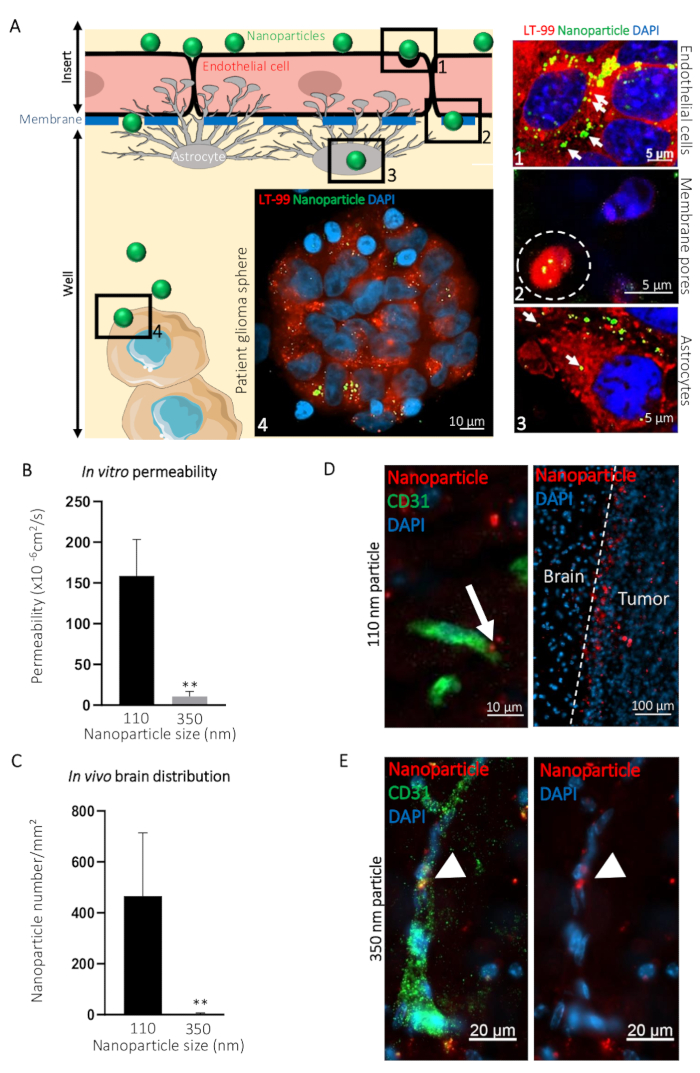
图 3: 利用体外 BBTB 模型预测体内 bbb 纳米颗粒的脑内转染.(A) BBTB 检测的图形表示, 并在所示的不同程度的小鼠 BBTB 模型中获得具有代表性的共聚焦图像。在 BBTB 细胞的血液侧添加直径为110纳米 (NP110) 并与 FITC (绿色) 结合的纳米粒子, 用溶酶体探针 (LT-99, 红色) 标记。 (1) 内皮细胞, (2) 纳米粒子通过膜的毛孔 (白色虚线)、(3) 星形胶质细胞和 (4) 患者胶质母细胞瘤球体通过膜的毛孔内细胞化, 并在图形上确定。对应的共聚焦显微图 (右)。纳米颗粒 (箭头) 的溶酶体包封表明通过 BBTB 的内皮细胞和星形胶质细胞层主动转胞。(B) 通过 BBTB 对表明的纳米颗粒渗透性进行体外定量 (n = 6)。(C) 在裸鼠尾静脉输注8小时后, 对脑组织切片中表明的纳米颗粒密度进行定量 (n = 3)。(D) 共聚焦显微镜图, 显示 o 110 纳米纳米粒子 (NP110, 红色) 在贴有抗小鼠 CD31 抗体 (绿色) 标签的小鼠脑组织部分的分布情况。箭头突出显示纳米颗粒的细胞化 (左面板)。纳米粒子在脑瘤细胞 (肿瘤、右面板) 周围积累, 原因是其表面出现了针对 coop 靶向的肽。在脑组织 (大脑) 中没有观察到明显的归巢现象。(E) 共聚焦显微镜显示了在贴有抗小鼠 CD31 抗体 (绿色) 标签的小鼠脑组织部分中的350纳米粒子 (NP350, 红色) 的分布。箭头指向保留在血管腔内并无法穿过 BBB 的 Np35d, 这可能是由于它们的直径比 Np110 更大, 细胞核被 DAPI (蓝色) 反染色。* * P < 0.01。P值是使用双尾、非参数的 Mann-wh仔细 u 测试计算的。误差线表示标准偏差。请点击这里查看此图的较大版本.
| 模仿小鼠 BBTB | 本德3 | bEND3+HIFko | bEND3+GB | bEND3+HIFko + GB | 在体内 |
| 渗透性 (10-6平方米) | 27.63 | 6.74 | 26。8 | 10.83 | 5.57 |
| SD (10-6平方米) | 3.45 | 3.01 | 7.99 | 2.65 | 2.19 |
| 模仿人类 BBTB | HuAR2T | HuAR2T+hIAs | HuAR2T+GB | HuAR2T+hIAs+GB | |
| 渗透性 (10-6平方米) | 104.92 | 47。4 | 89.08 | 48.24 | |
| SD (10-6平方米) | 27。1 | 14.32 | 10.21 | 13.07 |
表 1: 体外测定的钠荧光素 (Na-Fl) 渗透率 (以厘米/秒为单位) 的数值在指定的共培养系统和体内在 NMRI 裸鼠中一个有代表性的实验数据 (n = 3只老鼠)。
讨论
患者间肿瘤变异性概念的兴起, 使个性化癌症医学的研究重新焕发了活力。这种变异性也是中枢神经系统肿瘤的一个特征。由于肿瘤的不可预测性, 对化疗的反应增加了 BBB 对药物输送的庇护作用, 在病人护理中完全构成重大挑战.为了开发更有效的疗法, 通常需要筛选新分子的大库。为了评价新治疗靶点到达肿瘤部位的抗肿瘤效果和能力, 最好的选择是对体内植入小鼠患者化身的患者衍生细胞进行临床前研究。由于实际 (财政、时间、人力和设施资源) 和伦理原因 (使用实验动物时的3Rs 原则), 开发这样一个大规模的体内筛查平台往往是不可能的, 因此, 基于细胞的检测仍然是一个选择23的模型.选择已建立的细胞系和避免原代细胞的主要原因是为了促进可重复性和减少实验室动物的使用, 而实验室动物是分离和建立原生小鼠培养的主要来源。这里介绍的方法, 坚定地符合 3Rs, 可以有效地丢弃纳米颗粒从进一步的临床前调查的标准, 他们无法跨越模型 BBTB。作为一项原则证明, 我们在此描述了在 BBTB 开发和验证过程中获得的结果。我们能够在体内证实体外发现, 例如在测量376钠-荧光素的被动扩散时。
本文概述的协议描述了内皮细胞与星形胶质细胞共聚体形成血脑肿瘤样界面的准备工作。一旦这两种细胞类型之间的物理接触被建立, 内皮细胞层表现出与 BBB 的相似性 (例如, 紧密连接蛋白和相对较低的渗透率的细胞表面表达)。有趣的是, 模仿小鼠 BBTB 的研究似乎提供了与体内小鼠 BBB 渗透率测量24所获得的 Na-Fl 渗透率值特别相似的值.因此, BBTB 模拟的性能将与用来形成屏障的细胞的选择直接相关。BEND3 内皮细胞起源于大脑, 已知在与星形胶质细胞25形成障碍方面是成功的。然而, 我们一直在使用永生 HIFko 星形胶质细胞26生成 BBTB 模拟。由于缺乏低氧诱导因子, 这些星形胶质细胞不会产生 VEGF-A, 这在 BBTB 模拟稳定性中是典型的。星形胶质细胞已被确定为 BBB 通透性的调节剂, 例如通过释放 VEGF-A 以应对神经炎症27。血管内皮生长因子受体 (Vegfr) 的激活是体外28和体内29内皮细胞/血管通透性的关键调节剂.因此, VEGF-A 补充剂在培养基激活 VEGFR2 在内皮细胞上, 诱导磷酸化的粘附结蛋白, 如 ve-钙粘附在30。内皮细胞接触的丧失会产生高度渗透的血管。同样, 细胞培养检测中使用的胎儿牛血清的强有丝分裂特性和未知成分也会在屏障稳定和检测重现性方面引起重大问题。
人脐静脉内皮细胞 (Huvec) 有时被用于在体外形成 BBB 31;然而, 它们与大脑微血管内皮细胞 (如 Hcmece/d3 细胞系32) 在基因表达和障碍形成特性方面存在显著差异。然而, 与单独生长的 HuAR2T 细胞相比, 单独生长的 HuAR2T 细胞获得的渗透率相对较高, 通过将其与人类原发星胶质细胞结合, 大大降低了。虽然内皮细胞被要求形成细胞壁, 很明显, 星形胶质细胞具有同样重要的作用, 发挥 BBTB 形成和稳定。
当患者衍生的胶质瘤球体被添加到这个方程中时, 小鼠 BBTB 模仿重述了小鼠异种移植的一些特征, 如药物通过血管的扩散和肿瘤细胞靶向。例如, 当我们筛选出几种不同直径的纳米粒子时, 这里讨论的 BBTB 模拟成功地反映了体内的行为。为了说明体外模型和体内模型之间的相似性, 我们使用了前面描述的介孔硅酸盐纳米粒子33 , 它具有细胞穿透特性34与肿瘤靶向肽 coop 结合在他们的表面20。针对多肽的目的, 通过对侵入性肿瘤细胞的特异性结合, 与哺乳动物衍生的生长抑制剂 (MDGI) 结合。与正常组织35相比, 包括胶质瘤在内的几种癌症表达过度, 这使得 coop 成为一个非常有效的肿瘤靶向位, 能够增加有效载荷20的传递。这里使用的纳米颗粒以前已被证明扩散到大脑实质 (27547955), 当功能与紫杉醇功能化, 这些纳米货物已成功地减少胶质瘤生长在临床前模型36。在纳米颗粒表面添加聚乙二醇 (PEG) 残基也保持了其对正值 (约 + 4 mV) 的静态电荷, 从而与神经血管单元37有更好的相互作用, 并提高了它们的稳定性在流通。在所提供的数据中, PEG 的 3 kDa 与 Np110 结合在一起, 而 Np35v 被涂上 10 kDa 的 peg。然而, 分子量的聚乙二醇也导致纳米颗粒直径显著增加, 因此它们的物理能力跨越 BBB。因此, 我们检查了粒子的物理尺寸是否阻止了它们通过 BBTB, 以及这些观测是否可以在体内反映出来。
根据先前发表的观察, 我们观察到, Np110 在体外通过 BBTB 和携带颅内肿瘤的小鼠的 BBB 外渗, 而保留在 BBTB 的腔侧的 Np350 则模仿了 BBTB 的边缘和小 鼠。这些类似的结果强烈表明, BBTB 模型预测了纳米粒子在体内穿越 BBB 并到达大脑的能力。
BBB 细胞模型的相关性经常被讨论, 即使是对纳米粒子38的中央传递也是如此。我们在这里表明, 原代星形胶质细胞和内皮细胞, 都被认为是最相关的体外工具, 可以被不朽和/或市售细胞所取代, 确保更大的可扩展性和重现性。下一代的体外 bbb 仿制品可以通过结合微流体装置来开发, 允许形成精美的神经血管单位, 在结构上类似于实际的 bbb12,14。然而, 由于在交付的后续行动中存在技术限制, 这类模型目前不适合对传递给胶质瘤的分子进行高通量筛选14。确实很难捕捉到一道菜中 BBB 的生理复杂性, 而且 BBB 所表达的一些受体蛋白可能缺乏, 这可能会损害对结果的解释。另一个论点是, 体内和体外条件之间, 以及从一个细胞系到另一个细胞系, 特别是考虑内皮细胞, 基因表达的差异很大。然而, 也可以说, 神经血管单位不是大脑内的一个统一的实体39。生物学科学研究已经进入了一个人道的时代, 在设计实验之前, 总是考虑动物的福利、伦理责任和使用动物生命的成本。因此, 为了支持动物的替换, 最近越来越多的研究表明, 认识到模型的局限性, 并仔细选择细胞模型, 以建立障碍--重点是星形胶质细胞--需要在一道菜和动物模型40中获得的结果之间的匹配。通过这里描述的方法, 我们离减少用于筛选 BBB 转细胞增多以进行潜在治疗的实验动物数量又近了一步。
披露声明
作者没有什么可透露的。
致谢
这项研究得到了芬兰癌症组织 Jane & Aatos Erkko 基金会和 Sirid Juselius 基金会 (至 p. l. 和 v. l. j.)、瑞士国家科学基金会 (高级博士后. 流动赠款: P300PB_164732, 给 S. 的赠款。)、Orion 研究基金会 (至 s. k.)、Maud Kuistila 纪念基金会 (至 s. k.) 和芬兰科学院 (TERRA, 2017年, 赠款: 314 498)。生物成像单元 (赫尔辛基) 因提供显微镜成像核心设施而获得认可。
材料
| Name | Company | Catalog Number | Comments |
| Cells | |||
| bEND3 | ATCC | CRL-2299 | Cultured in: DMEM (1g/L glucose) supplemented with 10% FBS, 5 mL L-glutamine and 5 mL penicillin/streptomycin |
| HIFko immortalized mouse astrocytes | Isolated in Dr. Gabriele Bergers Lab | https://doi.org/10.1016/S1535-6108(03)00194-6 | Cultured in: BME-1 supplemented with 5% FBS, 5 mL 1 M HEPES, 5 mL 100 mM sodium pyruvate, 3 g D-glucose and 5 mL penicillin/streptomycin |
| HuAR2T | Isolated in Dr. Dagmar Wirth Lab | https://doi.org/10.1089/ten.tea.2009.0184 | Cultured in: EBM-2 with SupplementMix |
| normal human primary astrocytes | Lonza | CC-2565 | Cultured in: ABM with SingleQuots |
| Material and reagents | |||
| 100 mm x17 mm Dish, Nunclon Delta | ThermoFisher Scientific | 150350 | |
| 10 mL serological pipet | ThermoFisher Scientific | 170361 | |
| 15 mL Conical Sterile Polypropylene Centrifuge Tubes | ThermoFisher Scientific | 339650 | |
| ABM Basal Medium, 500 mL | Lonza | CC-3187 | For primary human astrocytes. ABM+: contains all the additives from the supplement mix. ABM-:all the additives except for rhEGF and FBS |
| Accutase Cell Detachment Solution | Corning | 25-058-CI | |
| AGM SingleQuots Supplements and Growth Factors | Lonza | CC-4123 | |
| B27 supplement | Gibco | 17504-044 | for both GBM + and - medium |
| Basal Medium Eagle | ThermoFisher Scientific | 21010046 | BME-1 |
| Corning Costar TC-Treated 6-Well Plates | Sigma-Aldrich | CLS3506 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3452 | |
| D-glucose | Sigma-Aldrich | G8270 | dissolve in 50 mL of BME-1 and sterile filter before adding to the medium |
| Dulbecco's Modified Eagle's Medium/Nutrient F-12 Ham | Gibco | 21331-020 | Specific to the culture of the patient-derived spheres isolated in our lab, may vary for other glioma cell lines |
| EBM-2 growth Medium SupplementMix | PromoCell | c-39216 | EBM+: contains all the additives from the supplement mix. EBM-:all the additives except for VEGF-A and FBS |
| Endothelial Basal Medium 2 (EBM-2) | PromoCell | c-22211 | EBM+: contains all the additives from the supplement mix. EBM-:all the additives except for VEGF-A and FBS |
| Fetal Bovine Serum (FBS), qualified, heat inactivated, E.U.-approved, South America Origin | ThermoFisher Scientific | 10500056 | |
| Fluorescein sodium salt | Sigma-Aldrich | F6377 | |
| Greiner CELLSTAR 96 well plates | Sigma-Aldrich | Greiner 655090 | black polystyrene wells flat bottom (with micro-clear bottom) |
| Menzel-Gläser 0.9 cm round borosilicate Cover Slips | Thermo Scientific | 10313573 | |
| PBS tablets | Medicago | 09-9400-100 | one tablet per liter of dH2O, then sterilize the solution by autoclaving |
| Poly-D-lysine hydrobromide | Sigma-Aldrich | P6407 | |
| Recombinant Human EGF | Peprotech | GMP100-15 | for GBM+ medium |
| Recombinant Human FGF-basic (154 a.a.) | Peprotech | 100-18B | for GBM+ medium |
| Immunofluorescence | |||
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| 24 mm x 60 mm microscope slide cover glass | ORSAtec | 0224601-D | |
| AlexaFluor 488 and 594 secondary antibodies | ThermoFisher Scientific | dilution: 1/500 | |
| Anti-Claudin-5 antibody | Abcam | ab15106 | dilution: 1/150 |
| Anti-GFAP antibody clone GF5 | Abcam | ab10062 | dilution: 1/150 |
| Anti-Mouse CD31 antibody Clone MEC 13.3 | BD Biosciences | 550274 | dilution 1/800 |
| Anti-SV40 T-antigen antibody | Abcam | ab16879 | dilution: 1/150 |
| Anti-Zonula Occludens-1 | Abcam | ab96587 | dilution: 1/200 |
| DAPI | TOCRIS | 5748 | |
| Fluoromount Aqueous Mounting Medium | Sigma-Aldrich | F4680 | |
| LysoTracker Red DND-99 | ThermoFisher Scientific | L7528 | |
| Animal procedures | |||
| 10 cm curved dissecting scissors | World Precision Instruments | 14394 | |
| BD Microlance 25 G needles | Becton Dickinson | 300600 | |
| Fine Forceps (12.5 cm) | World Precision Instruments | 503283 | for tissue dissociation |
| Intramedic Polyethylene tubing PE20 | Becton Dickinson | 427406 | |
| Ketaminol vet 50 mg/mL | Intervet | Vnr511485 | Ketamine |
| Mains Powered microdrill | World Precision Instruments | 503599 | |
| Menzel-Gläser 0.5 cm round borosilicate Cover Slips | Thermo Scientific | 11888372 | |
| Micro Bulldog clamp | World Precision Instruments | 14119 | |
| Physiological saline solution | Mustela | Sterile single dose vials 20 x 5 mL / 40 x 5 mL - Medical device class | |
| Rochester-Oschner forceps | World Precision Instruments | 501709 | |
| Rompun vet 20 mg/mL | Intervet | Vnr148999 | Xylazine |
| Stereotaxic adapter | World Precision Instruments | 502063 | |
| Sugi Sponge Points | Kettenbach | 31603 | |
| Equipment | |||
| Axio Zoom.V16 fluorescence stereo zoom microscope | Carl Zeiss | ||
| FLUOstar Omega microplate reader | BMG Labtech | ||
| ORCA-Flash 4.0 digital sCMOS camera | Hamamatsu Photonics | ||
| Universal 320 tabletop centrifuge | Hettich | Cat. No. 1401 | |
| ZEISS LSM 880 with Airyscan confocal microscope | Carl Zeiss |
参考文献
- Daneman, R., Prat, A. The blood-brain barrier. Cold Spring Harbor Perspectives in Biology. 7 (1), a020412 (2015).
- Quail, D. F., Joyce, J. A. The Microenvironmental Landscape of Brain Tumors. Cancer Cell. 31 (3), 326-341 (2017).
- Wang, Z., Sun, H., Yakisich, J. S. Overcoming the blood-brain barrier for chemotherapy: limitations, challenges and rising problems. Anticancer Agents in Medicinal Chemistry. 14 (8), 1085-1093 (2014).
- Alkins, R. D., Brodersen, P. M., Sodhi, R. N., Hynynen, K. Enhancing drug delivery for boron neutron capture therapy of brain tumors with focused ultrasound. Neuro Oncology. 15 (9), 1225-1235 (2013).
- Alli, S., et al. Brainstem blood brain barrier disruption using focused ultrasound: A demonstration of feasibility and enhanced doxorubicin delivery. Journal of Controlled Release. 281, 29-41 (2018).
- Ashby, L. S., Smith, K. A., Stea, B. Gliadel wafer implantation combined with standard radiotherapy and concurrent followed by adjuvant temozolomide for treatment of newly diagnosed high-grade glioma: a systematic literature review. World Journal of Surgical Oncology. 14 (1), 225 (2016).
- Guishard, A. F., Yakisich, J. S., Azad, N., Iyer, A. K. V. Translational gap in ongoing clinical trials for glioma. Journal of Clinical Neurosciences. 47, 28-42 (2018).
- Rahman, N. A., et al. Immortalized endothelial cell lines for in vitro blood-brain barrier models: A systematic review. Brain Research. 1642, 532-545 (2016).
- Helms, H. C., et al. In vitro models of the blood-brain barrier: An overview of commonly used brain endothelial cell culture models and guidelines for their use. Journal of Cerebral Blood Flow & Metabolism. 36 (5), 862-890 (2016).
- Wang, J. D., Khafagy, e. l. -. S., Khanafer, K., Takayama, S., ElSayed, M. E. Organization of Endothelial Cells, Pericytes, and Astrocytes into a 3D Microfluidic in Vitro Model of the Blood-Brain Barrier. Molecular Pharmaceutics. 13 (3), 895-906 (2016).
- Phan, D. T., et al. Blood-brain barrier-on-a-chip: Microphysiological systems that capture the complexity of the blood-central nervous system interface. Experimental Biology and Medicine (Maywood). 242 (17), 1669-1678 (2017).
- Bang, S., et al. A Low Permeability Microfluidic Blood-Brain Barrier Platform with Direct Contact between Perfusable Vascular Network and Astrocytes. Scientific Reports. 7 (1), 8083 (2017).
- Wilhelm, I., Krizbai, I. A. In vitro models of the blood-brain barrier for the study of drug delivery to the brain. Molecular Pharmacology. 11 (7), 1949-1963 (2014).
- Campisi, M., et al. 3D self-organized microvascular model of the human blood-brain barrier with endothelial cells, pericytes and astrocytes. Biomaterials. 180, 117-129 (2018).
- Pirsko, V., et al. An Effect of Culture Media on Epithelial Differentiation Markers in Breast Cancer Cell Lines MCF7, MDA-MB-436 and SkBr3. Medicina (Kaunas). 54 (2), (2018).
- Stebbins, M. J., et al. Differentiation and characterization of human pluripotent stem cell-derived brain microvascular endothelial cells. Methods. 101, 93-102 (2016).
- Canfield, S. G., et al. An isogenic blood-brain barrier model comprising brain endothelial cells, astrocytes, and neurons derived from human induced pluripotent stem cells. Journal of Neurochemistry. 140 (6), 874-888 (2017).
- Cao, Y., et al. Hypoxia-inducible factor-1alpha is involved in isoflurane-induced blood-brain barrier disruption in aged rats model of POCD. Behavioural Brain Research. 339, 39-46 (2018).
- Abbott, N. J. Astrocyte-endothelial interactions and blood-brain barrier permeability. Journal of Anatomy. 200 (6), 629-638 (2002).
- Kinnari, P. J., et al. Tumour homing peptide-functionalized porous silicon nanovectors for cancer therapy. Biomaterials. 34 (36), 9134-9141 (2013).
- Levin, V. A. Personalized medicine in neuro-oncology. CNS Oncology. 5 (2), 55-58 (2016).
- Weathers, S. S., Gilbert, M. R. Toward Personalized Targeted Therapeutics: An Overview. Neurotherapeutics. 14 (2), 256-264 (2017).
- O'Duibhir, E., Carragher, N. O., Pollard, S. M. Accelerating glioblastoma drug discovery: Convergence of patient-derived models, genome editing and phenotypic screening. Molecular and Cellular Neuroscience. 80, 198-207 (2017).
- Kaya, M., Ahishali, B. Assessment of permeability in barrier type of endothelium in brain using tracers: Evans blue, sodium fluorescein, and horseradish peroxidase. Methods in Molecular Biology. 763, 369-382 (2011).
- Yang, S., et al. Identification of two immortalized cell lines, ECV304 and bEnd3, for in vitro permeability studies of blood-brain barrier. PLoS One. 12 (10), e0187017 (2017).
- Blouw, B., et al. The hypoxic response of tumors is dependent on their microenvironment. Cancer Cell. 4 (2), 133-146 (2003).
- Argaw, A. T., et al. Astrocyte-derived VEGF-A drives blood-brain barrier disruption in CNS inflammatory disease. Journal of Clinical Investigation. 122 (7), 2454-2468 (2012).
- Miao, Z., et al. VEGF increases paracellular permeability in brain endothelial cells via upregulation of EphA2. The Anatomical Record (Hoboken). 297 (5), 964-972 (2014).
- Heinolainen, K., et al. VEGFR3 Modulates Vascular Permeability by Controlling VEGF/VEGFR2 Signaling. Circulation Research. 120 (9), 1414-1425 (2017).
- Claesson-Welsh, L. Vascular permeability--the essentials. Upsala Journal of Medical Sciences. 120 (3), 135-143 (2015).
- Adriani, G., Ma, D., Pavesi, A., Goh, E. L., Kamm, R. D. Modeling the Blood-Brain Barrier in a 3D triple co-culture microfluidic system. Conference Proceedings - IEEE Engineering in Medicine and Biology Society. 2015, 338-341 (2015).
- Weksler, B., Romero, I. A., Couraud, P. O. The hCMEC/D3 cell line as a model of the human blood brain barrier. Fluids and Barriers of the CNS. 10 (1), 16 (2013).
- Paatero, I., et al. Analyses in zebrafish embryos reveal that nanotoxicity profiles are dependent on surface-functionalization controlled penetrance of biological membranes. Scientific Reports. 7 (1), 8423 (2017).
- Prabhakar, N., et al. Stimuli-responsive hybrid nanocarriers developed by controllable integration of hyperbranched PEI with mesoporous silica nanoparticles for sustained intracellular siRNA delivery. International Journal of Nanomedicine. 11, 6591-6608 (2016).
- Hyvonen, M., et al. Novel target for peptide-based imaging and treatment of brain tumors. Molecular Cancer Therapeutics. 13 (4), 996-1007 (2014).
- Feng, X., et al. Mammary-Derived Growth Inhibitor Targeting Peptide-Modified PEG-PLA Nanoparticles for Enhanced Targeted Glioblastoma Therapy. Bioconjugate Chemistry. 26 (8), 1850-1861 (2015).
- Nance, E. A., et al. A dense poly(ethylene glycol) coating improves penetration of large polymeric nanoparticles within brain tissue. Science Translational Medicine. 4 (149), 149rA119 (2012).
- Berg, C. Quantitative analysis of nanoparticle transport through in vitro blood-brain barrier models. Tissue Barriers. 4 (1), e1143545 (2016).
- Noumbissi, M. E., Galasso, B., Stins, M. F. Brain vascular heterogeneity: implications for disease pathogenesis and design of in vitro blood-brain barrier models. Fluids and Barriers of the CNS. 15 (1), 12 (2018).
- Heymans, M., Sevin, E., Gosselet, F., Lundquist, S., Culot, M. Mimicking brain tissue binding in an in vitro model of the blood-brain barrier illustrates differences between in vitro and in vivo methods for assessing the rate of brain penetration. European Journal of Pharmaceutics and Biopharmaceutics. 127, 453-461 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。