需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
基于传输的野武学型差分干涉对比显微镜对等离子体纳米粒子的光谱处理
摘要
该协议的目的是详细介绍一种经过验证的制备等离子体纳米颗粒样品的方法, 以及用差分干涉对比度 (DIC) 显微镜对其进行单粒光谱的方法。
摘要
差动干涉对比度 (DIC) 显微镜是一种功能强大的成像工具, 最常用于使用可见光对微尺度物体进行成像。该协议的目的是详细介绍一种经过验证的制备等离子体纳米粒子样品的方法, 并利用 DIC 显微镜对其进行单粒光谱。为了进行可重复的光谱实验, 必须仔细遵循几个重要步骤。首先, 可以将地标刻在样品基板上, 这有助于在实验过程中定位样品表面和跟踪感兴趣的区域。其次, 基板必须适当清洗碎片和污染物, 否则可能会阻碍或模糊对样品的检查。正确制备样品后, 显微镜的光学路径必须使用科勒照明。使用标准的 Nomarski 风格 DIC 显微镜, 样品的旋转可能是必要的, 特别是当等离子体纳米粒子表现出与方向相关的光学特性时。由于 DIC 显微镜有两个固有的正交偏振场, 因此与波长相关的 DIC 对比度模式揭示了棒状等离子体纳米粒子的方向。最后, 必须仔细执行数据采集和数据分析。将基于 dic 的光谱数据表示为对比值是很常见的, 但也可以将其表示为强度数据。在这个演示的 DIC 为单粒子光谱, 重点是球面和棒状金纳米粒子。
引言
自20世纪80年代以来, 差动干涉对比度显微镜 (DIC) 已被广泛视为生物科学中为微尺度物体保留的一种重要成像方法。然而, 在1950年代和1960年代的发展过程中, 它的目的是作为材料科学的一种技术1。随着与等离子体纳米粒子相关的材料科学的最新进展, 人们对光学显微镜对材料的表征越来越感兴趣。
许多光学技术当然可用于纳米材料表征 (例如, 暗场、明亮场、偏振光、荧光等)。黑场在纳米粒子研究中广泛流行, 但它完全依赖于散射的收集, 并提供关于复杂样本的有限信息2。荧光是有用的, 但只有样品发光或可以适当染色。DIC 显微镜具有多种特点, 使其成为分析纳米粒子的宝贵工具。与其他方法相比, DIC 最常见的优点是: 无需样品染色、无光晕效应、景深浅、横向分辨率高3。DIC 具有对等离子体纳米粒子研究有价值的附加优势。首先, 存在两个固有的偏振场和正交偏振场, 它们可以同时测量, 用于光谱目的2。其次, 在最终图像2中没有捕获纳米粒子的去极化信号, 这可能是暗场光谱测量中严重关注的问题。
本文的目的是为利用透射光诺马尔斯基 DIC 显微镜对等离子体纳米粒子进行光谱研究提供一种清晰的方法。虽然 DIC 是一种功能强大的技术, 可应用于高度多样化的材料, 但它也是一种技术, 在成像纳米粒子时, 需要极大的技巧和理解才能正确操作。基于传输的 Nomarski DIC 显微镜具有复杂的光路径1 , 仅在此简要介绍。DIC 的光学列车显示在图 1中。光通过显微镜通过显微镜传播, 首先通过偏振器和分束的 Polarizer 棱镜, 然后被冷凝器聚焦到样品平面上。经过目标后, 光线会遇到一个组合 Nomarski 棱镜和分析仪的波束, 然后离开探测器。两个偏振器和 Polarizers 棱镜是 DIC 图像形成的关键, 负责产生 DIC 的两个正交偏振场1。有兴趣了解 nomarski DIC 显微镜的工作原理和光学路径的读者, 或 Nomarski DIC 与其他 DIC 风格之间的差异, 请参考有关这些主题的其他写得很好的说明 1,4 个,5,6,7。
同样重要的是, 在尝试对其进行光谱学之前, 了解等离子体纳米粒子的基本性质, 无论是使用 Nomarski DIC、暗场, 还是任何其他显微镜技术。在等离子体领域, 纳米粒子被定义为尺寸为10-100 纳米8,9的颗粒。纳米粒子可以具有多种形状 (例如, 球体、棒、星、哑铃等), 它们的大部分重要特性来自于电磁波谱的紫外线可见光近红外范围内与光线的相互作用。"等离子体" 一词并不限于纳米粒子10;然而, 在讨论纳米粒子时, 它被用于局部表面等离子体共振 (LSPR)。LSPR 是一种现象, 其中纳米粒子中的导电电子由于与高度特定和相对较窄的频带8的电磁辐射的库仑相互作用而振荡。在这些相同的频率下, 等离子体纳米粒子表现出更大的吸收和散射光, 使他们可以通过光学显微镜观察到。在许多情况下, 最好在冷凝器2之前放置带通滤波器时观察纳米颗粒, 以提高成像对比度并消除无法诱导 lspr 效应的光线。使用过滤器还可以进行单粒光谱实验。
Lspr 相关的光学行为高度依赖于纳米粒子的大小和形状, 可以用多种光学显微镜技术进行研究。然而, 为了破译具有各向异性 (即非球面) 形状的等离子体纳米粒子的取向信息, 有必要利用光场的极化。通过以较小的增量仔细旋转偏振场或样品基板, 可以监测单个纳米粒子的方向依赖性光谱特性。旋转和极化还可以帮助确定光谱特征是由于纳米粒子表面电子的双极振荡还是高阶振荡造成的。然而, 在各向同性 (即球形) 纳米粒子的情况下, 在偏振光下旋转样品时, 光谱剖面基本保持不变。
通过 DIC 显微镜观察时 (图 2), 纳米粒子有一个通风的圆盘, 在灰色背景下出现阴影的白色和黑色外观。球状纳米颗粒在旋转和带通滤波器的变化下将保持这种外观;然而, 当滤波器的中心波长与球体唯一的双极 LSPR波长 11只进一步分离时, 粒子将逐渐从视野中消失。纳米棒的外观可以发生相当大的变化, 因为他们是旋转2。纳米棒有两个具有双极行为的 LSPR 波段, 其位置基于纳米棒的物理尺寸。当纳米体的纵轴与一个 DIC 偏振场平行定向时, 如果使用与 LSPR 波长相关的带通滤波器查看, 则通风盘将显示为全白色或全黑色。旋转90°后, 它将采用相反的颜色。或者, 由于纳米轴的横轴垂直于纵轴, 因此在两个轴的 LSPR 波长匹配的滤波器之间切换时, 棒将采用相反的颜色。在其他方向和滤波器设置中, 纳米棒将更像球体, 呈现各种阴影投射的通风圆盘图案。对于具有 < 25 纳米的横向轴的纳米棒, 使用 DIC 显微镜在 LSPR 的波长处检测信号是很困难的。
要执行单个粒子光谱, 重要的是使用正确的光学元件并正确对齐它们。必须使用能够使用 DIC 显微镜的客观特性。对于单粒子实验, 80x 或100x 油目标是理想的。Nomarski DIC 棱镜通常有三个品种: 标准、高对比度和高分辨率。理想类型在很大程度上取决于实验的目的和纳米粒子的大小。标准棱镜适用于许多实验;但当使用较小的纳米粒子 (< 50 纳米) 时, 高对比度棱镜可能是有益的, 因为颗粒对比度会随着颗粒尺寸的减小而减小。根据显微镜品牌或型号6的不同, 通过旋转偏光片或翻译其中一个 dic 棱镜来调整 dic 对比度。
设置科勒照明和偏光片设置后, 在收集光谱数据时不重新调整这些设置是至关重要的。此外, 在数据收集过程中, 即使在滤波器和角度设置之间切换, 也必须始终保持恒定的平均背景信号。实际理想的背景值取决于科学相机的动态范围, 但一般来说, 背景应在相机最大检测水平的 15%-40% 的范围内。这降低了相机传感器饱和的可能性, 同时实现了最佳的粒子对比度。为了收集光谱数据, 有必要使用科学相机来捕捉黑白图像, 而不是彩色相机。
样品制备是成像等离子体纳米粒子的另一个关键方面。DIC 显微镜的操作人员必须了解样品的光学特性和样品的基板。"预清洁" 显微镜玻璃没有为纳米颗粒的成像做好充分准备, 在样品沉积之前必须对其进行适当的再清洗, 以确保样品的观察不受阻碍。许多显微镜幻灯片的清洁方案以前已经记录了 12个, 但这不是实验研究中通常报告的一个步骤。
最后, 数据分析方法是单粒光谱的最终组成部分。必须测量每种纳米粒子的最大强度和最小强度, 以及局部背景平均值。感兴趣的粒子应位于没有背景碎片、基板缺陷或照明不均匀的区域。确定纳米粒子光谱分布的一种方法是使用小于 11、13、14、15的公式计算每个波长的粒子对比度:

或者, 单个粒子的光谱可以被分割成其单独的最大和最小信号分量, 这代表 DIC 的两个偏振场, 从而显示同时收集的两个方向依赖谱,通过两个方程:
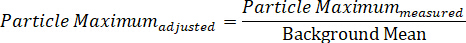
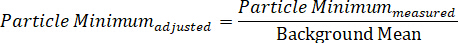
研究方案
1. 用标准玻璃显微镜幻灯片进行样品制备
- 准备玻璃显微镜幻灯片进行样品沉积。
注: 在某些情况下, 将玻璃存放在超纯水中而不是乙醇可能更为合适。然而, 储存在水或空气中, 会随着时间的推移使玻璃具有疏水性。- 为了获得最佳效果, 请购买玻璃或石英显微镜幻灯片和盖板玻璃。
- 使用划笔, 在每个玻璃盖滑块的中心放置一个浅的和短的划痕。
- 清洁所有显微镜玻璃, 即使是 "预先清洁" 购买, 以去除玻璃碎片、灰尘、粉末、有机残留物以及影响成像质量或样品沉积的任何其他污染物。
注: 下面的清洁方法适用于此处描述的样品类型, 并避免使用苛刻的化学品。更硬的化学品可以蚀刻玻璃, 需要在处理和处置时更加小心。- 将显微镜玻璃放在储物架上, 然后放入烧杯或染色罐中。不要将显微镜玻璃放在烧杯和其他实验室玻璃器皿底部而不进行压紧, 因为显微镜玻璃的每一块和表面都应完全暴露在清洗剂中。
- 将液体洗涤剂 (材料表) 倒在容器中 ~ 1 毫升, 然后用水顶出容器。索因30分钟。
注: 清洗过程开始后, 只需在戴手套时处理玻璃, 以避免在玻璃上留下指纹残留物。 - 将清洗容器中的液体中的物质倒进水槽。用超纯水将容器冲洗多次, 以去除洗涤剂的所有外观。用超纯水填充容器。用显微镜玻璃将容器再用30分钟。
- 至少重复上一步一次。在水中执行额外的超声, 直到很明显, 洗涤剂的所有痕迹已被删除。
- 把清洁容器里的东西倒出来。用超纯水冲洗容器。用乙醇填充容器。超声显微镜玻璃30分钟。
- 把清洁容器里的东西倒进废容器里。用乙醇填充。覆盖容器, 以防止通过蒸发而损失乙醇。将显微镜玻璃存放在此容器中, 直到实验时间。只要滑块仍然被乙醇淹没在有盖的容器内, 它们就会保持清洁和可用。
-
纳米颗粒溶液的制备
- 使用微移液器, 从其原始储存容器中取出 100μl 00-L 005 金纳米颗粒溶液, 并将该溶液喷射到 1.5 mL 离心管中。
- 以 6, 000 x g 的速度对样品进行10分钟离心。
- 用微型移液器去除上清液, 以去除多余的表面活性剂。
- 使用微移液器, 将100μl 的超纯水放入离心管中。
注: 如果第一次尝试时不能取出所有的上清液, 请重复离心和再悬浮步骤。 - 将样品短暂旋涡, 重新悬浮颗粒。后立即进行20分钟的完全重新悬浮和分解纳米颗粒集料。
注: 如果样品未立即使用, 则应在将溶液沉积到显微镜玻璃上之前再次进行20分钟的超声检查。
-
样品沉积
- 从存储容器中取出清洁的盖板和显微镜滑块。用加压氮气或氩吹干玻璃。
- 使用微移液器, 从步骤1.2.5 到盖滑下滴投6Μl 纳米颗粒溶液。要均匀地铺开液滴, 请小心地将第二块较大的显微镜玻璃放在盖板上, 如第二盖板或显微镜滑块。避免将气泡夹在两块玻璃之间。
- 将样品基板翻转过来, 用狭窄的指甲油线密封盖板的边缘, 以防止介质溶液蒸发。
- 或者, 要将样品 "干燥" 成像, 请让溶液在盖板上站立 5-15分钟, 然后取出不需要的玻璃块。用加压氮气或氩轻轻吹干盖板滑移。
- 如有可能, 请在制备后立即进行图像采样。如果无法做到这一点, 请将样品存储在有盖的容器中, 如培养皿, 直到成像。
2. DIC 成像
- 对齐目标和冷凝器。
- 将样品放在显微镜上后, 找到带有样品的焦平面。首先定位并聚焦于之前创建的划痕。然后微调焦点, 直到纳米粒子进入视野。
- 要确定冷凝器的准确位置, 请使用科勒照明方法。5科勒高放大倍率 (80x, 100x) 下的照明更容易通过首先在较低的放大倍率 (如 20x) 下设置科勒照明来实现。
注: 通常情况下, 科勒照明不需要在单个样品的成像过程中重新调整。但是, 在切换到新的显微镜幻灯片时, 最好验证科勒照明是否正确设置。
- 优化对比度设置。
- 在样品中选择感兴趣的区域进行成像。将区域集中在相机的视场中, 并根据需要调整对焦。
- 如果显微镜有德塞纳蒙特的设计, 从偏光片设置接近最大背景灭绝, 并逐步旋转偏光片朝着减少背景消光。背景强度将逐渐增加。
- 如果显微镜没有 de Senarmont 设计, 请从最大背景消光时设置的光学列车开始。在这种情况下, 逐渐调整客观棱镜位置, 以减少背景灭绝。
注: 当纳米粒子达到其最大强度差 (即对比度) 与平均局部背景值时, 就会达到理想的设置。对于等离子体纳米粒子, 最佳对比通常是在相对黑暗的背景下实现的, 因此是在接近最大背景消光的设置下实现的。
- 在样品中选择感兴趣的区域进行成像。将区域集中在相机的视场中, 并根据需要调整对焦。
- 对示例进行映像。
- 关闭室内照明, 防止杂散照明与过程交互。
- 在使用科学成像相机查看纳米粒子时, 确定最佳背景级别。使用10纳米全宽半最大 (FWHM) 带通滤波器, 其中心波长与主要 LSPR 波长同位, 查看感兴趣的区域。调整灯的强度或曝光时间, 直到背景水平在相机最大容量水平的 15%-40% 的范围内, 并且感兴趣区域内的任何物体都不会显示出超过相机最大强度水平90% 的信号强度。
注: 步骤2.3.2 的目标是防止传感器在滤波器之间切换时饱和。理想的背景级别因样品和相机而异。完成此步骤后, 可以调整曝光时间, 但不能调整灯泡强度。 - 使用一系列带通滤波器对样品进行成像, 每个滤波器的 FWHM 均为 10nm, 并作为一个整体, 可在整个感兴趣的波长范围内进行成像。通过调整曝光时间, 确保从图像到图像的背景强度保持一致 (彼此的 ~ 5% 以内)。切换滤镜后, 在捕获图像之前重新聚焦示例。
- 将图像另存为未压缩的 TIFF 文件和/或软件的本机文件格式, 以便保留所有信息。
- 旋转样品。
- 在原始位置收集样品图像后, 现在可以在光路径中的其他方向旋转和成像。在180°或360°范围内定期 (例如, 10°或 15°) 进行旋转。
注: 旋转需要可旋转的采样阶段。 - 与第2.1 至2.3 节一样, 调整相机设置以提供从图像到图像的一致背景级别。
注: 不应对科勒照明进行调整。
- 在原始位置收集样品图像后, 现在可以在光路径中的其他方向旋转和成像。在180°或360°范围内定期 (例如, 10°或 15°) 进行旋转。
3. 使用 ImageJ 进行数据分析
注: 以下计算可以在各种软件包中执行, 有时也可以在用于收集图像的本机程序中执行。ImageJ 是美国国立卫生研究院 (NIH) 免费提供的软件。
- 计算粒子对比度或强度。
- 使用 ImageJ 打开图像。
- 选择"矩形" 工具, 并在感兴趣的主要区域周围绘制一个矩形。
- 在工具栏上, 依次选择 "图像"、" 缩放" 和 "选择"。成像窗口将放大选定的区域。
- 在工具栏上, 依次选择 "图像"、 "调整" 和 "亮度/对比度"。此时将出现一个新窗口。若要更好地查看示例区域, 请调整四个设置: "最小"、"最大值"、"亮度" 和 "对比度"。这些调整并没有改变科学数据, 它们只是使抽样区域具有更好的能见度。
注: 3.1.3 和3.1.4 的步骤可以按相反的顺序执行多次。 - 再次使用矩形工具, 在要测量的第一个纳米粒子周围绘制一个框。盒子应该只比纳米颗粒的通风盘稍大一些。
- 在工具栏上, 选择 "分析", 然后选择"测量"。此时将出现一个新窗口, 报告位于所选框内的像素的 "最小值"、"最大值" 和 "平均值"。
- 将用于测量纳米粒子的框拖动到与粒子相邻的区域, 在该区域中, 背景对比度相对均匀, 并且不存在颗粒或污染物。保留框的原始大小。
- 使用 "测量" 工具确定背景区域的平均强度。
- 测量每个粒子的剩余粒子和相邻的背景区域。
- 对序列中所有图像中的每个粒子重复此过程。
- 将数据导出到电子表格中, 以计算每个粒子在所有波长和角度上的对比度或强度。
- 使用以下公式13、14、15计算每个粒子的对比度:

注: 使用此公式, 粒子对比度应始终 > 0。 - 通过将测量到的最大粒子强度除以背景平均值来计算粒子的背景调整最大值:
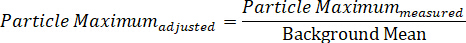
- 同样, 通过将测量到的最小粒子强度除以背景平均值来计算背景调整的最小值:
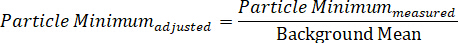
注: 计算时, 最大值应大于 1, 而最小值将小于1。可以接受将每个值减去 "1", 这样平均背景基本上为零, 最大值表示为正值, 最小值被赋值为负值 16。后一种方法允许分析师分别考虑沿每个极化场发生的情况, 这在研究各向异性粒子时非常有用。 - 要在给定的纳米粒子位置绘制光谱剖面图, 请绘制沿 x 轴的波长和沿 y 轴的对比度或强度的数据。
- 要在给定的波长上绘制旋转轮廓图, 请沿 x 轴绘制旋转角度, 沿 y 轴绘制对比度或强度图。
结果
在处理足够大的样品时, 通常不需要在玻璃基板上放置地标。然而, 在使用纳米材料或需要旋转样品时, 地标可以为定位、识别和跟踪样品的方向提供一种简单的方法。虽然更复杂的技术可以用来离开玻璃基板17的地标, 用划笔划伤玻璃是一种经济而简单的方法, 在许多情况下都是有效的。重要的是要避免检查紧邻这些地标的示例区域, 因为划痕会创建一个?...
讨论
使用 DIC 显微镜进行成像时, 在收集数据之前对光学元件进行优化至关重要。即使在实验中间对偏光片稍作调整, 也会对最终数据产生重大影响。此外, 不同的材料需要不同的偏光片设置。虽然这里使用了较大的步长来展示偏振角的影响, 但在实际实验中, 必须在最佳对比度设置的1°–2°范围内优化偏振器设置。偏振器设置也应记录, 以供将来参考。还建议始终在交叉偏光片 (0°) 点?...
披露声明
提交人没有什么可透露的。
致谢
Anthony S. Stender 博士感谢俄亥俄州大学纳米和量子现象研究所 (NQPI) 提供的技术支持。这篇文章是通过俄亥俄州大学向 Stender 博士提供的启动资金而成为可能的。
材料
| Name | Company | Catalog Number | Comments |
| Contrad 70 | Decon Labs, Inc. | 1002 | For cleaning microscope glass, Available through many chemical suppliers |
| Ethanol | Fisher Scientific | A962-4 | For cleaning and storing microscope glass |
| Glass microscope cover slips | Ted Pella | 260148 | |
| Glass microscope slides | Ted Pella | 26007 | |
| Gold nanorods | Nanopartz | DIAM-SPR-25-650 | |
| Gold nanospheres (80 nm) | Sigma Aldrich | 742023-25ML | |
| ImageJ | NIH | N/A | Free Software availabe for data analysis from NIJ |
| Nail polish | Electron Microscopy Sciences | 72180 | |
| Nikon Ti-E microscope | Nikon | N/A | |
| Nitrogen gas | Airgas | N/A | |
| ORCA Flash 4.0 V2+ digital sCMOS camera | Hamamatsu | 77054098 | |
| Scribing pen | Amazon | N/A | Many options available online for under $10. Not necessary to buy an expensive version. |
| Ultrapure water | 18 megaohm |
参考文献
- Pluta, M. Ch 7: Differential Interference Contrast in. Advanced Light Microscopy. 2, 146-197 (1989).
- Stender, A. S., Wang, G., Sun, W., Fang, N. Influence of Gold Nanorod Geometry on Optical Response. ACS Nano. 4 (12), 7667-7675 (2010).
- Stender, A. S., et al. Single Cell Optical Imaging and Spectroscopy. Chemical Reviews. 113 (4), 2469-2527 (2013).
- Mehta, S. B., Sheppard, C. J. R. Partially coherent image formation in differential interference contrast (DIC) microscope. Optics Express. 16 (24), 19462-19479 (2008).
- Murphy, D. B., Davidson, M. W. Ch 1: Fundamentals of Light Microscopy. Fundamentals of Light Microscopy and Electronic Imaging, Second edition. , 1-20 (2012).
- Stender, A. S., Augspurger, A. E., Wang, G., Fang, N. Influence of Polarization Setting on Gold Nanorod Signal at Nonplasmonic Wavelengths Under Differential Interference Contrast Microscopy. Analytical Chemistry. 84 (12), 5210-5215 (2012).
- Wang, G., Sun, W., Luo, Y., Fang, N. Resolving Rotational Motions of Nano-objects in Engineered Environments and Live Cells with Gold Nanorods and Differential Interference Contrast Microscopy. Journal of the American Chemical Society. 132 (46), 16417-16422 (2010).
- Kelly, K. L., Coronado, E., Zhao, L. L., Schatz, G. C. The Optical Properties of Metal Nanoparticles: The Influence of Size, Shape, and Dielectric Environment. The Journal of Physical Chemistry B. 107 (3), 668-677 (2003).
- Mulvaney, P. Not All That's Gold Does Glitter. MRS Bulletin. 26 (12), 1009-1014 (2012).
- Maier, S. A. . Plasmonics: Fundamentals and Applications. , (2007).
- Sun, W., Wang, G., Fang, N., Yeung, E. S. Wavelength-Dependent Differential Interference Contrast Microscopy: Selectively Imaging Nanoparticle Probes in Live Cells. Analytical Chemistry. 81 (22), 9203-9208 (2009).
- Cras, J. J., Rowe-Taitt, C. A., Nivens, D. A., Ligler, F. S. Comparison of chemical cleaning methods of glass in preparation for silanization. Biosensors and Bioelectronics. 14 (8), 683-688 (1999).
- Augspurger, A. E., Sun, X., Trewyn, B. G., Fang, N., Stender, A. S. Monitoring the Stimulated Uncapping Process of Gold-Capped Mesoporous Silica Nanoparticles. Analytical Chemistry. 90 (5), 3183-3188 (2018).
- Murphy, D. B., Davidson, M. W. Ch 2: Light and Color. Fundamentals of Light Microscopy and Electronic Imaging, Second Edition. , 21-33 (2012).
- Wayne, R. Ch 3: The Dependence of Image Formation on the Nature of Light. Light and Video Microscopy (Second Edition). , 43-78 (2014).
- Stender, A. S., Wei, X., Augspurger, A. E., Fang, N. Plasmonic Behavior of Single Gold Dumbbells and Simple Dumbbell Geometries. The Journal of Physical Chemistry C. 117 (31), 16195-16202 (2013).
- Hu, M., et al. Dark-field microscopy studies of single metal nanoparticles: understanding the factors that influence the linewidth of the localized surface plasmon resonance. Journal of Materials Chemistry. 18 (17), 1949-1960 (2008).
- Choo, P., et al. Wavelength-Dependent Differential Interference Contrast Inversion of Anisotropic Gold Nanoparticles. The Journal of Physical Chemistry C. 122 (47), 27024-27031 (2018).
- Funston, A. M., Novo, C., Davis, T. J., Mulvaney, P. Plasmon Coupling of Gold Nanorods at Short Distances and in Different Geometries. Nano Letters. 9 (4), 1651-1658 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。