Method Article
使用串行块面和聚焦的Ion光束扫描电子显微镜进行有针对性的研究
摘要
在这里,我们提出了一个协议,有效地结合串行块面和聚焦电束扫描电子显微镜的目标领域。这允许在三维中进行高效的搜索,并在大型视野中定位罕见事件。
摘要
该协议允许在电子显微镜的分辨率水平上对细胞或组织样本进行三维的高效成像。多年来,电子显微镜(EM)一直是一种固有的二维技术。随着串行扫描电子显微镜成像技术(体积 EM)的出现,使用集成的微原子或聚焦的电束进行切片,然后查看嵌入组织,第三个维度变得易于访问。串行块面扫描电子显微镜(SBF-SEM)使用塞姆室中封闭的超微体。它能够处理大型试样(1,000 μm x 1,000 μm)和以小 X、Y 像素大小拍摄大视场,但在 Z 尺寸时被金刚石刀限制。聚焦式水龙束SEM(FIB-SEM)不受3D分辨率的限制(±5nm的各向异性体素是可以实现的),但视野更为有限。该协议演示了将两种技术相结合的工作流,以允许在大型字段中查找感兴趣的单个区域 (ROI),然后以高同种体素分辨率成像后续目标体积。由于 SEM 成像中高效生成信号所需的额外对比度,因此对容量 EM 技术的准备要求更高。此类协议既耗时又耗费人力。该协议还集成了微波辅助组织处理,促进试剂的渗透,从而将处理协议所需的时间从几天缩短到数小时。
引言
该协议描述了一个工作流程,用于将高分辨率、三维电子显微镜 (EM) 有效地定位到特定感兴趣的区域 (ROI)。自 20 世纪 30 年代开始以来,EM 基本上是一种二维技术。首次公布的图像是整个组织或细胞的,但很快便让位于使用超微细胞手工切割的部分,并使用透射电子显微镜(TEM)成像。TEM 产生非常高分辨率的显微图,即使最小的细胞结构也清晰可见。然而,电子束成像组织所需的部分的薄度使得Z维度中的信息变得微乎其微。由于细胞是三维结构,细胞结构和细胞表面之间的相互作用必须从有限的数据中推断出来。这就增加了误解的可能性,特别是在复杂的结构中。一些显微镜通过序列分割细胞和组织获得了更准确的3D结构,然后从单个TEM图像1中艰难地重建它们。这是一个非常劳动密集型的过程,在数字成像和计算机渲染出现之前,结果也难以想象。近年来,已经引进了两种技术,它们统称为体积电子显微镜(体积EM)2,使三维的EM能够被更多的实验室访问。
从电子显微镜内的嵌入式模块中获取一叠图像的想法可以追溯到1981年,当时史蒂夫·莱顿和艾伦·库兹里安建造了一个微型微原子,并将其放置在扫描电子显微镜3(SBF-SEM)的腔室中。.23年后,登克和霍斯特曼4最终复制并改进了该原型,随后商业化。几乎在同一时间,生物科学家意识到另一种主要用于材料科学的技术,聚焦的子束。这种技术使用某种(氧化铝、等离子体)的电束从样品(FIB-SEM)5中去除非常少量的表面材料。这两种技术都采用切片术,然后是成像,可提供一系列可组合成 X、Y、Z 和堆栈的图像。这两种技术都提供 3D 信息,但分辨率不同。SBF-SEM 受金刚石刀的物理特性限制,可切割不超过 50 nm 的长串行成像运行;然而,可分割的样品块尺寸很大,高达1毫米x1毫米x1毫米。 由于后散射电子探测器(32k x 32k像素)的数字采集格式很大,因此从块面接收信号,图像像素大小可以小到 1 nm。这将导致非各向异性体素,其中 X,Y 尺寸通常小于 Z。由于孔束的精度,FIB-SEM 能够收集各向异性体素 +5 nm 的图像。但是,可以成像的总面积相当小。之前已发布使用这两种技术成像的各种示例和卷的摘要表。
体积EM的组织制备比标准TEM或SEM更难,因为样品必须染色才能在SEM中提供足够的信号生成。 通常,染色不仅需要针对特定的组织类型进行优化,还需要针对添加与某些细胞结构形成对比,使识别和重建更加容易。此处使用的协议基于 NCMIR 标准6。附加染色通常意味着额外的协议步骤。因此,对于体积EM,需要扩展标准协议,以确保试剂有足够的时间穿透样品。微波辅助处理可以将染色所需的时间从数小时缩短到几分钟,并使量EM样品制备更高效7。该方法适用于所有细胞和组织类型8,并研究组织不均匀性使特定区域取样所必需的问题9。
获得数据堆栈后,可以对齐,并将感兴趣的结构从其余数据分割,并在 3D 中建模。尽管成像许多组织切片的自动化使图像采集相对简单,但数据数字化重建和可视化的过程是一项耗时的任务。用于此目的的软件尚未集成或完全自动化。由于使用体积EM的早期工作大部分都针对神经科学,因此与其他细胞和细胞器相比,对斧头等结构进行染色和数字分段的技术相当先进。虽然关于其他非神经元组织的文献增长迅速,非线性或不规则结构需要更多的手动输入。
使用 SBF-SEM 和 FIB-SEM 是一种有用的方法,用于以高分辨率在 3D 中定位和成像特定的、非均匀的组织结构。结合微波辅助组织处理,大大减少了样品制备所需的时间。此工作流将使生成精细结构的高分辨率各向异性体素图像数据集成为一个高效和快速的过程。
研究方案
1. 电子显微镜的样品固定和处理
- 修复在琼脂板上生长的阿拉伯花皮幼苗,在0.5%的甲醛中生长,在0.1M磷酸盐缓冲液(PB)中使用2.5%的谷醛,在室温(RT)下2小时生长。
注意:醛具有刺激性和腐蚀性,具有致癌、诱变和致畸的潜力。所有解决方案都必须使用适当的防护设备并在烟气罩中处理。 - 切割在步骤1.1中生长的植物的根尖,并在0.5 mL管中放入2-3个尖头,在4°C下过夜,含有相同的固定剂。
注:此和其余步骤中的任何解决方案的体积由样本量决定;样本与溶液的最小比率为10:1。任何尺寸大于 1 mm 的样品都难以染色,因此处理较大的组织块会更加困难。并非所有组织都具有相同的特征;例如,植物叶子和茎可能难以染色。如果需要较大的样本或困难的组织类型,在继续收集数据之前,必须优化样品处理。 - 在步骤 1.7 之前准备需要新鲜且可用的硫碳水化合物 (TCH) 溶液。将0.1克硫碳水化合物加入10 mL的双蒸馏水(ddH2O),在烤箱中加热至60°C1小时溶解。使用前,使用0.22 μm注射器过滤器过滤TCH溶液。
- 从管中取出固定剂,用 0.1 M PB pH 6.8 更换。将管子以100rpm在轨道摇动台上,洗涤10分钟。使用新鲜的PBS重复洗涤5次。
- 用 2% 的四氧化二氮 (OsO4) 和 0.2% 的二氧化氮(0.1 M PB pH 6.8)替换 PB,从而固定根尖。将管子放在打开盖子的微波炉中,启动程序 9 (表 1)。
注意:在摄入时,Osmium 极其危险,吸入时非常危险,在皮肤接触时则非常危险。始终使用适当的防护设备并在烟气罩中处理。
注:在整个协议中,在微波步骤中,管盖始终打开。 - 用 ddH2O 洗涤根尖两次,每个在台面上 5 分钟。对于第三和第四ddH2O洗涤使用程序15上的微波炉(表1)。前 40 秒 ddH2O 洗涤后,从微波炉中抽取样品,用新鲜的 ddH2O 替换缓冲液。将样品放回微波炉中并继续程序。
注:当需要刷新缓冲液时,微波炉将发出警报。确保每次正确更换真空室的盖子。 - 在RT上孵育先前制备的TCH溶液样品2分钟,使用微波程序8(表1)进行进一步孵育。请勿在工作台和微波炉之间更换溶液。
- 如步骤 1.6 所述清洗样品。
- 将样品放入 1% OsO4 ddH2O 中的微波程序 9 (表 1)。
- 如步骤 1.6 所述清洗样品。
- 使用微波程序16(表1)在ddH2 O中孵育1%醋酸酯样品。
注意:醋酸尿酸是有毒的,是一种刺激物,具有致癌、诱变和致畸的潜能。始终使用适当的防护设备进行处理。 - 如步骤 1.6 所述清洗样品。
- 准备沃尔顿的铅解决方案,以便在步骤 1.14 中使用。首先,将0.998克L-阿斯巴酸加入250 mL的ddH2O,用1M KOH将pH调整为3.8,从而制作L-阿斯巴酸的库存溶液。接下来,在10 mL的L-阿斯巴酸原料溶液中溶解0.066克硝酸铅,并将pH型调整为5.5。将溶液放在60°C的烤箱中30分钟。
注:不应形成沉淀物。 - 在沃尔顿的铅溶液中孵育样品30分钟,在60°C的烤箱中孵育。
- 如步骤 1.6 所述清洗样品。
- 在 EtOH 中脱水样品的分级步骤为 50%、70%、90%,在 ddH2O 中,然后在 100% EtOH 中 2 倍。使用微波程序10(表1),微波将提示用户每40s更换解决方案与下一个EtOH步骤。这是微波中的最后一步。
- 在工作台上的RT处,在100%氧化丙烯中进一步脱水10分钟,更换台阶之间的溶液。
注:氧化丙烯可以溶解一些塑料,如聚苯乙烯;要么使用玻璃瓶进行此步骤,要么预测试塑料的电阻。
注意:氧化丙烯是高度易燃的。始终使用适当的防护设备并在烟气罩中处理。 - 通过在50%的热刺树脂中孵育丙烯氧化物(最小2小时),开始渗透根尖。
注意:喷剂的树脂成分是刺激物。始终使用适当的防护设备并在烟气罩中处理。 - 将溶液更换为 100% 喷刺,并在 RT 过夜。
- 2次更换为新鲜 100% 喷剂树脂(最小 2 h 孵育)。
- 将样品放入嵌入模具中,再次含有新鲜的 100% 喷剂树脂,并在 65°C 的烤箱中聚合 36–48 小时。
注:使用的嵌入模具取决于组织类型和用于成像的方法。在这里,使用了扁平硅胶嵌入模具 (图 1A)。
2. 准备嵌入式样品进行成像
- 从烤箱中取出样品,从嵌入模具中取出树脂(图1B)。
- 使用剃刀刀片,大致修剪样品到最大 0.5 毫米 x 0.5 毫米 x 0.5 毫米 (图 1C) 块。
注:为了防止在 SBF-SEM 中充电,必须尽可能修剪掉裸树脂,使样品尽可能平/薄。理想情况下,块的四面都包含组织,但最重要的是,将连接到金属销的一侧(参见步骤 2.3)必须包含暴露的组织,以便组织与导电金属直接接触。 - 从无关树脂中取出样品,并将其与导电环氧树脂(图1D)连接在金属销上,确保部分组织接触金属销。让环氧树脂在65°C的烤箱中过夜固化。
注:确保样品位于引脚中心,因为 SB-SEM 中的舞台移动有限。从多余的树脂中取出非常小的树脂包裹样品可能很困难,因为小样品在分离时有飞离的倾向。一个简单而有效的解决方案是用一片石蜡薄膜覆盖样品,如参考1的补充电影所示。 - 将托架固定在支架中,以进行超微体。使用剃刀刀片去除任何多余的环氧树脂,并使用超微体和钻石刀平滑表面和侧面的块,形成金字塔。确保至少部分组织已经暴露在块面上。
注: 使用金刚石刀的额外步骤是可选的,但它使生成的块更容易在 SBF-SEM 中接近,因为刀在块面上的阴影更清晰,因此可以更容易确定刀和块面之间的距离。 - 将修剪的样品块放入溅射涂层中,用薄层(2⁄5 nm)的铂金(Pt)涂覆样品。
注:在 SBF-SEM 中,块面上的铂金将被切割(见下文),但金字塔两侧的铂金将提供额外的导电性。在此示例中,样品涂有铂金,但黄金或金/铂也有效;然而,在成像过程中,涂上黄金会导致块面上的碎片增加。
3. SBF-SEM 中的成像
- 将托架插入 SBF-SEM 显微镜中,将刀靠近样品表面。使用金刚石刀修剪样品的上部,使Pt层已被移除,并且至少部分组织暴露。
注:由于每个 SBF-SEM 显微镜的此过程都不同,因此此处并未指定每个步骤。只要样品表面没有Pt并准备好成像,接下来的步骤就是可能的。 - 以低分辨率和较短的驻点时间开始成像,获取样本的概述并定位感兴趣的区域(图 1E)。
注:此处,512 x 512 像素和 1 μs 的放置时间用于快速扫描和定位舞台,2,000 x 2,000 像素的 1 μs 活动时间用于优化成像窗口和调整焦点。 - 在 80–100 pA 的电流下使用 1.5-2.0 kV 的加速电压,捕获组织的图像。
注:此处显示的示例是在高真空系统上拍摄的,其中光束电流需要调整以尽量减少充电,而充电非常依赖于样品。通常,电子束设置为 1.5±2.0 kV,但这与样品相关。在较高的放大倍率(通常为 10,000x)时,树脂受光束影响太大,无法保证平滑切片,因此通常像素大小设置为 8-20 nm,图像大小为 8,000~10,000 x 8,000~10,000 像素,相应的放大倍数为 430 |1,400x 和字段尺寸分别为 64 X 64 mm 和 200 x 200 mm。 - 确定感兴趣的区域,并使用背面散射电子探测器确定需要多少部分来覆盖兴趣量并开始成像运行。
注:此处介绍的示例中,以 10 nm 像素和 10,000 x 10,000 像素图像(驻点时间 1 μs)拍摄了 500 个 80 nm 的部分。显微镜设置为 1.6 kV 和 100 pA。通常,节数取决于样本和 ROI 的大小,并且连续节的样本数和大小可能从 100 s 到 1,000 s 不等。生成的数据集由每个部分的单个图像组成。这些图像需要转换为 3D 堆栈。
4. SBF-SEM数据处理
- 使用 Fiji,选择文件导入图像序列并查找图像堆栈以加载图像。根据数据集的大小,选中"使用虚拟堆栈"框。
注: 如果数据集确实很大,首先将其转换为 8 位(如果以 16 位收集),如有必要,将数据装箱,直到其大小可行。 - 使用图像底部的播放按钮滚动数据集以查看映像运行是否成功。检查 SBF-SEM 的典型成像伪像,例如从块面上从刀上掉下来的部分、在裸树脂区域充电、切割刀的人工制品(图像上的水平线)。
- 使用命令图像属性可调整运行期间使用的像素大小和体素深度(即节厚度)。如果数据已装箱,则考虑到这一点。
- 使用命令插件-注册-线性堆栈对齐与SIFT注册数据。
注:需要注册 SBF-SEM 数据,因为由于样品的充电或漂移,在成像过程中可能会有轻微的样品移动。由于这只是 XY 中最小的移动,因此只需要翻译。 - 通过滚动数据集检查对齐方式,如果确定使用文件菜单下的保存命令将对齐的数据集另存为 3D-tif 文件。
- 仔细分析数据集,查看是否包括 ROI,并包含生物问题所需的信息。在堆栈的最后一张图像(= 当前块面)上,为 FIB-SEM 成像选择新的 ROI。
注: 如果当前块面上不存在 FIB-SEM 成像的良好区域,则可以从块(仍在 SBF-SEM 中)剪切更多部分,直到出现 ROI。可以使用 FIB 成像的卷是有限制的。SBF-SEM 图像上的 ROI 最大为 X、Y,为 30-40 μm x 15-20 μm。
5. FIB-SEM 中的成像
- 在 SBF-SEM 中拍摄样品的概述图像,理想情况下包括样品的一个或多个边缘,然后在 FIB-SEM 中识别(图2A,C)。
注:在此示例中,SBF-SEM 概览图像以 10 nm 像素大小拍摄,在 1 μs 的驻点时间拍摄为 8,000 x 8,000 像素。显微镜仍设置为 1.6 kV 和 100 pA。 - 从 SBF-SEM 中取出样品,并放入溅射涂层中。在样品上涂上 ±20 nm 铂金,以便进行 FIB-SEM 成像。
- 将样品加载到FIB-SEM中,并使用15千伏的二次电子探测器,1 nA定位块面上SBF-SEM中识别的ROI(图2B,D)。
注:在 15 kV 下成像是看透铂涂层所必需的。 - 通过移动和倾斜舞台,将样品上的 ROI 引入 FIB 和 SEM 梁的巧合点(图 3A)。
注:FIB列通常安装在一个角度下(图3A)。这意味着任何样品都需要倾斜,以便要成像和分割的表面与 FIB 光束平行放置。现在,要成像的表面相对于 SEM 光束倾斜,在 SEM 能够成像 ROI 之前,需要移除组织沟槽(图 3E) - 使用FIB光束和气体喷射系统,在ROI以上的表面上沉积1毫米铂金保护层(图3C)。接下来,使用低铣电流(50-100 pA),将细线磨入铂沉积,在成像运行期间进行自动对焦和3D跟踪(图3D)。使用 FIB 柱和碳气体喷射器,用碳沉积覆盖这些管路。
注:此处的 ROI 大小对应于 SBF-SEM 映像上的 ROI 大小,因此最大大小可以是 30-40 μm x 15-20 μm。在此示例中,成像了 17 μm x 8 μm 的 ROI。需要碳沉积来保护生产线,并在碳和铂之间形成黑白对比,这是自动对焦的理想选择。用于每步的铣削电流见表2。 - 使用高铣削电流,在 ROI 前面铣削 30 μm 的沟槽,为 SEM 光束创建成像表面(图 3E)。
注:FIB光束具有固有的破坏性,在高电流下更是如此。确保将高电流成像保持在最小,在低放大倍率和快速扫描速度下保持图像,以避免在 ROI 时熔化树脂。 - 使成像表面平滑,使铣削电流更接近成像运行期间使用的电流。当所有自动对焦和 3D 跟踪标记在成像表面上清晰可见时停止抛光(图 3F)。FIB 的进度之后,可以使用 EM(使用背面散射电子探测器)在抛光时对表面进行成像。
- 确定要在新创建的曲面上成像的区域并设置成像参数。确保电子束聚焦在表面上,设置亮度和对比度,并设置像素大小和截面厚度。通过调整停机时间和线平均值,将成像时间保持在 1 分钟以下。
注: 使用低电压对电子束进行成像非常重要,以确保仅对模块的表面进行成像(即,没有来自样本深处的电子成像)。这是通过将电压保持在 2 kV 以下,并使用带网格电压的背散射电子探测器来实现的,因此仅允许对高能电子进行成像。在此示例中,电子束设置为 1.5 kV 和 1 nA,后散射电子探测器上的网格电压为 1.2 kV。此外,5 nm 的像素大小与 5nm 部分一起使用,从而产生具有各向异性体素的数据集。以6.5 μs的沉思时间和1.0的线平均值成像17μm x 10 μm的面积。 - 设置用于自动调整和 3D 跟踪的窗口,使用与成像相同的像素大小、停机时间和线平均值。
注: 此过程因系统而异,因此仅提及步骤,而不指定不同的操作。 - 在前 50 到 100 节中启动成像运行并监视过程的稳定性。一旦系统运行顺利,离开房间,并确保有尽可能少的干扰房间。
注: 运行持续时间和节数取决于 ROI 的大小和节厚度。在 FIB-SEM 中,Z 轴实际上是 SBF-SEM 图像上的 ROI 框的高度(最大 15~20 μm;图 3E. - 以与上述方式注册 FiB-SEM 数据,用于 SBF-SEM 数据。
结果
SBF-SEM 的图像提供了组织的概述,有助于深入了解细胞和细胞间连接的空间方向(图 4A)。后续的 FIB-SEM 成像对一个新区域(通常是在检查 SBF-SEM 运行后确定的感兴趣区域)增加了特定单元和/或结构的高分辨率细节(图 4B)。
图 4C,D显示了 SBF-SEM 数据(图 4C)和非各向异性体素 FIB-SEM 数据(图 4D)的非各向异性体素的呈现差异。SBF-SEM 中使用的 z 厚度表示渲染清楚地显示各部分,从而在表面上产生"楼梯"效果。在 FIB-SEM 数据中,5 nm 截面可确保渲染更加平滑,并且各个截面完全混合到曲面中。
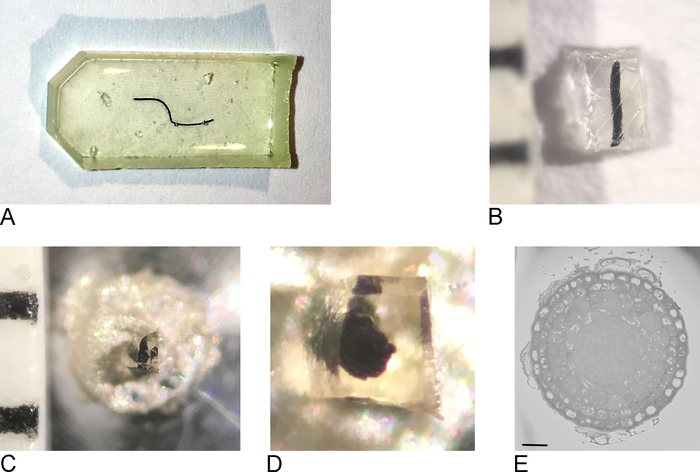
图1:从树脂嵌入样品创建块面。(A) 嵌入树脂的根尖.(B) 使用剃须刀将多余的树脂修剪掉,直到保留 0.5 mm2块。(C,D)修剪的块被粘在金属销上,在烤箱中过夜后,块的两侧被修剪,表面用钻石刀使用超微体平滑。(E) 在 SBF-SEM 内部,样品是定向的,以便识别块面和 ROI,比例条 = 20 μm。请点击此处查看此图的较大版本。
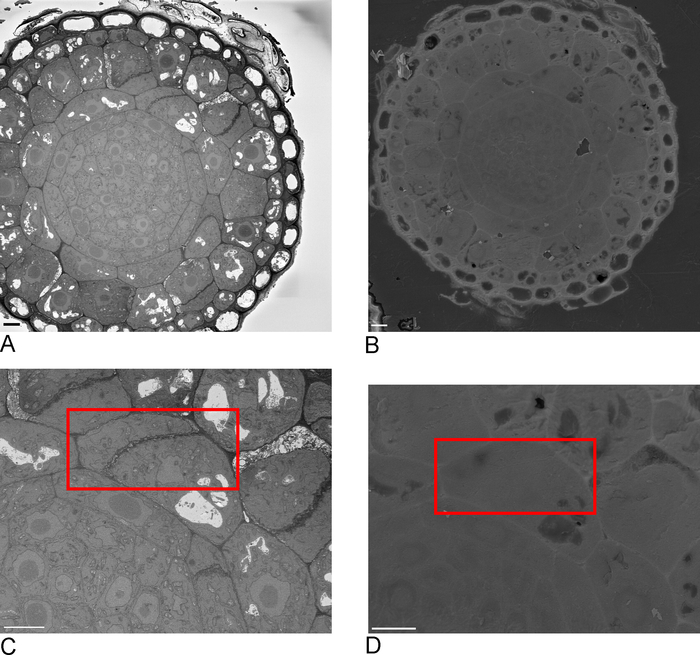
图2:SBF-SEM和FIB-SEM之间的相关性。使用 SBF-SEM (A) 和 FIB-SEM (B) 的块面概述图像, 刻度条 = 5 μm (C,D) 对 ROI 的缩放。红色框用FIB-SEM描绘要成像的区域,比例尺 = 5 μm。请点击此处查看此图的较大版本。
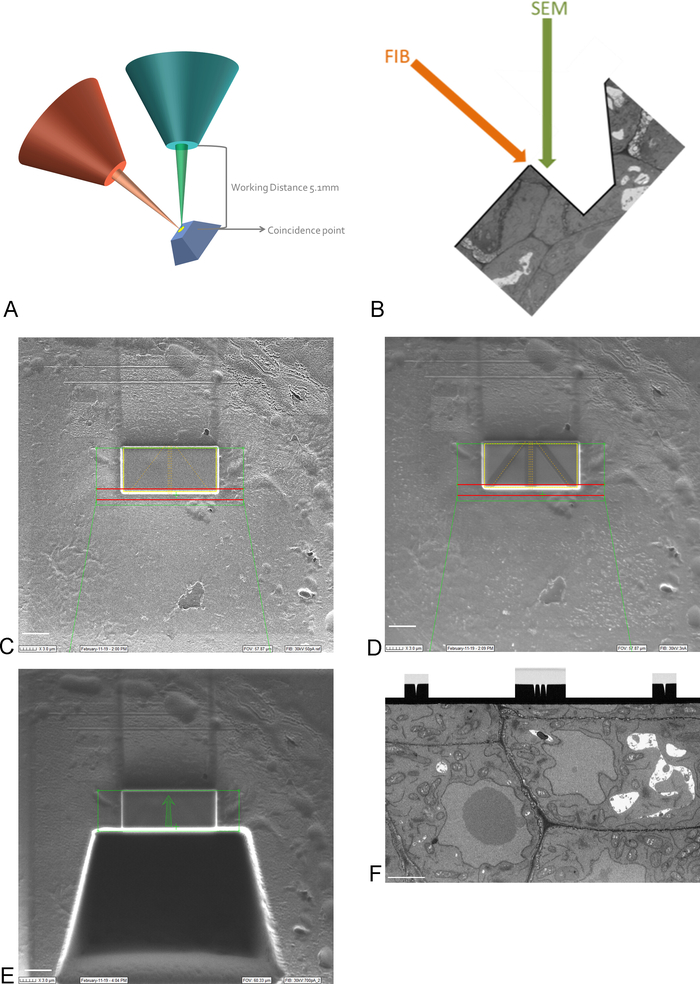
图3:FIB-SEM方案和准备步骤。(A) 显示FIB光束、SEM光束和样品方向的方案。样品需要定位到FIB和SEM光束的巧合点,以便能够在同一区域进行铣削和成像。(B) FIB 移除的截面的 SEM 成像所需的沟渠的原理图。(C) 使用 FIB 光束显示 ROI 上的白金沉积的图像,使用 FIB 光束拍摄的比例尺 5 μm (D) 图像,显示用于自动对焦和 3D 跟踪的线条。中间的线用于自动对焦,外线提供 3D 跟踪。线顶部的碳沉积提供执行这些任务所需的对比度(铂与碳),在挖沟后用FIB光束拍摄的刻度柱5μm(E)图像,刻度柱5μm(F)图像,SEM光束显示在FIB-SEM运行期间拍摄的感兴趣区域,比例尺2μm。请点击此处查看此图的较大版本。
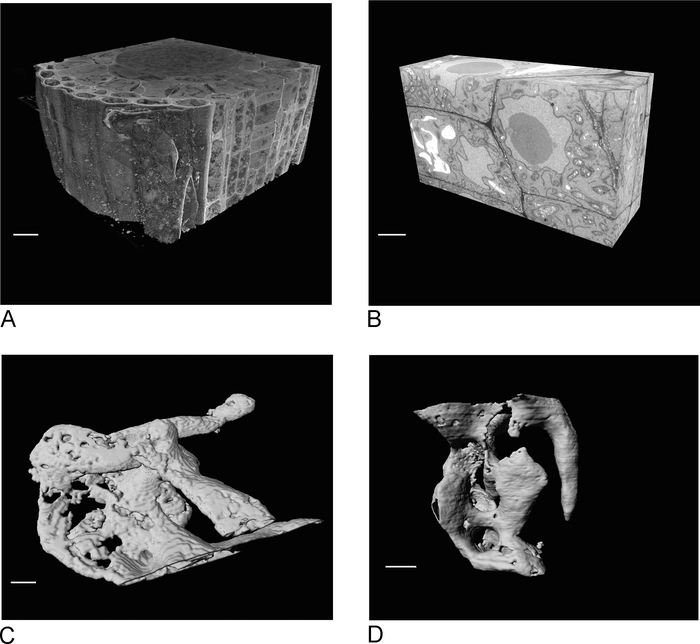
图 4:SBF-SEM 和 FIB-SEM 在分段前后的结果。(A) SBF-SEM 数据集的 3D 视图(100 x 100 x 40 μm,刻度条 = 10 μm),(B ) FIB-SEM 数据集的 3D 视图(17 x 10 x 5.4 μm,比例尺 = 2 μm),(C ) 通过阈值、刻度杆 = 2 μm D 的渲染颗粒分段的渲染真空从FIB-SEM数据中通过阈值,比例尺 = 2 μm。请点击此处查看此图的较大版本。
| 微波处理协议 | |||||||||
| 程序# | 描述 | 用户提示(开/关) | 时间(小时:分钟:秒) | 功率(瓦) | 温度 (°C) | 负载冷却器(关闭/自动/打开) | 真空/气泡泵(关闭/bubb/真空循环/真空打开/真空) | 稳定温度 | |
| 泵(开/关) | 温度 (°C) | ||||||||
| 8 | TCH | 关闭 | 0:01:00 | 150 | 50 | 关闭 | 真空循环 | 关于 | 30 |
| 关闭 | 0:01:00 | 0 | 50 | 关闭 | 真空循环 | 关于 | 30 | ||
| 关闭 | 0:01:00 | 150 | 50 | 关闭 | 真空循环 | 关于 | 30 | ||
| 9 | 锇 | 关闭 | 0:02:00 | 100 | 50 | 关闭 | 真空循环 | 关于 | 30 |
| 关闭 | 0:02:00 | 0 | 50 | 关闭 | 真空循环 | 关于 | 30 | ||
| 关闭 | 0:02:00 | 100 | 50 | 关闭 | 真空循环 | 关于 | 30 | ||
| 关闭 | 0:02:00 | 0 | 50 | 关闭 | 真空循环 | 关于 | 30 | ||
| 关闭 | 0:02:00 | 100 | 50 | 关闭 | 真空循环 | 关于 | 30 | ||
| 10 | 50% EtOH | 关于 | 0:00:40 | 150 | 50 | 关闭 | 关闭 | 关于 | 30 |
| 70% EtOH | 关于 | 0:00:40 | 150 | 50 | 关闭 | 关闭 | 关于 | 30 | |
| 90% EtOH | 关于 | 0:00:40 | 150 | 50 | 关闭 | 关闭 | 关于 | 30 | |
| 100% EtOH | 关于 | 0:00:40 | 150 | 50 | 关闭 | 关闭 | 关于 | 30 | |
| 100% EtOH | 关于 | 0:00:40 | 150 | 50 | 关闭 | 关闭 | 关于 | 30 | |
| 15 | 0.1M 卡科迪 | 关于 | 0:00:40 | 250 | 50 | 关闭 | 真空循环 | 关于 | 30 |
| 0.1M 卡科迪 | 关于 | 0:00:40 | 250 | 50 | 关闭 | 真空循环 | 关于 | 30 | |
| 15 | ddH2O | 关于 | 0:00:40 | 250 | 50 | 关闭 | 真空循环 | 关于 | 30 |
| ddH2O | 关于 | 0:00:40 | 250 | 50 | 关闭 | 真空循环 | 关于 | 30 | |
| 16 | 乌兰尔醋酸盐 | 关闭 | 0:01:00 | 150 | 50 | 关闭 | 真空循环 | 关于 | 30 |
| 关闭 | 0:01:00 | 0 | 50 | 关闭 | 真空循环 | 关于 | 30 | ||
| 关闭 | 0:01:00 | 150 | 50 | 关闭 | 真空循环 | 关于 | 30 | ||
| 关闭 | 0:01:00 | 0 | 50 | 关闭 | 真空循环 | 关于 | 30 | ||
| 关闭 | 0:01:00 | 150 | 50 | 关闭 | 真空循环 | 关于 | 30 | ||
| 关闭 | 0:01:00 | 0 | 50 | 关闭 | 真空循环 | 关于 | 30 | ||
| 关闭 | 0:01:00 | 150 | 50 | 关闭 | 真空循环 | 关于 | 30 | ||
表 1.微波处理的详细协议。
| 步 | 当前 | 估计时间 |
| 沉积铂金 | 3n A | 10-15分钟 |
| 铣削自动调谐和跟踪标记 | 50-100 pA | 4-6分钟 |
| 沉积碳 | 3 nA | 5-10分钟 |
| 铣削粗沟 | 15-30 nA | 30-50 分钟 |
| 抛光表面 | 1.5-3 nA | 15-20 分钟 |
| 映像运行 | 700 pA-1.5 nA | 小时-天 |
表2.用于样品制备和成像运行的FIB铣削电流
讨论
体积电子显微镜比传统的SEM或TEM更具挑战性和耗时。由于需要将组织或细胞染色,处理步骤必须足够长,以确保试剂在整个样品中渗透。使用微波能量促进渗透,可缩短处理时间,提高处理效率,并改善染色。因为EM的制备比光显微镜的制备要严格得多,所有溶液和试剂都必须严格质量控制。pH、可恢复性、不纯试剂的使用以及由于技术落后而引入污染物的变化,都可能对最终图像产生有害影响。
卷 EM 还需要针对每种不同样本类型定制协议。不同类型的哺乳动物组织:植物、单细胞如酵母、锥体、C. elegans等,都需要它们自己的变异来达到最佳效果。固定和染色的设计必须保持结构完整性,并保持样品尽可能接近其体内形态。在生理温度、pH值和耐食性下固定组织对于使样品尽可能栩栩如生至关重要。样品的高压冷冻(HPF)可能有助于保持更逼生的情况(或可能只是产生不同的伪影),但对于细胞和非常薄的组织HPF将失败,因为冰冰只能产生小体积。因此,对于许多问题,化学固定是唯一的选择。无论固定是 HPF 还是化学,在任何 EM 实验中,结构结果都需要与活细胞或组织成像的类似结果进行仔细比较,以查看它们是否一致。在考虑需要回答的具体问题和用于数字图像可视化的协议时,还必须优化染色。
在许多实验中,将 SBF-SEM 和 FIB 系统都靠近是一个很大的优势。SBF-SEM 的大视野和高 X、Y 分辨率使查找单个结构/细胞/事件变得简单明了,并提供了组织中细胞的整体空间方向。此外,它允许通过Z中的样品进行成像的能力非常强大;但是,由于它生成的非各向异性体素,需要精细几何细节的重建可能会失败或使用此技术产生伪影。FIB 受过程物理特性的限制,但其 3D 分辨率足以进行非常精确的重建。结合这两种技术非常简单,因为样品无需进一步处理或准备即可从 SBF-SEM 移动到 FIB。我们承认,使用 SBF-SEM 搜索样本以查找特定区域是使用功能更精的一种工具的非常昂贵。但是,能够立即查看新的块面并确定是否达到了 ROI 是一个很大的优势。此外,使用串行半薄 (0.5 μm) LM 截面的替代方法可以在检测到小结构之前将其移除,并使用必须切割的单 TEM 截面检查块,将其放在网格上,然后在同样昂贵的 TEM 中查看,这与高效的方法。
由于存在许多程序来对数据进行分段和呈现,并且单个应用程序可能无法最好地满足给定结构的需求,因此无法提出标准工作流。如果某些简单结构属于非常狭窄的灰度值,则可以使用阈值算法进行分割。神经元结构可以使用 Ilastik11等程序半自动分段,但它在更随机或复杂形状的细胞器(如 ER)上用处较少。显微镜图像浏览器是一个非常灵活的程序,可以对齐,分段和渲染卷EM数据,但需要大量的用户交互12。一般来说,数字可视化结果所需的时间将大大超过准备样本和成像的时间。
卷 EM 技术为超结构分析开辟了第三个维度。获得 3D EM 的其他方法在体积(TEM 断层扫描)或效率(串行部分 TEM)方面有限制。尽管大部分数量 EM 技术过于复杂且成本高昂,无法在单个实验室中实施,但提供这些技术的共享核心设施数量一直在增长,成功成像的样本类型数量也迅速增加。对于那些有一个特定问题和一个特定的组织,它很可能有人将能够提供建议和说明,其准备和成像。可以改进容量 EM 设备,以包括处理 SBF-SEM 中较大样品的能力,以及使用 FIB 铣削较大 ROIs 的能力。能够以更自动化的方式分段感兴趣的结构的软件将大大简化数据分析的过程,而计算速度的改进将缩短这样做所需的时间。尽管存在当前的限制,卷 EM 仍然是一个有用的工具,将 SBF-SEM 和 FIB-SEM 相结合提供了一个高效的工作流,用于识别罕见事件并以高分辨率成像它们。
披露声明
作者没有什么可透露的。
致谢
用于量EM的设备由佛兰德斯政府慷慨赠款提供。
材料
| Name | Company | Catalog Number | Comments |
| 3View 2XP | Gatan | NA | In chamber ultramicrotome for SBFI |
| Cacodylate buffer 0.2M solution | EM Sciences | 11652 | |
| Conductive epoxy resin (circuit works) | RS components | 496-265 | |
| Diatome Histo 4.0mm diamond knife | EM Sciences | 40-HIS | |
| Digitizing tablet | Wacom | DTV-1200W | No longer available |
| Eppendorf tubes | Eppendorf | 0030 120.094 | |
| Flat Embedding Mold | EM Sciences | 70900 | |
| Gluteraldehyde 25% solution | EM Sciences | 16220 | |
| High MW Weight Tannic Acid | EM Sciences | 21700 | |
| Lead Citrate | Sigma-Aldrich | 22861 | |
| NaCl | Sigma-Aldrich | 746398 | |
| Osmium Tetroxide 4% solution | EM Sciences | 19170 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Pelco Biowave Pro + | Ted Pella | 36700 | |
| Potassium Ferrocyanide | Sigma-Aldrich | P3289 | |
| Quorum Q150T ES sputter coater | Quorum Technologies | 27645 | |
| Reichert-Jung Ultracut ultramicrotome | NA | NA | No longer available |
| Sodium Cacodylate 0.2M | EM Sciences | 11653 | |
| Spurrs Resin kit | EM Sciences | 14300 | |
| Uranyl Acetate | EM Sciences | 22400 |
参考文献
- Linberg, K. A., Fisher, S. K. An ultrastructural study of interplexiform cell synapses in the human retina. Journal of Comparative Neurology. 243, 561-576 (1986).
- Peddie, C. J., Collinson, L. M. Exploring the third dimension: volume electron microscopy comes of age. Micron. 61, 9-19 (2014).
- Leighton, S. SEM images of block faces, cut by a miniature microtome within the SEM – A technical note. Scanning Electron Microscopy. (pt 2), 71-76 (1981).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three dimensional tissue nanostructure. PLoS Biology. 11, 329 (2004).
- Heymann, J. A., Hayles, M., Gestmann, I., Giannuzzi, L. A., Lich, B., Subramaniam, S. Site specific 3D imaging of cells and tissues with a dual beam microscope. Journal of Structural Biology. 155 (1), 63-73 (2006).
- . NCMIR Methods for 3D EM: A new protocol for preparation of biological specimens for serial block face scanning electron microscopy. V7_01_10 Available from: https://ncmir.ucsd.edu/sbem-protocol (2019)
- Giberson, R. T., Austin, R. L., Charlesworth, J., Adamson, G., Herrera, G. A. Microwave and digital imaging technology reduce turnaround times for diagnostic electron microscopy. Ultrastructural Pathology. 27 (3), 187-196 (2003).
- Kremer, A., et al. Developing 3D EM in a broad biological context. Journal of Microscopy. 259 (2), 80-96 (2015).
- Vanslembrouck, B., Kremer, A., Pavie, B., van Roy, F., Lippens, S., van Hengel, J. Three-dimensional reconstruction of the intercalated disc including the intercellular junctions by applying volume scanning electron microscopy. Journal of Histochemistry and Cell Biology. 149, 479-490 (2018).
- Russel, M. R., et al. 3D correlative light and electron microscopy of cultured cells using serial blockface scanning electron microscopy. Journal of Cell Science. 130 (1), 278-291 (2017).
- Sommer, C., Strähle, C., Köthe, U., Hamprecht, F. A. ilastik: Interactive Learning and Segmentation Toolkit. Eighth IEEE International Symposium on Biomedical Imaging (ISBI). Proceedings. , 230-233 (2011).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy Image Browser: A Platform for Segmentation and Analysis of Multidimensional Datasets. PLoS Biology. 14 (1), e1002340 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。