Method Article
多发性硬化患者综合解剖计划
* 这些作者具有相同的贡献
摘要
多发性硬化症是一种炎症性脱骨髓疾病,没有治愈的方法。脑组织分析为了解疾病的发病机制提供了重要线索。在这里,我们讨论在克利夫兰诊所运行中通过独特的快速解剖程序收集的MS脑组织的方法和下游分析。
摘要
我们描述了一个针对多发性硬化症(MS)患者的快速组织捐赠计划,该计划要求科学家和技术人员每年365天24小时待命。参与者同意捐献他们的大脑和脊髓。克利夫兰梅伦MS治疗和研究中心的神经学家随后对大多数患者进行了跟踪。他们的临床课程和神经残疾是良好的特征。死亡后不久,尸体被运送到MS成像中心,在那里通过3T磁共振成像(MRI)对大脑进行原位扫描。尸体随后被转移到验尸室,在那里大脑和脊髓被切除。大脑被分成两个半球。一个半球立即放在一个切片盒中,交替的1厘米厚的切片要么固定在4%的甲醛中两天,要么迅速冻结在干冰和2-甲基丁烷中。短固定脑切片储存在冷冻保存溶液中,用于组织学分析和敏感抗原的免疫细胞化学检测。冷冻切片储存在-80°C,用于分子、免疫细胞化学和原位杂交/RNA范围研究。另一半球被置于4%的甲醛中几个月,放在切片盒中,在3T磁共振(MR)扫描仪中重新扫描,并切成厘米厚的切片。原位MR图像(MRI)与1厘米厚的脑切片共同注册,以促进MRI-病理学相关性。所有脑切片都得到拍摄,大脑白质病变被识别。脊髓被切成2厘米的段。备用段固定在4%的甲醛或快速冻结。死后MS组织的快速采购允许MS大脑和脊髓的病理和分子分析以及脑MRI异常的病理相关性。这些快速处理的验尸组织的质量(通常在死亡6小时内)对MS研究具有极大的价值,并导致了许多高影响力的发现。
引言
研究疾病的最好方法之一是检查病变组织本身。这给研究中枢神经系统疾病(CNS)的人带来了挑战。患病的大脑和脊髓的活检极为罕见,通常涉及非典型病例。近年来,患有中枢神经系统疾病的个人的验尸率已大幅下降,在进行时,他们往往不能快速采购组织。这些挑战导致建立了以疾病为中心的脑库,包括几个侧重于从多发性硬化症(MS)患者那里收集组织。MS 是一种炎症介导的中枢神经系统疾病,破坏骨髓素、寡核苷酸(骨髓形成细胞)、神经元和斧子。大多数MS患者有双相病过程,开始与神经残疾与可变恢复,最终演变为一种渐进的疾病,可能是神经退行性的性质1。对于大多数捐赠的MS大脑,死亡和组织处理之间的验尸间隔(PMI)超过24小时。虽然这些组织提供了关于MS大脑病理变化的宝贵信息,但它们并不适合更高级的分子研究,这些研究可以为疾病病理生理学提供强有力的见解。基因分析研究尤其如此,需要完整的RNA。
为了克服上述限制,我们开发了一个快速组织捐赠计划,允许MRI/病理相关性。该协议提供了适合现代分子研究的保存良好的组织,并允许直接比较MS大脑中的大脑病理学和MRI异常。克利夫兰诊所多发性硬化组织捐赠计划已经存在了20多年。这个快速的组织捐赠计划从患有MS和其他相关自身免疫性神经系统疾病的个人获得大脑和脊髓。该计划旨在在死亡6小时内获得原位核磁共振成像,然后切除大脑和脊髓进行组织处理。
招聘
捐赠是通过直接从患者(事先同意)或死后从近亲获得的预验尸同意获得的。在俄亥俄州克利夫兰的梅伦多发性硬化治疗和研究中心,通常从临床人群中确定预先同意的患者。虽然在快速组织捐赠计划招募中优先考虑在纵向研究方面一直遵循的患者,但它对所有在中心看到的患者开放。死亡前登记的参与者被指示家庭成员或护理提供者在死亡时或死亡迫在眉睫时与研究小组联系。个人进入组织捐赠计划的第二种方法是在死亡时经近亲同意。俄亥俄州要求将死亡报告提交联邦授权的器官采购组织LifeBanc,该组织在俄亥俄州东北部的20个县开展业务。LifeBanc 对所有死亡进行筛选,以诊断 MS,这是器官捐赠的排除。LifeBanc 已做出安排,通知 MS 组织捐赠计划的调查人员所有死亡,并在克利夫兰诊所方圆 75 英里范围内进行 MS 相关诊断。然后,组织捐赠计划工作人员与近亲和医院工作人员联系,并征得捐赠大脑和脊髓组织的同意。这两种通过LifeBanc进行预验尸和验尸的方法每年导致大约10-12次脑捐献。调整死亡年龄上限,以管理从LifeBanc获得的转诊数量。
采购捐款
该计划要求24小时覆盖,每年365天由组织捐赠计划的成员组织采购。覆盖组织捐赠的临床团队使用集中组织捐赠通知电子邮件/寻呼机/移动设备文本通知系统。LifeBanc 提供电话,以便与组织捐赠计划的随叫随到人员联系。医院提供者/近亲(事先同意)或 LifeBanc 和其他转诊来源将会员告知死亡。首先,确定死亡时间和组织捐赠的可行性。然后对死亡进行筛查,以确定可能导致组织质量差的情况,包括长期的验尸前缺氧、大量破坏性脑组织(例如,颅内大出血、广泛的双半球中风、广泛的肿瘤负担),延长呼吸机支持(>3天),以及长时间使用血管活性剂(>3天)死亡前。当一名法医介入死亡时,研究神经学家可以与医学检验员交谈,探索一种在不损害验尸官责任的情况下及时接收组织的方法。如果认为有活的组织存在,则获得书面同意(如果未获得验尸前),并为身体运输做好准备。然后联系先前签约的死者运输服务,以便运送到克利夫兰诊所的 MRI 设施。注意确保身体保持在室温下,并且不会放入冷藏中,因为较低的体温与 MRI 信号特性的变化相关。
临床病史
临床病史包括MS诊断、症状发作、所用治疗、临床和准临床检测结果(诱发电位、脑脊液结果、光学一致性断层扫描)、多发性硬化症功能复合,和扩大残疾状况表(EDSS;实际或估计),从病历(如有)收集,并直接与近亲面谈。还会收集验尸前 MRI。
研究方案
该协议已获得克利夫兰诊所机构审查委员会的批准,并遵循克利夫兰诊所人类研究伦理委员会的指导方针。
1. 原位核磁共振成像
- 将供体带到 MRI 套件,并在 MS 成像设施进行 2 h MRI 成像协议。在 3 T 或 7 T 成像仪上进行 MRI。
注:由于大多数遗留数据已在 3 T 上执行,因此优先处理 3T,但不可用时,使用 7T 进行成像。指定的核心序列对所有病例执行(表1),如果时间允许,则执行依赖于当前研究兴趣的其他序列(在死亡后不到12小时实现组织固定的限制)。表 1描述了核心序列。
2. 尸体解剖
注:在原位 MRI 之后,通过实验室成员进行分片和组织处理,将身体运送到停尸房进行大脑和脊髓提取。
- 在身体抵达停尸房之前,执行以下步骤。两小时前,准备3L的4%甲醛(PFA),并标记容器和袋子用于组织储存。准备 3 L 8% PFA 和稀释 1.5 L 8% PFA 到 4% PFA。将剩余的 8% PFA 置于 4°C 中,以进行第 2 天的工作。
- 在前往停尸房之前,将 2 个旅行冷却器加注至 50% 的容量,并加盖干冰(大块碎以适合和小颗粒)。
- 在停尸房,将不锈钢容器半填入2-甲基丁烷和干冰,并盖上盖子,准备快速冻结组织。
- 称量并拍摄被压片移除后的大脑。
- 将任何附加的杜拉放入装满 PFA 的容器中。
- 将小脑和脑干从脑中分离,并拍摄大脑。
- 识别视神经、气管和片,并使用探头和钳子进行分离。用手术刀切除结构。
注:使用希金斯墨水进行识别,标记视神经一侧的远端段。 - 纵向分离大脑半球,并单独拍摄每个半球。
- 将主要运动皮层 (PMC) 用于左半球,重新拍摄,并将其放入 3.3 L 容器中进行长期固定。记录大脑固定的开始时间。
- 右半球的 PMC 可以墨迹或切除。
- 如果被切除,首先去除覆盖的脑膜炎。
- 重新拍摄已墨迹或已切除的 PMC。
- 如果去除 PMC,则切成 6 个大小相等的部分。
- 墨水每个部分的玫瑰色方面。
- 将奇数部分放入 PFA 填充容器中进行短路固定。
- 将偶数部分扣住,放入密封的冷冻袋中,放入冷藏#1。
- 将右半球前半部分切成1厘米厚的日冕部分。
- 记录严重异常(例如,切割工件、出血和病变)。
- 将奇数部分放入装有 PFA 的容器中,以便进行短期固定。
- 捕捉冻结偶数部分,并放置在密封的冷冻袋中。
- 记录大脑固定时间的结束。
- 将脑干从小脑中分离出来,放入充满 PFA 的容器中进行短固定。
- 纵向分开小球。
- 将每个半球切成4个同样厚的囊中部分。
- 照片中视图和横向视图。
- 将左半球片放入装有PFA的容器中,以便进行短期固定。
- 捕捉冷冻右半球片,放入密封的冷冻袋中放入较冷的#1。
- 从压片中获取具有神经根的脊髓。
- 取出脊髓杜拉母体,并将杜拉储存在装有PFA的容器中。
- 分离左和右前神经根和后神经根。从脊髓切开左前部和后神经根,并放置在PFA填充容器中进行短固定。
- 从脊髓中切下右前神经根和后神经根,扣住,放入密封的冷冻袋中,然后放入较冷的#2。
- 拍摄脊髓最长20厘米的牛。记录腰部增大的位置。
- 切割 2 厘米的线横向部分从牛到罗斯尔。
- 墨水每个切割截面的玫瑰面。
- 将奇数部分放入装有 PFA 的容器中,以便进行短期固定。
- 捕捉冻结偶数部分,放入密封的冷冻袋中,然后放入较冷的#2。
- 记录脊髓固定的开始时间和任何严重异常。
- 拍摄脊髓的剩余玫瑰部分。
- 记录宫颈增大的位置。对于剩余的脊髓,请按照步骤 2.13.5_2.13.8 操作。
- 在停尸房后,将冷冻组织放入 -80 °C 冰柜中标记的包装盒中。将固定组织储存在4°C。
- 在24小时后验尸(第2天)稀释剩余的8%PFA到4%。
- 将 4% PFA 更换至固定容器中的 4% PFA,并更换为新稀释的 4% PFA。
- 在60h后,在4%PFA中制备2.5%谷醛的溶液,从谷氨酸、PFA、dH2O和索伦森的缓冲液中制备(通过按顺序混合制备:0.2M磷酸盐缓冲液pH 7.4,聚氯丙酮1%w/v,蔗糖30%w/v,和乙二醇30% v/v)。
- 从短路容器中取出用过的 4% PFA。
- 在索伦森的缓冲液中冲洗组织,并将其放入冷冻保护溶液中(甘油20%,0.4M索伦森的缓冲液20%,dH2O中的0.02%阿齐德钠)。
- 拍摄短固定脑切片、小脑、脑干和运动皮层(如适用)。
- 用手术刀从每个2厘米短固定脊髓部分切割2毫米厚的横截面。
- 将部分放入2 mL闪烁小瓶中,并在4%PFA中填充2.5%谷醛溶液。
- 将剩余部分返回到原来的 20 mL 闪烁小瓶。用索伦森的缓冲液冲洗部分,用冷冻保护溶液替换。
3. 病理学
注:右半球的短固定切片以及长固定的左半球(在 4% PFA 中放置数月)要么被切成 30 μm 部分(称为自由浮动),要么嵌入石蜡中,切成 12-14 μm 部分(称为石蜡嵌入)。这些部分通常使用蛋白脂蛋白 (PLP) 进行处理,用于检测脱骨髓病变和主要组织相容性复合物 II (MHC-II), 使用二氨基苯甲酸 (DAB) 方法进行免疫活动。这些协议已经标准化,并在几份出版物中使用2,3,4,5,6,7,8,9,10,11,12.
-
自由浮动 (30 μm) DAB-Avidin-生物体复合物 (ABC) 组织染色
- 从冷冻储存溶液中取出部分,将截面转移到六孔板,并在 2 mL 的 1x 磷酸盐缓冲盐水 pH 7.0 (PBS ) 中每层清洗 3 次 5 分钟。当转移到下一口井在六井板使用小心不要撕裂组织。在每个洗涤和孵育步骤中,将六孔板放在摇摇器上,让组织轻轻摇动。
注:以较小的体积和较大的板(即 12 孔和 24 孔板)孵育的组织部分往往表现出表面和边缘撕裂。 - 在玻璃烧杯中通过微摇部分执行抗原检索,该杯中含有约 30 mL 的 10 mM 酸盐缓冲液 (pH 6.0)。确保组织不折叠,使用画笔和微波部分操作2-3分钟或直到锡酸盐缓冲液开始沸腾。允许部分冷却至室温(约 20 分钟)。
- 将部分移回六孔板,在 PBS/0.3% Triton X-100 的 2 mL 中各清洗 3x 部分 5 分钟。在室温(RT)下,在2 mL的3%H2 O2/0.3% Triton X-100/PBS中孵育截育部分,30分钟。C组内源性过氧化物酶。
- 在 PBS/0.3% Triton X-100 的 2 mL 中,将部分清洗 3 倍,每次 5 分钟。块部分在2 mL的3%正常山羊血清/0.3% Triton X-100/1x PBS为1小时在RT。
- 在针对微胶质和骨髓表的初级抗体中孵育一夜之间至5天(取决于抗体),以检测4°C的炎症(MHCII)和脱骨髓(PLP)(见材料表)。
注:在此步骤或后续步骤中孵育时,确保各部分不会折叠,因为这将导致部分内区域没有污渍。 - 在 1x PBS 的 2 mL 中,将部分清洗 3 倍,每次 5 分钟。然后在次生生物异化抗体(见材料表)中孵育部分1小时,在RT.在孵育期间制备Avidin-Biotin复合物(ABC)溶液,在下一个洗涤步骤之前大约45分钟,使ABC复合物形成。
- 在 1x PBS 的 2 mL 中,将部分清洗 3 倍,每次 5 分钟。然后在 ABC 中孵育部分 1 小时,在 RT 上孵育。
- 在 2 mL 的 1x PBS 中清洗部分,每次 5 分钟。在过滤后 DAB 中孵育部分(2 mL/井/节),包含 H2O 2(DAB 中 30% H2O2的 1:500 稀释),直到颜色充分发展(±3~8 分钟)。
- 在 1x PBS 的 2 mL 中,将部分清洗 3 倍,每次 5 分钟。要增强信号(可选),请使用 0.04% OsO4 (±30 s) 进行渗透。
- 在 1x PBS 中,洗涤部分三次,每次 5 分钟。分别将每个部分从六孔板转移到一个装满 1x PBS 的小容器中,并将组织部分放置在尽可能平坦的玻璃幻灯片上。
- 轻轻地将滑轨从 PBS 中提起,同时确保组织部分尽可能平坦。使用两个油漆刷,轻轻地平展和拉伸滑道上的组织,并用纸巾擦去多余的水。使用甘油(或等效的安装介质)安装组织部分,用透明指甲油密封盖玻片。
- 从冷冻储存溶液中取出部分,将截面转移到六孔板,并在 2 mL 的 1x 磷酸盐缓冲盐水 pH 7.0 (PBS ) 中每层清洗 3 次 5 分钟。当转移到下一口井在六井板使用小心不要撕裂组织。在每个洗涤和孵育步骤中,将六孔板放在摇摇器上,让组织轻轻摇动。
4. 石蜡嵌入的半球部分:DAB 染色
- 在 60°C 烤箱中将石蜡从滑轨上熔化 5~10 分钟。
- 通过在二甲苯中孵育3倍,每个半部分脱石化各5分钟。
- 在分级乙醇中补充水合组织,每次100%(2次,每次5分钟),95%(2倍5分钟),70%(2次,每次5分钟),50%(1次,每次5分钟)。在 PBS 中盖上幻灯片。
- 在 10 mM 酸盐缓冲液 (pH 6.0) 的烧杯中通过微摇滑块回收抗原。
- 在 1x PBS 中清洗幻灯片(每次 3 次,每次 5 分钟)一旦冷却到室温。通过孵育组织在3%H2O2/1% Triton-X 100/PBS 中孵育组织30分钟,阻断内源性过氧化物酶。
- 在 1x PBS 中清洗组织三次,每次 5 分钟。在PBS中用6%正常山羊血清块状组织1小时。
- 在室温 (RT) 下在 PBS 中孵育原抗体部分(见材料表)过夜(最大 20 小时)。
- 在 1x PBS 中,将部分洗涤 3 次,每次 5 分钟。然后在PBS中孵育相应二级抗体(见材料表)的各部分,在RT处孵育1小时。
- 在孵育过程中,在下一个洗涤步骤之前大约45分钟准备ABC溶液。
- 在 1x PBS 中每洗3次5分钟,然后在ABC中孵育1小时在RT。
- 在 1x PBS 中,将部分 3x 每部洗涤 5 分钟。
- 在过滤后(0.45 μm 滤孔大小)中孵育部分,DAB 包含 H2O 2(DAB 中 30% H2O2的 1:500 稀释),直到颜色充分发展(±3-8 分钟)。
- 在 1x PBS 中洗涤部分(3x 5 min)。为了增强信号,使用0.04%的四氧化二氮(OsO4;约30s)进行渗透。
- 在 1x PBS 中洗涤部分(3x 5min)。
- 在分级系列的乙醇 50%(1x 5min),70% (1x 5min), 95% (2x 5min), 100% (2x 5 分钟) 和 100% 二甲苯 (1x 5 分钟) 脱水组织。让二甲苯蒸发。
- 使用基于苯的快速干式安装介质安装部分。建议使用含有抗氧化剂的配方,以防止污渍漂白。使用剃刀从滑动边缘移除多余的安装介质,以便后续存储。
5. MRI/病理学相关性
注:为了将 MRI 与病理学关联,我们首先在可调节的框中执行长固定完整脑半球(上文步骤 2.9)的外体 MRI,带有 MRI 可见标记,指示切片槽。然后,我们切片大脑,并拍摄1厘米切片,使原位核磁共振成像(MRIs)与单个脑切片共同注册。然后,我们可以执行 MRI 引导分析,在 MRI 上识别感兴趣的区域 (ROI), 以指导组织分析。我们也可以进行组织病理学指导分析,在组织上识别ROI(例如,白质病变、无脱骨髓的白质等),然后以共同局部MRI测量(表1)为特征。
-
基于 MRI 的 ROI 识别
注:在以前的研究中,我们确定了白质11、12、13、14、15和灰质16、17的ROIs。 18.以下例子用于白质分析。- 对原位核磁共振成像(从步骤1.1开始)进行T2超强病变,最初由自动算法处理,然后由有经验的用户手动纠正。
- T2病变内的T1低强度病变作为体素,其信号强度小于或等于周围正常脑组织信号强度的80%。
- 磁化传输比 (MTR) 映射中的段低强度区域具有 80% 阈值。
- 使用上述分段创建三种分类:(a) T2 加权/FLAIR 扫描在 T2 加权/FLAIR 扫描中异常但 T1 加权或 MTR 扫描正常,(b) T2T1MTR 病变,在所有 T2 加权/FLAIR、T1 加权和 MTR 扫描中均异常;和 (c) 正常出现的白色物质 (NAWM),在所有 T2 加权/FLAIR、T1 加权和 MTR 扫描中均正常。
注:我们选择切片的依据是同一切片上所有三个感兴趣区域类型(仅限 T2、T2T1MTR 和 NAWM)。 - 计算每个 ROI 的标准化强度,以尽量减少由不同的大脑和不同的大脑位置引起的变异性。
-
原位MRI与脑切片的共同登记
- 在自定义切片框中扫描固定的大脑半球,其中有四行 MRI 敏感标记,可本地化可插入刀切大脑的插槽。执行 T1 加权 3D MPRAGE 采集,具有 1 mm 各向异性分辨率,覆盖固定大脑和所有标记。
注:这称为固定后 MRI,仅用作将原位 MRI 共同注册到脑切片的中间步骤。 - 扫描后,立即将大脑半球切成1厘米分开的插槽,形成约15片。
- 拍摄前侧和后侧的大脑切片。
- 通过以下步骤共同登记脑切片的原位MRI和照片。
- 对于固定后和原位MPRAGE的分割,预处理固定后和原位MPRAGE MRIs的强度非均匀性19。
- 从预处理的固定后 MPRAGE 中分割大脑和四行标记。
- 分割半球对应于固定后MRI20,21从预先处理的原位MPRAGE。
- 使用FSL FLIRT22,通过一系列线性登记过程,共同登记原位提取的大脑提取和固定后MRIs,最高可达到12个自由度(仿数登记)。缩放和剪切组件可考虑固定收缩的影响。
- 通过使用分段标记最小化最大投影强度的总和,查找切片平面的正常方向。这些重新定向角度被合并到从上一步获得的变换矩阵中。
- 使用内部图像查看器将 MRI 图像与固定后脑切片的照片进行视觉匹配,从而改变法向量的深度和方向。需要小的修改,因为大脑切片是不完美的。
- 为每个切片应用 AFFINE 图像变换13,将原位 MRIs 转换为与脑切片照片相同的切片位置。
- 对于固定后和原位MPRAGE的分割,预处理固定后和原位MPRAGE MRIs的强度非均匀性19。
- 在自定义切片框中扫描固定的大脑半球,其中有四行 MRI 敏感标记,可本地化可插入刀切大脑的插槽。执行 T1 加权 3D MPRAGE 采集,具有 1 mm 各向异性分辨率,覆盖固定大脑和所有标记。
结果
如上所述,几乎一半的脑半球是冷冻的,可用于使用DNA、RNA或蛋白质进行分子研究。从历史上看,使用死后脑组织的研究已证明受验尸前条件、年龄、性别、组织pH值、mRNA完整性(RIN)、验尸间隔(PMI)、诊断确定性、合并物质使用和先前药物治疗的影响状态23.根据使用脑组织的研究,与RNA相比,DNA和蛋白质的影响似乎较小。然而,根据我们的经验,RNA分离和下游分析受脑组织验尸前条件和验尸间隔的影响最大。因此,我们讨论了使用死后MS组织进行基于RNA的分析应遵循的一些条件。
对于我们所有的研究,在验尸时收集大脑后,它被切片(1厘米厚),然后固定在4%的甲醛中用于形态学研究,或迅速冻结进行生化分析。所有组织块都通过使用PLP进行免疫染色进行脱骨髓,如上所述。具有代表性的分析方案如图1所示。组织部分检查是否存在白质病变(图1A)。选定的区域被染色用于免疫活动(图1B)和脱骨髓(图1C)。冷冻组织安装在冷冻装置上(图1D),冷冻30μm截面被切割。接下来是收集3-4个后续部分,从相邻的组织分离,并储存DNA、RNA或蛋白质分离。利用这个协议,我们成功地分离了DNA24,25,RNA5,6,7,8,9以及蛋白质26。虽然讨论了一些分析MS大脑RNA的主要发现,但以下是与分析RNA死后MS大脑有关的一些问题。
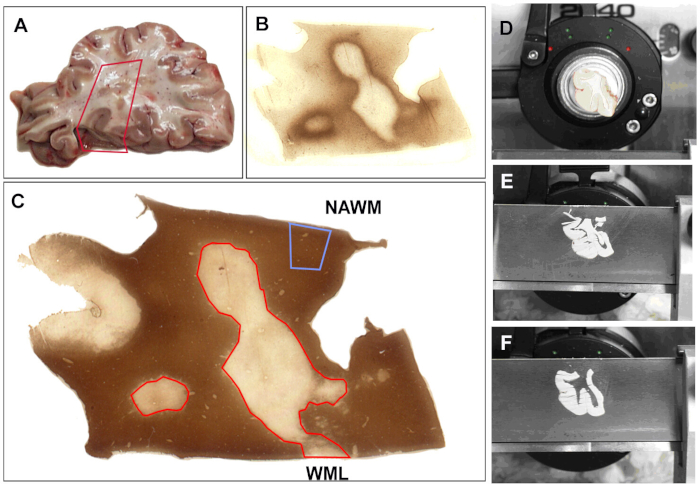
图1:mRNA分析的样本收集。(A) 选择尸体组织进行分析.选择组织区域,切除部分组织。所有部分均沾染 (B) MHC-II (主要组织相容性复合物 (MHC) II 类 HLA-DR CR3/43) 抗体检测炎症活性,并使用 (C ) 蛋白脂蛋白 (PLP) 使用已公布的协议确定骨髓状态。根据骨髓状态,块由手术刀 (D ) 打分。截面 (60 μm) 被切割 (E) 和以前评分的区域被移除,在管中分离,并标记 (F )。PLP 和 MHC-II 污渍每 5 节后重复,以确保组织的正确收集。正常出现白质 (NAWM) 和白质病变 (WML) 以红色轮廓。请点击此处查看此图的较大版本。
MS10病变中的斧体分差。这个项目最初的科学重点是对脱骨髓白质病变的细胞成分的表征。局部抗原中是非磷酸化神经纤维(NFs)。大多数NF在骨髓化的斧子中是磷酸化的。脱髓后,对斧子进行脱磷。我们检测了脱骨髓性斧子中非磷酸化NF的预期表达。在急性MS病变中,许多这些脱模的斧头以斧头缩回球结束(图2A),反映横断面斧头的近端。与相邻的正常区域10相比,急性病变的横射斧子超过11,000 mm 3。这些观察有助于推动MS研究的范式转变,使该领域朝着将神经退化描述为MS患者永久性神经残疾的主要原因的方向发展。
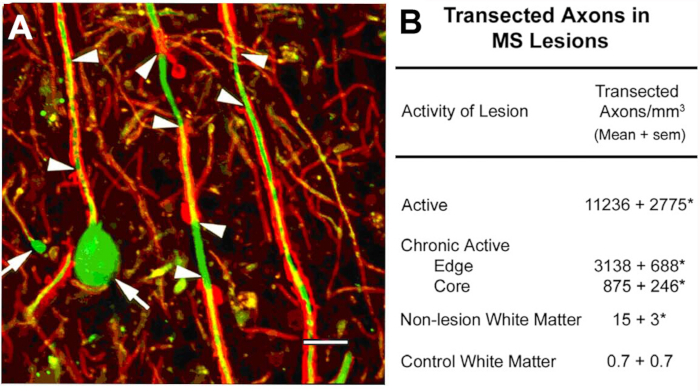
图2:炎症脱骨髓期间的斧水分段。在炎症脱骨髓(A,箭头)期间发生斧头分型,并诱导端形卵波的形成(A,箭头)。当量化(B) 时, 横断面的斧子在 MS 病变中是丰富的,并且似乎与病变的炎症活性相关。经许可,从特拉普等人10号转载的小组A。红色:蛋白脂蛋白,绿色:抗非磷酸化神经纤维。请点击此处查看此图的较大版本。
慢性MS脑的再生3。在MS的早期阶段,再生可能很健壮。然而,许多慢性MS病变没有再发生。我们调查了寡核苷酸祖细胞(OPCs)的存在,还是新寡核苷酸细胞的产生限制了慢性脱骨髓性白质病变的再骨髓。虽然OPC密度经常降低,但它们存在于所有慢性脱骨髓病变3中。新生成的寡核苷酸也存在于许多慢性MS病变中。与奥洛登德罗基特工艺相关,但没有髓母化斧子(图3)。这些研究表明,OPCs及其产生新的寡核苷酸细胞的能力并不限制慢性白质病变的再细胞。我们假设,长期脱髓化的斧子,经常出现营养不良,不接受新生产的寡核苷酸细胞的再髓化。
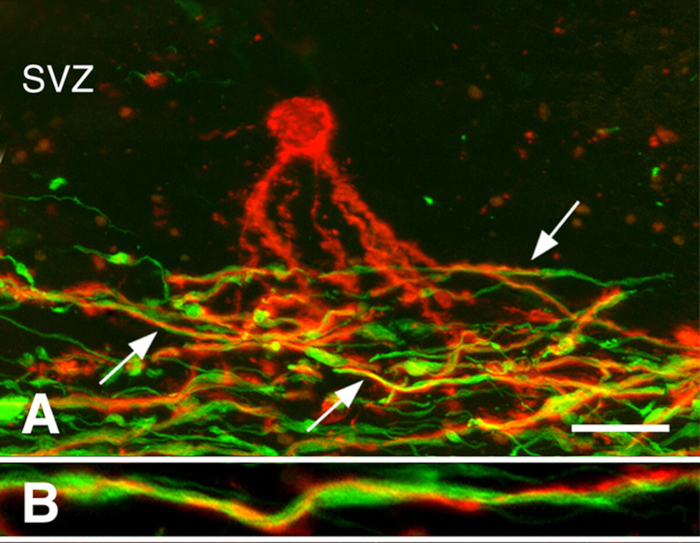
图3:与斧子相关的前骨髓核苷酸细胞的过程。显示与PLP抗体(面板A、B组为红色)和神经纤维抗体(面板A、B中的绿色)的MS病变共理显影。 亚温布区域(SVZ)中一种预骨髓化寡核苷酸(在面板A中的红色)将过程扩展到慢性MS病变的脱骨髓化斧子(小组A中的绿色)区域。其中许多过程(面板 A 中的箭头)围绕斧子旋转,如放大倍率较高(面板 B)所示。刻度条表示 20 μm (A) 和 5 μm (B)。经许可转载,由张等人3人转载。请点击此处查看此图的较大版本。
MS6中的线粒体功能障碍。我们进行了从慢性MS患者获得的快速冷冻运动皮层神经元基因变化的无偏见搜索(图4A)。对该数据集的无偏见搜索发现,MS中的23个核编码线粒体mRNA显著减少(图4B)。使用免疫细胞化学和原位杂交的证明研究表明,这些基因在皮质投影神经元(图4C)中高度富集,从投影斧子中分离的线粒体显示糖解减少(图 4D.本文催化了对线粒体功能障碍的关注,并减少了ATP生产,这是导致MS的斧道退化的主要原因。
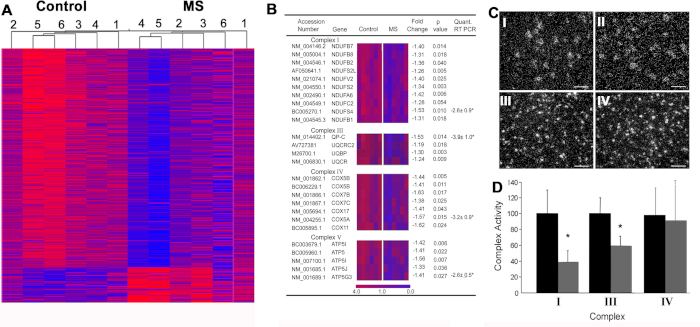
图4:在MS运动皮层中执行的微阵列数据和下游验证技术。(A) 从对照 (C1-C6) 和 SPMS (MS1-MS6) 运动皮层样本中显著改变的转录本的分层聚类,分别支持与疾病相关的基因表达模式。在MS运动皮层减少的转录中,有26个属于电子传输链(B)。线粒体复合体I(NDUFA6)mRNA在MS运动皮层(CII)的神经元(n = 55-130)中比对照组(CI)减少,而PLP mRNA密度在对照(CIII)和MS(CIV)脑皮层之间相似。电子传输复合物I和III的活性在MS患者运动皮层(n = 3) (D) 的线粒体富集分数中减少。经允许,从杜塔等人6号转载。错误条表示 SEM;CI-IV 中的刻度条是 25 μm. = p < 0.05 学生 t-测试。请点击此处查看此图的较大版本。
MS8中认知功能障碍的发病机制。40%至60%的MS患者有认知衰退和降低执行功能。我们确定海马,这是记忆/学习的功能位,作为在MS中脱骨髓的一个常见的站点。接下来,我们比较了骨髓化和去骨髓化海马中的神经元基因表达,发现编码记忆/学习的蛋白质的神经元mRNA显著减少。我们扩展了这些数据,证明在脱骨髓化海马中增加选择性微RNA,并且这些微RNA可以降低谷氨酸受体的表达。我们在啮齿动物模型中复制并扩展了这些观察结果。接下来,我们比较了骨髓化和去骨髓化海马中的神经元基因表达,发现记忆/学习中涉及的神经元mRNA编码蛋白质显著减少。
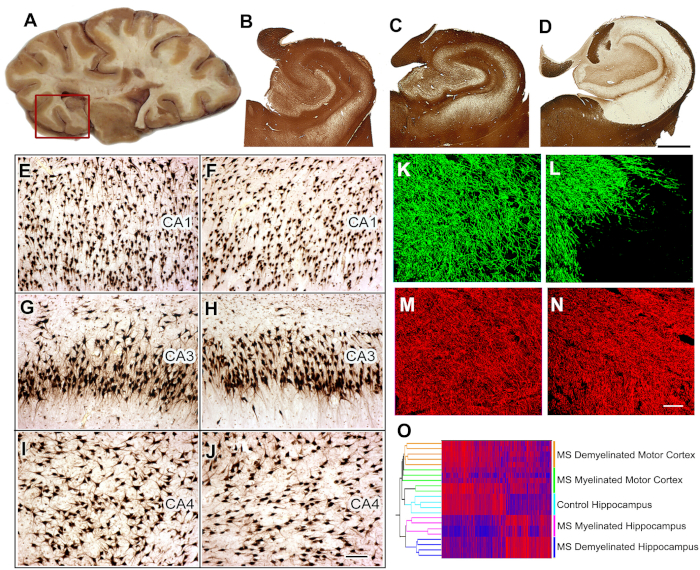
图5:MS海马中的组织收集、组织学分析和基因表达研究。在验尸期间选择含有海马的脑切片 (A) 和海马和相邻区域被移除 (红色框) 供进一步分析.PLP的免疫染色显示在所有对照(B)和40%的MS海马(C )中保存了骨髓素。在 +60% 的 MS 海马 (D )中检测到广泛的脱骨髓。与对照海马(E,G,I)相比,在CA1、CA3或CA4区域未检测到显著的神经元损失,如HuR免疫组织化学所示。 与控制海马(控制海马区相比),骨髓素(骨髓基本蛋白(MBP)、绿色)和黄突(SMI32,红色)的双标记免疫荧光显示骨髓素(L)的损耗(L),在MS去黄体中相对保存的斧头(N)MBP, K;SMI32, M)mRNA表达水平的双聚类根据骨髓状态(骨髓和脱骨髓)和位置(海马与运动皮层)(O)将样本排列成离散簇。高 mRNA 水平由红色表示,蓝色表示低表达水平。经许可,从杜塔等人8号改编的C-O面板。B-D:2毫米,E-J:100 μm,K-N:50 μm。请点击这里查看这个数字的较大版本。
MRI的病理相关性变化12。虽然 MRI 是 MS 诊断和治疗反应的重要指标,也是 MS 疾病进展的预测因素,但 MRI 变化的病理相关性却知之甚少。我们的死后MRI研究集中在两个MRI ROI上。只有T2超强度(仅限T2)和具有T1低强度、T2超强度和磁化转移比(MTR)(T2T1MTR)组合的脑白物质ROI。大约45%的脑白质T2仅ROIs是骨髓,证实了其非特异性性质。相比之下,83%的T2T1MTR ROIs是慢性脱骨髓的,并出现为黑洞。T1 和 MTR 值是半定量的,其值在 T2T1MTR ROIs 中差异很大。如果骨髓的丢失是这些 MRI 变化的唯一因素,则值应该是恒定的。与 T1 和 MTR 值相关的斯沃伦去黄子。
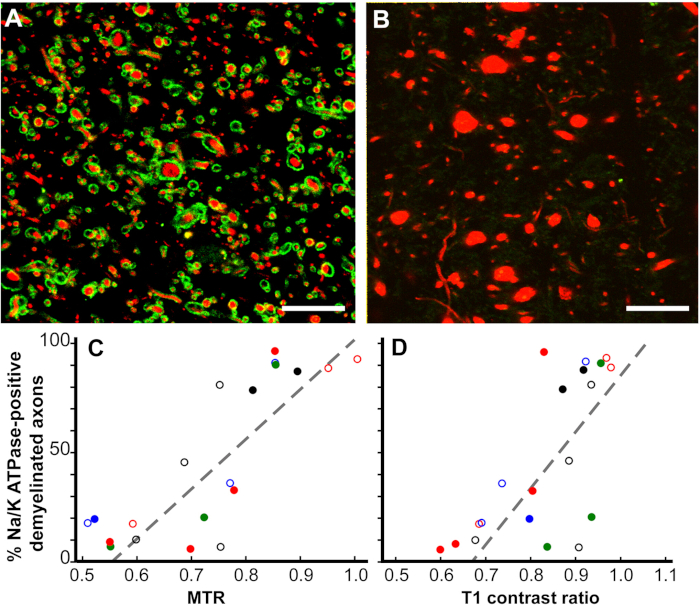
图6:磁化转移比(MTR)和T1对比度与慢性MS病变中Na+/K+ ATPase阳性斧子的百分比呈线性相关。长期脱骨髓病变染色为Na+/K+ ATPase (绿色) 从近100% (A) 到零 (B) 在神经纤维 (红色).许多没有 Na+/K= ATPase 的斧子增加了直径 (B)。与定量验尸MTR(p <0.0001,C)和T1对比度(p <0.0006,D )相关的Na+/K= ATPase阳性斧子在慢性脱血性MS病变中的百分比进行比较。 每个数据点都来自单个病变,每个独特的颜色符号组合表示所研究的大脑之一。缩放条 = 5 μm. 经许可从 Young 等人12中转载。请点击此处查看此图的较大版本。
神经退化独立于脱骨髓11。从历史上看,MS的神经退化被认为是脱骨髓造成的。然而,脑成像研究提出了神经退化和脱骨髓可能是独立事件的可能性。我们最近发现了一个MS患者的亚群,这些患者脊髓和大脑皮层脱骨髓,但不是脑白质。我们这个MS亚型作为骨髓性MS(MCMS)。)。MCMS病例为研究脑白质脱髓与皮质神经元损失的关系提供了一个平台。与控制皮质相比,MCMS皮质的皮质神经元损失明显大于典型的MS皮质。控制脑组织是从克利夫兰诊所的病理学部获得的。这项研究为神经脱髓没有变性提供了第一个病理证据。
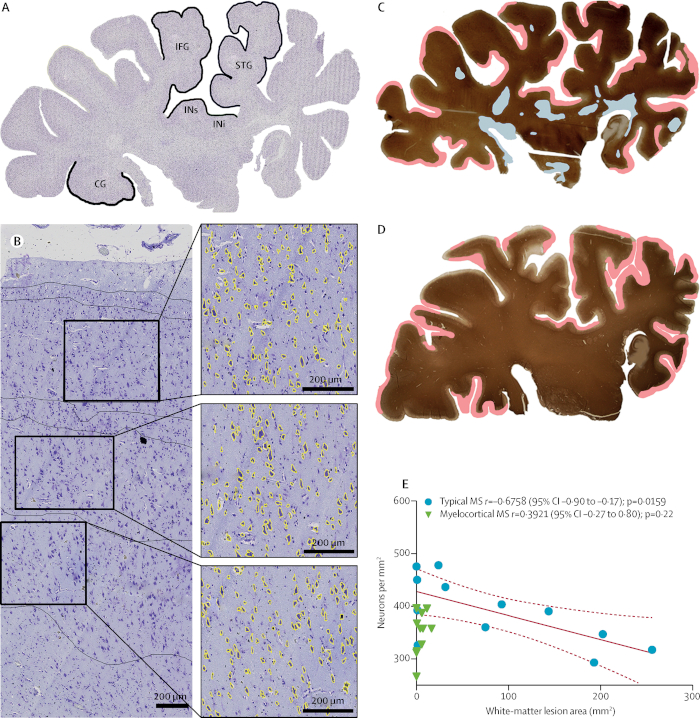
图7:神经损失在无脑白质脱髓的情况下。一个乳色紫色染色的日冕半球部分从一个分类为具有典型的MS (A)。在五个标记区域中,在皮质层 III、V 和 VI 中分别比较了神经元密度。面积大于60μm 2(黄色)的神经元在来自上部时间皮层 (B ) 的代表性图像中显示。在具有典型MS(C)和骨髓性MS(D)的半球区部分,为PLP贴标签和脱髓病变的分布(白质脱髓以蓝色突出显示;亚皮脱骨髓以粉红色突出显示))显示。在典型的MS中,皮质神经元密度降低与脑白质病变体积增加之间存在显著的相关性,但在骨髓性MS(E);虚线表示 95% 置信区间 (CI)。IFG = 下级正面陀螺。STG = 卓越的时间陀螺。INi = 劣质岛。InNs = 高级岛。CG = 结结陀螺。经许可转载,从特拉普等人11。请点击此处查看此图的较大版本。
| 序列持续时间 | 序列描述 | 序列使用 |
| 0:09 | 本地化器 | 后续序列的本地化 |
| 9:14 | 3D 磁化准备快速梯度回波 (MPRAGE) | 脑结构结构成像体积估计 |
| 5:14 | 3D 流体衰减反转恢复 (FLAIR) | 病变识别病变分割量变评估 |
| 2:35 | 2D T2 加权 | 病变识别病变分割量变评估 |
| 5:12 | 3D 梯度回波,磁化传输预脉冲 (MT-ON) | 正常出现和病变组织中骨髓含量的测量 |
| 5:12 | 3D 梯度回波,无磁化传输预脉冲 ,(MT-OFF) | |
| 0:27 | 扩散张力成像 (DTI) 场映射 | 测量脑组织中的水扩散,被认为反映脑组织的完整性。 |
| 10:27 | 扩散张力成像 (DTI) 多壳 | |
| 1:18 | 扩散张力成像 (DTI) 多壳 | |
| 39:48:00 | 亚数:核心 |
表1:事后成像方案。
讨论
我们描述了一种协议,该协议已用于从 150 多名 MS 患者中快速采购和处理组织。该协议的一个重要特点是,利用该组织的科学家也负责建立协议和执行组织收集。这为满足个别研究项目的科学需要提供了灵活性。该协议的几个方面增强了它的效用。患者通常在死前特征良好,因为许多患者都跟随了我们中心的神经学家。关键的一步是在死亡后不久处理组织捐赠,这与其他一些脑库相比,提高了冷冻组织的质量。这使得分子研究在描述转录和转化基因产物的变化方面具有重大价值,这对于组织学和免疫细胞化学观察的证实至关重要。利用多种情况下的形态/免疫细胞化学和分子数据可提高结论的可靠性。我们描述脑皮层的线粒体基因变化和去骨髓化海马的神经元基因变化,最能说明这一点。新型基因分析方案正在快速开发中,我们库的冷冻组织应该为组织和单细胞分析提供高质量的RNA。
我们协议的另一个重要方面是短固定脑切片。这些组织被切成30微米厚的自由浮动部分。这些部分非常适合使用共聚焦显微镜在三维分析两个或多个抗原。很好的例子包括骨髓前寡核苷酸过程与慢性MS病变中的营养不良性斧子的相互作用,以及识别与横端的斧状缩回球的单个斧状连接。这与7μm厚的石蜡截面的常规使用形成鲜明对比,在3D图像不可行的情况下。石蜡嵌入组织对一些问题有很大的价值,特别是半球7微米厚的部分神经元密度的定量。因此,我们的组织处理方案多种多样,可提供灵活性,确保固定和快速冷冻的组织。
我们协议的另一个独特特征是原位脑MRI的验尸。脑磁共振成像是MS疾病不可替代的生物标志物。因此,建立异常MRI信号的病理相关性至关重要。我们的研究表明,仅T2和T2T1MTR ROIs经常被骨髓化。这一发现支持需要更具体的成像模式,可靠地区分骨髓和脱骨髓性脑白质。MRI似乎对骨髓的检测很敏感,但我们的研究表明,即使T1/T2/MTR的组合也不专门用于识别骨髓。我们的验尸协议为测试新的成像模式区分骨髓和脱骨髓性脑白质的能力提供了一个理想的平台。MRI 还提供了将基础科学成果转化为临床实践的理想工具,因为 MRI 在我们的转化研究中使用,并在活患者中广泛使用。
虽然切割短片、长固定切片以及冷冻切片为不同研究的多种模式处理组织提供了优势,但这种方法存在一些局限性。评估整个结构可能会受到限制,因为结构的某些部分可能在相邻切片上以不同的方式处理。然而,组织库的体积大,提供了研究多个受试者感兴趣的结构的能力,以改进采样。利用死后组织的研究的另一个一般限制是它们是横截面的。需要在此背景下解释关于变更的时间和进展的结论。捐赠其组织的患者可能存在选择偏差,这可能限制所有 MS 患者的数据通用化。由于大多数捐赠者死于晚期MS并发症,因此将这些患者的发现推断为MS早期患者可能并不合适。尽管如此,我们还是收到了因非MS相关疾病(即急性心肌梗死、药物过量、自杀)而死亡的年轻患者的纸巾。我们的协议范围不包括与MS有关的其他器官(如胃肠道和骨髓)的取样。我们相信,该计划的优势远远大于其局限性。
披露声明
提交人声明没有利益冲突。
致谢
作者还要感谢克里斯托弗·纳尔逊博士的编辑协助。验尸程序部分由R35授予BDTNS097303支持。研发实验室的工作得到NINDS(NS096148)和美国国家多发性硬化协会(RG 5298)的资助。
材料
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Biotinylated goat anti-mouse IgG | Vector Laboratories | BA-9200 | 1:500 dilution for hemispheric; 1:1,000 for 30µm free-floating. RRID: AB_2336171 |
| Biotinylated goat anti-rabbit IgG | Vector Laboratories | BA-1000 | 1:500 dilution. |
| Biotinylated goat anti-rat IgG | Vector Laboratories | BA-9400 | 1:500 dilution for hemispheric; 1:1,000 for 30µm free-floating. RRID: AB_2336208 |
| Glial fibrillary acid protein (GFAP) | Dako | Z0334 | 1:700 dilution for hemispheric. RRID: AB_10013382 |
| HuR, mouse IgG, 3A2 clone | Santa Cruz | SC-5261 | 1:500 for 30µm free floating. RRID: AB_627770 |
| Major histocompatibility complex (MHC) class II HLA-DR CR3/43 | Dako | Mo746 | 1:250 dilution for hemispheric; 1:500 for 30 µm free floating. RRID: AB_2313661 |
| Non-phosphorylated neurofilament (SMI32) | Biolegend | 801701 | 1:5,000 dilution for hemispheric; 1:2,500 for 30 µm free-floating. RRID: AB_2564642 |
| Phosphorylated neurofilament (SMI31) | Biolegend | 801601 | 1:5,000 dilution for hemispheric; 1:2,500 for 30 µm free-floating. RRID: AB_2564641 |
| Proteolipid protein (PLP) | Gift from Wendy Macklin | 1:250 dilution for IHC; alternative anti-PLP antibodies commercially available. | |
| Reagents | |||
| 125 mm filter paper | Whatman | 1452-125 | For filtering PFA. |
| 50% Glutaraldehyde | Electron Microscopy Sciences | 16320 | Electron microscopy grade. |
| Cytoseal | ThermoScientific | 8310-16 | |
| Ethylene glycol | Fisher Chemical | BP230-4 | |
| Glycerol | Sigma-Aldrich | G7893 | 400 mL/2 L Cryoprotection solution. |
| Millex-HV Syringe Filter Unit, 0.45 µm, PVDF, 33 mm, gamma sterilized | Millipore-Sigma | SLHV033RB | |
| Paraformaldehyde | Electron Microscopy Sciences | 19200 | Prills form. |
| Polyvinylpyrolidone (PVP-40) | Fisher Chemical | BP220-212 | |
| Sodium azide | Fisher Chemical | S227I | 2 g/2 L Sorenson's buffer. |
| Sodium phosphate dibasic | Sigma-Aldrich | S0876 | 98.8 g/2 L Sorenson's buffer. |
| Sodium phosphate mono basic monohydrate | Sigma-Aldrich | S9638 | 14.352 g/2 L Sorenson's buffer. |
| Sucrose | Sigma-Aldrich | PVP40-500G | |
| VectaStain ABC Kit | Vector Laboratories | PK-6100 | 1:1,000 dilution of A and B. RRID: AB_2336819 |
| Waterproof drawing black ink | Higgins | 44201 | |
| Xylene | Fisher Chemical | X3S | Histological grade. |
| Equipment | |||
| 3T MRI Magnetom Prisma | Siemens Healthineers | ||
| 7T MRI Agilent 830AS | Siemens Healthineers |
参考文献
- Trapp, B. D., Nave, K. A. Multiple sclerosis: an immune or neurodegenerative disorder?. Annual Review of Neuroscience. 31, 247-269 (2008).
- Chang, A., Nishiyama, A., Peterson, J., Prineas, J., Trapp, B. D. NG2-positive oligodendrocyte progenitor cells in adult human brain and multiple sclerosis lesions. Journal of Neuroscience. 20, 6404-6412 (2000).
- Chang, A., Tourtellotte, W. W., Rudick, R., Trapp, B. D. Premyelinating oligodendrocytes in chronic lesions of multiple sclerosis. New England Journal of Medicine. 346, 165-173 (2002).
- Chang, A., et al. Neurogenesis in the chronic lesions of multiple sclerosis. Brain. 131, 2366-2375 (2008).
- Chang, A., et al. Cortical remyelination: A new target for repair therapies in multiple sclerosis. Annals of Neurology. 72, 918-926 (2012).
- Dutta, R., et al. Mitochondrial dysfunction as a cause of axonal degeneration in multiple sclerosis patients. Annals of Neurology. 59, 478-489 (2006).
- Dutta, R., et al. Activation of the ciliary neurotrophic factor (CNTF) signalling pathway in cortical neurons of multiple sclerosis patients. Brain. 130, 2566-2576 (2007).
- Dutta, R., et al. Demyelination causes synaptic alterations in hippocampi from multiple sclerosis patients. Annals of Neurology. 69, 445-454 (2011).
- Dutta, R., et al. Hippocampal demyelination and memory dysfunction are associated with increased levels of the neuronal microRNA miR-124 and reduced AMPA receptors. Annals of Neurology. 73, 637-645 (2013).
- Trapp, B. D., et al. Axonal transection in the lesions of multiple sclerosis. New England Journal of Medicine. 338, 278-285 (1998).
- Trapp, B. D., et al. Cortical neuronal densities and cerebral white matter demyelination in multiple sclerosis: a retrospective study. Lancet Neurology. 17, 870-884 (2018).
- Young, E. A., et al. Imaging correlates of decreased axonal Na+/K+ ATPase in chronic multiple sclerosis lesions. Annals of Neurology. 63, 428-435 (2008).
- Fisher, E., et al. Imaging correlates of axonal swelling in chronic multiple sclerosis brains. Annals of Neurology. 62, 219-228 (2007).
- Moll, N. M., et al. Imaging correlates of leukocyte accumulation and CXCR4/CXCL12 in multiple sclerosis. Archieves of Neurology. 66, 44-53 (2009).
- Moll, N. M., et al. Multiple sclerosis normal-appearing white matter: pathology-imaging correlations. Annals of Neurology. 70, 764-773 (2011).
- Nakamura, K., Chen, J. T., Ontaneda, D., Fox, R. J., Trapp, B. D. T1-/T2-weighted ratio differs in demyelinated cortex in multiple sclerosis. Annals of Neurology. 82, 635-639 (2017).
- Chen, J. T., et al. Clinically feasible MTR is sensitive to cortical demyelination in MS. Neurology. 80, 246-252 (2013).
- Nakamura, K., Fox, R., Fisher, E. CLADA: cortical longitudinal atrophy detection algorithm. Neuroimage. 54, 278-289 (2011).
- Sled, J. G., Zijdenbos, A. P., Evans, A. C. A nonparametric method for automatic correction of intensity nonuniformity in MRI data. IEEE Transactions of Medical imaging. 17, 87-97 (1998).
- Fisher, E., Cothren, J. R. M., Tkach, J. A., Masaryk, T. J., Cornhill, J. F. Knowledge-based 3D segmentation of the brain in MR images for quantitative multiple sclerosis lesion tracking. Proc. SPIE 3034, Medical Imaging. , 19-25 (1997).
- Avants, B. B., Epstein, C. L., Grossman, M., Gee, J. C. Symmetric diffeomorphic image registration with cross-correlation: evaluating automated labeling of elderly and neurodegenerative brain. Medical Image Analysis. 12, 26-41 (2008).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. Neuroimage. 17, 825-841 (2002).
- Lewis, D. A. The human brain revisited: opportunities and challenges in postmortem studies of psychiatric disorders. Neuropsychopharmacology. 26, 143-154 (2002).
- Chomyk, A. M., et al. DNA methylation in demyelinated multiple sclerosis hippocampus. Scientific Reports. 7, 8696 (2017).
- Huynh, J. L., et al. Epigenome-wide differences in pathology-free regions of multiple sclerosis brains. Nature Neuroscience. , (2014).
- Ishii, A., et al. Human myelin proteome and comparative analysis with mouse myelin. Proceedings of the National Academy of Sciences. U. S. A. 106, 14605-14610 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。