Method Article
使用流感抗原微阵列测量病毒亚型血清抗体的广度
摘要
我们提出了一种使用通过将流感抗原打印到硝基纤维素涂层幻灯片上构建的蛋白质微阵列的协议,以同时针对来自不同病毒株的 250 多种抗原检测血清的多种抗体等型,从而允许测量病毒亚型血清抗体的广度。
摘要
由于现有疫苗的有效性有限,流感病毒仍然是全世界死亡的重要原因。开发通用流感疫苗的一个关键挑战是抗原漂移产生的高抗原多样性。要克服这一挑战,需要新的研究工具来测量针对不同抗原亚型许多病毒株的血清抗体的广度。在这里,我们提出了一个协议,用于分析血清抗体的广度,针对各种流感病毒株使用流感抗原的蛋白质微阵列。
这种流感抗原微阵列是通过使用微阵列打印机将纯化血凝素和神经氨酸酶抗原打印到硝基纤维素涂层膜上而构建的。人类血清在微阵列上孵育,将抗体与流感抗原结合。量子点结合二级抗体用于同时检测与微阵列上每个抗原结合的IgG和IgA抗体。定量抗体结合是使用便携式成像仪测量荧光强度。显示具有代表性的结果表明,在测量亚型特异性和交叉反应性流感抗体时,在人血清中具有可重复性。
与ELISA等传统方法相比,流感抗原微阵列提供了一种高通量多路复用方法,能够在短时间内对数百种抗原测试数百种血清中多种抗体等型,因此具有血清监测和疫苗开发中的应用。限制是无法区分结合抗体和中和抗体。
引言
流感病毒每年因死亡或残疾而死亡2 000万年,占全世界每年死亡人数的1%,对热带和发展中世界的老年人和人口造成不成比例的影响。 2,3.除了季节性流行病的疾病负担外,通过基因重组出现新型流感毒株,要么自然在共同宿主中分类,要么人为地用于生物恐怖主义,可能导致全球大流行,传播迅速,杀伤力高4,5.虽然目前有许多流感疫苗,但其有效性受到亚型特异性6的限制,因此需要开发通用流感疫苗,从而对多种病毒具有持久的免疫力菌株7.
开发通用流感疫苗的一个关键挑战是各菌株的抗原多样性高。当前疫苗的抗原特异性与循环病毒的抗原变异相结合,使疫苗菌株与循环菌株不匹配。这赋予了进化优势,有利于在流行期间进一步遗传偏离疫苗菌株,将疫苗的疗效限制在50%以下8,9。抗原不匹配的另一个来源是疫苗制造过程中产生的卵子适应性病毒突变,导致抗体与循环病毒10、11结合不良。
要克服高抗原多样性的挑战,需要新的研究工具来描述血清和粘膜标本中临床上相关的抗原变异中预先存在和引出的免疫反应的广度。目前可用的方法,包括血凝素抑制 (HAI)、微中和 (MN) 和传统 ELISA,仅限于一次检测针对单个病毒株的抗体,因此用于检测多种抗体异型对抗多种病毒株可迅速耗尽可用的临床标本和实验室资源。此外,HAI 和 MN 需要仅在专业实验室中提供的活病毒培养。
蛋白质微阵列,可能由多达数千种抗原组成,打印在硝基纤维素涂层幻灯片上,如图1所示,可以满足这一需求12。这些微阵列可以以高通量的方式生产和探测,同时消耗少量的临床标本,以确定针对阵列上每个单个抗原的定量抗体等型/亚型水平。这种抗原发现方法已应用于针对多种传染性病原体的诊断和疫苗开发13。迄今为止,我们已经为超过35种病原体(包括超过60,000种表达的蛋白质)生产了蛋白质微阵列,并使用它们从受感染和控制个体中探测超过30,000个人类血清。最近开发的用于微阵列幻灯片的便携式成像平台使最终用户更容易访问这种方法。
在该领域15、16、17、18、19的多个贡献者以前广泛工作的基础上,最近研制出一种含有250纯化血凝素(HA)抗原变异,代表所有18个亚型12,20。利用这种方法,证明自然流感感染能产生广泛反应IgG和IgA抗体,针对与植物遗传相关的HA亚型,而肌肉内流感疫苗接种只产生亚型特异性IgG抗体21。然而,在动物研究中,在HA亚型中加入一种辅助剂,激活类似收费的受体,以扩大引起IGG抗体反应的HA亚型22。
这个微阵列目前被用来调查从一个对被跟踪的大学生的流感感染的前瞻性队列研究中收集的血清。本文报告了流感抗原微阵列的方法,并演示了检测可重复性,以检测本研究样本中亚型特异性和交叉反应抗体。
研究方案
所有人类血清都按照经批准的生物安全机构协议处理和处置,并使用保护性个人设备。所有参与此协议的实验室人员都接受过生物安全和研究伦理方面的培训。
1. 生产流感抗原微阵列
-
设计和获取微阵列抗原集
- 获得表达和纯化的蛋白质抗原作为冻干粉。
-
将抗原打印到微阵列幻灯片上
- 将每个冻干抗原重组至磷酸盐缓冲盐水(PBS)中浓度为0.1mg/mL,浓度为0.001%补间-20(T-PBS)。将每个重组抗原的10μL转移到未经处理的384孔平底板的单个孔中。
- 使用微阵列打印机打印抗原(本研究中使用的微阵列打印机不再具有商业版本,参见讨论),使用低容量微阵列点针将抗原吸入样品通道,并通过直接沉积接触和毛细管作用到16垫硝基纤维素涂层玻璃玻片上。
- 使用源印版配置和打印参数对打印软件(例如 Gridder)进行编程。
- 使用下拉菜单选择将使用此打印方法使用的印版类型的名称。对于本研究,使用未经处理的384孔平底板。
- 选择"印版数"旁边的文本框,并键入此打印协议中使用的样本板数。对于本研究,使用 1 个板。
- 选择要与此方法一起使用的引脚配置。对于本研究,请使用 8 针配置。
- 确保原点偏移是幻灯片原点(在管理部分中校准)与打印图钉将在幻灯片上开始打印的位置之间的距离(在 X 和 Y 方向中)。
- 使用"阵列设计"选项卡,定义数组的大小和形状(每个子数组的点间距和点数)。在本研究中,使用 8 个引脚以 18x18 格式将 324 个点(直径 180 μm,间距为 300 μm)打印到 16 张幻灯片上。
- 选择打印引脚拾取和点胶样品的参数。在本研究中,每个引脚吸出 250 nL 的抗原溶液,并将 1 nL 打印到 40 个点(所有 8 个引脚共 20 张幻灯片)
- 配置引脚清洁协议和印迹协议。在这项研究中,每个引脚打印抗原,浸入无菌ddH2O的声波洗涤容器中,然后吸出下一个抗原。
- 定义示例块打印到幻灯片上的顺序。阵列软件将构造一个带批过的网格索引(.gal)文件来描述每个微阵列中抗原的排列。
注: 顶行用于基准(在成像中使用的所有波长都有荧光,例如,本研究中 Qdot 585 nm 链球蛋白偶联和 Qdot 800 nm 链球蛋白联结的混合),以在成像过程中定向网格。对于长时间印刷,源板中的抗原可以通过上下移液,然后离心,或可以准备和使用新的源板定期重新悬浮。
- 使用源印版配置和打印参数对打印软件(例如 Gridder)进行编程。
- 将未探测的微阵列幻灯片放在防光箱中,并保存在室温干燥器柜中,以便长期存放。
注: 此时,协议可能会无限期暂停。
-
执行质量控制检查(需要聚-异氨酸标签)
- 如步骤 2.1.1-2.1.2 中所述且如图 2所示,将幻灯片连接到探测室,并用阻塞缓冲液重新冻结。
- 在过滤的1x阻断缓冲液中稀释小鼠单克隆多-His抗体1:100。
注:如果非纯化蛋白抗原(例如,在体外转录和翻译系统中表示)直接用于打印微阵列,则添加蛋白质表达系统的组成部分(例如大肠杆菌解结物),与阻断用于血清稀释的缓冲液,以阻止针对这些成分的任何抗体。 - 吸入后,将100μL稀释的聚-His抗体加入每个带阵列垫的滑动室,在室温下孵育2小时,或在摇摇器上4°C下孵育2小时。如步骤 2.2.1 所述,使用 T-TBS 缓冲液清洗 3 倍。稀释生物锡结合山羊抗小鼠IgG二级抗体1:200在阻断缓冲液中,吸入后每孔加入100μL,并在振动器室温下孵育1小时。使用 T-TBS 缓冲液清洗 3 倍。
- 稀释 Qdot 585 nm 链球菌结合到 4 nM 的阻塞缓冲液中,吸入后每孔加入 100 μL,并在振动器室温下孵育 1 小时。使用 T-TBS 缓冲液洗涤 3 倍,然后用 TBS 缓冲器洗涤一次(不带补间)。
- 如步骤 2.2.5 和 3.1.2 中所述,对幻灯片进行分解和量化。
注:蛋白质抗原必须包含他的10个标签才能使用此质量控制协议。或者,如果包含其他标签,可以使用该标签的抗体或配体进行质量控制检查。
2. 使用微阵列的流感抗体探针血清
-
在微阵列上孵育血清,用于抗体结合
- 使用剪辑将微阵列幻灯片连接到腔室,并放置在帧中,如图3所示。
注意:始终避免用手和仪器触摸微阵列垫。确保幻灯片朝向,垫面朝上,右上角的小切口。 - 再水化微阵列滑动100μL每孔过滤1x阻塞缓冲液,稀释血清1:100在100μL的阻塞缓冲液(可以使用未经处理的96孔板或2 mL管)。在100-250rpm的轨道摇床室温下,在覆盖框架中孵育再水化微阵列幻灯片,并在室温下分别孵育30分钟。在摇床上类似地执行所有后续孵育步骤。
注:Sera 应在-80°C 处进行加注和冷冻,以便长期储存,以尽量减少冻融周期,并在使用前涡旋混合和离心以去除颗粒。在此步骤期间和之后仔细观察滑动室,以检测任何需要重新装配滑动室的泄漏。 - 使用连接到带有二次收集瓶的真空管线的移液器吸头,小心地从每个腔室的角落吸气缓冲缓冲器,无需接触焊盘。以类似方式执行所有后续的吸入步骤。吸入后快速将稀释的血清添加到垫子中,以免垫子干燥。
- 将盖框架放在被湿纸巾包围的辅助容器内的托盘中,并密封以防止蒸发。在摇摇器上以4°C孵育过夜(或者,在100-250rpm的轨道摇床室温下孵育2小时)。
- 使用剪辑将微阵列幻灯片连接到腔室,并放置在帧中,如图3所示。
-
标记结合血清抗体与量子点结合的二级抗体
- 如上文所述,从腔室中小心吸气,每井加入100 μL T-TBS缓冲液(20mM Tris-HCl,150 mM NaCl,ddH2O 中的0.05%补间-20,调整至pH 7.5并过滤,可进行商业处理),并在轨道摇摇器上孵育5分钟,100-250 rpm。重复此洗涤步骤共 3 倍(所有后续洗涤步骤都执行类似)。
- 将二级抗体的混合物稀释至1 μM,以阻断缓冲液,并在使用前和使用期间通过移液彻底混合,以保持均匀性。
注:为了保持测定的可重复性,应使用同一批次的每个二级抗体进行所有探测实验,并计划对实验数据进行定量比较。二次抗体的具体浓度可能需要根据亲和力而变化;随时随制造商的协议。 - 最终洗涤后从腔室吸气缓冲液,每井加入100μL的二次抗体混合物,并在振动器室温下孵育2小时。
- 吸气二级抗体混合物用T-TBS缓冲液洗涤3x,然后用TBS缓冲液洗涤一次(无补间)。
- 从腔室中小心地滑动微阵列,以避免接触垫,用过滤过的 ddH2O 轻轻冲洗,然后放入 50 mL 管中并离心 500 x g 10 分钟。请小心冲洗。
- 将探头微阵列幻灯片放在防光箱中,并保存在室温干燥器柜中,以便长期存放。
注: 此时,协议可能会暂停长达 1 周。
3. 定量与微阵列内抗原结合的抗体
-
可视化微阵列幻灯片并量化点荧光强度,以测量抗体结合
- 使用带有内置软件的便携式成像器获取微阵列幻灯片的图像。
- 在"配置映像器"选项卡中,选择正确的幻灯片配置。对于本研究,请使用 16 张幻灯片。
- 在"图像控制"选项卡中,选择正确的荧光通道,并根据血清的反应性调整增益、曝光时间和采集时间,以获得最佳图像。本研究的IgA和IgG的荧光通道分别为585nm和800nm,成像设置增益为50,暴露时间为500ms,采集时间为1s。
- 单击"捕获"可开始获取图像的过程。
注:微阵列幻灯片可以在多个设置下重新成像,只要它们存储在黑暗和干燥,信号不会降低。如果与幻灯片兼容,可以使用其他成像系统。
- 使用基于基准标记的网格检测阵列点,并将点强度作为像素强度的中位数减去围绕点测量的背景。使用内置成像器软件批量执行此量化算法,该软件利用步骤 1.2.2 中构造的 .gal 文件将点强度连接到每个微阵列上的单个抗原。
- 在"文件信息"面板中,通过从计算机上的文件夹选择上载 .gal 文件,并在"分析选项"部分中指定要保存分析输出文件的文件夹。
- 在"图像控制"选项卡中,打开要量化的获取图像之一,然后选择右上角的"自动"按钮。
- 在右下角的"阵列分析"部分中,按照软件的说明创建基准模板。
- 单击"批处理分析",选择包含要量化的图像的文件夹,然后选择在上一步中创建基准模板。该软件分析每个图像并量化点强度。
注:此步骤将生成一个 .csv 文件,其中包含每个血清样本中定量的抗体的点强度,这些抗体与微阵列上的每个单个抗原结合,随后可在电子表格操作或分析软件中操作。
- 分析原始数据,比较抗原和血清标本的抗体结合。在这项研究中,IgA和IgG抗体测量为585nm和800nm荧光点强度,在实验的2个独立运行之间,使用不同日期的不同幻灯片对所有抗原进行了比较,并进行了相关分析,测量测定可重复性。
注:对于作为表达混合物打印的非纯化蛋白质,数据分析应从无DNA对照的背景减法开始。
- 使用带有内置软件的便携式成像器获取微阵列幻灯片的图像。
结果
作为该协议的证明,基线血清是从16名大学生的前瞻性队列研究中对流感抗原微阵列的流感感染进行测定的。为了证明测定的可重复性,这些样本在不同的幻灯片和不同天被探测了两次。
在这项研究中,含有他10个标签的纯化流感抗原是从商业供应商(见材料表)和合作者获得的。这些抗原包括251个总HA抗原,有63个球头域(HA1)和186个全长蛋白(HA0),包括96个单体HA0蛋白和90个含有熔融三化("foldon")域的修剪HA0蛋白23。本研究中使用的抗原和控制措施的完整列表作为补充文件包含在内。在这项研究中,二级抗体被山羊抗人IgG与800nm(GAH-IgG-Q800)的量子点发射结合,山羊抗人类IgA与585nm(GAH-IgA-Q585)的量子点发射结合,用于IgG和IgA抗体的多路检测。如图3所示。对从上述临床组群获得的血清,与流感HA抗原的不同亚型和分子形式的IgG和IgA抗体进行了结合。
生成的热图如图4所示,图 5中的图形表示。在这些数字中,仅标记阵列上具有高表示力的临床相关子类型以节省空间,"*"表示所有剩余子类型较高的数字,以及按顺序包含的次要或不太表示的子类型(例如,H1 介于 H1 之间的 H2和 H3)。数组上的菌株和子类型的完整列表作为补充文件包含在内。这些数据表明,HA头组的抗体是亚型特异性的,临床上流行的菌株(H1N1、H3N2和B)的抗体数量预期为高,其他菌株的抗体数量较低。然而,整个HA的抗体(包括茎域)在子类型之间更具交叉反应性,当整个HA被修剪时,这种效应似乎会增强。此结果并不意外,因为整个 HA 包括 stem 区域,该区域在子类型中高度保存。因此,对非临床亚型(例如H5和H7)的整个HA分子的抗体可能代表最初针对临床亚型(例如H1和H3)产生的抗干细胞抗体,这些抗体与其他HA亚型的茎区发生交叉反应在数组上。这一点说明了在阵列上同时包括头 HA 和整个分子 HA 以区分头部抗体和显示不同反应性配置文件的干区域的重要性。
该测定在探测运行中表现出良好的可重复性。第二次运行显示所有菌株的IgG抗体略低,尽管菌株之间的模式是一致的。这种全面轻微下降可能是由于二级抗体的批次到批次变异性,在IgG的运行之间发生了改变,而不是IgA。因此,如协议所述,建议在计划定量比较的任何实验中使用相同批次的每种二次抗体。如果由于要测试的样品数量很多,需要不同批次的抗体,我们建议在具有不同抗体批次的实验运行之间加入共享样本,以便与校正进行定量比较。
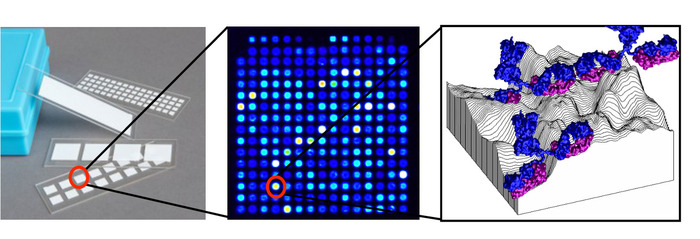
图1:蛋白质微阵列的原理图。每张幻灯片包含多个焊盘,每个焊盘都有一个阵列,该阵列由数百种抗原打印在网格中排列的斑点上,每个点包含一个抗原吸附到硝化纤维素表面的三维地形上。来自血清的抗体被束缚。请点击此处查看此图的较大版本。
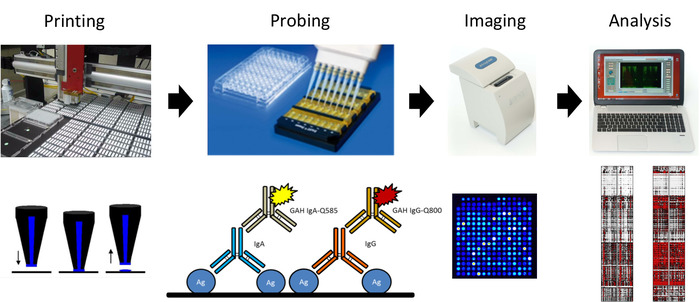
图2:流感抗原微阵列打印和探测方案的原理图。从左到右,微阵列使用显化纤维素涂层幻灯片打印,用于使用量子点结合的二级抗体探测IgG和IgA抗体的血清,并使用便携式成像器对幻灯片进行成像,并将结果分析为生成热图。请点击此处查看此图的较大版本。

图3:将探测室连接到微阵列幻灯片的过程。从A到F,探测室以正确的方向放置在幻灯片的顶部,使用两侧的水平夹连接到幻灯片,并放置在探测托盘中。请点击此处查看此图的较大版本。
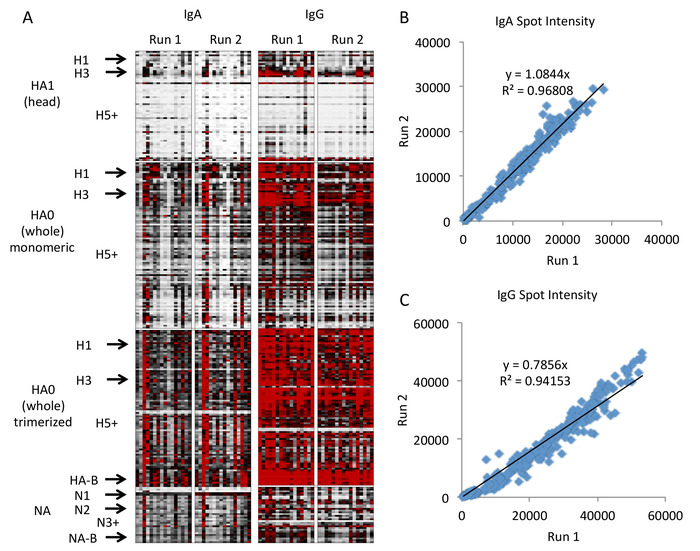
图4:流感抗原微阵列代表性结果。热图表示抗原特异性抗体反应,每行表示按分子、亚型和应变排列的单个抗原,每列表示单个样本的探测运行,由抗体等型和运行(A ,白色 = 0,黑色 = 20000,红色 = 40000 荧光强度)。抗原亚型包括1至18的所有血凝素亚型以及1至10的所有神经氨酸酶亚型垂直排列并标记在左侧。通过两次运行之间的荧光强度比较,通过线性回归显示IgA(B)和IgG(C)具有良好的测定重现性。请点击此处查看此图的较大版本。

图5:在流感抗原微阵列上测定血清抗体的广度。血清IgA (A) 和IgG (B) 按HA和NA分子形式和亚型分组,以证明全HA头组抗体对临床亚型的高特异性,以及整个HA的高交叉反应性,以及整HA抗体的修剪性全HA抗体。包括茎区。请点击此处查看此图的较大版本。
补充文件:流感抗原微阵列抗原清单。阵列上所有324个斑点的含量显示,包括空白、基准、对照(人IgG和IgA以及0.1mg/mL和0.3 mg/mL的抗人类IgG和IgA),以及抗原,包括来源、分子形式、亚型和应变信息。缩写如下:来源,中国生物有限公司,FKL + 弗洛里安克拉默实验室;对于分子形式,HA1 = 头 HA,HA0 = 整个 HA,HA2 = 茎 HA,NP = 核蛋白。对于来自中生物公司的抗原,显示目录号;对于来自克拉默实验室的抗原,将列出抗原 ID。请点击此处下载此文件。
讨论
此处描述的流感抗原微阵列方案适用于任何需要分析许多抗原的抗体反应的项目。微阵列平台可用于任何在任何系统中表达的蛋白质抗原,如前所述,无论是否纯化,可实现 0.1 mg/mL 或更高的产量。如果直接用于打印微阵列的非纯化蛋白抗原(例如,在体外转录和翻译系统中表达),则应在用于阻断缓冲液中添加1:10 稀释血清和质量控制抗体,以阻止针对这些成分的任何抗体。滑动配置在每个幻灯片上具有数量较低的较大焊盘,以适应每个阵列中数量较多的抗原。在这项研究中,我们使用 GeneMachines OmniGrid 100 微阵列打印机,该打印机利用直接接触硝基纤维素表面的引脚在阵列上沉积点。虽然此微阵列打印机不再用于商业,但其他商用微阵列打印机可用于此协议,但可能需要自定义引脚(触点或非接触)和软件,并且应具有足够的点分辨率和幻灯片和成像器的兼容性。根据血清的反应性,可以使用1:50至1:400的稀释。无血清缓冲液可用作阴性对照,而已知与抗原结合的单克隆抗体可用作阳性对照。
用户应了解一些疑难解答问题。使用抗体检查他标签的质量控制的目的是检查任何抗原,打印不成功。在多个阵列的质量控制检查中始终发出低信号的任何点都可能表示未打印的抗原。可能的原因包括源板中的聚集或沉淀或抗原,或由于硝基纤维素垫的厚度变化,印刷销和微阵列滑动之间的接触不良。此时,我们不会根据质量控制检查的定量结果执行检测规范化,因为检测到的抗His抗体结合可能受此标记的可用性影响,这依赖于三维构象特定于每个抗原。
流感抗原微阵列与传统方法如ELISA相比具有若干优势,对HAI和MN等功能性检测具有补充性。16 垫蛋白微阵列是一种样品分离技术,能够同时针对血清 1 μL 中的大约 300 种抗原测量多种等型抗体。通过减少每个幻灯片的垫片数量,抗原的数量可以增加到数千个。多路复用测定还省去人员时间和消耗品资源,因为数百个血清可以在2天内探测抗体,并且除了幻灯片和试剂之外的所有材料都可以重复使用,因此不会产生大量的塑料废物。
虽然微阵列打印机可能无法广泛分布,但微阵列幻灯片可以在集中位置打印,然后传送给最终用户进行探测。探测所需的唯一设备是低成本和便携式成像仪。传播此协议的目的是使该技术的利用更加广泛。
流感抗原微阵列的主要局限性是无法描述检测到的抗体的功能和动力学。微阵列检测出每种抗原的一组结合抗体。这些抗体可能在HAI和MN测定中中和病毒发挥作用,也可能不起作用。然而,HAI和MN检测需要活病毒培养,相关设施需要配备高级生物安全柜,以检测针对禽流感亚型的抗体,而蛋白质微阵列不涉及活病毒组件,因此可以在任何基本实验室使用。关于结合动力学,对血清进行单次稀释,其阵列包含每个抗原的单个浓度,产生一个数据点,该数据点表示与抗原结合的所有抗体所结合的数量和亲和力的复合.为了完全解决抗原-抗体结合动力学,需要多种抗原浓度和/或血清的连续稀释。
尽管存在这些限制,流感抗原微阵列是描述整个抗原环境中流感抗体广度的有用工具,可以补充在通量和可用性方面更为有限的功能性检测。
披露声明
作者没有披露。
致谢
作者要感谢Don Milton教授(马里兰大学应用公共卫生研究所,美国医学博士帕克学院)根据马里兰大学IRB协议收集人类血清#313842由DARPA N66001-18-2-4015 P00001资助。作者还感谢Florian Krammer教授(美国西奈山伊坎医学院)提供由ODNI IARPA DJF-15-1200-K-0001725资助的三聚体和NA抗原。S. Khan通过授予KL2 TR001416获得国家研究资源中心和国家卫生研究院国家转化科学促进中心的部分支持。内容完全由作者负责,不一定代表NIH的官方观点。
材料
| Name | Company | Catalog Number | Comments |
| 16-pad nitrocellulose-coated glass slides | Grace Bio Labs | 305016 | |
| 1x GVS FAST blocking buffer | Fischer Scientific | 10485356 | |
| ArrayCam portable imager | Grace Bio Labs | 400S | Other imaging devices can be used to visualize slides if capable of achieving the resolution of the microarray spots and the excitation and emission wavelengths of the quantum dots. |
| Biotin-conjugated goat anti-mouse-IgG antibody | Thermo Fischer | 31800 | |
| HiBase 384-well plate | Greiner Bio-One | T-3037-11 | |
| Microarray pins | ArrayIt | GMP2 | Each different microarray printer may require its own custom microarray pins. |
| Mouse monoclonal poly-His antibody | Sigma-Aldrich | H1029 | |
| OmniGrid 100 microarray printer | GeneMachines | The version of the microarray printer used in this work is no longer commercially available, but the updated similar equipment is the OmniGrid Accent microarray printer from Digilab (Hopkinton, MA), and the same protocol can be carried out with most commercially available microarray printers. | |
| ProPlate slide chambers | Grace Bio Labs | 246890 | |
| ProPlate slide clips | Grace Bio Labs | 204838 | |
| ProPlate slide frames | Grace Bio Labs | 246879 | |
| Quantum dot 585 nm conjugated goat anti-human-IgA antibody | Grace Bio Labs | 110620 | |
| Quantum dot 585 nm streptavidin conjugate | Thermo Fischer | Q10111MP | |
| Quantum dot 800 nm conjugated goat anti-human-IgG antibody | Grace Bio Labs | 110610 |
参考文献
- Murray, C. J., et al. Disability-adjusted life years (DALYs) for 291 diseases and injuries in 21 regions, 1990-2010: a systematic analysis for the Global Burden of Disease Study. Lancet. 380 (9859), 2197-2223 (2010).
- Renegar, K. B., Crouse, D., Floyd, R. A., Krueger, J. Progression of influenza viral infection through the murine respiratory tract: the protective role of sleep deprivation. Sleep. 23 (7), 859-863 (2000).
- Li, L., et al. Heterogeneity in Estimates of the Impact of Influenza on Population Mortality: A Systematic Review. American Journal of Epidemiology. 187 (2), 378-388 (2018).
- Fauci, A. S. Seasonal and pandemic influenza preparedness: science and countermeasures. Journal of Infectious Diseases. 194 Suppl 2, S73-S76 (2006).
- Duggal, A., Pinto, R., Rubenfeld, G., Fowler, R. A. Global Variability in Reported Mortality for Critical Illness during the 2009-10 Influenza A(H1N1) Pandemic: A Systematic Review and Meta-Regression to Guide Reporting of Outcomes during Disease Outbreaks. PLoS One. 11 (5), 2009-2010 (2016).
- Demicheli, V., Jefferson, T., Ferroni, E., Rivetti, A., Di Pietrantonj, C. Vaccines for preventing influenza in healthy adults. Cochrane Database Systematic Reviews. 2, CD001269 (2018).
- Erbelding, E. J., et al. A Universal Influenza Vaccine: The Strategic Plan for the National Institute of Allergy and Infectious Diseases. Journal of Infectious Diseases. , (2018).
- Xie, H., et al. H3N2 Mismatch of 2014-15 Northern Hemisphere Influenza Vaccines and Head-to-head Comparison between Human and Ferret Antisera derived Antigenic Maps. Scientific Reports. 5, 15279 (2015).
- Tricco, A. C., et al. Comparing influenza vaccine efficacy against mismatched and matched strains: a systematic review and meta-analysis. BMC Medicine. 11, 153 (2013).
- Katz, J. M., Webster, R. G. Efficacy of inactivated influenza A virus (H3N2) vaccines grown in mammalian cells or embryonated eggs. Journal of Infectious Disease. 160 (2), 191-198 (1989).
- Zost, S. J., et al. Contemporary H3N2 influenza viruses have a glycosylation site that alters binding of antibodies elicited by egg-adapted vaccine strains. Proceedings of the National Academy of Science. 114 (47), 12578-12583 (2017).
- Davies, D. H., et al. Profiling the humoral immune response to infection by using proteome microarrays: high-throughput vaccine and diagnostic antigen discovery. Proceedings of the National Academy of Science U. S. A. 102 (3), 547-552 (2005).
- Liang, L., Felgner, P. L. A systems biology approach for diagnostic and vaccine antigen discovery in tropical infectious diseases. Current Opinion in Infectious Diseases. 28 (5), 438-445 (2015).
- Jain, A., et al. Evaluation of quantum dot immunofluorescence and a digital CMOS imaging system as an alternative to conventional organic fluorescence dyes and laser scanning for quantifying protein microarrays. Proteomics. 16 (8), 1271-1279 (2016).
- Desbien, A. L., et al. Development of a high density hemagglutinin protein microarray to determine the breadth of influenza antibody responses. Biotechniques. 54 (6), 345-348 (2013).
- Mace, C. R., et al. Label-free, arrayed sensing of immune response to influenza antigens. Talanta. 83 (3), 1000-1005 (2011).
- Koopmans, M., et al. Profiling of humoral immune responses to influenza viruses by using protein microarray. Clinical and Microbiology Infections. 18 (8), 797-807 (2012).
- Bucukovski, J., Latorre-Margalef, N., Stallknecht, D. E., Miller, B. L. A Multiplex Label-Free Approach to Avian Influenza Surveillance and Serology. PLoS One. 10 (8), e0134484 (2015).
- Meade, P., Latorre-Margalef, N., Stallknecht, D. E., Krammer, F. Development of an influenza virus protein microarray to measure the humoral response to influenza virus infection in mallards. Emerging Microbes and Infection. 6 (12), e110 (2017).
- Vigil, A., Davies, D. H., Felgner, P. L. Defining the humoral immune response to infectious agents using high-density protein microarrays. Future Microbiology. 5 (2), 241-251 (2010).
- Nakajima, R., et al. Protein Microarray Analysis of the Specificity and Cross-Reactivity of Influenza Virus Hemagglutinin-Specific Antibodies. mSphere. 3 (6), (2018).
- Van Hoeven, N., et al. A Formulated TLR7/8 Agonist is a Flexible, Highly Potent and Effective Adjuvant for Pandemic Influenza Vaccines. Scientific Reports. 7, 46426 (2017).
- Krammer, F., et al. A carboxy-terminal trimerization domain stabilizes conformational epitopes on the stalk domain of soluble recombinant hemagglutinin substrates. PLoS One. 7 (8), e43603 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。