需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用核酸探针进行核酸活性的动力学筛选
* 这些作者具有相同的贡献
摘要
改变的核酸酶活性与不同的人类条件有关,这是其作为生物标志物的潜力的基础。本文提出的模块化且易于实施的筛选方法允许选择特定的核酸探针,以利用核酸酶活性作为疾病的生物标志物。
摘要
核酸酶是一类酶,通过催化连接核糖的磷酸键的水解来分解核酸。核酸酶在原核生物和真核生物中表现出各种重要的生理作用,从保持基因组稳定到提供对病原体的保护。改变的核酸酶活性与几种病理疾病有关,包括细菌感染和癌症。为此,核酸酶活性显示出作为特定生物标志物被开发的巨大潜力。然而,基于此活动的可靠和可重复的筛选方法仍然非常可取。
本文介绍一种利用核酸探针作为基质进行核酸活性筛选的方法,其范围是区分病理条件和健康条件。此方法提供了以迭代方式设计新的探测库的可能性,其特异性也越来越高。因此,利用化学修饰的核酸的可用性,需要进行多轮筛选,以增强特性改进探针的设计。所拟提出的技术的巨大潜力在于其灵活性、高可重复性和用于筛查与疾病条件相关的核酸酶活性的多功能性。预计这项技术将开发有前途的诊断工具,在临床上具有巨大的潜力。
引言
核酸酶是一类酶,能够分解形成核酸分子骨干结构的磷酸键。核酸酶的多样化使得它们的分类相当困难。然而,有一些常用的标准用于描述核酸酶,如基质偏好(脱氧核糖核酸(DNA)或核糖核酸(RNA)),裂解位点(内糖酶或外糖酶),或金属组依赖,等等1。核酸酶是高度保守的催化酶,在原核生物和真核生物中具有基本作用,并已作为基因编辑工具2使用并继续使用。他们也是DNA维护和复制的基本参与者,帮助保持基因组稳定和参与校对过程3。例如,在细菌中,核酸酶被确定为重要的毒治因素,能够通过降低宿主免疫系统4、5、6、7的功效来促进细菌生存。,8.在哺乳动物中,核酸酶被建议与凋亡9、线粒体生物生成和维持10和抗菌和抗病毒先天免疫反应的中介有关11。毫不奇怪,核酸酶活性的改变,无论是增强还是缺乏,都与广泛的人类疾病有关。这些疾病范围从多种癌症12,13到心脏肥大10或自身免疫性疾病14。因此,核酸酶已成为人类异常群体的生物标志物,成为有趣的候选物。事实上,核酸酶已经显示出其作为检测特定细菌制剂(如金黄色葡萄球菌或大肠杆菌15)引起的感染的成功诊断工具的潜力。 16.在许多癌症类型中,葡萄球菌类核酸酶领域含微糖蛋白1(SND1)核糖酸酶的表达表明预后不佳17。在胰腺癌患者中,升高的核糖核酸I(RNase I)血清水平已报告18,并提议与癌细胞表型19相关。在缺血性心脏疾病中,如心肌梗死或不稳定的心绞痛,脱氧核糖核酸I(DNase I)血清水平已被证明是有效的诊断标记20,21。
据推测,在健康和疾病状态中,核酸酶活性的全球蓝图可能有所不同。事实上,最近的报告已经利用核酸酶活性的差异来区分健康表型22或以特定物种15、23的方式识别致病性细菌感染。这些发现为利用核酸酶作为疾病的生物标志物开辟了一条新途径。因此,有必要开发一种全面的筛选方法,能够系统地查明核酸酶活动中与疾病相关的差异,这可能对开发新的诊断工具至关重要。
在此,我们介绍并描述了一种新的体外筛选方法(图1),以识别敏感和特定的探针,这种探针能够区分健康不健康中的核酸酶活性,或特定于某类细胞或细菌的活动。利用核酸的模块化,我们设计了一个初始的淬火荧光寡核苷酸探针库,该库由一套全面的不同序列和化学成分组成,都是库设计的重要参数。这些寡核苷酸探针的两侧分别有荧光团(氟辛石、FAM)和5'和3'端的环流(潮汐淬火2,TQ2)(表1)。通过使用这种基于荧光共振能量转移 (FRET) 的荧光测定来测量酶降解动力学,我们能够识别具有识别核酸酶活性差异模式的候选探针与健康或疾病状态相关。我们设计了一个迭代过程,其中基于最佳候选探测器创建新库,从而可以在后续筛选步骤中识别更具体的候选探测器。此外,这种方法利用核酸酶的催化性质来增加灵敏度。这是通过利用报告器探针的可激活性以及核酸酶持续处理基质分子的能力来实现的,这两者都代表了替代抗体或基于小分子的筛选方法的关键优势。
这种方法提供了一个高度模块化,灵活和易于实施筛选工具,用于识别能够区分健康状态和疾病状态的特定核酸探针,并为开发新的可适应未来临床应用的诊断工具。因此,这种方法用于识别从沙门氏菌(以下简称沙门氏菌)衍生的核酸酶活性,以特定鉴定这种细菌。在下面的协议中,我们报告一种使用动力学分析筛选细菌核酸酶活性的方法。
研究方案
1. 橄榄核苷酸库的设计与准备
- 图书馆设计
- 根据以下标准设计一个8至12mer长的淬火荧光寡核苷酸探针库,以避免二次结构形成,所有探头的长度相等。
- 包括至少一个DNA和一个RNA随机序列,其中包含腺苷(A)、瓜宁(G)、细胞氨酸(C)和胸腺(T)/尿(U)(表1中的DNA和RNA探针的组合)。
注:表1中描述的DNA和RNA序列作为对未知核酸酶活性(DNase或RNase)进行分类的初始基质非常有用。这两个序列被推荐作为任何筛选的起点,因为它们已经显示出在细菌和组织样本中检测核酸酶活性谱的广泛能力。如果这些DNA和RNA序列未观察到核酸酶活性,则需要设计额外的寡核苷酸。 - 包括由单一核苷酸组成的多核苷酸序列,以确定给定核酸酶活性的序列依赖性(DNA-Poly A、DNA-Poly T、DNA-Poly C、DNA-Poly G、RNA-Poly A、RNA-Poly U、RNA-Poly C 和RNA-Poly G)。
- 使用与初始DNA和RNA序列相同的核苷酸残留序列,包括含有核苷类化合物的序列,这些序列在核糖糖的2'位置(如2'-Fluoro和2'-O-甲基)具有化学修饰,作为严格的步骤增加核酸酶的选择性。
- 包括完全由2'-氟核苷模拟或2'-O-甲基核苷模拟(所有2'-F和所有2'-OMe,表1)组成的完全修改的序列。
- 包括由未经修饰的天然紫杉醇和2'-氟比米丁核苷模拟(RNA Pyr-2'F,表1)组成的嵌合序列。
- 包括由未经修饰的天然紫杉醇和2'-O-甲基苯丙胺核苷模拟(RNA Pyr-2'OMe,表1)组成的嵌合序列。
- 包括由未经修饰的天然丙胺和2'-氟尿素核苷类比(RNA Pur-2'F,表1)组成的嵌合序列。
- 包括由未经修饰的天然丙胺和2'-O-甲基紫杉醇核苷模拟物(RNA Pur-2'OMe,表1)组成的嵌合序列。
- 包括至少一个DNA和一个RNA随机序列,其中包含腺苷(A)、瓜宁(G)、细胞氨酸(C)和胸腺(T)/尿(U)(表1中的DNA和RNA探针的组合)。
- 根据以下标准设计一个8至12mer长的淬火荧光寡核苷酸探针库,以避免二次结构形成,所有探头的长度相等。
- 寡核苷酸探针制备和储存
注:寡核苷酸由磷酰胺石法合成。合成后,使用高性能液相色谱(HPLC)纯化寡核苷酸,并通过质谱测量质量。- 使用离心机将冻干寡核苷酸探针向下旋转,并在Tris-EDTA(TE)缓冲液中稀释,以防止核酸酶降解。根据每个探头的收率确定稀释体积,以呈现浓度为 500 pmol/μL 的库存溶液。
- 短期储存在4°C或室温下冻干寡核苷酸。对于长期储存(月到年),在-20°C储存冻干寡核苷酸。在TE中重新悬浮冻干寡核苷酸后,将库存溶液储存在-20°C,或优选在-80°C储存。
2. 细菌培养
- 在无菌条件下从低温储存小瓶中取一个多孔玻璃珠。
- 要分离单个细菌菌落(沙门氏菌和大肠杆菌),使用象限方法24,将珠子直接条纹/滚动到含有试皮大豆Agar(TSA)介质的培养皿上,并辅以脱脂羊血。
- 在37°C孵育培养24小时。
3. 超上准备
- 将单个菌落从固体介质转移到 50 mL 试皮大豆汤 (TSB),并在 37°C 下在 200 rpm 下孵育 24 小时。
- 稀释TSB(亚培养)中的培养(1:500),在37°C下在摇动的培养箱中以200rpm孵育24小时。
注:预计24小时后,细菌培养物处于静止相位,达到高于109 CFU/mL的值。 - 潜伏期后,将培养物转移到盖上无菌管和离心机4,500 x g30分钟。
- 收集上清液并立即使用。或者,将上生物储存在4°C或-20°C。
4. 核酸酶活性测定
- 工作解决方案的准备
- 通过稀释(1:10 比)库存溶液(500 pmol/μL),为1.5 mL无核酸微离心管中的每个探头制备20 μL工作溶液,最终工作浓度为50 pmol/μL。为此,将含有MgCl2和CaCl2的18 μL磷酸盐缓冲液盐碱(PBS)与2μL探针剂溶液混合。
注:请注意,在工作溶液中,寡核苷酸更容易受到核酸酶降解的影响,因此,建议在设置反应之前准备工作溶液。 - 在制备过程中避免直接接触,并在处理荧光管时保持黑暗(用箔纸包裹)。
- 通过稀释(1:10 比)库存溶液(500 pmol/μL),为1.5 mL无核酸微离心管中的每个探头制备20 μL工作溶液,最终工作浓度为50 pmol/μL。为此,将含有MgCl2和CaCl2的18 μL磷酸盐缓冲液盐碱(PBS)与2μL探针剂溶液混合。
- 反应设置
- 将荧光计预热(例如,环流 1)至 37°C。
- 为每个样品(TSB、大肠杆菌和沙门氏菌)制备一套(一管/探针)的1.5 mL无核酸酶微离心管,并贴上相应的标签。
- 小心地加入96 μL的TSB无菌培养培养物、沙门氏菌上清液或大肠杆菌上清液(从步骤3.4中)。随后,相应地添加4 μL/管探头工作溶液。在室温下执行此步骤。
注:第一轮筛选使用了10个探头,第二轮使用了6个探头。 - 通过上下移液彻底混合,获得均匀的溶液。混合时避免将气泡引入样品中。
- 将每个溶液(探针 + 上清或培养层)的 95 μL 加载到黑色底部、未经处理的 96 孔板的单独孔中。装载时,通过小心地分配靠近井壁的尖端,尽量减少井中气泡的形成。
- 用盖子盖住盘子。目视检查盖子并检查笔标记或灰尘颗粒堆积,这些标记或灰尘颗粒堆积可能引入测量伪影。如果是这种情况,请更换新盖的盖子。
- 测量设置
- 单击软件快捷方式图标 (图 S1A) 打开获取软件 (Gen5 3.05)。
- 选择"立即从任务管理器"窗口中阅读,然后选择"新建..."以创建动力学测量协议 (图 S1B)。
- 单击标题为"过程"的对话框窗口中的"设置温度",然后选择 37 °C。按"确定"(图 S1C)确认并保存设置。
- 单击标题为"过程"的对话框窗口中的"开始动力学"。然后在名为"动能步骤"的弹出式对话框窗口中,在"运行时"输入框中选择 2 小时,在"间隔输入"框中选择 2 分钟。按"确定"(图 S1D)确认并保存设置。
- 单击标题为"过程"的"阅读"。然后在名为"读取方法"的弹出式对话框窗口中,选择荧光强度作为检测方法,将端点/动力学作为读取类型,将滤波器作为光学类型。按"确定"(图 S1E)确认并保存设置。
- 在标题为"读取步骤(动能)"的弹出式对话框窗口中,从"筛选器集"中选择"绿色"。按"确定"(图 S2A)确认并保存设置。
- 在标题为"过程"的对话框窗口中,选择"使用盖子"并单击"验证"以确保创建的协议有效。这由一个弹出窗口(图S2B)确认。
- 在菜单栏中选择协议并选择过程(图 S2C)。
- 在标题为"过程"的对话框窗口中,定义要测量的井 (图 S2D)。
- 在文件名输入框中输入实验名称 (图 S2E)。
- 将带盖子的板装入板式读卡器中。确保板的方向正确。
- 单击工具栏中的"读取新按钮"(图 S2F)开始获取。
- 数据分析
- 单击对话框窗口中标题为"板 1"(图 S3A)中的测量井之一。
- 单击选择井,并在"井选择"对话框窗口中包括所有测量的井。请按"确定"确认并保存设置。(图 S3B)
- 在标题为"板 1"的对话框窗口中选择数据以可视化表格结果(图 S3C)。
- 通过从上下文菜单中选择快速导出将数据导出到跨页表 (图 S3C)。
- 在页散工作表中,为每个样本和探测标记相应的数据列。
- 通过绘制相对荧光单位 (RFU) 与时间(x 轴:反应的时间线和 y 轴:RfUs),使用具有标记样式的线生成动力学图。
注: 使用电子表格程序(例如 Excel)时,生成图形的说明适用。但是,任何其他程序都可用于通过绘制 RFU 与时间之间的原始数据生成图形。 - 根据以下公式25计算每个测量间隔的酶反应速率:速率*,
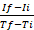 其中If在最大间隔时间点为 RFU,Ii 在最小间隔时间点为 RFU,Tf 和Ti分别是最大和最小间隔时间点。
其中If在最大间隔时间点为 RFU,Ii 在最小间隔时间点为 RFU,Tf 和Ti分别是最大和最小间隔时间点。 - 为每个曲线选择具有最高值 (R最大值) 的速率。如果每个样本有多个 R最大值,请选择在最早测量时间点发生的 R 最大值。
- 计算 R最大值与发生 R最大值的时间间隔的平均值之间的比率:速率系数 |
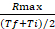
- 计算每个探针的沙门氏菌和大肠杆菌的速率系数之间的折差 (FD)。
- 将高于 3 的折差值视为显著值。
- 将具有最高折叠差值 (FD) 的重要探头作为候选探头,并作为下一轮筛选中库设计的基础。
5. 筛选轮选择标准 (图 1)
- 第一轮筛选
- 使用DNA、RNA和多核苷酸探针进行核酸酶活性测定(如第4节所述)。
- 通过比较DNA和RNA候选探针的数量和性能(FD值),评估DNA化学或RNA化学的偏好。
- 选择核酸化学的类型,呈现最多的候选探针,如图1所示。
- 第二轮筛选
- 使用完全修饰的探针和嵌合探针,根据第一轮筛选中选定的核酸基板设计,执行核酸活性测定(如第 4 节所述)。
- 通过比较2'-Fluoro和2'-O-甲基改性候选探针获得的结果,评估对含有2'-Fluoro和2'-O-甲基核苷类比的序列的偏好。
- 选择核苷模拟修改的类型,呈现数量最多的候选探头,如图1所示。
结果
图 1显示了此方法的工作流程,该方法分为两个筛选轮。在第一轮筛选中,我们使用5个DNA探针(DNA、DNA聚A、DNA聚A、DNA聚子和DNA聚氨酯)和5个RNA探针(RNA、RNA聚A、RNA聚Dna聚氨酯和RNA聚氨酯)。本筛选轮的原始数据可在补充表 1 中找到。在第二轮中,通过用化学修饰的核苷(所有2'-Fluoro和所有2'-O甲基)替换RNA序列,或者结合RNA和纯化或化学修饰的紫杉醇(RNA Pyr-2...
讨论
核酸酶活性的改变与各种各样的疾病表型有关,包括不同类型的癌症和细菌感染。这些改变被建议为一个条件14的致病剂,而在其他情况下,它们是有害生理事件20或致病剂16,26的结果。毫不奇怪,使用核酸酶和核酸酶活性作为诊断生物标志物的尝试被描述为15,22,23,26,具有相当大的前景。
披露声明
作者没有什么可透露的。
致谢
作者要感谢路易莎·埃尔南德斯(林克平大学)对手稿的认真修订和宝贵建议。这项工作得到了克努特和爱丽丝·沃伦贝格基金会以及瑞典政府战略研究区在林雪平大学高级功能材料材料战略研究区的支持(学院授予SFO-Mat-LiU No.2009-00971)。
材料
| Name | Company | Catalog Number | Comments |
| Black bottom, non-treated 96 well plate | Fisher Scientific | 10000631 | |
| Cytation1 | BioTek | CYT1FAV | |
| Eppendorf tubes | Thermofisher | 11926955 | |
| Escherichia coli | ATCC | 25922 | |
| Microbank cryogenic storage vial containing beads | Pro-Lab Diagnostics | 22-286-155 | |
| Nucleic acid probes | Biomers.net | # | |
| Phosphate Buffer Saline containing MgCl2 and CaCl2 | Gibco™ | 14040117 | |
| Salmonella enterica subs. Enterica | ATCC | 14028 | |
| Tris-EDTA | Fisher Scientific | 10647633 | |
| Tryptone Soya Agar with defibrinated sheep blood | Thermo Fisher Scientific | 10362223 | |
| Tryptic Soy Broth | Sigma Aldrich | 22092 |
参考文献
- Yang, W. Nucleases: diversity of structure, function and mechanism. Quarterly Reviews of Biophysics. 44 (1), 1-93 (2011).
- Adli, M. The CRISPR tool kit for genome editing and beyond. Nature Communication. 9 (1), 1911 (2018).
- Mason, P. A., Cox, L. S. The role of DNA exonucleases in protecting genome stability and their impact on ageing. Age (Dordr). 34 (6), 1317-1340 (2012).
- Berends, E. T., et al. Nuclease expression by Staphylococcus aureus facilitates escape from neutrophil extracellular traps. Journal of Innate Immunity. 2 (6), 576-586 (2010).
- Kiedrowski, M. R., et al. Staphylococcus aureus Nuc2 is a functional, surface-attached extracellular nuclease. PLoS One. 9 (4), 95574 (2014).
- Morita, C., et al. Cell wall-anchored nuclease of Streptococcus sanguinis contributes to escape from neutrophil extracellular trap-mediated bacteriocidal activity. PLoS One. 9 (8), 103125 (2014).
- Hasegawa, T., et al. Characterization of a virulence-associated and cell-wall-located DNase of Streptococcus pyogenes. Microbiology. 156, 184-190 (2010).
- Moon, A. F., et al. Structural insights into catalytic and substrate binding mechanisms of the strategic EndA nuclease from Streptococcus pneumoniae. Nucleic Acids Research. 39 (7), 2943-2953 (2011).
- Li, L. Y., Luo, X., Wang, X. Endonuclease G is an apoptotic DNase when released from mitochondria. Nature. 412 (6842), 95-99 (2001).
- McDermott-Roe, C., et al. Endonuclease G is a novel determinant of cardiac hypertrophy and mitochondrial function. Nature. 478 (7367), 114-118 (2011).
- Wang, Y. T., et al. A link between adipogenesis and innate immunity: RNase-L promotes 3T3-L1 adipogenesis by destabilizing Pref-1 mRNA. Cell Death & Disease. 7 (11), 2458 (2016).
- Li, C. L., Yang, W. Z., Shi, Z., Yuan, H. S. Tudor staphylococcal nuclease is a structure-specific ribonuclease that degrades RNA at unstructured regions during microRNA decay. RNA. 24 (5), 739-748 (2018).
- Wan, L., et al. MTDH-SND1 interaction is crucial for expansion and activity of tumor-initiating cells in diverse oncogene- and carcinogen-induced mammary tumors. Cancer Cell. 26 (1), 92-105 (2014).
- Keyel, P. A. Dnases in health and disease. Developmental Biology. 429 (1), 1-11 (2017).
- Hernandez, F. J., et al. Noninvasive imaging of Staphylococcus aureus infections with a nuclease-activated probe. Nature Medicine. 20 (3), 301-306 (2014).
- Flenker, K. S., et al. Rapid Detection of Urinary Tract Infections via Bacterial Nuclease Activity. Molecular Therapy. 25 (6), 1353-1362 (2017).
- Kannan, N., Eaves, C. J. Tipping the balance: MTDH-SND1 curbs oncogene-induced apoptosis and promotes tumorigenesis. Cell Stem Cell. 15 (2), 118-120 (2014).
- Kemmer, T. P., Malfertheiner, P., Buchler, M., Kemmer, M. L., Ditschuneit, H. Serum ribonuclease activity in the diagnosis of pancreatic disease. International Journal of Pancreatology. 8 (1), 23-33 (1991).
- Fernandez-Salas, E., Peracaula, R., Frazier, M. L., de Llorens, R. Ribonucleases expressed by human pancreatic adenocarcinoma cell lines. European Journal of Biochemistry. 267 (5), 1484-1494 (2000).
- Fujibayashi, K., et al. Serum deoxyribonuclease I activity can be a useful diagnostic marker for the early diagnosis of unstable angina pectoris or non-ST-segment elevation myocardial infarction. Journal of Cardiology. 59 (3), 258-265 (2012).
- Kawai, Y., et al. Diagnostic use of serum deoxyribonuclease I activity as a novel early-phase marker in acute myocardial infarction. Circulation. 109 (20), 2398-2400 (2004).
- Hernandez, L. I., Ozalp, V. C., Hernandez, F. J. Nuclease activity as a specific biomarker for breast cancer. Chemical Communication (Cambridge). 52 (83), 12346-12349 (2016).
- Machado, I., et al. Rapid and specific detection of Salmonella infections using chemically modified nucleic acid probes. Analytica Chimica Acta. 1054, 157-166 (2019).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiment. (63), e3064 (2012).
- Worthington Biochemical Corporation. . Manual of Clinical Enzyme Measurements. , (1972).
- Burghardt, E. L., et al. Rapid, Culture-Free Detection of Staphylococcus aureus Bacteremia. PLoS One. 11 (6), 0157234 (2016).
- Bibette, J. Gaining confidence in high-throughput screening. Proceedings of the National Academy of Science U. S. A. 109 (3), 649-650 (2012).
- Hernandez, L. I., Machado, I., Schafer, T., Hernandez, F. J. Aptamers overview: selection, features and applications. Current Topics in Medicinal Chemistry. 15 (12), 1066-1081 (2015).
- Pande, J., Szewczyk, M. M., Grover, A. K. Phage display: concept, innovations, applications and future. Biotechnology Advances. 28 (6), 849-858 (2010).
- Skerra, A. Alternative binding proteins: anticalins - harnessing the structural plasticity of the lipocalin ligand pocket to engineer novel binding activities. FEBS Journal. 275 (11), 2677-2683 (2008).
- Ku, T. H., et al. Nucleic Acid Aptamers: An Emerging Tool for Biotechnology and Biomedical Sensing. Sensors (Basel). 15 (7), 16281-16313 (2015).
- Jayasena, S. D. Aptamers: an emerging class of molecules that rival antibodies in diagnostics. Clinical Chemistry. 45 (9), 1628-1650 (1999).
- Gray, B. P., Brown, K. C. Combinatorial peptide libraries: mining for cell-binding peptides. Chemical Reviews. 114 (2), 1020-1081 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。