Method Article
人卵成熟度评估及其临床应用
摘要
我们使用偏振光显微镜为非侵入性评估人类卵子成熟度提供临床方案大纲。
摘要
细胞内质精子注射(ICSI)的最佳时机是生育计划的一个严重问题,因为过早的精子进入会削弱卵子的发育能力。第一极体 (PB) 与中心主轴的存在表明卵母细胞成熟完成和卵子受精的准备。在临床实践中,通常假设所有显示PB的卵母细胞都是成熟的元相(MII)卵母细胞。然而,PB挤出之前形成双极MII主轴。这种异步性使得仅仅存在PB就成为卵母细胞成熟度的不可靠标记。使用偏振光显微镜 (PLM) 进行非侵入性主轴成像,可快速轻松地检查 PB 显示卵母细胞在 ICSI 之前是否实际重新组装了微缩主轴。在这里,我们提出了在临床实验室中执行人类卵子成熟度评估的标准方案。我们还展示了如何优化ICSI在卵母细胞发育阶段的时间,以防止晚熟卵母细胞过早精子注射。使用这种方法,即使是不成熟的卵母细胞在体外挤出PB也可以临床利用。确认MII主轴在精子注射之前存在,在预后不良体外受精(IVF)周期中,用于受精的卵母细胞数量少,对ICSI时间的个体调整尤为重要。
引言
要成为可受精的单倍体卵子,双倍体卵母细胞必须将其一半的遗传信息挤出到一个相邻的细胞中,称为第一极体(PB),并在双极元相II(MII)主轴的赤道中对齐染色体。虽然传统光显微镜可以清楚地观察到PB,但遗传材料和细胞骨骼结构的检测通常需要与卵母细胞进一步用于生育治疗的侵入性准备程序不相容。因此,在临床实践中,PB的存在被认为是卵母细胞成熟的标志。然而,在人类卵母细胞成熟期间微管和染色体动力学的实时成像显示,PB在双极MII主轴组装和染色体对齐前几个小时变得可见。然而,在透射光中,MII的卵子与刚刚进入染色体分离过程的卵母细胞没有区别。因此,一组卵母细胞,仅基于PB的存在被归类为MII卵母细胞,可能含有尚未完成发育的晚熟卵母细胞,因此尚未做好受精准备。
卵母细胞成熟延迟可能影响在刺激周期2中意外收集的MII卵母细胞数量少和未成熟卵母细胞比例高的不良反应者群体。在体内,只有一个单一的,最好的质量的鸡蛋达到成熟,并成为排卵。在体外受精(IVF)周期中,受控卵巢过度刺激用于招募多个卵母细胞进行成熟。戈纳多品激增触发恢复的美能程序和卵子祖体应该在36小时内达到MII逮捕阶段3。然而,从前卵泡中检索到的卵母细胞通常构成PB显示MII卵母细胞和未成熟的卵母细胞的分类,无论是在元相I(MI)或发芽囊泡阶段(GV)(图1)。只有 MII 卵母细胞接受细胞内质精子注射 (ICSI),而未成熟的卵母细胞通常被丢弃。然而,在体外培养时,通常观察到MI卵母细胞在体外挤出PB。尽管它们普遍自卑,但晚熟的卵母细胞在通宵培养期间自发地完成了第一次美尿分裂,但已被成功用作最后一个资源卵母细胞,并且活产报告有4,5个 ,6,7,8.因此,精子的过早注射可能是导致晚熟卵母细胞发育不良的主要原因,这些卵母细胞在以前的研究9、10、11中报告。
极化光显微镜 (PLM) 与图像处理软件相结合,可对活卵母细胞中的中心主轴进行非侵入性可视化。双反射是由偏振光束与构建双极轴的微管的高度有序装配相互作用产生的。由于偏振光是正常强度,该技术可以安全地用于临床设置,以查看分裂装置11,12,13,14的动态。卵母细胞内MII主轴双旋度的存在已被确定为卵子发育能力9、15、16、17、18的标志。 19,20,21,22,23。因此,在临床实践11、14、20中,建议将非侵入性美西主轴成像用于卵子质量控制。
由于卵母细胞细胞间微管动力学的时间线已经解决1,观察到的PLM模式可以更好地与MI到MII转换的时间过程相关。在 PB 排放后不久,新生的 MII 主轴就变得无法被 PLM 检测到。然而,如果卵母细胞保存在培养物中,当双极MII主轴重新组装9,10,11时,双核信号可能会出现。因此,在卵母细胞在体外挤出PB时,主轴的缺失可能只是暂时对应于晚熟卵母细胞从MI阶段到MII阶段的生理过渡。如果 MII 主轴信号检测不到,精子注射可以推迟到稍后的时间点,为 MII 主轴形成提供额外时间。ICSI时间的PLM辅助优化,最大限度地利用晚熟卵母细胞的机会,对预后差的患者9产生影响。
下面,我们提供如何在人类卵母细胞中执行非侵入性主轴成像的分步协议。我们还演示了如何使用 PLM 来避免晚熟卵母细胞过早受精的风险。
研究方案
该协议描述了临床程序,这是标准IVF治疗的"附加"。它应由有经验的人员按照良好的实验室实践和临床指南24、25进行。建议获得合格患者的书面知情同意。该议定书得到机构道德委员会的批准。
1. 取卵和脱蛋
- 诱导卵巢刺激使用传统的刺激方案3。调整剂量到个人反应。当两个或两个以上卵泡,通过超声波扫描,达到直径18毫米,诱导卵母细胞成熟与应用250μg人类胆囊性促性腺激素(hCG)。在 hCG 注射后 35-36 小时安排卵母细胞拾取 (OPU)。
- 在 CO2独立处理介质(材料表)中收集检索到的积聚物-卵母细胞复合物 (COCs)。在CO2独立培养箱中短暂孵化期(10~15分钟)后,将收集的COC短暂(最多30秒)暴露于透明质尿酶溶液(材料表)。在立体显微镜下,通过用200μL滤波尖轻轻移液COCs,机械地去除积液-冠状细胞。
- 使用直径逐渐减小(200 μm、180 μm 和 150 μm)的脱脂微管器,从剩余的卵泡细胞中轻轻剥离卵母细胞,并在处理介质中清洗卵母细胞 3x。
- 根据细胞核和第一PB的存在或不存在,评估脱卵母细胞的数量和发育状况(图1)。
- 检查 PLM 考试的包含标准。如果 (1) 在 OPU 收集的小于 6 MII 卵母细胞对常规刺激有意外的不良反应,以及 (2) 以前受精失败或卵母细胞不成熟的历史,则执行卵子成熟度评估。
- 将GV、MI和MII卵母细胞放入IVF盘中的单独井中,每个井含有500μL的预平衡CO2依赖培养基(材料表),上面覆盖着矿物油(材料表)。
- 在5%O2和6%CO2的加湿气氛中,在37°C下再孵育3⁄4小时。
2. 为PLM考试和随后的ICSI做好准备
注:此处提供的协议描述了使用 OCTAX 极地 AIDE 系统 (材料表) 执行的 PLM 评估。或者,也可以使用其他市售的主轴视图系统。
- 准备胚胎培育板。
- 根据要检查的卵母细胞数量(MII 卵母细胞总数和 MI 卵母细胞在预孵育期间挤出 PB),准备 4 孔板或 12 孔板,分别用 500 μL 或 30 μL 培养基填充每个孔,并覆盖先前平衡的矿物油。
- 确保培养介质和矿物油在CO2培养箱中一夜之间得到平衡。将准备好的培养皿保存在CO2依赖培养箱中至少2小时。如有必要,请为井数,以跟踪单个卵母细胞的发育命运。
- 准备ICSI菜。
- 使用指定的塑料盘,为每个显示 PB 的卵母细胞制作 5 μL 预加热处理介质的滴,以及用于针清洗的额外滴。在ICSI(在ICSI之前添加精子)和预加热矿物油叠加之前,为精子固定制作一个额外的聚乙烯醇酮(PVP)溶液(PVP)溶液(材料表)。
- 将准备好的ICSI培养皿保存在CO2独立培养箱中至少20分钟。 如有必要,在ICSI之后,为井数以跟踪卵母细胞。
- 准备 PLM 检查盘。
- 使用分配的玻璃底盘,为每个显示 PB 的卵母细胞制作 5 μL 预加热处理介质液滴。覆盖预加热矿物油。
- 将培养皿保存在CO2独立培养箱中至少20分钟。必要时,在PLM检查后,为卵母细胞进行跟踪。
- 设置显微镜,以便进行 PLM 检查。
- 提前在倒置显微镜上切换加热台,以实现正确的加热温度。在微操作过程中,确保准确调整设置,使 PLM/ICSI 盘中的处理介质液滴保持 37 °C。
- 将无菌保持和 ICSI 针头放入显微注射支架,并加以聚焦。或者,使用孵化针。
- 选择适当的物镜(20x 和 25x 是最适合的),并确保冷凝器处于明亮的场位。
- 插入绿色干涉滤波器(指示灯变为绿色),并将液晶分析滑块设置为工作位置。
- 将快门设置为 ±50%,并调整圆形偏振器以降低背景噪音。
- 设置计算机准备进行 PLM 检查。
- 启动成像软件。
- 选择视频 |视频源 |极性在顶部菜单栏的视频菜单中。
- 切换到实时视频,转到视频页面,并通过点击视频工具栏中的图标(补充图1)来激活主轴和 zona 分析。
- 选择主轴成像期间动态缩放的显示模式:(1) 红色(双色)/绿色(背景)组合视图,或 (2) 白色(双色)/和黑色(背景)视图。动态评分模式用于自动评分的zona pellucida。
3. 鸡蛋成熟度检查
- 预孵育期(3⁄4 小时)后,在 ICSI 标准时间(hCG 触发后 39–40 小时)进行 PLM 检查,揭示卵母细胞成熟度状态。
- 将所有卵母细胞转移到 PLM 盘上的单个液滴中,并将其置于为主轴成像准备的倒置显微镜下。在开始检查之前,请记得从玻璃底盘上取下塑料盖。
- 将第一个卵母细胞聚焦。如果难以在绿灯下搜索单元格,则暂时拉出绿色滤镜。在分析之前,请确保插入绿色过滤器。
- 观察检测到的卵母细胞双色图像(绿色背景上的红色/橙色),因为它经过计算机处理,并在计算机屏幕上实时显示。请记住,信号在目镜中不可见。
- 如果宣布曝光过低/过高的消息弹出,请使用显微镜的光强旋钮将亮度调整到适当的强度。
- 使用保持针和 ICSI 指针转动卵母细胞,使 PB 处于 12 点钟位置,并将焦点聚焦到 PB。
- 如果在 PB 附近一见钟极,则通过稍微接触区域,轻轻转动每个轴周围的卵母细胞,以确保极化光与阵列主轴纤维对齐(补充视频)).宣布 MII 主轴不存在,只要卵母细胞未显示主轴信号,尽管旋转严格。
- 根据观察到的双核形态,将卵母细胞分为以下类别(图2):(A)具有双极桶形MII主轴明亮信号的卵母细胞,其边界清晰划定,甚至分布于双核;(B) 具有变形、极性和半透明 MII 主轴的卵母细胞,具有不规则的边界和信号分布不均匀;(C) 卵母细胞,在卵母体中无可检测的MII主轴双重质; (D) aa相 I/端相 I 卵母细胞,显示微管桥(第一 PB 和卵母细胞之间的连接链),而不是 MII 主轴。
注: 具有可检测 MII 主轴信号(A 级或 B 级)的卵母细胞适用于即时 ICSI。 - 拍摄快照 (F9) 或录制视频以进行报告和/或后续图像分析。保留图像模式的文档,以减少操作员的主观性。
- 移动到下一个卵母细胞的位置,并重复步骤 3.6_3.9。
4. 优化ICSI计时
- 将所有主轴阳性卵母细胞(A级或B级,步骤3.8)转移到ICSI盘中,并根据标准协议24、25进行ICSI处理。
- 如果卵母细胞显示没有可检测到的MII主轴信号,将PLM盘放入CO2- 独立的培养箱中,并将ICSI移入以后的时间。
- 执行 PLM 重新检查 +2⁄3 小时后执行步骤 3.3_3.9。如果某些卵母细胞仍然缺乏 MII 主轴,则进一步延迟 ICSI 1⁄2 小时。
- 将所有卵母细胞转移到ICSI盘中,并根据标准协议24注射。如果 PLM 盘与显微注射针的弯曲角度兼容,则在切换到明亮场模式后立即在 PLM 盘中执行 ICSI。
- 在ICSI,将卵母细胞移植到准备板用于胚胎培育和培养,直到胚泡阶段。
结果
极化光显微镜可以立即检查卵母细胞在ICSI之前是否完成了核成熟和组装MII主轴。由于其非侵入性,它可以用来安全地评估人类卵子在临床设置11,12,13,14的受精准备。与没有主轴9、15、16、17、18、19的卵母细胞相比,主轴卵母细胞更有可能产生可行的胚胎。20,21,22,23.此外,具有明显双极性主轴的卵母细胞似乎比具有变形主轴的卵母细胞具有更高的发育能力。综合起来,主轴成像可以作为一种工具,以确定最有潜力成功受精的卵母细胞,进行植入前发育,并支持全月妊娠9,1516,17,18,19,20,21,22,23.
主轴报告的发生率各不相同 (44-97%)反映被研究人口的多样性9,15,16,17,18,19,20,2122,23,26,27,28.在体内成熟卵母细胞从正常反应者通常显示双极MII主轴在40小时后hCG触发9,18,27,29。然而,在缓慢的响应者中,从前卵泡中检索到的卵母细胞池受到成熟延迟9,27的影响。在这里,应进行主轴成像,以区分在MII阶段逮捕的卵母细胞与经历重要母体过渡的卵母细胞(图3)。我们建议在检索后立即去除卵泡细胞,并在单独的井中孵化MI和MII卵母细胞,以便能够在ICSI前不久区分体内成熟卵母细胞和晚熟卵母细胞在体外挤出PB。如果在ICSI之前进行脱硝,这两个卵母细胞种群根据PB外观无法区分。
在中经成熟期间,PLM 模式的相位特定变化应在主轴动力学知识的上下文中解释。在相互作用期间,分体装置进行广泛的结构重组,PLM信号瞬时消失1,9,10,11。因此,在发育延迟的卵母细胞在体外挤出PB中,MII主轴信号的缺失不一定反映细胞干扰,但它可以指示卵母细胞从MI阶段到MII阶段的进展(图3)。如果精子在非生理时间点被注射,卵子的发育潜力就会受到损害。推迟ICSI为晚熟的卵母细胞提供了更多的时间来组装MII主轴,其存在与更好的临床结果9,10,11相关。在涉及慢/差反应者的临床研究中,近60%的最初主轴阴性卵母细胞在PLM重新检查前大约2小时后9发出主轴信号。根据晚熟卵母细胞的发育阶段和整体适应性,PB挤出后的 MII 主轴外观通常需要 2~6 小时(未发表的观察)。在第一次 PLM 检查中,展示微管桥(aaphase/端相,D 级)的卵母细胞比没有可见主轴(新兴主轴,C 级)的卵母细胞需要更长的时间来开发 MII 主轴信号。单独调整ICSI的时间到卵子的发育阶段,防止卵母细胞过早激活,并导致提高受精率和成功的胚胎发育9。
虽然晚熟卵母细胞在体外挤出PB的发育能力通常低于体内成熟卵母细胞,但如果它们在延迟ICSI(爆炸)之前能够组装一个可检测的主轴,胚胎发育率是可以接受的率 41.32%)9.使用这种方法,即使是不成熟的卵母细胞,通常被拒绝用于生育治疗,可以临床利用,产生可转移的胚胎,并产生全期怀孕。评估每个卵母细胞的母体阶段特别有利于在不良预后周期产生少量MII卵母细胞和/或执行抢救在体外成熟未成熟的卵母细胞9。
除了卵子成熟度评估外,在 PB 活检之前,还建议进行主轴成像,以避免在 Aain I/端粒体中破坏主轴。在实验胚胎学中,在卵子精加工和/或主轴移植过程中使用中心主轴的可视化13。
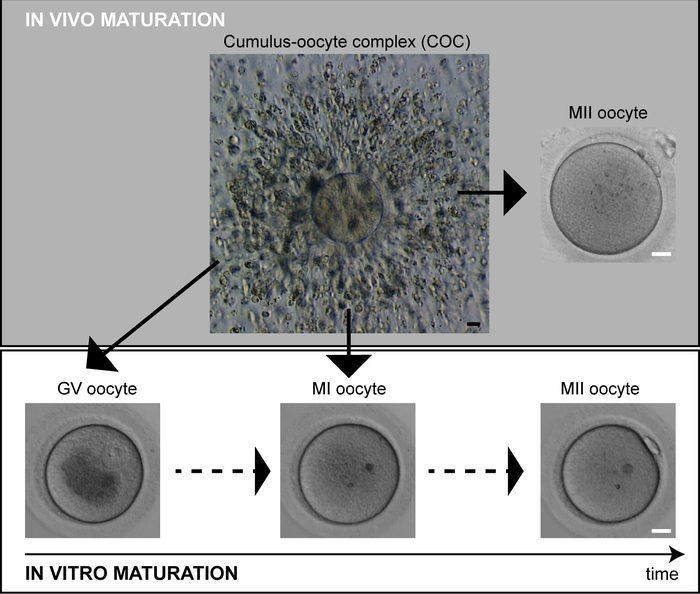
图1:人类卵母细胞成熟。体内成熟卵母细胞(MII)在检索时表现出PB。不成熟的卵母细胞(GV,MI)可以在体外自发完成成熟。比例尺 = 20 μm。请点击此处查看此图的较大版本。
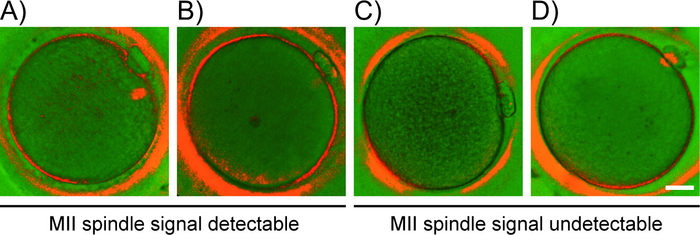
图2:基于PLM检测模式的卵母细胞分类。基于主轴信号外观的卵母体等级 (A-D) 的代表性示例。PLM检测模式: (A) 双极主轴的突出信号, (B) 半透明极性 MII 主轴, (C) 无可检测主轴, 和 (D) 微管桥.比例尺 = 20 μm。请点击此处查看此图的较大版本。
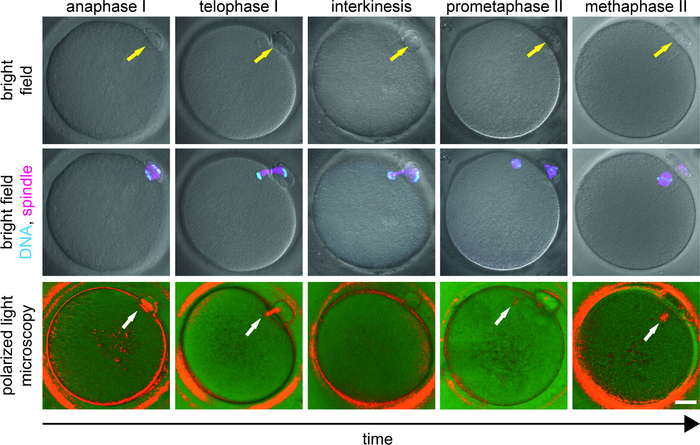
图3:卵母细胞成熟中MI到MII过渡的阶段。显示亮场(顶行)中的卵母细胞的外观,结合染色体(青色)和微管(品红色)(中行)和偏振光(下排)的荧光信号。每个卵母细胞首先经过PLM检查并立即修复。固定卵母细胞(免疫)与Hoechst(DNA)和抗β-图布林抗体(微管)标记。黄色箭头表示 PB 的存在,白色箭头突出显示双环微管的位置。刻度条 = 20 μm。这个数字已由Holubcová等人修改,JARG 20199。请点击此处查看此图的较大版本。
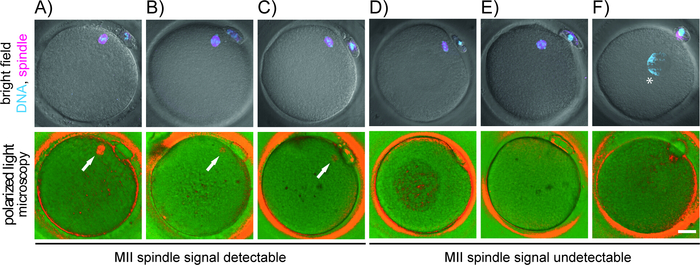
图4:偏振光显微镜检测的染色体-微管组织与双核化模式的相关性。显示了卵母细胞在明亮场中的外观,结合染色体(青色)和微管(洋红色)(上行)和偏振光(下排)的荧光信号。每个卵母细胞在PLM检查后立即修复。脱氧核糖核酸(Hoechst)和微管(β-图布林)被染色。(A-C) 具有 PLM 可检测主轴但染色体(A、B)未对齐的卵母细胞(A、B)或松散聚焦的主轴极 (C ); (D-F) 异常卵母细胞,没有 PLM 可检测的 MII 主轴显示欠发达 (D)、极极 (E) 或无主轴 (F)。白色箭头突出显示双核微管的位置,星号 (*) 指示去凝血染色质的位置。比例尺 = 20 μm。请点击此处查看此图的较大版本。
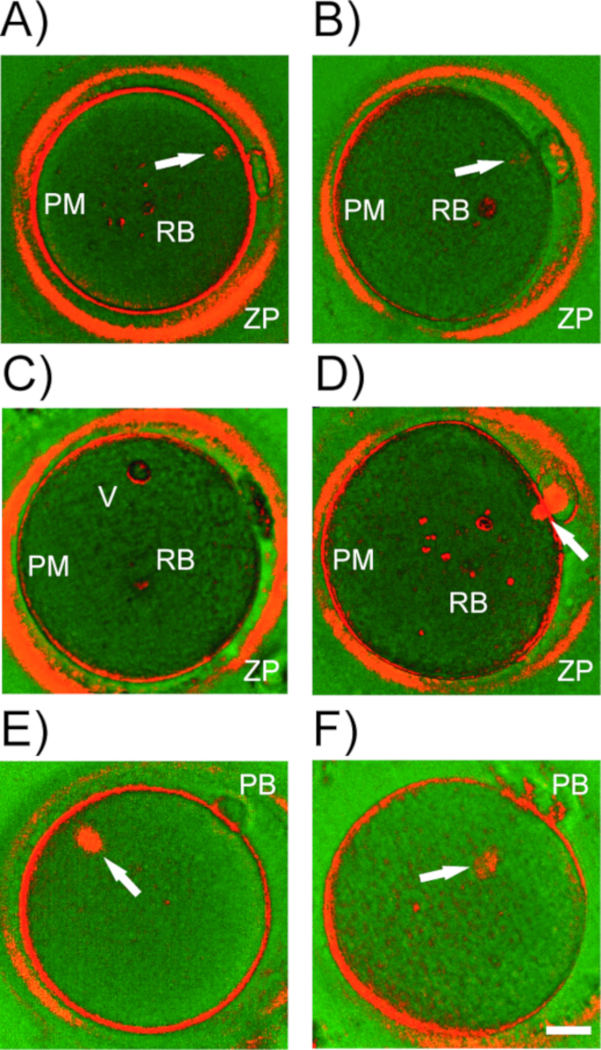
图5:人类卵母细胞中的双核结构。(A-D) 人类卵母细胞中由PLM检测到的双核结构的代表性示例.ZP = zona pellucida;PM = 等离子膜(欧莱马);RB = 屈光体,真空。白色箭头,不同成熟阶段的中心主轴。(E) MII 主轴与极体 (PB) 不对齐。(F) 主轴脱离等离子膜.比例尺 = 20 μm。请点击此处查看此图的较大版本。
补充图1:图像分析软件的桌面布局。请点击此处下载此文件。
补充视频:PLM 检查程序。需要旋转卵母细胞以排除主轴(箭头)的存在。比例尺 = 20 μm.请点击此处下载此文件。
讨论
人类卵母细胞中的中位体中心主轴高度动态,结构细腻。在次优条件下,微管纤维迅速去聚合,中心主轴分解30、31、32、33。因此,确保卵母细胞培养和微操作条件(即温度和pH值)处于最佳范围内至关重要。为了将主轴中断的风险降至最低,卵母细胞应保存在温度控制的环境中,在卵母细胞介质中保持 37 ± 0.5 °C。严格要求使用配备加热级的显微镜和显微注射装置。所有在孵化器外的卵母细胞操作都必须在HEPES/MOPS缓冲介质中进行,以避免pH波动。为避免在环境条件下过度卵母细胞交手的潜在不利影响,PLM检查总时间不得超过10分钟。由于在光束路径中放置标准塑料会损害图像分析,因此必须在玻璃底部盘上对卵母细胞进行分析,并拆除塑料盖。由于塑料和玻璃底盘具有不同的热特性,因此应直接在检查盘的处理介质的液滴中检查温度。
除了实验室条件外,程序差异和操作人员的微操作技能也会对 PLM 检查的准确性产生影响。只有高度组装的双极主轴才能非侵入性可视化。观测信号与主轴的结构组织程度成正比。新生、极性、松动或乱摆的主轴只显示模糊的双重轴或根本没有(图3和图4)。此外,尽管实际存在发达的双极性主轴(图4),但极化光与微管阵列的不完全对齐只产生半透明且定义不明确的双重点。除非正确定向,否则主轴信号可能很容易丢失,卵母细胞成熟度误诊 (补充视频)。为了获得最佳的主轴成像,卵母细胞必须正确转动每个轴。由于双目在目镜中不可见,操作员在进行卵母细胞旋转时必须观看计算机屏幕。在转移到临床应用之前,在多余的体外成熟卵母细胞中进行微操作和主轴成像训练的经验是可取的。
除了主轴外,卵母细胞、卵母体周围的积木细胞、色拉图的内层和一些细胞质结构(例如,屈光体、屈体)表现出双核化(图5A-D)。除非在成像前彻底从卵母细胞中取出,否则紧密附着的卵泡细胞会产生背景噪声,并危及美质主轴检测。小心不要将大折射体误认为主轴。许多细胞质内含物驻留在细胞质中,显示高亮度,这与暗背景形成鲜明对比。另一方面,混音主轴只显示中等信号,边界模糊,通常附着在第一个 PB 下方或相邻的古乐。有时,PLM 检查会显示主轴偏离其标准位置的总偏差(图 5E,F)。如果分部装置和 PB 之间存在重大错位,PLM 有助于定位卵母细胞,以避免在显微注射过程中主轴受伤的风险。卵母细胞内主轴的相对位置似乎不会影响产生的胚胎17、34的发育潜力。然而,当主轴竞争地从乌莱马分离时,就会发生受精异常。有趣的是,一些质量差的卵母细胞在PB挤出后立即进行染色质脱粒,而不是开始微管成核(图4F)。使用传统的光显微镜和PB作为卵母细胞成熟度的唯一标志,这种亚能力卵母细胞将被视为可受精。因此,在常规形态学评估的基础上,主轴成像增加了有关卵子成熟度的重要信息,并可以作为其质量的间接标志。
主轴MII卵母细胞的发病率可能受研究人群特征(如遗传背景、医疗状况、产妇年龄)的影响。此外,发育迟缓的卵母细胞在队列中的比例将影响实际数量的检测到主轴阴性卵母细胞9,27。通过人工主轴可视化,可以清楚地识别在 MII 阶段逮捕的可受精卵母细胞。此外,稍后的第二次检查可能会显示主轴阴性卵母细胞是否异常,或只是最近才通过MI/MII过渡9,10,11。当允许在ICSI之前发育主轴时,即使是通常被丢弃的未成熟的卵母细胞,也能产生可行的胚胎9。在可用于受精的很少卵母细胞的周期中,精点化的卵母细胞挤出PB的ICSI可以作为一种拯救策略和替代循环取消。
然而,延长预孵育时间不应推广到所有卵母细胞。体内成熟卵母细胞从正常反应者通常表现出MII主轴9,20,21,27。在这里,成功的主轴成像的机会随着时间的推移减少,由于后检查体外老化35。如果可能的话,ICSI应在检索当天进行,并且不应超过9小时(hCG后45小时),这个周期与导致胚胎质量下降36,37相关。显示不同双极主轴的卵母细胞应毫不拖延地受到 ICSI 的影响。总之,ICSI时间的个性化优化在预后差的患者中是值得排除任何过早精子注射风险的。然而,这是不必要的,太耗时和费力在所有IVF周期执行。
PLM分析揭示了卵母细胞是否达到MII阶段。然而,中心主轴的非侵入性可视化没有提供有关染色体组织的信息。可能有严重的染色体错位和/或母体年龄相关的色谱分裂在卵母细胞具有双极主轴(图5)。各种其他因素对生殖成功有显著影响(例如,精子因子、线粒体、胚胎基因组活化、不规则裂解、表观遗传学、子宫内膜、母体免疫)。因此,检测MII主轴本身,并不能保证IVF程序的阳性临床结果。
披露声明
作者没有什么可透露的。
致谢
我们要感谢国际再获利的胚胎学实验室。我们还感谢 MEYS CR (LM2015062 捷克生物成像)支持 CEITEC 的核心设施 CELLIM,感谢他们支持获取此处介绍的免疫荧光成像数据。
材料
| Name | Company | Catalog Number | Comments |
| Continuous Single Culture Complete with Human Serum Albumin | Irvine Scientific | 90164 | bicarbonate based single-step culture medium for embryo culture |
| Denuding micropipette 150 µm | Microtech IVF | 005-150C | |
| Denuding micropipette 180 µm | Microtech IVF | 005-180B | suitable for oocyte transfer between dishes |
| Denuding micropipette 200 µm | Microtech IVF | 005-250-A | suitable for oocyte transfer between dishes |
| FluoroDish | World Precision Instruments | FD 5040-100 | glass-bottom dish |
| (alternative: WillCo-dish GWST-5040 WillCo Wells) | |||
| Holding micropipette | Microtech | 001-120-30 | sterile glass microneedles |
| Hyaluronidase solution | Irvine Scientific | 90101 | for oocyte denudation |
| ICSI micropipette | Microtech | 002-5-30 | sterile glass microneedles |
| Micro Droplet Culture Dish | Vitrolife | 16003 | 12-well plate for embryo culture |
| Multipurpose Handling Medium (MHM) with Gentamicin | Irvine Scientific | 90163 | handling medium, MOPS/HEPES buffered |
| Nikon Eclipse TE 2000-U | Nikon | inverted microscope with heated stage | |
| Nunc IVF Petri Dish, 60 mm | Thermo Fisher Scientific | 150270 | plastic ICSI dish |
| Nunc non-treated 4-well IVF dish | Thermo Fisher Scientific | 179830 | 4-well plate for embryo culture |
| OCTAX polarAide | MTG | integrated PLM system | |
| Oil for embryo culture | Irvine Scientific | 9305 | oil for overlay |
| Polyvinylpyrrolidone | Irvine Scientific | 90123 | for sperm immobilization prior to ICSI |
参考文献
- Holubcova, Z., Blayney, M., Elder, K., Schuh, M. Human oocytes. Error-prone chromosome-mediated spindle assembly favors chromosome segregation defects in human oocytes. Science. 348 (6239), 1143-1147 (2015).
- Oudendijk, J. F., Yarde, F., Eijkemans, M. J., Broekmans, F. J., Broer, S. L. The poor responder in IVF: is the prognosis always poor?: a systematic review. Human Reproduction Update. 18 (1), 1-11 (2012).
- Gautam, N., Allahbadia, Y. M. . Ovarian Stimulation Protocols. , (2016).
- Piqueras, P., et al. Live birth after replacement of an embryo obtained from a spontaneously in vitro matured metaphase-I oocyte. Systems Biology in Reproductive Medicine. 63 (3), 209-211 (2017).
- Liu, J., Lu, G., Qian, Y., Mao, Y., Ding, W. Pregnancies and births achieved from in vitro matured oocytes retrieved from poor responders undergoing stimulation in in vitro fertilization cycles. Fertility and Sterility. 80 (2), 447-449 (2003).
- Shu, Y., et al. Fertilization, embryo development, and clinical outcome of immature oocytes from stimulated intracytoplasmic sperm injection cycles. Fertility and Sterility. 87 (5), 1022-1027 (2007).
- Sachdev, N. M., Grifo, J. A., Licciardi, F. Delayed intracytoplasmic sperm injection (ICSI) with trophectoderm biopsy and preimplantation genetic screening (PGS) show increased aneuploidy rates but can lead to live births with single thawed euploid embryo transfer (STEET). Journal of Assisted Reproduction and Genetics. 33 (11), 1501-1505 (2016).
- De Vos, A., Van de Velde, H., Joris, H., Van Steirteghem, A. In-vitro matured metaphase-I oocytes have a lower fertilization rate but similar embryo quality as mature metaphase-II oocytes after intracytoplasmic sperm injection. Human Reproduction. 14 (7), 1859-1863 (1999).
- Holubcova, Z., et al. Egg maturity assessment prior to ICSI prevents premature fertilization of late-maturing oocytes. Journal of Assisted Reproduction and Genetics. 36 (3), 445-452 (2019).
- Montag, M., Schimming, T., van der Ven, H. Spindle imaging in human oocytes: the impact of the meiotic cell cycle. Reproductive BioMedicine Online. 12 (4), 442-446 (2006).
- Montag, M., van der Ven, H. Symposium: innovative techniques in human embryo viability assessment. Oocyte assessment and embryo viability prediction: birefringence imaging. Reproductive BioMedicine Online. 17 (4), 454-460 (2008).
- Keefe, D., Liu, L., Wang, W., Silva, C. Imaging meiotic spindles by polarization light microscopy: principles and applications to IVF. Reproductive BioMedicine Online. 7 (1), 24-29 (2003).
- Caamano, J. N., Munoz, M., Diez, C., Gomez, E. Polarized light microscopy in mammalian oocytes. Reproduction in Domestic Animals. 45, 49-56 (2010).
- Eichenlaub-Ritter, U., Shen, Y., Tinneberg, H. R. Manipulation of the oocyte: possible damage to the spindle apparatus. Reproductive BioMedicine Online. 5 (2), 117-124 (2002).
- Wang, W. H., Meng, L., Hackett, R. J., Odenbourg, R., Keefe, D. L. The spindle observation and its relationship with fertilization after intracytoplasmic sperm injection in living human oocytes. Fertility and Sterility. 75 (2), 348-353 (2001).
- Wang, W. H., Meng, L., Hackett, R. J., Keefe, D. L. Developmental ability of human oocytes with or without birefringent spindles imaged by Polscope before insemination. Human Reproduction. 16 (7), 1464-1468 (2001).
- Moon, J. H., et al. Visualization of the metaphase II meiotic spindle in living human oocytes using the Polscope enables the prediction of embryonic developmental competence after ICSI. Human Reproduction. 18 (4), 817-820 (2003).
- Cohen, Y., et al. Spindle imaging: a new marker for optimal timing of ICSI?. Human Reproduction. 19 (3), 649-654 (2004).
- Rama Raju, G. A., Prakash, G. J., Krishna, K. M., Madan, K. Meiotic spindle and zona pellucida characteristics as predictors of embryonic development: a preliminary study using PolScope imaging. Reproductive BioMedicine Online. 14 (2), 166-174 (2007).
- Heindryckx, B., De Gheselle, S., Lierman, S., Gerris, J., De Sutter, P. Efficiency of polarized microscopy as a predictive tool for human oocyte quality. Human Reproduction. 26 (3), 535-544 (2011).
- Kilani, S., Cooke, S., Tilia, L., Chapman, M. Does meiotic spindle normality predict improved blastocyst development, implantation and live birth rates?. Fertility and Sterility. 96 (2), 389-393 (2011).
- Kilani, S., Chapman, M. G. Meiotic spindle normality predicts live birth in patients with recurrent in vitro fertilization failure. Fertility and Sterility. 101 (2), 403-406 (2014).
- Tilia, L., Venetis, C., Kilani, S., Cooke, S., Chapman, M. Is oocyte meiotic spindle morphology associated with embryo ploidy? A prospective cohort study. Fertility and Sterility. 105 (4), 1085-1092 (2016).
- ESHRE Guideline Group on Good Practice in IVF Labs, De los Santos, M. J., et al. Revised guidelines for good practice in IVF laboratories (2015). Human Reproduction. 31 (4), 685-686 (2016).
- Montag, M., Morbeck, D. . Principles of IVF Laboratory Practice: Optimizing Performance and Outcomes. , (2017).
- Chamayou, S., et al. Meiotic spindle presence and oocyte morphology do not predict clinical ICSI outcomes: a study of 967 transferred embryos. Reproductive BioMedicine Online. 13 (5), 661-667 (2006).
- Rienzi, L., et al. Relationship between meiotic spindle location with regard to the polar body position and oocyte developmental potential after ICSI. Human Reproduction. 18 (6), 1289-1293 (2003).
- Woodward, B. J., Montgomery, S. J., Hartshorne, G. M., Campbell, K. H., Kennedy, R. Spindle position assessment prior to ICSI does not benefit fertilization or early embryo quality. Reproductive BioMedicine Online. 16 (2), 232-238 (2008).
- Kilani, S., Cooke, S., Chapman, M. Time course of meiotic spindle development in MII oocytes. Zygote. 19 (1), 55-62 (2011).
- Wang, W. H., Meng, L., Hackett, R. J., Odenbourg, R., Keefe, D. L. Limited recovery of meiotic spindles in living human oocytes after cooling-rewarming observed using polarized light microscopy. Human Reproduction. 16 (11), 2374-2378 (2001).
- Sun, X. F., Wang, W. H., Keefe, D. L. Overheating is detrimental to meiotic spindles within in vitro matured human oocytes. Zygote. 12 (1), 65-70 (2004).
- Mullen, S. F., et al. The effect of osmotic stress on the metaphase II spindle of human oocytes, and the relevance to cryopreservation. Human Reproduction. 19 (5), 1148-1154 (2004).
- Swearman, H., et al. pH: the silent variable significantly impacting meiotic spindle assembly in mouse oocytes. Reproductive BioMedicine Online. 37 (3), 279-290 (2018).
- Rienzi, L., Vajta, G., Ubaldi, F. Predictive value of oocyte morphology in human IVF: a systematic review of the literature. Human Reproduction Update. 17 (1), 34-45 (2011).
- Miao, Y. L., Kikuchi, K., Sun, Q. Y., Schatten, H. Oocyte aging: cellular and molecular changes, developmental potential and reversal possibility. Human Reproduction Update. 15 (5), 573-585 (2009).
- Pujol, A., Garcia, D., Obradors, A., Rodriguez, A., Vassena, R. Is there a relation between the time to ICSI and the reproductive outcomes?. Human Reproduction. 33 (5), 797-806 (2018).
- Yanagida, K., et al. Influence of oocyte preincubation time on fertilization after intracytoplasmic sperm injection. Human Reproduction. 13 (8), 2223-2226 (1998).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。