Method Article
通过心肌毒素损伤和在 Vivo 中注射自传递 siRNA 在骨骼肌再生过程中的卫星细胞功能分析
摘要
我们描述了一种体内方法,通过使用心肌心肌的心肌毒素介导损伤和自交付siRNA的注射的组合,研究卫星细胞中特定基因的功能损失。
摘要
骨骼肌具有巨大的能力,在受伤后再生。这个过程主要是由肌肉干细胞,也称为卫星细胞驱动。卫星细胞的特点是转录因子Pax7的表达及其在休息骨骼肌的基底层下的位置。受伤时,卫星细胞被激活,进行自我更新或分化,形成新的肌纤维或与受损细胞融合。利用骨骼肌心肌心肌心肌心肌毒素损伤模型,可以研究体内卫星细胞的功能。为了研究一个基因在骨骼肌再生过程中的功能,主要使用转基因小鼠模型。在这里,我们提出了转基因小鼠的替代方法,以研究卫星细胞在再生过程中的基因功能,例如,在转基因小鼠不可用的情况下。我们将特定骨骼肌的心肌毒素介导损伤与将自我传递的siRNA注射到再生肌肉中,然后由卫星细胞在其他细胞中接受。因此,我们提供了一种方法,分析卫星细胞在生理条件下再生过程中的基因功能,无需转基因小鼠。
引言
骨骼肌是身体最大的组织,约占总体重的40%,支持自愿运动。骨骼肌的组织结构主要由后密体、终位分化、多核化肌纤维以及周围神经系统、血管系统和间质细胞1的各种其他细胞组成。重要的是,骨骼肌具有巨大的能力,以再生和恢复功能时受伤或损伤2。这个过程取决于组织驻留肌肉干细胞又称卫星细胞3,4。卫星细胞位于肌纤维和基底层之间,其特征是转录因子Pax75,6,7的表达。在静息条件下,卫星细胞是静止的,但由于创伤性损伤而激活,例如,通过偏心运动或通过注射蛇毒心毒素6、8进行实验。一旦激活,Pax7阳性卫星细胞共同表达MyoD和Myf5,使干细胞进入造血分化。卫星细胞抵制承诺因素的向上调节,将保留其干细胞潜力,并恢复静止,以补充干细胞库以满足未来需求。在造血原前体池膨胀后,转录网络被异构因子(如Myogenin)激活,从而启动细胞周期退出和终端分化。这些肌体原体然后相互融合或与现有的肌纤维融合,从而促进肌核,以保持肌核域的大小。肌纤维表达末期肌肉分化基因,如肌辛重链。最后,新形成的肌纤维生长成熟,建立骨骼肌9、10的功能单元。
骨骼肌的再生可能受各种条件的影响,包括肌肉疾病或老化11,12,从轻度损伤到威胁生命的情况,例如 Duchenne 肌肉营养不良13,14.因此,再生医学旨在通过瞄准卫星细胞功能15、16,利用其固有的再生能力,恢复受损或出现故障的骨骼肌组织。为了充分发挥其潜力,需要在骨骼肌再生期间全面了解卫星细胞的内源性。虽然存在实验方法分离卫星细胞,其附近的肌纤维17,卫星细胞及其环境的细胞和系统相互作用的全部复杂性只能在体内重新概括。在这方面,关于骨骼肌再生的很大知识已经获得使用小鼠损伤模型2,18。
这里我们介绍了一个特定的实验小鼠损伤模型,以研究心肌毒素引起的体内肌肉损伤的干细胞介导再生。心毒素,一种蛇衍生的细胞解毒毒素,导致肌纤维脱极化和坏死,被注射到前肌中,进而引发组织退化,然后再生。为了分析基因在急性再生过程中的功能,在损伤后的第3天,在卫星细胞扩张的高峰期注射自传递siRNA。实验动物在不同时间点被牺牲,并收集前肌。解剖的肌肉被冷冻和处理,以进一步冷冻切片。免疫荧光显微镜然后用于分析再生标记。该方法允许使用野生型小鼠在卫星细胞驱动骨骼肌肉再生期间研究单个基因的功能。
研究方案
所有动物程序都经特林格·兰德桑特动物福利部批准,即《无维尔劳彻舒茨》(03-048/16;TLV;巴德·兰根萨尔扎,德国)。
1. 心毒素诱发肌肉损伤
注:根据国家动物福利法,在适当的无菌条件下,进行所有涉及活小鼠的实验。此外,必须按照《国家动物福利法》对动物进行牺牲。
- 用70%乙醇消毒用于吸入麻醉的吸入盒和手术区域。在进行手术的加热垫上放置一块无菌手术布。
- 在 37°C 下打开加热垫。
- 在手术开始前15分钟服用镇痛药(例如,1毫克/千克体重梅洛西卡姆下皮下)。
注:对于典型的实验,使用至少6周大、性别匹配且身体状况良好的小鼠。 - 制备心毒素溶液(20 μM,以0.9%NaCl为单位),将溶液储存在-20°C。
- 使心肌毒素溶液达到室温 (RT)。
- 将小鼠转移到吸入盒中,用异常鲁兰诱导麻醉(在纯氧中启动 3.5 ~ 5%)。检查麻醉深度,对脚趾捏没有反应。
- 将鼠标放在干净的纸巾上,用鼻罩维持麻醉(纯氧中 1.5 % ~ 3 % 的等值)。护用颅下腿的注射区域(从膝盖到爪子,图1A)。去除所有过度松弛的头发。
注:物理分离房间的剃须和注射区域将为注射提供更无菌的条件。 - 将鼠标置于加热垫上,其侧卧位置覆盖着无菌手术布,用鼻罩维持麻醉(纯氧中为 1.5 ~ 3% 的异常)。
- 用70%乙醇消毒颅下腿的注射区域(从膝盖到爪子)。
- 在开始肌肉注射之前进行脚趾捏,以确保麻醉深度。
- 使用带有29口径针头的胰岛素注射器,将50μL心肌毒素(20μM(0.9%NaCl)注射到tibialis前肌中。首先,刺穿皮肤只是膝盖的远端。
- 将针头完全插入肌肉(在肌纤维方向/平行于骨骼),并沿着肌肉的全长缓慢(10-20 s)注射心肌毒素,同时来回移动针头,从而允许心毒素的均匀分布伤害整个头骨前肌 (图 1B,C)。
注:仅从一条腿伤害前肌,反向前肌可作为内部控制,以确定骨骼肌肉在心肌毒素损伤之前没有病理影响。 - 将鼠标移回放在加热垫上的笼子,并监控恢复过程,直到动物清醒并变得流动。
注:老鼠只会有轻微的跛行。如果老鼠严重跛行,根本不把重量放在腿上,就牺牲老鼠。 - 在接下来的2天内服用镇痛药(例如,1毫克/千克体重,每24小时服用一次),并每周监测一次。
2. 将自我传递的siRNA注射到再生性肌内肌肉中(在心毒素损伤后的第3天)
- 根据制造商的说明,在 0.9% NaCl(最终浓度为 2 μg/μL)中重新悬浮 siRNA(例如,siRNA 智能池),制备 siRNA 溶液。
注:siRNA经过化学修饰,便于细胞被动接受,并保护其免受核酸酶降解。无需转染试剂,从而降低毒性。使用四个独立的siRNA序列的智能池,针对相同的基因,提高击倒效率。 - 将siRNA储存在-20°C,并将其转移到冰上到手术室。
- 用70%乙醇消毒用于吸入麻醉的吸入盒和手术区域。在进行手术的加热垫上放置一块无菌手术布。
- 在 37°C 下打开加热垫。
- 将小鼠转移到吸入盒中,用异常鲁兰诱导麻醉(在纯氧中启动 3.5 ~ 5%)。检查麻醉深度,对脚趾捏没有反应。
- 将鼠标置于加热垫上,其侧卧位置覆盖着无菌手术布,用鼻罩维持麻醉(纯氧中为 1.5 ~ 3% 的异常)。
- 消毒颅下腿的注射区域(从膝盖到爪子)。
- 在开始肌肉注射之前进行脚趾捏,以确保麻醉深度。
- 使用带有29G针头的胰岛素注射器,将高达50μL的siRNA溶液(在0.9%NaCl中共注入100μg;针对靶基因;使用炒siRNA作为对照)注射到受伤的tibialis前肌中。首先,刺穿皮肤只是膝盖的远端,然后将针头插入前肌。
- 将针头完全插入肌肉(在肌纤维方向/平行于骨骼),并沿着肌肉的全长缓慢(10 – 20 s)注射siRNA溶液,同时来回移动针头,以便沿整个头骨前肌。
- 将鼠标移回放在加热垫上的笼子,并监控恢复过程,直到动物清醒并变得流动。
注:肛门症不一定是注射siRNA后。
3. 蒂比亚利前肌的解剖
- 在使用前至少12小时准备冷冻溶液(2部分OCT化合物和1部分30%蔗糖在去离子水中),以避免气泡。
- 通过将铝箔包裹在铅笔上,用胶带密封,准备冷冻模具。模具底部提供均匀、闭合的表面非常重要。
注:较小的冷冻模具允许更快的肌肉冻结,避免冻结工件。 - 牺牲小鼠,例如,通过CO2吸入,在各自的再生时间点,用70%乙醇喷洒整个小鼠和解剖工具。
注:此外,在隔离前肌时,可以应用宫颈脱位,以避免腿部过度出血。 - 用额外的精细锋利剪刀(切割边缘:13 mm)切割脚踝的皮肤,并用钳子将皮肤拉向膝盖,从而去除受伤后肢的皮毛和皮肤。
- 要露出脚踝上的前肌腱,将剩余的皮肤拉向脚部或用锋利的剪刀切割。
注:可以将鼠标固定到支撑板上,以便更好地固定鼠标。 - 在收获前肌之前,使用细钳(杜蒙特 5 或 7,直或弯曲)去除筋膜。捏合的钳子穿过受伤腿脚踝的骨骼旁边的筋膜(图2A)。将钳子移向膝盖,从而撕裂筋膜并暴露前肌(图2B)。
- 要分离前肌,露出远端肌腱,用细钳抓住它(Dumont 7,弯曲)。使用弹簧剪刀(切削刃:5 mm,尖端直径:0.35 mm)切割肌腱,并将肌肉(在肌腱处握住)拉向膝盖。
- 要收获前肌,请使用锋利的剪刀将其切得尽可能靠近膝盖。
- 在冷冻之前,用直剪刀将肌肉中腹区域的叶前肌切成两半大小相等,以便分析中腹区域(图2C,D)。
- 用冷冻溶液将冷冻模具填充一半。
- 将前肌的两半插入冷冻模具中,中间腹部区域朝向模具底部(图2E)。确保将前半部分插入直立位置,靠在冷冻模具的壁上,以避免肌肉倾斜。
注:模具中的冷冻溶液越多,冻结时间越长,从而增加了冷冻伪影的风险。 - 用钳子握住冷冻模具,并将其半途转移到液氮中(图2F)。在冷冻过程中,确保没有液氮进入冷冻模具。
- 观察冻结过程,冻结介质的颜色从透明变为白色并变为固体。将冷冻模具浸入液氮中几秒钟,并将冷冻模具转移到 -80°C 冷冻机或干冰中,以便将来进行加工。
- 将冷冻肌肉储存在-80°C冷冻模具中,直至进一步使用。
注:冷冻模具适合24孔板或1.5 mL反应管,允许贴标和有组织地存储。 - 处理冷冻模具中的肌肉,以便始终在干冰上进一步使用。
4. 再生蒂比亚利前肌的冷冻剖分
- 在开始切片之前,将低温室温度设置为-21°C,物体温度设置为-20°C,切割厚度为10、12或14μm(取决于未来的应用)(图3A)。
- 将冷冻模具中的肌肉样本转移到冷冻器中,使其根据温度调节几分钟。在此期间,标记显微镜幻灯片。
- 使用冷冻器内的预冷却钳去除嵌入肌肉周围的箔。避免接触样品,因为低温培养基开始容易解冻。
- 使用低温介质将前肌的中腹区域向上定向到低温支架的金属样品支架上。这可确保肌肉的切割部位(模具底部)面向实验者。
- 将带有安装样品的样品支架插入切片机制中。
注:为确保正确分割样品,在开始之前使用新刀片。 - 首先,修剪样品块(30 μm),以获得均匀的切片平面并到达肌肉的相应区域(图3B)。
- 修剪后,切割相应厚度的连续部分(例如,14 μm)。
- 将幻灯片正面朝下放在截面上,收集显微镜玻璃玻片上的部分。该部分附加到幻灯片 (图3C)。
- 将部分储存在-80°C或-20°C,直到进一步使用或直接用于免疫荧光或免疫植物化学。
5. 再生标记的免疫染色
- 在加湿室中执行所有进一步的步骤。
- 简单地说,在室温下平衡各部分。
- 修复每张幻灯片 1 mL 为 2% PFA(PBS 中,pH 7.4)的分区,在 RT 上进行 5 分钟。
- 将 2% 的 PFA 溶液倒入相应的废物容器中,将其拆下。
- 在 RT 下用 1 mL 的 PBS (pH 7.4) 洗涤 3 分钟。
- 将 PBS 倒入废物容器中,将其拆下。
- 每张幻灯片,添加1 mL的渗透溶液(0.1 % Triton X-100,0.1 M 甘氨酸在PBS pH 7.4)10分钟。
- 将渗透溶液倒入废物容器中,将其清除。
- 每张幻灯片添加 150 μL 的阻滞溶液(M.O.M. 1:40,PBS pH 7.4),并盖上盖板。在 RT 孵育 1 小时。
- 取出盖玻片和阻滞溶液,每张幻灯片涂抹100μL原抗体溶液[PAX7、DSHB、小鼠IgG1、未稀释或开发MHC、DSHB、未稀释、小鼠IgG1和拉米宁(兔子,1:1,000)]。盖上盖板。在 4 °C 下孵育 O/N(过夜)。
注:通过省略主要抗体来执行控制染色,用阻断溶液孵育该部分。 - 在 RT 下用 1 mL 的 PBS (pH 7.4) 洗涤 3 分钟。
- 将 PBS 倒入废物容器中,将其清除。
- 每张幻灯片中加入100 μL的二级抗体溶液(Alexa Fluor 546山羊抗小鼠IgG1和Alexa Fluor 488驴抗兔子IgG在阻滞溶液中,1:1,000),并盖上盖板。在 RT 孵育 1 小时。
- 在黑暗中孵育幻灯片,例如,使用铝箔覆盖或使用黑色加湿室。
注:从现在起,所有步骤都应在较低的光照条件下执行,因为某些二级抗体对光敏感。 - 拆下盖玻片和二级抗体溶液。
- 在 RT 下用 1 mL 的 PBS (pH 7.4) 洗涤 3 分钟。
- 将 PBS 倒入废物容器中,将其拆下。
- 在RT时,将每张幻灯片的1 mL溶液添加到10μg/mL的最终浓度中,进行DAPI染色,5分钟。
- 将 DAPI 染色溶液倒入废物容器中,将其去除。
- 在 RT 下用 1 mL PBS (pH 7.4) 清洗 3 次,5 分钟。
- 完全取出用于清洗的 PBS。
- 应用 2 ~ 3 滴水安装介质,用新的盖玻片直接盖住滑轨。
- 在黑暗中,让幻灯片在 RT 处干燥 1 小时。
- 在黑暗中将染色部分储存在4°C下,直到使用荧光显微镜进行进一步分析。
6. 血氧林和欧辛染色
- 在加湿室中执行所有进一步的步骤。
- 修复每张幻灯片 1 mL 为 2% PFA(PBS 中,pH 7.4)的分区,在 RT 上进行 5 分钟。
- 将 2% 的 PFA 溶液倒入相应的废物容器中,将其拆下。
- 将幻灯片转移到科普林罐中。
- 用自来水轻轻冲洗幻灯片。
注:不要将水龙头打开得过高,因为这可能会损坏部分。 - 将幻灯片转移到加湿室。取出液体。
- 应用1 mL的血氧林染色溶液(Gill No 3)2分钟。
- 将幻灯片转移到科普林罐中。
- 用自来水轻轻冲洗幻灯片,直到细胞核变蓝。
注:不要把水龙头打开得太高,因为这可能会损坏你的部分。 - 将幻灯片转移到加湿室。取出液体。
- 应用1 mL的Eosin Y溶液,孵育2分钟。
- 将幻灯片转移到科普林罐中。
- 用自来水轻轻冲洗幻灯片,直到从滑梯上流下自来水畅通。
- 取出所有液体,让幻灯片干燥 2 分钟。
- 安装在适合免疫性化学的安装介质中。
结果
图4A,B中给出了在心肌毒素介导损伤前后对胆菌前肌进行血氧素和欧辛(H&E)染色的典型结果。在控制肌肉中,肌肉的结构是完整的,如肌纤维边缘核的定位和间质空间中单核细胞的缺乏积累(图4A)。心毒素介导损伤后7天,新的肌纤维形成,以中心位置核为标志(图4B)。此外,可以观察到单核细胞的积累,主要由卫星细胞组成,但也包括免疫细胞等非造血细胞。整个肌肉应受伤,其特点是所有肌核的中心位置和单核细胞在整个肌肉部分的积累。
为了描述再生过程的进展和成功,可以使用再生标记进行多种免疫荧光染色。卫星细胞的数量可以通过对Pax7的染色来评估,Pax7是卫星细胞的规范标记(图4C,D)。损伤三天后,卫星细胞的数量增加(图4D),卫星细胞不再位于基底层下。为了进一步分析再生过程,新形成的肌纤维可以沾染定向到发育肌苷的抗体(图4E)。新形成的肌纤维显示位于中心位置的细胞核和发育肌苷的强烈表达。随着肌纤维的成熟,发育肌苷的表达减少,肌纤维的直径增加,核迁移到肌纤维的外围。
使用转基因小鼠或注射自传递siRNA可以研究单个基因对再生过程的影响。荧光标记的自交付炒控制siRNA被注射到恢复性前肌在受伤后的第3天,当卫星细胞增殖高峰的时间点。注射siRNA卫星细胞两天后,分析是否存在荧光标记的siRNA(图4F)。我们分析了有多少卫星细胞在注射到再生肌肉两天后服用了荧光标记的siRNA(图5)。再生肌肉中大约75%的卫星细胞对荧光标记siRNA呈阳性反应。此外,我们确定,所有再生肌纤维中,约74%对荧光标记的siRNA呈阳性反应,这表明74%的再生肌纤维已经吸收了siRNA,或者siRNA阳性卫星细胞与彼此形成新的肌纤维或与已经存在的再生肌纤维发生融合(图5)。这表明卫星细胞会占据自传递的siRNA,并且siRNA在卫星细胞中至少存在两天。
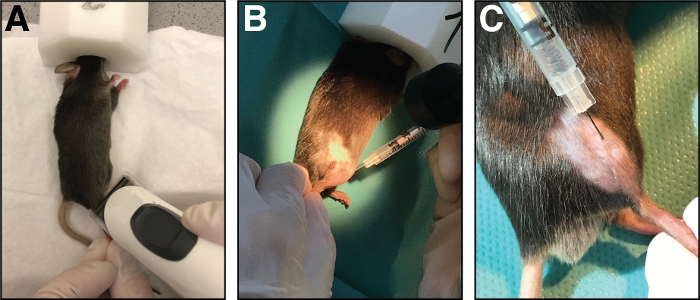
图1:将心肌毒素注射到前肌中。(A) 老鼠通过吸入胶质进行麻醉,下肢被切过。(B) 29 G 针注射到头骨前肌(C) 中,在注射心毒素溶液时沿头骨移动。请点击此处查看此图的较大版本。

图2:切除和冷冻受伤的前肌的步骤。(A) 后肢肌肉暴露 (B) 和围绕前肌的筋膜被撕裂以暴露肌肉.(C) 去除肌肉后,用锋利的直剪刀(D) 将其在腹部中段切成两半大小相似。(E) 解剖肌肉的半部分嵌入铝箔模具中,填充冷冻溶液,并冷冻在液氮(F) 中。请点击此处查看此图的较大版本。

图3:前肌收缩的设备和步骤。(A) 低温室温度设置为 -21 °C.(B) 冷冻溶液中的前肌安装在样品架上。(C) 厚度为 14 μm 的部分附着在玻璃显微镜玻片上.请点击此处查看此图的较大版本。
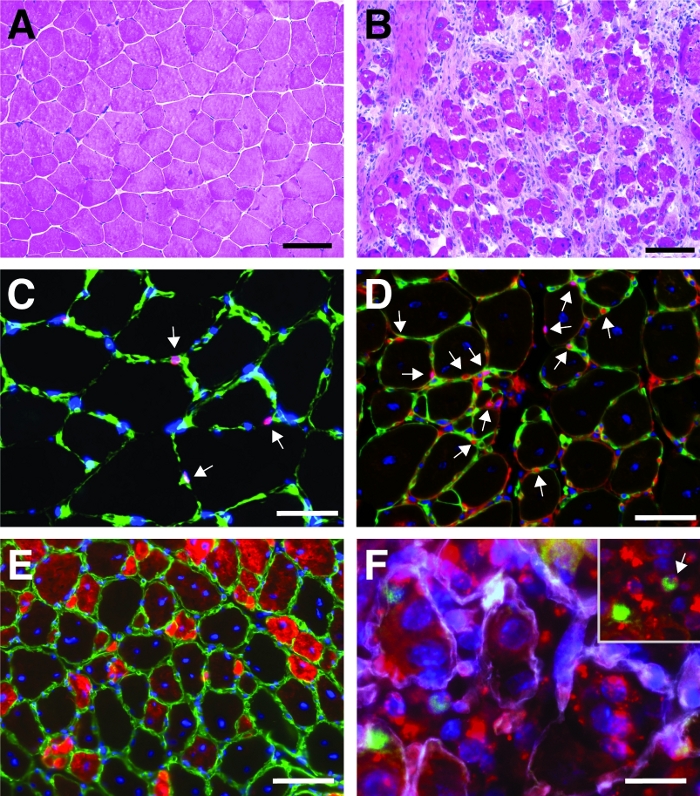
图4:再生前肌肌肉的代表性图像。在 ( A ) 和心肌毒素损伤后 7 天 (B) 前肌的 H&E 染色前 (A) 和 7 天。(C) 在未受伤的肌肉 Pax7 阳性(红色)卫星细胞位于以层压素(绿色)为标志的基底层下。核与 DAPI(蓝色)反染。Pax7阳性细胞用箭头标记。(D) 再生10天后,肌纤维的特点是位于中心位置的核(蓝色),Pax7以红色显示,拉米宁以绿色显示。Pax7阳性细胞用箭头标记。(E) 新形成的肌纤维表达发育肌苷(红色),拉米宁在绿色,核与DAPI(蓝色)反染。(F) 荧光标记的自传递siRNA(siRED,以红色表示)仍然存在于卫星细胞(Pax7阳性,绿色,在内注中用箭头标记)2天后,自传递的siRNA注射到再生的tibialis前肌肉(在心肌毒素介导损伤后第3天注射)。拉米宁以白色显示,核与DAPI(蓝色)反染。刻度条 = 100 μm(A 和 B),50 μm (C-E),25 μm (F)。请点击此处查看此图的较大版本。
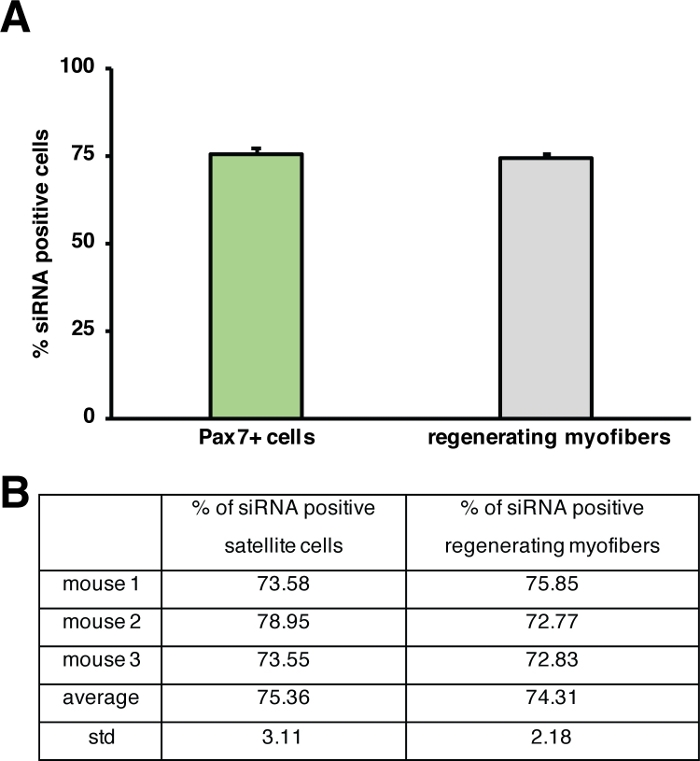
图5:荧光标记siRNA的摄取量定量。(A) 通过卫星细胞(Pax7+细胞)对siRNA摄取进行定量,并在注射后2天再生肌纤维,再生骨骼肌。注射在心毒素介伤后第3天进行。n = 3,误差条显示 SEM. (B) 在 (A) 中描述的图形基础的量化。请点击此处查看此图的较大版本。
讨论
在这里,我们提出了一种方法,以研究特定基因在骨骼肌再生过程中的功能,而无需转基因动物。这是通过心肌毒素诱发肌肉损伤与在受伤后的第3天将自我传递的siRNA注射到再生骨骼肌的组合。我们详细描述了心肌毒素的肌肉损伤过程、自交付siRNA的注射和收获肌肉的处理,以分析再生的进度。我们证明,将蛇毒心肌毒素注射到骨骼肌中会有效地伤害整个肌肉,并且在注射到骨骼肌两天后,在其它细胞类型中,大约75%的卫星细胞中发现自我传递的siRNA。再生骨骼肌(图4,图5)。
应特别注意前肌的同质损伤,因为不同程度的损伤会影响再生结果,从而也会影响 siRNA 的影响。此外,将整个再生区域注入自交付的siRNA至关重要。对于再生过程的分析,建议始终比较再生骨骼肌的类似区域,因此,前肌应切成两半,以始终比较肌肉的中腹区域。在分析肌肉时,需要分析整个冷冻节,因为肌纤维组成在前肌中不同,因此可能以不同的方式再生。
卫星细胞的功能可以通过各种实验程序来研究,包括其在相邻的分离单肌纤维17上的培养,通过移植和分析诱导损伤后骨骼肌的再生18,19.利用体内诱导损伤模型(例如,注射心肌毒素)调查卫星细胞的功能,通过分析卫星细胞功能的能力,也能够分析卫星细胞与其他细胞类型(如巨噬细胞和调查系统因素的影响2。骨骼肌的损伤可以通过各种方式完成,例如,偏心运动,冷冻损伤,注射BaCl2或注射蛇毒,如心毒素或注意辛18。虽然偏心运动可能是最生理损伤的方法,但一个特定肌肉的损伤只有20个。当卫星细胞向损伤部位迁移是研究目的,或者只有肌肉的特定部分应受伤时,可以应用冻结损伤。在实验中,冻伤的缺点是需要进行开手术才能应用预冷金属探头。注射BaCl2或蛇毒是最具戏剧性的伤害方法,因此对卫星细胞功能的挑战最大。此外,注射是微创的,手术时间,一般是少于五分钟,不涉及缝合等,从而尽量减少感染的风险。
肌肉损伤主要用于研究失去基因功能的功能后果,例如,Pax77,21。特别是如果老年小鼠是科学问题的焦点,转基因小鼠的产生或使用往往不可行。注射针对特定基因的自传递siRNA是这些情况下的可行替代品,并已成功使用22。简而言之,小鼠的前肌因注射心肌毒素而受伤,在受伤后的第3天注射了针对纤维蛋白(FN)的自送siRNA。损伤10天后对肌肉进行了分析,在siFN与炒siRNA对照条件下观察到卫星细胞数量显著减少。在siRNA注射后2天通过定量实时PCR在全肌肉分解中确定敲除效率,表达水平降低58%,表明输送和敲除效率足以发挥作用分析22.测试击倒效率的替代方法是免疫球体或免疫荧光分析,带有针对目标基因的抗体。在注射小鼠之前,应确定用于体内注射的siRNA的效率和特异性,例如,通过测试分离的卫星细胞或原发性细胞的效率。使用由 4 种不同的 siRNA 和单个 siRNA 组成的智能池可提高击倒效率,但也会增加非特定定位的风险。所有使用siRNA序列的特异性应在细胞培养中测试,以避免脱靶效应。作为一种控制,应使用非靶向的炒siRNA,因为注射siRNA本身可能会影响由于注射的再生过程,从而对肌肉造成额外的损伤。注射siRNA的时间点取决于科学问题和靶基因的表达特征。一般来说,在心肌毒素损伤后的第3天注射自交付性siRNA,目标是大多数对卫星细胞增殖至关重要的基因,因为卫星细胞增殖在损伤后的第3天左右达到高峰。第一次siRNA注射的时间点不应少于48小时后,心毒素损伤,因为心肌毒素的注射量相当高,在向肌肉注入额外的溶液之前,应该对液体进行重新吸收。一般来说,多次注射siRNA或不同siRNA的组合是可能的,虽然人们必须考虑每次注射到再生肌肉是造成额外的损害。
所述方法的一个局限性是,观察到的效果不一定只取决于卫星细胞中目标基因的敲除,而是可能归因于其他细胞类型,如免疫细胞或纤维化祖细胞。因此,有必要将这些实验与研究纯卫星细胞群的实验结合起来。人们可以使用浮肌纤维培养物进行实验,在相邻的肌纤维上培养卫星细胞,或者使用孤立的卫星细胞进行移植实验。
注射自传递siRNA的替代方法是注射小分子抑制剂或重组蛋白,可以执行,这取决于科学问题。例如,在15、16岁的小鼠中成功地注射了JAK/STAT信号的细胞外基质蛋白纤维蛋白或小分子抑制剂。只有在使用诱导的遗传小鼠模型,才能在骨骼肌再生(例如卫星细胞)期间分析某一特定细胞类型的特定基因功能。注射自交付的siRNA、重组蛋白或小分子抑制剂可能会影响再生骨骼肌的多种细胞类型。
披露声明
我们要感谢克里斯蒂娜·皮克和克里斯蒂娜·波塞尔的出色技术援助,感谢萨斯基亚·施泰纳在确定siRNA转染效率方面给予的帮助。我们感谢核心服务公司为之提供出色的技术支持,尤其是萨宾·兰德曼和琳达·罗森伯格。我们还感谢FLI的动物设施小鼠的出色支持。这项工作得到了德国福森斯格明舍夫特(MA-3975/2-1)和德国克雷布斯希尔夫(DKH-JvM-861005)向J.v.M的赠款的支持。
致谢
作者声明没有相互竞争的经济利益。
材料
| Name | Company | Catalog Number | Comments |
| Isoflurane | Henry Schein | Isothesia | inhalation narcotics |
| Hot Plate 062 | Labotect | 13854 | |
| Anesthesia System (Tec 7) with inhalation box + nose masks | Tem Sega | Minihub | |
| Shaver for rodents | isis | GT420 | |
| Cardiotoxin | Latoxan | L8102 | snake venom needed for muscle injury |
| Accell siRNA smart pool | Dharmacon | depending on your target gene | self delivering siRNA |
| Alexa Fluor 488 donkey anti-rabbit IgG | Thermo Fisher | A-21206 | secondary antibody |
| Alexa Fluor 546 goat anti-mouse IgG1 | Thermo Fisher | A-21123 | secondary antibody |
| Coverslips | VWR | 631-1574 | |
| CV Mount | Leica | 14046430011 | mounting medium for immunohistochemistry |
| DAPI | Sigma Aldrich | D9542 | nuclear staining |
| devMHC antibody | DHSB | F.1652 | |
| Eosin Y | Thermo Fisher | 73104 | |
| Haematoxylin Gill No3 | Sigma-Aldrich | GHS316-500ML | |
| Insulin syringe (29 g) | Terumo | 3SS05M2813 | syringue used for muscle injections |
| Laminin antibody | Sigma Aldrich | L9393 | |
| M.O.M blocking reagent | Vector labs | MKB-2213 | blocking for immunofluorescent staining |
| Meloxicam | Boehringer Ingelheim | Metacam | analgesics |
| OCT | Thermo Fisher | 6502 | tissue embedding |
| Pax7 antibody | DSHB | PAX7 | satellite cell specific antibody |
| ProLong Gold Antifade Mountant | Thermo Fisher | P36934 | aequos mounting medium |
| Sucrose | Carl Roth | 4621.1 | tissue embedding |
| Superfrost plus | Thermo Scientific | J1830AMNZ | microscope slides |
| TritonX-100 | Amresco | 0694-1L | permeabilization reagent |
| Dissection tools | |||
| Dumont 5, straight | Fine Science Tools | 11295-10 | |
| Dumont 7, curved | Fine Science Tools | 11272-40 | |
| Extra fine Bonn scissors (cutting edge: 13 mm) | Fine Science Tools | 14084-08 | |
| Narrow pattern forceps | Fine Science Tools | 11002-16 | |
| Spring scissors (cutting edge: 5 mm, tip diameter: 0.35 mm) | Fine Science Tools | 91500-09 |
参考文献
- Frontera, W. R., Ochala, J. Skeletal muscle: a brief review of structure and function. Calcified Tissue International. 96 (3), 183-195 (2015).
- Schmidt, M., Schuler, S. C., Huttner, S. S., von Eyss, B., von Maltzahn, J. Adult stem cells at work: regenerating skeletal muscle. Cellular and Molecular Life Sciences. , (2019).
- Lepper, C., Partridge, T. A., Fan, C. M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytolology. 9, 493-495 (1961).
- Shea, K. L., et al. Sprouty1 regulates reversible quiescence of a self-renewing adult muscle stem cell pool during regeneration. Cell Stem Cell. 6 (2), 117-129 (2010).
- von Maltzahn, J., Jones, A. E., Parks, R. J., Rudnicki, M. A. Pax7 is critical for the normal function of satellite cells in adult skeletal muscle. Proceedings of the National Academy of Sciences of the United States of America U S A. 110 (41), 16474-16479 (2013).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Yin, H., Price, F., Rudnicki, M. A. Satellite cells and the muscle stem cell niche. Physiological Reviews. 93 (1), 23-67 (2013).
- Bentzinger, C. F., Wang, Y. X., Rudnicki, M. A. Building muscle: molecular regulation of myogenesis. Cold Spring Harb Perspectives in Biology. 4 (2), (2012).
- Schworer, S., et al. Epigenetic stress responses induce muscle stem-cell ageing by Hoxa9 developmental signals. Nature. 540 (7633), 428-432 (2016).
- Sousa-Victor, P., et al. Geriatric muscle stem cells switch reversible quiescence into senescence. Nature. 506 (7488), 316-321 (2014).
- Dumont, N. A., et al. Dystrophin expression in muscle stem cells regulates their polarity and asymmetric division. Nature Medicine. 21 (12), 1455-1463 (2015).
- von Maltzahn, J., Renaud, J. M., Parise, G., Rudnicki, M. A. Wnt7a treatment ameliorates muscular dystrophy. Proceedings of the National Academy of Sciences of the United States of America U S A. 109 (50), 20614-20619 (2012).
- Price, F. D., et al. Inhibition of JAK-STAT signaling stimulates adult satellite cell function. Nature Medicine. 20 (10), 1174-1181 (2014).
- Lukjanenko, L., et al. Loss of fibronectin from the aged stem cell niche affects the regenerative capacity of skeletal muscle in mice. Nature Medicine. 22 (8), 897-905 (2016).
- Huttner, S. S., et al. Isolation and Culture of Individual Myofibers and Their Adjacent Muscle Stem Cells from Aged and Adult Skeletal Muscle. Methods in Molecular Biology. , (2019).
- Hardy, D., et al. Comparative Study of Injury Models for Studying Muscle Regeneration in Mice. PLoS One. 11 (1), e0147198(2016).
- Hall, M. N., et al. Transplantation of Skeletal Muscle Stem Cells. Methods in Molecular Biology. 1556, 237-244 (2017).
- Dueweke, J. J., Awan, T. M., Mendias, C. L. Regeneration of Skeletal Muscle After Eccentric Injury. Journal of Sport Rehabilitation. 26 (2), 171-179 (2017).
- Lepper, C., Conway, S. J., Fan, C. M. Adult satellite cells and embryonic muscle progenitors have distinct genetic requirements. Nature. 460 (7255), 627-631 (2009).
- Bentzinger, C. F., et al. Fibronectin regulates Wnt7a signaling and satellite cell expansion. Cell Stem Cell. 12 (1), 75-87 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。