需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
超声成像对小鼠肺肿瘤进展的检测
摘要
该协议描述了在小鼠中诱导KRAS肺肿瘤的步骤,以及通过超声波成像对形成肿瘤的定量。小肿瘤在早期时间点被可视化为B线。在以后的时点,通过超声软件中的测量工具实现相对肿瘤体积测量。
摘要
每年有160万受害者,肺癌极大地加重了全世界的癌症负担。肺癌的部分原因是肿瘤基因的基因改变,如KRAS肿瘤基因,占肺癌病例的25%。治疗针对KRAS驱动的肺癌的难点部分源于实验室中模拟疾病进展的不良模型。我们描述了一种通过超声波成像在可诱导的LSL-KRAS G12D小鼠模型中允许原发性KRAS肺肿瘤相对定量的方法。该方法依赖于肺气肿的亮度(B)模式采集。此模型中最初形成的肿瘤被可视化为 B 线,并且可以通过计算获取图像中存在的 B 线数进行量化。这些将代表在小鼠肺表面形成的相对肿瘤数。随着形成肿瘤随时间的发展,它们被视为肺气肿内的深层裂裂。由于形成肿瘤的周长定义明确,通过测量肿瘤的长度和宽度并将其应用于肿瘤卡钳测量公式,可以计算相对肿瘤体积。超声成像是一种非侵入性、快速和用户友好的技术,通常用于小鼠的肿瘤定量。虽然在获得超声图像时可能会出现伪影,但事实证明,与其他成像技术(如计算机断层扫描 (CT) 成像和生物发光成像(BLI)。研究人员可以通过比较不同组小鼠之间的肺肿瘤启动和进展来研究这种技术的新治疗靶点。
引言
肺癌作为全球癌症相关死亡的主要原因,对治疗仍然难以治疗,主要是因为缺乏相关的临床前模型,可以在1号实验室重述该病。约25%的肺癌病例是由于KRAS肿瘤基因2的突变。KRAS驱动的肺癌通常与预后差和对治疗反应低有关,这突出表明了在这种疾病2中进一步研究的重要性。
优化了KRAS肺癌诱导免疫功能小鼠肺肿瘤生长实时相关评估的方法。我们使用 Lox-停止-Lox KRAS G12D (LSL-KRAS G12D) 小鼠,其中 KRAS G12D 角基因可以用克里慢病毒载体3、4表示。这些载体是由碳氢化物2驱动,允许病毒感染特别发生在阿尔韦拉上皮细胞5。此外,为了加速肺肿瘤的启动和进展,慢病毒结构还表达P53 shRNA从U6/H1启动子(这里的慢病毒结构将被称为Ca2Cre-shp53)6。该方法的生物学相关性在于小鼠肺肿瘤发育的自然过程,而不是小鼠非异种肿瘤的异种移植。使用正交方法的一个障碍是在不牺牲小鼠的情况下监测肺肿瘤的生长。为了克服这一限制,我们优化了超声成像,以便在此小鼠模型中以二维(2D)模式分析肺肿瘤进展。感染后7周开始肿瘤在超声波图像中反射为B线,可以计数,但不会反映肺部肿瘤的确切数量。B线的特点是激光状的垂直白线,产生于肺胸膜线7,8。大肿瘤可以在感染18周后可视化。这些肿瘤的相对体积通过超声波的二维测量进行量化。
该方法是研究LSL-KRAS G12D小鼠模型中药理药物对肺肿瘤生长作用的研究人员的最佳方法。此外,肺肿瘤进展可以比较具有不同遗传谱系的小鼠之间的进展,以检查是否存在某些基因/蛋白质对肺肿瘤体积发育的重要性。
Access restricted. Please log in or start a trial to view this content.
研究方案
动物研究是根据麦吉尔大学机构动物护理和使用委员会(IACUC)进行的,程序得到了麦吉尔大学动物福利委员会的批准(动物使用协议#2009-5754)。
1. 生成 CA2Cre-shp53 伦蒂病毒蒂特
注:以下协议与《夏等人6》中描述的协议相同,稍作修改。
- 培养慢病毒(15 厘米 x 10 厘米菜肴)
- 在第1天,板健康HEK293T细胞(7.5 x 106细胞每10厘米盘)与10 mL的Dulbeco的改性鹰培养基(DMEM),10%胎儿牛血清(FBS)和1%笔/链球菌。培养在37°C,5%CO2孵化器。
- 准备磷酸钙转染混合物(15个板的混合物)。制备含有225微克(15微克/板)的慢病毒载体(Ca2Cre-shp53),75μg(5微克/板)的PsPAX2质粒(含有HIV-1 gag和HIV-1波尔基因),75μg(5微克/板)的pMD2.G质粒(含有VV-G基因)用于包装, 最终浓度为0.15 M的CaCl2,并填充蒸馏H2O至3.75 mL的管。制备含有 3.75 mL 的 2x HEPES 缓冲盐水(HBS;50 mM HEPES,pH 7.05,280 mM NaCl,10 mM KCl,1.5 mM Na2HPO4+2H2O 和 12 mM D-d-dextrose) 的管 B。
- 涡流管A,在连续涡旋下滴落到管B中。
注:总容量为 7.5 mL。 - 在黑暗中室温下孵育20-30分钟。
- 电镀细胞后约9小时,将500μL的转染混合物滴入细胞培养基(7.5 mL/15菜盘:每盘0.5 mL)。
- 轻轻旋转每道菜混合,并在37°C,5%CO2孵育所有菜肴。
- 在转染后的第2天12-18小时,每10厘米盘用10mL的无抗生素减少血清培养物(材料表)代替培养物。将菜肴放回 37°C,5% CO2培养箱中。
- 第 3 天,收集含有表达 Ca2Cre-shp53 的慢病毒的培养基,并通过 0.45 μm 过滤器进行过滤。用新鲜的无抗生素减少血清培养素补充培养剂。
注:收集的介质可保持4°C不超过3天。 - 第 4 天,第二次收集含有慢病毒的介质,并通过 0.45 μm 过滤器进行过滤。保持在4°C(不超过3天)。
- 结合步骤 1.1.8 和 1.1.9 中的病毒超生物。通过离心滤光片单元(材料表)将其浓缩,在1,372 x g下离心,在4°C下30分钟。重复此过程,直到所有收集的媒体都通过列。
注:每次离心后,可收获100~200μL的浓缩滤液。 - 在 15 mL 冰冷的管中收集并混合浓缩滤液。混合浓缩的慢病毒,然后等分(例如,100 μL/管)。储存在-80°C。
- 伦蒂病毒滴定
注:本协议使用不朽小鼠胚胎成纤维细胞(MEFs)表达绿色荧光蛋白(GFP)的loxP侧角等位基因,用于病毒性定子的定量。然而,任何具有 loxP-GFP 等位基因的细胞系应适合此步骤。- 培养细胞在37°C下表达具有DMEM、10%FBS和1%笔/链球菌的GFP的loxP侧角等位基因,CO2为5%。
- 板 2 x 105单元在两个 50 mm 孔的 6 孔板中。
注:一口井的细胞将用于慢病毒感染,而另一口的细胞则用作阴性对照。 - 第二天,在慢病毒感染前用2 mL的DMEM、10%的FBS和1%的笔/链球菌2小时补充细胞。
- 在慢病毒感染中加入20 μL的CA2Cre-shp53慢病毒(容量可能在需要时会有所不同)。
- 培养3天后,通过流动细胞测定确定Cre诱导的GFP阳性细胞的频率,如图1所示。用磷酸盐缓冲盐水(PBS)洗涤细胞,通过胰蛋白化分离,并在112 x g下角收集细胞。
- 用PBS清洗细胞两次。最后,将细胞悬浮在PBS的100μL中。通过细胞分析仪(材料表)确定GFP阳性细胞的百分比。
- 使用以下公式计算慢病毒传染性/功能性奶色:

其中F是GFP阳性细胞的频率,通过从感染前的GFP阳性细胞(背景)频率(Fi)中减去GFP阳性细胞的频率(Fi),Cn是镀层细胞的数量(2 x 105),V是接种(mL)的体积,而DF是病毒稀释因子。
注:传染性/功能浓度 = ±2 x 106 TU/mL。
2. LSL-KRASG12D小鼠中伦蒂病毒的内切内插管
注:Vandivort等人9号在公布的协议中使用了内切内插管方法。在此协议中,在C57BL/6背景中的小鼠LSL-KRASG12D小鼠在6~8周使用。如《Vandivort等人》第9条所述,使用自制工作程序板。电路板位于实验者前面,位于一个方便的工作空间(约1米2)。
- 通过取出 1 mL 注射器的柱塞并将 60 μL 的 PBS 加载到注射器中,准备肺活量计。
- 将 22 G 导管尖端连接到注射器中并放在一边。
- 通过注射1μL/g的氯胺酮(50毫克/mL)/木兰辛(5毫克/mL)/丙丙丙胺(1毫克/mL)鸡尾酒,对小鼠进行麻醉。确保以低呼吸速率(每 2 s 呼吸 1 次)对小鼠进行适当的镇流。
- 将CA2Cre-shp53慢病毒的20μL吸气到移液器中并放在一边。
- 将镇静鼠标钩入电路板螺纹,将镇静鼠标置于工作程序板上。
注: 鼠标的地向应与平台平起平坐。 - 将胸腔的卷盘部分带到平台,以确保在手术过程中小鼠对齐。
- 在 80-100% 的强度之间调整鹅颈照明器,并将光线从皮肤表面放置 1⁄2 厘米。
- 从平台后面,用无菌钳子将舌头从小鼠的口腔中抽出。
- 固定舌头时,将压压器插入小鼠的口腔,然后释放舌头。
- 将鹅颈放在主茎支气管上以照亮气管。
注:气管可能通过呼吸的作用可见,导致光线波动。 - 当气管被清楚地观察时,将制备的肺活量计(带PBS和导管的注射器)插入气管路径。
- 取出压压器,观察注射器中PBS的上升和下降。每次呼吸。
注: 这是导管正确定位到气管的指示器。 - 取出含有PBS的注射器,同时保持气管内的导管,如前一个位置。
- 将 20 μL CA2Cre-shp53 慢病毒沉积到导管中心。
- 保持导管到位的同时,使用空注射器将300μL的空气注入导管,以确保慢病毒在肺部的正确分布。
- 将导管保持在原位,并将吸管重新插入导管。
注: PBS 气泡的兴衰将确保该过程成功。 - 拆下导管和胶带。将动物放在温暖干燥的地方,直到它复活。
3. 小鼠肺肿瘤的超声成像
注:使用材料表中列出的系统,在慢病毒插管7周和18周后进行超声成像;但是,任何模型都可用于分析。
- 成像前一天,从插管小鼠的胸部区域去除毛皮。
注:在此步骤中,小鼠应放在3%的分氟和2L/分钟O2的感应室中,从而给鼠标镇静。 - 在映像当天,设置工作区,如图2所示。打开超声波凝胶加热泵和温度监测器。
- 建立一个温暖的33°C培养箱,将小鼠置于成像后。
- 将三维 (3D) 电机 (图 2F) 放在集成导轨系统上.
- 确保 3D 电机和传感器安装系统牢固到位。
- 连接首选传感器(频率:40 MHz;图2E和材料表),用于垂直于3D马达的肿瘤测量。
- 开始对超声波软件进行新的研究。
- 选择"学习浏览器",然后在屏幕底部选择"新建"。
- 选择"新研究",将出现一个新的窗口,除了有关研究的进一步信息,即研究日期、研究人员姓名等之外,还增加了一个研究名称。
- 填写系列名称中的信息,即动物ID、应变、体重、出生日期等。
- 选择"完成",程序将更改为 B 模式。
- 将加热灯放在动物平台上方的方便位置。
- 将鼠标放入感应室(3.5% 无二环)。
注:适当的麻醉是由小鼠的无意识和较慢的呼吸速率约1呼吸每2秒。 - 当小鼠镇静时,改变麻醉机对动物平台的连接,将异胶降低至2.5%。
- 将鼠标放在动物平台上,放在腹腔内,其口腔朝向麻醉管。
- 在鼠标眼睛上涂抹润滑剂。
- 将鼠标放在背边,将手脚牢牢地贴在动物平台上。
- 在小鼠胸部涂上一小层超声波凝胶。
- 使用高度控制旋钮降低采集探头,触摸鼠标胸部表面。定位探头,使鼠标的心脏大致居中。
- 使用微型旋钮从两个四肢获取整个胸部的图像,在横向方向中,理想情况下每只鼠标收集 500 帧(帧数可能因个人选择而异)。
- 成像完成后,从小鼠胸部取出凝胶,并将鼠标放入温暖的培养箱中。
4. 超声图像的二维分析
- 在超声波软件上打开采集的帧后,扫描帧的肿瘤。
- 对于小型启动肿瘤,每 10 帧定期计算 B 线数,以计算所获取的 500 帧的完整长度。
因此,B 线总共计算在 50 个图像中,每个图像由 10 帧分隔。B 线的特点是纵向白色直线完全穿过屏幕。 - 对于大肿瘤的二维测量,选择线性工具并测量肿瘤的宽度和长度。
- 要计算肿瘤的体积,请使用以下公式:
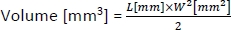
其中L和W分别是肿瘤的长度和宽度。
Access restricted. Please log in or start a trial to view this content.
结果
在获得+2 x 106 TU/mL(图1)的慢病毒传染性色度后,当LSL-KRAS G12D小鼠达到适当的年龄(6~8周)9时,Ca2Cre-shp53慢透病毒被注射在肠内。超声成像是在肿瘤开始感染7周后进行的(图3B)。成像在7周内进行,以包括LSL-KRASG12D小鼠模型中发生的各种前体病变,从增生到腺瘤3不等,如图
Access restricted. Please log in or start a trial to view this content.
讨论
我们演示了一种通过超声波在可诱导的LSL-KRAS G12D小鼠模型中评估肺肿瘤生长的方法。该方法可用于评价药理抑制剂对肺肿瘤生长的影响。它也可以用来比较不同遗传背景的小鼠之间的肺肿瘤生长。使用这种技术不需要专门的计算技能,但是,如果使用该方法比较不同的小鼠组,则对用于分析的帧数进行系统化非常重要,以便进行适当的比较。
LSL-KRAS G12D小鼠的+2 x 106 T...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
我们感谢I.Verma博士的慢病毒Ca2Cre-shp53载体。这项工作得到了加拿大卫生研究院(CIHR MOP 137113)到AEK的资金支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 0.45 μm Acrodisc Syringe Filters | Pall Corporation | PN 4614 | |
| 100-mm Cell Cultre Plate | CELLSTAR | 664 160 | |
| 6-well Cell Culture Plate | CELLSTAR | 657 160 | |
| Amicon Ultra - 15 Centrifugal Filter Units | Merck Millipore Ltd. | UFC910024 | |
| BD LSR-Fortessa | BD Biosciences | 649225B 3024 | |
| CA2Cre-shp53 lentiviral vector | From Dr. I Verma Laboratory | ||
| DMEM | Multicell | 319-005-CL | |
| FBS | Multicell | 80450 | |
| LSL-KRASG12D mouse | JAX Mice | 8179 | |
| MX550S; Centre Transmit: 40 MHz | FUJIFILM VisualSonics | 51070 | |
| OptiMEM | gibco | 11058-021 | |
| Pen/strep | Multicell | 450-201-EL | |
| pMD2.G | Addgene | 12259 | |
| PsPAX2 | Addgene | 12260 | |
| VEVO-3100 | FUJIFILM VisualSonics | 51072-50 |
参考文献
- Eisenstein, M. Personalized medicine: Special treatment. Nature. 513, 8(2014).
- Karachaliou, N., et al. KRAS mutations in lung cancer. Clinical Lung Cancer. 14 (3), 205-214 (2013).
- Jackson, E. L., et al. Analysis of lung tumor initiation and progression using conditional expression of oncogenic K-ras. Genes & Development. 15 (24), 3243-3248 (2001).
- DuPage, M., Dooley, A. L., Jacks, T. Conditional mouse lung cancer models using adenoviral or lentiviral delivery of Cre recombinase. Nature Protocol. 4 (7), 1064-1072 (2009).
- Chen, J., Lecuona, E., Briva, A., Welch, L. C., Sznajder, J. I. Carbonic anhydrase II and alveolar fluid reabsorption during hypercapnia. American Journal of Respiratory Cell and Molecular Biology. 38 (1), 32-37 (2008).
- Xia, Y., et al. Reduced cell proliferation by IKK2 depletion in a mouse lung-cancer model. Nature Cell Biology. 17 (4), 532(2015).
- Demi, L., et al. Determination of a potential quantitative measure of the state of the lung using lung ultrasound spectroscopy. Scientific Reports. 7, 12746(2017).
- Mohanty, K., et al. Characterization of the Lung Parenchyma Using Ultrasound Multiple Scattering. Ultrasound in Medicine and Biology. 43, 993-1003 (2017).
- Vandivort, T. C., An, D., Parks, W. C. An Improved Method for Rapid Intubation of the Trachea in Mice. Journal of Visualized Experiments. (108), e53771(2016).
- Saraogi, A. Lung ultrasound: Present and future. Lung India. 32 (3), 250-257 (2015).
- Gargani, L., Volpicelli, G. How I do it: lung ultrasound. Cardiovascular Ultrasound. 12, 25(2014).
- Soldati, G., et al. On the Physical Basis of Pulmonary Sonographic Interstitial Syndrome. Journal of Ultrasound in Medicine. 35 (10), 2975(2016).
- Raes, F., et al. High-Resolution Ultrasound and Photoacoustic Imaging of Orthotopic Lung Cancer in Mice: New Perspectives for Onco-Pharmacology. PLoS One. 11 (4), 15(2016).
- Lakshman, M., Needles, A. Screening and quantification of the tumor microenvironment with micro-ultrasound and photoacoustic imaging. Nature Methods. 12 (4), 372(2015).
- Chichra, A., Makaryus, M., Chaudhri, P., Narasimhan, M. Ultrasound for the Pulmonary Consultant. Clinical Medicine Insights: Circulatory Respiratory and Pulmonary Medicine. 10, 9(2016).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。