Method Article
视觉GPCR-迷你G蛋白信号复合物的战略筛选与表征,成功结晶
摘要
本报告描述了不同的洗涤剂的筛选,以准备视觉GPCR,红蛋白,其复合与微型Go。演示了在纯化过程中不同阶段对复杂质量进行特征的生化方法。该协议可以推广为其他膜蛋白复合物,用于其未来的结构研究。
摘要
确定膜蛋白复合物晶体结构的关键是结晶前样品的质量。特别是,洗涤剂的选择是至关重要的,因为它影响复杂的稳定性和单分散性。我们最近确定了牛红豆素活性状态的晶体结构,与工程G蛋白,迷你Go,在3.1°分辨率。在这里,我们详细介绍了优化红蛋白-迷你Go复合物制备的过程。暗状态红黄素是在经典和新苯二醇(NPG)洗涤剂中制备的,随后在光线照射下形成具有微型Go的复杂形成。紫外可见(UV-VIS)光谱仪对多松子的稳定性进行了评估,该光谱监测光敏配体的红斑蛋白,9-cis视网膜的重组。自动大小排除色谱(SEC)用于描述红蛋白和红蛋白-迷你Go复合物的单扩散性。SDS-聚丙烯酰胺电泳(SDS-PAGE)在用库马西蓝色染色凝胶后,确定了红斑蛋白和迷你Go之间的1:1摩尔比,从而证实了该复合物的形成。在交叉验证所有这些分析数据后,我们消除了不合适的洗涤剂,并继续使用用于大规模制备和结晶的最佳候选洗涤剂。另一个问题来自N-糖基化的异质性。在SDS-PAGE上观察到异质表达的红蛋白有两种不同的N-糖基化种群,这很可能阻碍晶体生成。因此,测试了不同的去酶酶,并且EndoglycosidaseF1(EndoF1)产生多糖酶与单一种类的N-糖基酶。通过这种蛋白质质量特征化的战略管道,对多普辛-迷你Go复合体的制备进行了优化,以提供晶体结构。这只是GPCR+G蛋白信号复合物的第三个晶体结构。该方法还可以为其他膜蛋白及其复合物进行推广,以促进样品制备和结构测定。
引言
由于难以获得衍射晶体,因此确定膜蛋白及其复合物的晶体结构一直具有挑战性。与可溶性蛋白质相比,整体膜蛋白构成跨越细胞膜的疏水性核心。为了将细胞膜中的膜蛋白去除为水缓冲液,必须使用洗涤剂来形成洗涤剂蛋白云母,从而取代膜蛋白的疏水性核心周围的脂质。膜蛋白的稳定性、活性和完整性直接取决于洗涤剂1的化学和结构特性,洗涤剂的特性也决定了云母的大小。大型洗涤剂云母可以遮挡小膜蛋白的亲水表面,从而防止在使用蒸汽扩散方法时缺乏晶体接触而结晶。小洗涤剂云洗剂对晶体学有利,但短链洗涤剂通常较苛刻,因此会导致膜蛋白的不稳定和聚集。因此,在结晶之前,额外的洗涤剂筛选程序是必不可少的,通常针对仍然保持蛋白质稳定性的较短的洗涤剂。
G蛋白耦合受体(GPCRs)是含有七种跨膜异卵物的集成膜蛋白。GPCRs存在于两种主要状态,要么是由反前体或拮抗剂稳定的非活动状态,要么是与激动剂结合并由G蛋白稳定而存在的活性状态,尽管这两个极端之间可能存在多种子状态。GPCR 的结构确定最初侧重于与反逆论者和敌对者结合的非活动状态,由于其稳定性高于活动状态2。当GPCR在激动剂结合时激活时,受体是高度动态的,并且裂解在G蛋白耦合受体的细胞质表面暂时形成。据认为,这种活力是为什么受激动的GPCR往往比非活动状态更不稳定的原因。因此,筛选适合所研究受体的构象状态的洗涤剂变得至关重要,因为与非活动状态相比,研究活性状态可能需要较温和的洗涤剂。
在本报告中,我们使用视觉GPCR,牛红蛋白3,其复合与微型Go蛋白44,55进行洗涤剂筛选实验,分别代表非活性状态和活性状态。洗涤剂筛选侧重于经典的烷基麦芽糖苷和糖苷洗涤剂和新苯二醇(NPG)洗涤剂。在此背景下,经典洗涤剂由糖头组和烷基链构建,而NPG型洗涤剂包含两种相同的经典洗涤剂,在糖和烷基链66、7、87,8之间的界面上由四元碳融合。
设计了一个实验工作流程,从不同洗涤剂中杜松子酶的纯化开始,然后形成红豆蛋白-迷你-Go复合物,最后使用几种方法对复合物进行表征(图1)。对于多普辛的非活性状态,光敏感配体9-cis视网膜的重组通过紫外线可见(UV-VIS)光谱监测。光谱揭示了视网膜的物理化学状态,并指示其环境在杜松素的视网膜结合口袋。尺寸排除色谱(SEC)用于评估纯正红蛋白的单次分散以及红蛋白-迷你-Go复合物的形成。当SEC根据蛋白质分子的大小和形状进行区分时,聚合的蛋白质群可以识别为在空隙体积中。为了确认复杂地层,通过硫酸钠硫酸盐-多丙烯酰胺凝胶电泳(SDS-PAGE)对SEC的分数进行评估,以确认红糖素和微型Go的存在。
需要考虑的另一个因素是膜蛋白的翻译后修饰 (PTM)。PTM,如N-glycosy化,经常在哺乳动物和昆虫细胞表达系统产生的真核膜蛋白上观察到。人类胚胎肾293(HEK293)细胞的有限N-糖基化菌株是通过删除编码N-乙酰二醇酰胺酶I(GnTI)的基因而形成的,导致GlcNAc2Man5在共识站点Asn-X-Ser/Thr中形成均质的N-glycic化。虽然N-糖基化可以通过在共识位点中突变氨基酸残留物来预防,但这也可能改变蛋白质的功能或折叠效率。在牛罗多普素中,N-糖基化残留物Asn15的突变导致不正确的折叠和减少G蛋白活化9,9,10。本报告中使用的多辛在HEK 293 GnTI缺乏细胞系中表达。然而,SDS-PAGE显示了两种红蛋白的存在。这种异质性可以防止晶体形成,因此使用肽-N-糖苷酸F(PNGase F)和原体糖酶F1(Endo F1)进行去糖化。脱糖化产物的特点是SDS-PAGE和液相色谱质谱(LC-MS),以识别糖基化水平及其同质性。
研究方案
注:此洗涤剂筛选协议详细规定 30 g HEK293 细胞颗粒作为起始材料。
1. 材料、化学品和试剂
注:所有溶液均使用分析级试剂和超纯水制备,从去离子水中纯化,在25°C时达到18.2MΩcm的电阻率。
- 缓冲库存解决方案
- 制备 10 倍磷酸盐缓冲盐水 (10x PBS)。
- 准备 HEPES 缓冲液:1 M,用 NaOH 打分到 pH 7.5。
- 准备 5 M NaCl。
- 准备 2 M MgCl2。
注:所有库存溶液均通过 0.22 μm 过滤器,保持其无菌性。
- 洗涤剂库存解决方案
- 准备多代麦芽糖侧 (DDM),10%(v/ v)。
- 准备二乙酰麦芽糖侧 (DM),10%(v/ v)。
- 准备6环丙六基-六基麦芽糖(Cymal-6),10%(v)。
- 准备5环氧乙基-五氯苯甲酰麦芽糖侧(Cymal-5),10%(v)。
- 准备非基糖苷 (C9G),10%(v/ v)。
- 制备桂原麦芽糖新本醇 (LMNG),5%(v/ v)。
- 制备二乙酰麦芽糖新本醇 (DMNG),10%(v/ v)。
- 制备半氯苯甲酸酯-6新本醇(C6NG),10%(v)。
- 制备半氯苯甲酸酯-5新本醇(C5NG),10%(v)。
- 制备八基葡萄糖新苯二醇 (OGNG),10%(v)。
注:对于10%的洗涤剂库存溶液,用温和的摇动将1克洗涤剂粉末溶解在超纯水中,然后将最终体积调整到10mL。洗涤剂库存溶液应保持在-20°C,用于长期储存和工作期间在冰上。
注意:通常建议将瓶装洗涤剂存放在-20°C冰柜。装有洗涤剂粉末的瓶子在打开前应加热到室温。洗涤剂粉是吸湿剂,因此温度均衡会防止冷凝的形成,从而使洗涤剂变湿。
- 其他化学品和试剂
- 制备 1D4 免疫亲和力琼脂树脂:50% 浆料的 10 mL。
注:1D4免疫亲和性琼脂是与单克隆Rho1D4抗体相连的琼脂珠,它结合牛多普素TETSQVAPA的最后9种氨基酸作为表位。1D4 免疫亲和力琼脂用作亲和力纯化材料,用于捕获含有 C 端 1D4 序列的蛋白质。这种净化材料可以准备99,1111或购买。 - 制备9-cis视网膜溶液:1 mM,溶解在100%乙醇中。
注:在准备和储存过程中,防止光线暴露在视网膜下。 - 制备 1D4 肽(序列 TETSQVAPA):800 μM,溶于水中。
- 制备 1D4 免疫亲和力琼脂树脂:50% 浆料的 10 mL。
- 缓冲区
注:所有缓冲液均从库存溶液混合到所需浓度。使用前,所有缓冲液均冷却至4°C。- 准备缓冲区 A:PBS,0.04% DDM。
- 制备缓冲液 B:20 mM HEPES pH 7.5,150 mM NaCl,0.04% DDM。
- 制备缓冲液 C:20 mM HEPES pH 7.5、150 mM NaCl 和洗涤剂的工作浓度表1所列。
- 制备缓冲液 D:20 mM HEPES pH 7.5,150 mM NaCl。
- 制备洗脱液缓冲液:20 mM HEPES pH 7.5、150 mM NaCl、80 μM 1D4肽和洗涤剂在其工作浓度下。
- 制备 SEC 缓冲液:20 mM HEPES pH 7.5、150 mM NaCl、0.025% DDM;通过 0.22 μm 过滤器过滤。
- 用于LC-MS的溶剂
- 制备溶剂A:含有0.1%甲酸的醋酸。
- 制备溶剂B:超纯水,含有0.1%的酸。
- 制备溶剂C:异丙醇。
2. 细胞膜溶解和蛋白质提取
- 解冻30克HEK293 GnTI-细胞颗粒表达牛红豆素突变N2C/M257Y/D282C3,99到室温,加入120 mL的1xPBS缓冲液含有蛋白酶抑制剂鸡尾酒和均质使用脱脂均质器或电动均质器(13,000 rpm为30s)。3在烧杯中收集均质细胞悬浮液,并将体积调整到 150 mL。
注:30克细胞颗粒相当于3升细胞培养在2 x 106细胞/mL密度。 - 轻轻将 10% DDM 添加到均质细胞中,最终浓度为 1.25%。在冰上搅拌1小时。
- 将细胞在 4 °C 和 150,000 x g下分离45分钟,以清除未溶解的碎屑。
- 将上清液转移到500 mL瓶中,加入10 mL的1D4免疫亲和力琼玫瑰树脂(50%浆料)。轻轻混合溶解细胞乳酸和树脂4小时或一夜在4°C。
- 将集物/树脂混合物装载到开柱上以收集树脂。
- 用洗涤缓冲液 A 的 10 列体积 (CV) 清洗树脂。
注: 列卷是包装的体积 (100%)使用的阿加罗斯树脂。在这种情况下,1 CV 是 5 mL。 - 用 2 个 CV 的缓冲液 A 重新悬浮树脂。
注意:从第 2.8 步开始,需要在昏暗的红灯条件下执行的步骤在描述开头标有"[Dark]"。 - [黑暗]将 9-cis 视网膜添加到重新悬浮树脂中,最终浓度为 50 μM。在黑暗中轻轻混合在4°C下4-16小时。
注:较短的孵育时间可能导致视网膜的不完全重组。 - [黑暗]从列中删除流。用 20 CV 缓冲液 A 清洗树脂,然后是 15 CV 缓冲液 B。
- [黑暗]将树脂重新悬浮在 2 CV 缓冲液 B 中,然后将树脂悬浮液平均划分为 10 10 mL 处理柱。
- [黑暗]从柱中取出流,然后重新悬浮树脂在1 mL缓冲液C中。 在4°C下孵育1小时。
- [黑暗]重复步骤 2.11。
- [黑暗]从柱中去除流,然后在每个柱的 0.8 mL 排液缓冲液中重新挂起树脂。轻轻混合 2 小时。
- [黑暗]从柱体收集到 2 mL 管中。
- [黑暗]在每个柱的 0.7 mL 解流缓冲液中重新悬浮树脂。轻轻混合 1 小时。
- [黑暗]从柱子收集到同一管中。
3. UV-VIS 光谱
- 准备分光度计,覆盖 250-650 nm 的测量范围。使用水或洗脱缓冲液记录基线。
- [黑暗]将洗脱的蛋白质加载到石英cuvette上。测量蛋白质样本的光谱。
- [黑暗]直接在皿中照亮蛋白质 2 分钟,光线通过 495 nm 长通过滤器。
- 测量照明样品的光谱。
- 对其他 9 种洗涤剂中纯化的所有蛋白质样品执行相同的测量,包括深色和发光状态。
- 在 X-Y 散点图中绘制曲线(吸收率与波长)。
4. 杜松子和红蛋白-迷你Go复合物的自动尺寸排除色谱
- [黑暗]使用分子量截止量 (MWCO) 在 4°C 时的分子量截止 (MWCO) 30 kDa 的旋转集中器,通过离心将蛋白质浓缩到 100 μL。过度浓缩的样品可以使用从集中器或缓冲器 C 流中稀释。要确定蛋白质样品浓度,请使用分光光度计测量 280 nm 的吸收度。
注:从第4.2步开始,实验不需要黑暗的环境,因此样品可以在正常光下制备。 - 在每个洗涤剂条件下,以0.7mg/mL制备100μL多脂蛋白。
- 为每个洗涤剂条件制备100 μL的红蛋白(0.7毫克/mL)和微型Go4、12(0.2mg/mL)12混合物。4用1 mM MgCl2补充混合物。用 495 nm 长通滤光片的光照亮混合物,孵育 30 分钟。
- 在液体色谱净化器上安装一个24 mL凝胶过滤柱,球状蛋白的分馏范围为10-600 kDa。将列与 SEC 缓冲区进行平衡。
注:液相色谱净化器配有自动采样器、多波长检测器和分数收集器。 - 将样品转移到自动取样器小瓶,并将其放入样品托盘中。对方法文件进行编程,以自动按每个样本运行 SEC 运行,自动采样器将样本的 77 μL 加载到列中,然后净化器以每次运行 0.5 mL/min 的流速对 SEC 缓冲区进行 24 mL 的抽取。将吸光度记录在 280 nm 和 380 nm 处。
- 在12.9 mL左右的保留量下收集多辛和多普辛-迷你Go复合物的峰值分数。
- 分析步骤 4.2 中的左红斑蛋白样品和 4-12% SDS-变性梯度凝胶上的多普辛-迷你-Go复合物的峰值分数,并带有 Coomassie 蓝色染色。
- 绘制洗脱色度图(A280或 A380与保留体积)。
5. 去糖化和LC-MS研究
- 对于LC-MS研究,仅在 LMNG 洗涤剂中使用纯化的红蛋白样品。
- 在1mg/mL和PNGase F13下以0.01毫克/米L制备200μL的红蛋白混合物。混合好,在4°C孵育过夜。
- 在 1 mg/mL 和 Endo F113下以 0.01 mg/mL 制备 200 μL 的杜松子酶混合物。混合好,在4°C孵育过夜。
- 通过 SDS-PAGE 和库马西蓝色染色分析消化结果。
- 浓缩未经处理和 Endo F1 处理的红蛋白样品,并在缓冲 D 中接受 SEC 纯化。
注:这是准备样品与最少的洗涤剂量为LC-MS研究。缓冲D不含任何洗涤剂,但由于从膜蛋白14中LMNG的缓慢脱脂率,红蛋白不会聚集。 - 在 12.9 mL 左右的保留量下收集峰值分数。使用旋转集中器(MWCO 30 kDa)浓缩至 1 mg/mL。
- 将10μg的蛋白质注入Reprosil 200 C18-AQ柱,并使用线性梯度方法将该柱与表2所列溶剂成分和设置一起注入。质谱仪的流量分为25%,紫外线检测的流量分为75%。
结果
示例制备和分析的实验工作流在图 1中进行了总结。使用开放式柱进行小规模的亲和力纯化,使我们能够在许多不同的洗涤剂条件下并行制备样品(图1A)。这种小规模的纯化设置产生了足够的蛋白质,用于使用UV-VIS光谱仪、SEC和SDS-PAGE进一步分析(图1B-C)。
UV-VIS 光谱显示多普辛稳定性
视网膜重组的红蛋白的稳定性通过光学吸收度进行了评估(图2)。在黑暗状态下,9-cis视网膜作为质子的希夫基地与Lys296有共价的联系。照明后,9-cis视网膜异构体与全跨异构体异构,Schiff基环解质子。质子9-cis视网膜在488nm处提供吸收峰值,而非质子全转视网膜的峰值为380nm。DDM 中杜松素的 UV-VIS 光谱显示了 9 cis 视网膜结合和光活化红黄素的典型吸收,其中蓝移为 108 nm,光学密度大致相同(图 2A,左上面板)。当红蛋白被不稳定,然后视网膜变化的绑定口袋,导致视网膜去垂和可能分离。如果发生这种情况,然后频谱显示从去Prode的贡献,以及视网膜15的自由形式。因此,我们通过蛋白质(280 nm)和视网膜(质子9-cis视网膜的488 nm,用于脱质子全透视网膜)之间的吸收比,确定视网膜重组成红蛋白酶的效率(图2B)。在经典洗涤剂(DDM、DM、Cymal-6、Cymal-5、C9G)中纯化的罗多普辛样品显示相同的光学轮廓。然而,在NPG洗涤剂(LMNG、DMNG、Cymal-6NG、Cymal-5NG)中纯化的样品显示光学轮廓,表明除OGNG样品外,视网膜的结合环境不够理想,后者提供的光学轮廓与DDM样品相同。
大小排除色谱法显示样品纯度和蛋白质单一分散性。
SEC 是一种高效、可靠的分析工具,用于在制备和筛选过程中评估蛋白质样本。它验证了先前纯化步骤的样品纯度以及蛋白质分子的单分散性。对于杜松子及其微型Go复合体,从280nm和380nm的吸收曲线中解释样品质量(图3A)。280纳米的微量显示蛋白质的存在,380nm的微量显示视网膜的存在。在空隙体积中出现的任何信号(使用此列时约为 8 mL)都归因于蛋白质聚集体。因此,结果表明,在经典洗涤剂中制备的样品处于单分散状态,但C9G除外,C9G中出现了一部分聚集。相比之下,使用NPG型洗涤剂制备的样品比C9G样品含有更多的聚合体;LMNG 和 Cymal-6NG 导致最聚集的形成,但在 DMNG 和 Cymal-5NG 中观察到的聚合较少。情况例外是 OGNG,它显示了与 DDM 类似的配置文件。在空隙体积下,蛋白质聚集量的视网膜占用率也较差,A280/A380比率与135 kDa的保留量为±12.9 mL的峰值相比有所增加。我们观察到的另一个特征是,多普素和红黄素-迷你Go围绕相同的保留体积(图3B)。这并不奇怪,因为洗涤剂结合的红蛋白的明显分子量为120 kDa和多普辛-迷你Go 144 kDa。因此,我们无法仅从 SEC 数据中确定复杂形成,因此使用 SDS-PAGE 进一步分析 SEC 纯化样本。
SDS-PAGE 已确认复杂地层
SDS-PAGE 是识别样品中蛋白质成分的标准方法。SDS-PAGE 对浓缩杜松子蛋白(在 SEC 纯化之前)进行了分析,以确认其纯度,并显示两个带数接近 37 kDa 和涂抹带超过 50 kDa(图 4A)。较低的两个波段后来被证实有不同的N-糖基化状态。50 kDa 以上的频带被解释为 SDS-PAGE 样品缓冲器诱导的聚合红蛋白酶寡聚物,因为这些聚合在 SEC 或任何其他检测方法中未观察到。由于 SEC 数据无法确认复杂地层,因此使用 SDS-PAGE 对罗多普素-迷你 Go样本中的分数进行了分析。SDS-PAGE在所有洗涤剂条件下都显示了多辛和迷你Go的蛋白质带,这表明无论洗涤剂的选择如何,都形成了这种复合物(图4B)。
LC-MS光谱仪鉴定了红蛋白酶中的N-糖基化模式
来自亲和力纯化和SEC的Rhodopsin样本显示,在SDS-PAGE凝胶上,两个蛋白带的表位分子量约为37 kDa,在使用24mL柱时,SEC无法分离。HEK 293GnTI中异质表达的红蛋白不同模式是最有可能的解释。因此,两种酶,PNGase F和EndoF1,测试其脱糖基性多糖酶的能力。从SDS-PAGE数据,Endo F1将两种蛋白带的分子量降低为一个产品,而PNGase F消化仍然给两个种群(图5A)。使用LC-MS光谱法对未消化的和Endo F1处理的样品进行分析,以识别不同物种的质量。数据显示,在HEK 293 GnTI中产生的红豆蛋白-细胞含有一两个N-甘油,质量差异为1014±1 Da。 Endo F1处理过的红糖蛋白不含任何N-甘酸,与含有两个N-甘油的红豆蛋白相比,其质量差异为2027±1 Da。这些结果与用于表达多多普素的细胞系中缺少N-乙酰二聚酰胺酶I一致,这导致所有N-甘油具有GlcNAc2人5,(质量1014 Da)。
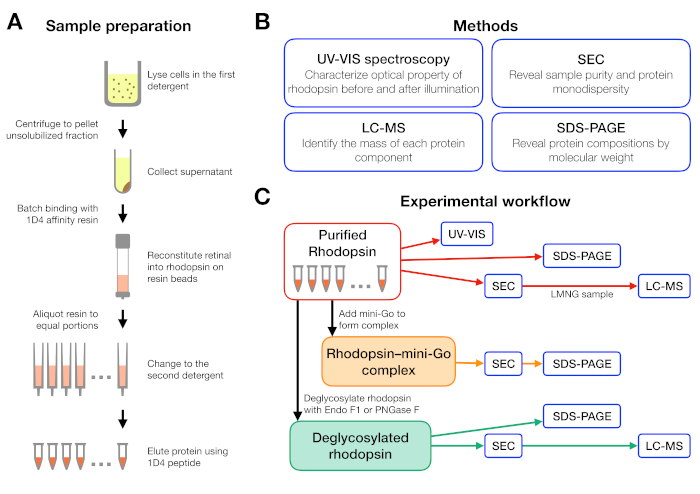
图1:洗涤剂筛选实验的样品制备和表征。(A) 在纯化过程中,在不同洗涤剂中制备多辛样品。(B) 协议中使用的方法:UV-VIS光谱、大小排除色谱(SEC)、SDS-PAGE 和液体色谱-质谱法 (LC-MS)。(C) 多普素、红糖素-迷你Go和多糖素去酶化产物的特性实验工作流程。请点击此处查看此图形的较大版本。
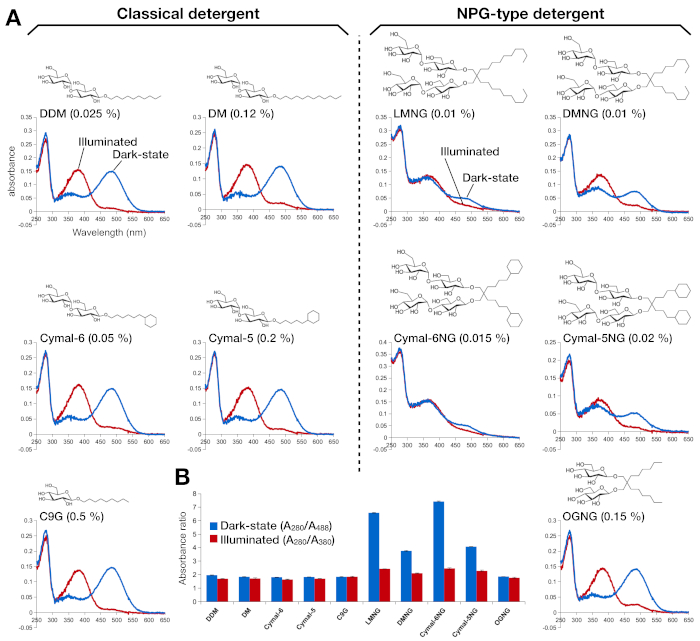
图2:红蛋白的UV-VIS光谱。(A) 杜松素的UV-VIS光谱。暗状态、9-cis视网膜结合的红蛋白的光谱以蓝色曲线显示。照明后,9-cis视网膜被去质子和异构体成全转视网膜,发光的红蛋白素的光谱显示为红色曲线。每个洗涤剂的化学结构显示为内部。(B) A280/A488 (蓝色柱)和 A280/A380 (红色条) 的比率分别描绘了红松在黑暗状态和光状态下的稳定性。请点击此处查看此图形的较大版本。
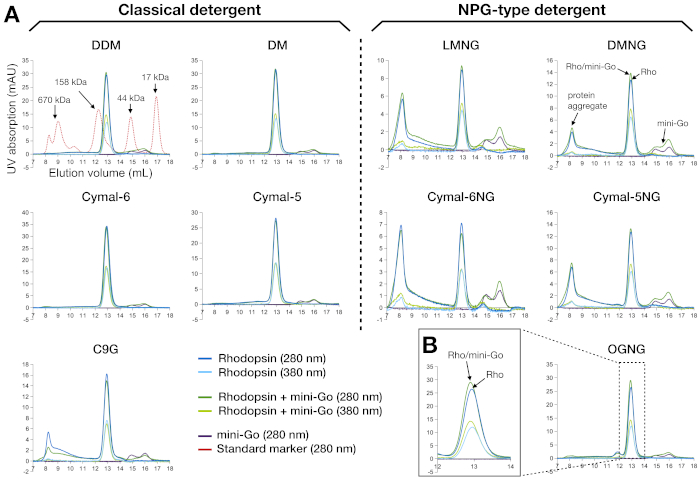
图3:罗多辛和红松子的尺寸排除色谱谱–在10种不同的洗涤剂中纯化的微型Go复合物A。右侧面板表示在 NPG 型洗涤剂中纯化的样品的 SEC 配置文件。标准标记蛋白的轮廓与 DDM 样本一起显示为叠加。峰值配置文件的解释用于 DMNG,对于 DDM、DM、Cymal-6、Cymal-5 和 OGNG,可以看到理想的方案(无聚合)。(B) OGNG 样品的放大轮廓在 12-14 mL 的保留量中。所有样品都使用 Superdex200 增加 10/300 GL 列进行分析。请点击此处查看此图形的较大版本。
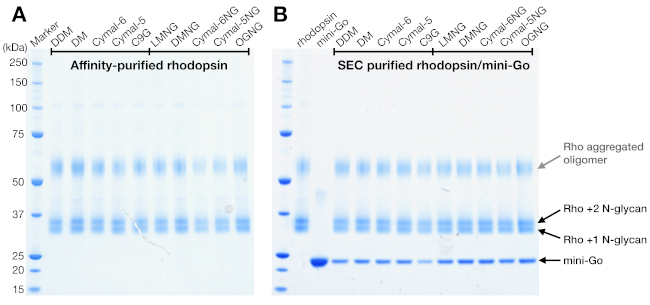
图4:红蛋白和红蛋白酶/微果复合物的SDS-PAGE分析。(A) 在洗涤剂中纯化的罗多普辛样品。50 kDa 以上的涂片带归因于 SDS-PAGE 样品缓冲液诱导的聚合多辛寡聚物。(B) SEC 纯化的杜松子蛋白/微型围棋复合物样品。描述含有1和2 N-甘油和迷你Go的罗多普辛。请点击此处查看此图形的较大版本。
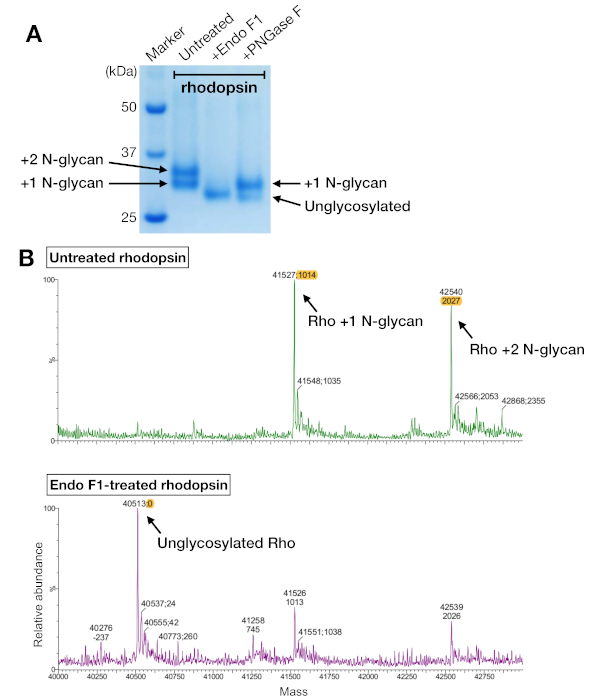
图5:多糖酶中糖参异的鉴定。(A) SDS-PAGE 使用 PNGasE F 和 Endo F1 对去糖基化多糖蛋白酶的分析。(B) 不含(上面板)的红蛋白酶的 LC-MS 光谱,以及 Endo F1(下面板)的去糖化。为了准备红斑狼疮-迷你Go复合物进行结晶,我们选择了Endo F1而不是PNGase F,因为Endo F1提供了单一同质的红斑狼疮。请点击此处查看此图形的较大版本。
| 洗涤剂 | 工作浓度(%) | 关键云母浓度 (%) |
| Ddm | 0.025 | 0.0087 |
| Dm | 0.12 | 0.087 |
| 西马尔-6 | 0.05 | 0.028 |
| 西马尔-5 | 0.2 | 0.12 |
| C9G | 0.5 | 0.2 |
| LMNG | 0.01 | 0.001 |
| DMNG | 0.01 | 0.0034 |
| 西马尔-6NG | 0.015 | 不可用;应低于 0.056 |
| 西马尔-5NG | 0.02 | 0.0056 |
| OGNG | 0.15 | 0.058 |
表1:缓冲剂C洗涤剂浓度。
| 时间(分钟) | 溶剂 A (%) | 溶剂 B (%) | 溶剂 C (%) | 流速(毫升/分钟) |
| 0 | 0 | 95 | 5 | 0.5 |
| 1 | 0 | 95 | 5 | 0.5 |
| 5 | 20 | 75 | 5 | 0.6 |
| 25 | 85 | 10 | 5 | 0.6 |
| 26 | 90 | 5 | 5 | 0.6 |
| 30 | 90 | 5 | 5 | 0.6 |
表 2:列洗脱参数。
讨论
蛋白质结晶的成功很大程度上依赖于蛋白质样本,特别是膜蛋白及其复合物,由于洗涤剂引起的并发症。本报告演示了 GPCR-mini-G 蛋白信号复合物的洗涤剂筛选和评估样品质量。多种方法已广泛应用于研究膜蛋白的生化特性,例如,使用荧光染料16、17,17进行热稳定性测定,结合测定,通过测量锥形荧光信号18的变化或生物传感器的共振能量传递19来检测复杂地层。然而,这些方法中使用的化学环境与制备结晶样品的环境大不相同,要么蛋白质的浓度低千倍,用于荧光测量,要么蛋白质嵌入脂质双层或一种固定洗涤剂条件下。在该协议中,在结晶前的大规模样品制备中也对所使用的方法进行了标准化。因此,优化的参数可以很容易地转移到结晶尺度制备,而无需进一步的主要筛选和优化。
该协议的目的是优化制备稳定、均匀的GPCR-迷你G蛋白复合物,通过X射线晶体学进行蒸汽扩散结晶和结构测定。该协议集成了一套方法,以定性地评估洗涤剂和脱糖在制备红糖酶-迷你Go复合物过程中的影响。在洗涤剂中纯化的辛氏醇(C8G)20、21、22和C9G20,21,22 23、24,24时,在非活性状态和光活状态与传感器肽结合和未结合的光活性肽已经结晶。由于在C8G和C9G中纯化的红蛋白-mini-Go复合物没有产生晶体(数据未显示),我们使用所述策略探索了更广泛的其他洗涤剂(图1)。通过利用红蛋白的光敏度,我们很可能遵循280nm以外的波长视网膜的重组。在UV-VIS光谱和SEC中,我们在380nm或488nm处检测到视网膜。然而,大多数膜蛋白在纯化过程中没有如此方便的色光来遵循功能。其他选择是添加可检测光的色光或使用放射性配体结合和热移测定25来检测配体。
罗多普辛的分子量为40 kDa。由于它结合的洗涤剂质量,它在SEC上的明显分子量约为120 kDa。因此,在 SEC 上不容易检测到微型 Go (24 kDa) 的结合,这并不奇怪,因为这需要分化表面质量为 120 kDa 和 144 kDa 的蛋白质。因此,SDS-PAGE对SEC分数进行分析,以确认样品纯度和复杂地层。即使 SEC 配置文件在复杂地层上有明显变化,仍建议执行 SDS-PAGE 分析,以使用正确的结合伙伴(而不是其他共纯纯蛋白污染物)确认复杂形成。
多面胶和微型Go均以毫克量纯化,允许对复合物使用低灵敏度检测,如在SEC和SDS-PAGE凝胶的Commassie蓝色染色过程中吸收UV-VIS。在样品有限的情况下,应使用更灵敏的检测,例如配备荧光检测器的LC净化器,用于跟踪来自蛋白质的色氨酸信号(280 nm 激发,350 nm 发射)和 SDS-PAGE 凝胶的银染色。另一种方法是将荧光蛋白(如绿色荧光蛋白(GFP)与感兴趣的蛋白质融合,这种蛋白质即使在蛋白质表达26期间也能检测,但在结晶前也应将其去除。
必须确保纯化蛋白也不含可变PTM引起的异质性。在此描述的案例中,在SDS-PAGE凝胶上观察到的两个红豆蛋白酶种群被定性为有一两种N-甘油。蛋白质的可变修饰可能会阻止衍射晶体的形成,因此我们去糖化的红蛋白酶。endogcosidase Endo F1是最有效的endogcosidas酶测试和治疗导致单一种类的未糖化受体,而PNGase F只部分去除红豆素上的甘油,导致红豆素完全无糖化或与一个N-甘油的混合物。未经脱糖酶处理的红豆蛋白已成功结晶3,3,27,28,,28和红糖酶Asn15上的N-甘油是重要的形成晶体接触在这些情况下。在多糖酶-迷你Go的情况下,有必要通过Endo F1去除N-甘油以获得晶体。在结晶之前,没有去糖化蛋白质的标准化规则,但当蛋白质在广泛的结晶试验后无法结晶时,应考虑去除异质PTM。
此处描述的数据和方法引导我们选择 OGNG 作为多普辛-迷你Go复合物结晶的首选洗涤剂,因为它的云母体积小,能够稳定复合物。我们还使用 Endo F1 来确保纯化的红蛋白是一种同质物种。晶体随后被获得,我们确定晶体结构为+3.1×4,这只是4GPCR_G蛋白信号复合体14,29,29的第三个晶体结构。
对于与伴侣蛋白结合和没有伴侣蛋白的膜蛋白,它们应被视为两种不同的蛋白质。不同功能状态下的蛋白质具有不同的一致性,并且处于不同的能量水平。因此,建议优化每个功能状态的准备协议,因为非活动状态的参数可能无法完全传输到激活状态。此外,更何况蛋白质属性的变化复杂的结合伙伴蛋白。该协议采用标准化的方法制备结晶样品,以制备不同洗涤剂中的非活性膜蛋白,然后进行蛋白质活化和复杂形成,并表征蛋白质质量。因此,这种协议可以很容易地推广到其他膜蛋白及其复合物,进行结构研究,进行细微的修改。
披露声明
CGT 是 Sosei Heptares 科学咨询委员会的顾问和成员。所有其他作者都没有什么可透露的。
致谢
我们感谢格布哈德·舍尔特勒博士对这个项目的长期支持,罗杰·道森博士和霍夫曼·拉罗什博士在细胞培养方面给予的支持。这项工作由瑞士国家科学基金会赞助(向GFXS提供210030*153145和310030B_173335),欧洲研究理事会(EMPSI,339995)和医学研究委员会(MRC U105197215)向CGT提供资金。FP通过国家分子超快科学和技术研究中心(NCCR MUST)和ETH飞秒和Atto秒科学和技术(ETH FAST)项目确认苏黎世ETH。FP、JM、AB 和 CJT 承认保罗·舍勒研究所提供的长期财政支持。
材料
| Name | Company | Catalog Number | Comments |
| 1D4 peptide | Peptide2.0 | Under request | |
| 9-cis retinal | Sigma-Aldrich | R5754 | |
| Autosampler A-900 | GE Healthcare | Discontinued | |
| C9G | Anatrace | N324 | |
| cOmplete, EDTA-free protease inhibitor coctail | Roche | 5056489001 | |
| Cymal-5 | Anatrace | C325 | |
| Cymal-5NG | Anatrace | NG325 | |
| Cymal-6 | Anatrace | C326 | |
| Cymal-6NG | Anatrace | NG326 | |
| DDM | Anatrace | D310 | |
| DM | Anatrace | D322 | |
| DMNG | Anatrace | NG322 | |
| Econo column | Bio-Rad | 7372512 | |
| Ettan LC | GE Healthcare | Discontinued | |
| FRAC-950 | GE Healthcare | Discontinued | |
| HPLC Water 2795 Separation Module | Waters AG | 720000358EN | |
| InstantBlue Protein Stain | Expedeon | ISB1L | |
| LCT Premier mass spectrometer (ESI-TOF) | Waters AG | - | |
| LMNG | Anatrace | NG310 | |
| Monitor UV-900 | GE Healthcare | 18110835 | |
| Nanodrop 1000 | Witec AG/ThermoFisher | Discontinued | |
| NuPAGE 4-12% Bis-Tris gel 1.0 mm, 15 well | ThermoFisher | NP0323BOX | |
| NuPAGE MES SDS buffer (20x) | ThermoFisher | NP0002 | |
| OGNG | Anatrace | NG311 | |
| PAGEr Minigel Chamber | Lonza | 59905 | |
| Reprosil 200 C18-AQ column | Morvay Analytik GmbH | #s1503 | |
| Superdex 200 Increase GL column | GE Healthcare | 28990944 | |
| Tabletop centrifuge 5424R | Eppendorf | 5404000413 | |
| Ultracentrifuge Optima XE-100 | Beckmann Coulter | A94516 | |
| ULTRA-TURRAX T25 | IKA WERKE | 0003725003 | |
| UV-VIS spectrophotometer | Shimadzu | UV-2401PC | |
| Waters 2487 Dual λ Absorbance Detector | Waters AG | - |
参考文献
- Tate, C. G. Practical considerations of membrane protein instability during purification and crystallisation. Methods in Molecular Biology. 601, 187-203 (2010).
- Lebon, G., Bennett, K., Jazayeri, A., Tate, C. G. Thermostabilisation of an agonist-bound conformation of the human adenosine A(2A) receptor. Journal of Molecular Biology. 409 (3), 298-310 (2011).
- Deupi, X., et al. Stabilized G protein binding site in the structure of constitutively active metarhodopsin-II. Proceedings of the National Academy of Sciences. 109 (1), 119-124 (2012).
- Tsai, C. -. J., et al. Crystal structure of rhodopsin in complex with a mini-G o sheds light on the principles of G protein selectivity. Science Advances. 4 (9), (2018).
- Carpenter, B., Tate, C. G. Engineering a minimal G protein to facilitate crystallisation of G protein-coupled receptors in their active conformation. Protein Engineering Design and Selection. 29 (12), 583-594 (2016).
- Chae, P. S., et al. Maltose-neopentyl glycol (MNG) amphiphiles for solubilization, stabilization and crystallization of membrane proteins. Nature Methods. 7 (12), 1003-1008 (2010).
- Loll, P. J. Membrane proteins, detergents and crystals: what is the state of the art. Acta Crystallographica Section F Structural Biology Communications. 70 (12), 1576-1583 (2014).
- Chae, P. S., et al. Glucose-neopentyl glycol (GNG) amphiphiles for membrane protein study. Chemical communications. 49 (23), 2287-2289 (2013).
- Standfuss, J., Xie, G., Edwards, P. C., Burghammer, M., Oprian, D. D., Schertler, G. F. X. Crystal structure of a thermally stable rhodopsin mutant. Journal of Molecular Biology. 372 (5), 1179-1188 (2007).
- Kaushal, S., Ridge, K. D., Khorana, H. G. Structure and function in rhodopsin: the role of asparagine-linked glycosylation. Proceedings of the National Academy of Sciences of the United States of America. 91 (9), 4024-4028 (1994).
- Molday, L. L., Molday, R. S. 1D4: a versatile epitope tag for the purification and characterization of expressed membrane and soluble proteins. Methods in Molecular Biology. 1177 (604), 1-15 (2014).
- Carpenter, B., Tate, C. G. Expression and Purification of Mini G Proteins from Escherichia coli. Bio-Protocol. 7 (8), (2017).
- Grueninger-Leitch, F., D'Arcy, A., D'Arcy, B., Chène, C. Deglycosylation of proteins for crystallization using recombinant fusion protein glycosidases. Protein Science. 5 (12), 2617-2622 (1996).
- Rasmussen, S. G. F., et al. Crystal structure of the β2 adrenergic receptor-Gs protein complex. Nature. 477 (7366), 549-555 (2011).
- Loginova, M. Y., Rostovtseva, Y. V., Feldman, T. B., Ostrovsky, M. A. Light damaging action of all-trans-retinal and its derivatives on rhodopsin molecules in the photoreceptor membrane. Biochemistry (Moscow). 73 (2), 130-138 (2008).
- Alexandrov, A. I., Mileni, M., Chien, E. Y. T., Hanson, M. A., Stevens, R. C. Microscale Fluorescent Thermal Stability Assay for Membrane Proteins. Structure. 16 (3), 351-359 (2008).
- Sonoda, Y., et al. Benchmarking Membrane Protein Detergent Stability for Improving Throughput of High-Resolution X-ray Structures. Structure. 19 (1), 17-25 (2011).
- Maeda, S., et al. Crystallization scale preparation of a stable GPCR signaling complex between constitutively active rhodopsin and G-protein. PloS One. 9 (6), 98714 (2014).
- Boute, N., Jockers, R., Issad, T. The use of resonance energy transfer in high-throughput screening: BRET versus FRET. Trends in Pharmacological Sciences. 23 (8), 351-354 (2002).
- Singhal, A., Guo, Y., Matkovic, M., Schertler, G., Deupi, X., Yan, E. C. Y. Structural role of the T 94 I rhodopsin mutation in congenital stationary night blindness. EMBO Report. 17 (10), 1-10 (2016).
- Choe, H. -. W., et al. Crystal structure of metarhodopsin II. Nature. 471 (7340), 651-655 (2011).
- Mattle, D., et al. Ligand channel in pharmacologically stabilized rhodopsin. Proceedings of the National Academy of Sciences of the United States of America. 115 (14), 3640-3645 (2018).
- Okada, T., Fujiyoshi, Y., Silow, M., Navarro, J., Landau, E. M., Shichida, Y. Functional role of internal water molecules in rhodopsin revealed by X-ray crystallography. Proceedings of the National Academy of Sciences of the United States of America. 99 (9), 5982-5987 (2002).
- Blankenship, E., Vahedi-Faridi, A., Lodowski, D. T. The High-Resolution Structure of Activated Opsin Reveals a Conserved Solvent Network in the Transmembrane Region Essential for Activation. Structure. 23 (12), 2358-2364 (2015).
- Magnani, F., et al. A mutagenesis and screening strategy to generate optimally thermostabilized membrane proteins for structural studies. Nature Protocols. 11 (8), 1554-1571 (2016).
- Kawate, T., Gouaux, E. Fluorescence-detection size-exclusion chromatography for precrystallization screening of integral membrane proteins. Structure. 14 (4), 673-681 (2006).
- Standfuss, J., et al. The structural basis of agonist-induced activation in constitutively active rhodopsin. Nature. 471 (7340), 656-660 (2011).
- Singhal, A., et al. Insights into congenital stationary night blindness based on the structure of G90D rhodopsin. EMBO reports. 14 (6), 520-526 (2013).
- Carpenter, B., Nehmé, R., Warne, T., Leslie, A. G. W., Tate, C. G. Structure of the adenosine A(2A) receptor bound to an engineered G protein. Nature. 536 (7614), 104-107 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。