Method Article
在果蝇黑色无gaster的Axon死亡期间,对Axon及其突触的形态和功能评估
摘要
在这里,我们提供协议,在果蝇黑色素气仪中执行三个简单的伤害诱发的斧子退化(斧子死亡)测定,以评估被切断的斧子及其突触的形态和功能保存。
摘要
Axon退化是神经退行性疾病和神经系统受到机械或化学力挑战的共同特征。然而,我们对斧子退化背后的分子机制的理解仍然有限。伤害引起的斧子退化是一个简单的模型,用于研究断的斧子如何执行自己的拆卸(斧子死亡)。近年来,从苍蝇到哺乳动物,已发现一种进化保存的斧子死亡信号级联,这是分离的斧子在受伤后退化所必需的。相反,衰减的斧子死亡信号会导致被割断的斧子及其突触的形态和功能保存。在这里,我们提出了三个简单的和最近开发的协议,允许观察六核形态,或合六和突触功能被切断的断体和突触功能,从神经元细胞体被切断,在果蝇果蝇果蝇果蝇果蝇果蝇果蝇果蝇。形态学可以在机翼中观察到,其中部分损伤导致同一神经束中未受伤的控制斧头并排死亡。或者,在大脑中也可以观察到斧形形态,整个神经束会经历由天线消融引起的斧子死亡。分离的斧子及其突触的功能保存可以通过简单的光遗传学方法与突触后修饰行为相结合来评估。我们举例使用高线功能丧失突变和过度表达的dnmnat,两者都能够延迟斧子死亡数周至数月。重要的是,这些协议可以在伤害之外使用;它们有助于神经元维持因子、斧路迁移和同形线粒体的表征。
引言
神经元的形态完整性对于整个生命中持续神经系统功能至关重要。绝大多数的神经元体积是由斧子11,22采取;因此,对神经系统来说,维持特别长的斧子是一个重大的生物和生物能量挑战。已确定多种共和体内和胶质外在支撑机制,确保终身共和生存。他们的损伤导致斧子退化3,这是神经系统在疾病中受到挑战的一个常见特征,并且受到机械或化学力44,5。5然而,安克逊退化的基本分子机制在任何情况下仍然难以理解,使得开发有效的治疗方法来阻止斧子损失具有挑战性。发展针对这些神经系统疾病的有效疗法很重要,因为它们给我们的社会造成了巨大的负担。
伤害引起的斧子退化是研究断体斧子如何进行自身拆卸的简单模型。瓦勒亚退化(WD)由奥古斯都·沃勒于1850年发现并命名,是一个总称,由两个不同的分子分离过程7组成。首先,在斧头损伤后,从细胞体分离的斧头在受伤后一天内通过进化保存的斧头死亡信号级联积极执行自己的自我毁灭(斧头死亡)。其次,周围的胶质和专门的邻形细胞在三到五天内接触和清除产生的斧屑。斧子死亡信号的衰减导致断的斧子,保持数周9,109,10,11,12,而胶质吞没的衰减最终在斧子碎片,持续数周在体内,11,1213,14,15。13,14,15
对苍蝇、老鼠、老鼠和斑马鱼的研究表明,阿克斯死亡信号信号发出信号的几种进化保存和基本中介。斧子死亡突变体含有分断的斧子和突触,这些斧子和突触没有经历斧子死亡;,在没有细胞体支撑,,,,9、10、12、13、16、17、18、19、20、21、22、2310,的情况下,它们在形态上和功能上保持了数周。,,1821,221323,20912161719这些中介的发现和表征导致了执行斧子死亡的分子通路的定义。重要的是,斧子死亡信号不仅被切开,粉碎或拉伸24,25,25激活;它似乎也是神经条件的不同动物模型(例如,斧子以与损伤无关的方式退化4,但具有一系列有益结果44,8)8的贡献者。因此,了解斧子死亡如何在受伤后执行斧子退化,可能会提供超越简单伤害模型的见解;它也可以提供治疗干预的目标。
果蝇果蝇果蝇黑色素虫(果蝇)已被证明是一个宝贵的系统,斧子死亡信号。研究揭示了四个基本进化保存的轴子死亡基因:高线(hiw)11,14,dnmnat12,26,dsarm1011,14和dsarm10dnmnat12,26axun死(轴)12。这些调子的修改——hiw、dsarm和斧头的功能丧失dsarm突变,以及dnmnat的过度表达——有力地阻止了苍蝇寿命的轴子死亡。虽然被切断的野生轴突在1天内死亡,但被切断的轴突及其缺乏hiw、dsarm或斧头的突触不仅停留在hiw形态学上,而且功能保存数周。能否通过高水平的dnmnat实现功能保存,仍有待确定。
在这里,我们将提出三种简单和最近开发的协议,以研究斧子死亡(例如,被切断的斧子的形态和功能及其突触随着时间的推移),在缺乏细胞身体支持。我们演示了衰减的斧子死亡如何导致被切断的斧子,这些斧子在形态上保存与hiw功能丧失突变(hiw_N),以及衰减的斧子死亡如何导致被切断的斧子和突触,这些斧子和突触在功能上保持至少7天,过度表达的dnmnat(dnmnat dnmnatOE)。这些协议允许在中枢或外周神经系统(分别为CNS和PNS)13、14,14中观察个体轴突和突触形态,而在CNS中,通过使用简单的光遗传学设置与修饰作为行为读出12相结合,可以可视化被切断轴子及其突触的功能保存。
研究方案
1. 在PNS的斧子死亡期间对斧子形态的观察
- 翼伤:斧子束的部分损伤
- 使用5个处女母和5个雄性从右基因型(图4A,P0代)在室温(RT)执行交叉。每 3-4 天将 P0放入新小瓶。每天收集新鲜封闭的成年后代(F1代),并年龄为 7-14 天。
- 麻醉苍蝇在CO2垫上。使用微型剪刀切割前翼静脉大致在机翼中间(图1A)。使用一个翼为受伤,另一翼作为年龄匹配的未受伤的控制。施加每个机翼一个损伤,并确保有足够的机翼受伤(约15个机翼)。
注:整个机翼可以切开,但只切割前翼静脉就足够了。这是机翼最强壮的部分。 - 用含食物的小瓶回收苍蝇。
- 翼解剖和斧子的可视化
- 沿整个玻璃滑轨用移液器将10μL的卤化碳油27(图1B)。
- 切断受伤者以及未受伤的控制翼在所需的时间点(例如,受伤后1或7天)。用微剪刀剪,用钳子抓住翅膀。将最大4个机翼放入卤化油27(图1B),用盖板覆盖它们。
- 使用旋转盘显微镜立即对机翼进行成像。沿 z 轴获取一系列具有 0.33 μm 步长大小的光学截面,并将 z 堆栈压缩到单个文件中,以便进行后续分析。
注:不要抓住细胞体和斧子所在的前翼静脉。抓住中间的机翼。翅膀中的组织不固定;保持时间从安装翅膀到成像这些在8分钟以下。
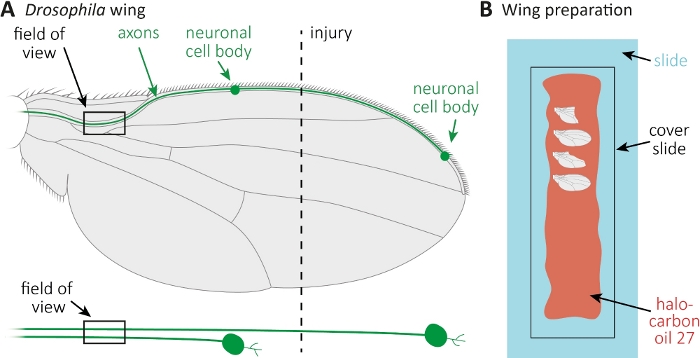
图1:观察机翼斧子死亡时的斧子形态。(A) 架构飞翼有两个稀疏的GFP标记的感官神经元,下面也分别表示。指示受伤地点和观察场。(B) 机翼成像的原理图设置。受伤和未受伤的控制翼(灰色)安装在卤化油27(红色)玻璃滑轨(浅蓝色)上,并盖上盖板(黑色)。请点击此处查看此图形的较大版本。
2. 在中枢神经系统的斧子死亡期间对Axon和突触形态的观察
- 天线消融:整个斧子束的伤害
- 使用5个处女母和5个雄性从右基因型(图5A,P0代)执行交叉在RT.通过P0到新的小瓶每3⁄4天。每天收集新鲜封闭的成年后代(F1代),让他们年龄长达7天至14天。
- 麻醉苍蝇在CO2垫上。使用钳子将右侧第3 天线段消融为单边消融;或左右3天线段为双边消融(图2A-C)。这将删除GFP标记的神经元细胞体,而它们的六核投影留在中枢神经系统。
注: 天线消融切断整个斧子束。如果执行单边消融,则对侧(未加减天线)上的斧头束用作内部控制。确保执行足够的天线消融(大约 15 只动物)。 - 用含食物的小瓶回收苍蝇。
- 斧子的脑解剖和可视化
- 将硅弹性体底座(9 mL)和固化剂(1 mL)混合,体积比为10:1。将每 5 mL 混合物转移到 35 mm 的组织培养板中,并在一夜之间与烟雾罩中温和搅拌混合,减少引入的空气。混合物在 24 小时内凝固。
注:解剖板必须只准备一次,并且可以多次使用。 - 在 CO2垫上麻醉苍蝇,并在所需时间点(例如,天线消融后 1 或 7 天)使用两个钳子将苍蝇斩首。使用一个钳子抓住脖子,另一个钳子来修复胸部。轻轻拉起颈部,从胸腔上取下头。
注: 将斩首头留在 CO2垫上,直到达到所需的数量,但请确保在 30 分钟内继续执行下一步。 - 将所有头转移到含有1 mL固定溶液的1.5 mL微离心管中,该溶液含有4%的甲醛(PFA)和0.1%的Triton X-100磷酸盐缓冲盐水(PBS),使用浸入固定溶液中的钳子。
注:飞头粘在湿钳子上。它使将所有头迅速转移到微离心管是可行的。 - 在RT时用温和的搅拌将头部固定20分钟。将微离心管放在冰上,头会被吸引到微离心管的底部。用移液器去除上清液,用5个2分钟洗涤,在PBS中含有0.1%Triton X-100的洗涤缓冲液,在RT时轻轻搅拌,去除残留固定溶液。
注:关于如何解剖成人果蝇大脑的视频是随时可用的27。 - 用玻璃移液器将头部转移到充满洗涤缓冲液的解剖板中。使用一个钳子抓住并拉下头,同时用另一个钳子握住头部。这将留下一个洞,如果前骨骼连接到外骨骼。
- 使用两个钳子去除孔和每个复合眼之间的外骨骼。这将使打开头部结构与两个钳子,并轻轻地刮出大脑里面是可行的。
- 清除每个大脑,去除卡在大脑的气管或脂肪(图2D,顶部)。一旦大脑被清洗,把它放在一个新的微离心管,含有1mL的洗涤缓冲在冰上。
注:受损或丢失的视波不会影响大脑中心的嗅觉叶(图2D,顶部)。 - 一旦所有大脑被收集并积聚在微离心管底部,用1 mL固定溶液代替洗涤缓冲液。在 RT 处摇动,固定大脑 10 分钟,然后用 RT 摇动在 1 mL 的洗涤缓冲液中洗涤 5 次 2 分钟。
- 在洗涤缓冲液中应用原抗体(1:500),在4°C时摇动,然后用RT的1 mL洗涤缓冲液在2小时以上洗涤10次。
- 在洗涤缓冲液2h中应用二次抗体(1:500),在RT处摇动,将微离心管包裹在铝箔中,以阻挡光线。在其余过程中,将微离心管与铝箔覆盖。在 RT 处摇动时,将 1 mL 洗涤缓冲液涂在 2 小时以上, 涂抹 10 次洗涤。
- 取出上清液,使用一滴抗褪色试剂覆盖微离心管中的大脑。在4°C下孵育大脑至少30分钟,然后准备安装和成像。
- 准备封面幻灯片,在胶带上贴上实验室胶带,并从磁带上剪出类似"T"的形状(图2D,底部)。由此产生的空间作为包含大脑的反褪色试剂28将被移入的区域,最好进入两个腔室。
注:使用 20-200 μL 移液器尖端,其中 3 mm 的尖端被切断,以扩大移液器的开口。这将使移液含脑的抗褪色试剂变得可行。用盖板小心地盖住大脑。 - 使用粘土准备两个小均匀卷。确保粘土卷不高于玻璃滑板的高度。将粘土卷贴在玻璃滑道上(图2D,底部)。将含脑盖滑三明治放在粘土卷上。
注:GFP标记的斧子及其突触位于大脑前部。因此,从正面拍摄它们更容易。然而,大脑要么朝上,要么朝下面对封面幻灯片三明治。粘土卷作为三明治支架,在成像过程中,三明治可以倒置。这将使从每个大脑获取正面图像变得可行。 - 使用共聚焦显微镜沿 z 轴获取一系列具有 1.0 μm 步长大小的光学截面,并将 z 堆栈压缩到单个文件中,以便进行后续分析,以评估保持完整无缺的轴投影数量。
- 将硅弹性体底座(9 mL)和固化剂(1 mL)混合,体积比为10:1。将每 5 mL 混合物转移到 35 mm 的组织培养板中,并在一夜之间与烟雾罩中温和搅拌混合,减少引入的空气。混合物在 24 小时内凝固。
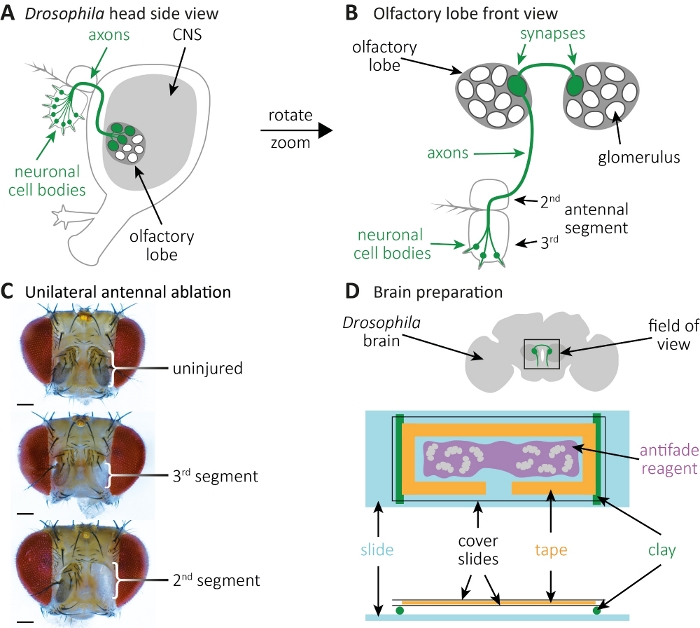
图2:观察大脑斧子死亡期间的斧子和突触形态。(A) 带有 GFP 标记的细胞体、斧子和突触的原理图飞头的侧视图。(B) 高放大前视图 GPF 标记的嗅觉受体神经元及其斧子和突触。细胞体被安置在第3天线段,他们的斧子项目进入CNS。Axons 在左嗅觉叶的球状体中形成突触,穿过中线,在反向嗅觉叶的球状体中形成突触。(C) 具有单侧天线消融的飞头示例。顶部:未受伤的控制。中间:第3 天线段的消融。底部:第 2个(因此也是第 3个)天线段的消融。(D) 大脑准备.顶部:原理图解剖苍蝇大脑与指示的嗅觉叶和在视野中的斧头投影。底部:用于大脑成像的原理图设置。两个粘土卷(绿色)被安装在玻璃幻灯片上(浅蓝色),它们携带一个盖板滑三明治,其中包含飞脑(灰色)。大脑安装在防褪色试剂(紫色)中,周围是实验室胶带(橙色),由两张盖板(黑色)覆盖。请点击此处查看此图形的较大版本。
3. 光遗传学诱导的梳理作为Axon和突触功能的读出
- 光遗传学设置
- 在黑暗的房间里进行光遗传学实验。确保设置包括 850 nm 红外 (IR) LED 聚光灯,用于照亮黑暗中的苍蝇(图 3A)、闪烁的 660 nm 红色 LED 聚光灯以激活表达 CsChrimson 的神经元,以及一个带 700 nm 长通滤波器的单色摄像机,可防止记录红灯闪烁。
- 使用 3D 打印机生成直径为 1 厘米的微小圆形行为室,用盖板覆盖,并将 860 nm 发射器耦合到造型室旁边的红色 LED 聚光灯(图 3B)。
注: 发射器指示红色 LED 聚光灯何时打开,从而激活神经元。 - 将 LED 聚光灯和摄像机安装在造型室顶部(图3A,C)。
- 在 10 秒内,以 10 Hz 闪烁激活神经元。激活持续时间可根据实验设计进行调整。
- 为光遗传学准备苍蝇
- 融化在微波炉中飞食。食物冷却后,凝固前,将乙醇中所有转反核蛋白(EtOH)的1:100加入到最终浓度为200μM。
注意:避免在热食物中添加所有反视网膜,这可能导致光遗传学效率降低。 - 盖小瓶,里面装着凝固食品,有塞子或棉球。用铝箔包裹小瓶。然后,将含食物的小瓶存放在黑暗、寒冷的房间里。
- 使用5个处女母和5个雄性(图6A,P0代)从右基因型执行交叉在RT.通过P0到新的小瓶每3⁄4天。每天在基地收集新鲜封闭的成年后代(F1代),让他们在含有200μM所有飞食的铝覆盖小瓶中老化7至14天。
- 收集苍蝇,从含食物的小瓶中敲击苍蝇,放入没有食物的空小瓶中。将小瓶冷却在含冰水中约30s。苍蝇会睡着。将单个苍蝇迅速放入覆盖在盖板的小腔室中(图 3B)。
注:苍蝇一热身,它们就会醒来。将单个苍蝇迅速传播到单个腔室至关重要。避免CO2垫麻醉苍蝇,这将影响他们的行为。 - 执行光遗传学,以引起天线梳理。在这里,协议包括以下间隔:30秒,其中红灯不存在,然后是10秒的红灯照射在10赫兹。重复这个程序共三次,然后额外的30秒间隔,其中红灯缺席12,29,30。12,29,30
注:此协议可根据实验首选项进行调整。 - 在 CO2垫上从每个腔室收集单个苍蝇。使他们受到天线伤害。放弃左侧和右侧 2个天线段(图 2Figure 2C)。这将去除约翰斯顿的器官(JO)神经元的细胞体,而斧子投影留在中枢神经系统。在铝覆盖小瓶中回收苍蝇,这些小瓶含有200μM,全部为反视网膜。
注:对于由光遗传学诱导的天线修饰,感觉神经元细胞体位于第2天线段(图2CC)。 - 在相应的时间点(例如,天线消融后7天),受试者飞到另一个梳妆测定(回到步骤3.2.4)。
- 融化在微波炉中飞食。食物冷却后,凝固前,将乙醇中所有转反核蛋白(EtOH)的1:100加入到最终浓度为200μM。
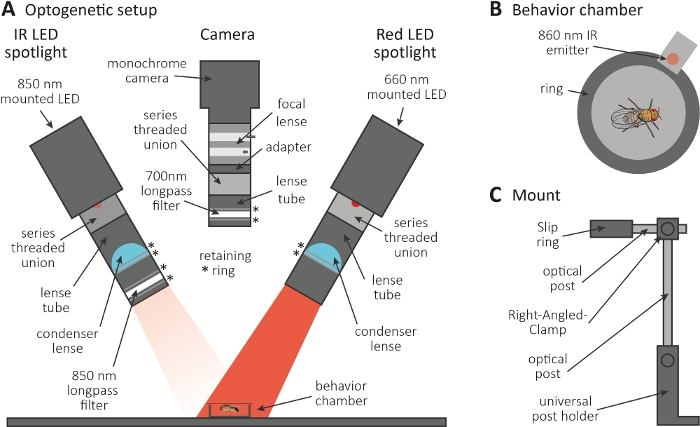
图 3:光遗传学设置,以诱导梳理作为斧子和突触函数的读出。(A) 光遗传学所需组装成分的插图。红外 (IR) LED 聚光灯、摄像机和红色 LED 聚光灯(分别从左到右)。包括详细说明在内的组件列在材料表中。(B) 行为室(包括红外发射器)的顶视图插图,指示红色 LED 聚光灯激活。(C) 单个安装设置的插图。两个 LED 聚光灯和摄像机总共需要三个安装设置。请点击此处查看此图形的较大版本。
结果
上面,我们描述了三种方法来研究断的斧子及其突触的形态和功能。第一种方法允许对PNS中的单个斧子进行高分辨率观察。它需要由MARCM技术14,31,31生成的克隆。在这里,我们执行十字生成野生类型和高线突变MARCM克隆(图4A)。机翼中间的简单切口会导致位于远端的神经元的斧子损伤(例如,在机翼的外侧),而近端神经元(例如,在切口部位和胸部之间)仍然未受伤。这种方法使得在同一神经束中并排观察未受伤的控制斧头的斧头死亡是可行的(图1A,图4B)。在这里,我们使用遗传背景导致GFP标记的克隆数量少(例如,每个实验14中的两个)。我们举了野生型斧子受伤后1天和7天的例子,分别提供了控制斧子、接受斧子死亡的斧子和周围胶体清除的斧子碎片的例子。此外,我们在高线突变体中反复出现连带损伤,在受伤后7天分析了结果。
未受伤的控制翼窝有两个野生型克隆,因此两个GFP标记的野生型斧子(图4B,野生类型,未受伤的控制)。使用微剪刀切割机翼中间的一天后,在GFP标记的斧子中诱导斧子死亡,细胞体与切割部位远向,而近在座细胞体的斧子则在同一神经束内作为内部控制(图4B,野生类型,受伤后1天)。请注意箭头指示的上部部的斧屑痕迹。在斧伤7天后,GFP标记的斧屑被周围的胶体清除,而标有未受伤的控制斧子的GFP留在神经束中(图4B,野生类型,7天后受伤,箭头)。相比之下,被切断7天的高线突变斧子在形态上保持保存,与先前发现11、14(,14图4B,高线,7天受伤后,箭头)一致。这些结果显示了果蝇翅膀强大的视觉分辨率。同一神经束中可并排观察到未受伤的控制,可观察到Axon死亡。虽然野生型斧子在受伤后1天内死亡,结果的碎片在7天内被清除,但斧子死亡缺陷高线突变体在形态上保留7天。

图4:研究机翼中GFP标记的感官神经元斧子的斧子死亡的方法。(A) 原理图交叉生成翼翼中的野生类型和高线克隆(分别为 P0和 F1代)。处女在左边,男性在右边。有关基因型的详细信息,请参阅材料表。(B) 控制和受伤的 GFP 标记的斧子的示例。视图字段在 (图 1A) 中指示。从左到右:未受伤的野生型控制斧子,野生型斧子1天后伤,野生型斧子7天后受伤,高线突变斧子7天后分别受伤。箭头表示断断的斧子,刻度条 = 5 μm。请点击这里查看此图形的较大版本。
第二种方法描述了如何可视化向CNS投影到的整个斧子束,它们形成突触,这些突触属于位于左右天线中的神经元(图2A-C)。在这里,我们执行十字生成野生类型和高线突变MARCM克隆(图5A)。未受伤,GFP标记的斧子及其突触可以在几天到几周的过程中可视化,在没有损伤的情况下(图5B,野生类型,未受伤的控制)。或者,动物可以遭受第3天线段消融,并被切断GFP标记的斧子及其突触可以在几小时到数天的时间过程中观察到。我们专注于天线消融后的7天,因为此时,斧子及其突触已经经历了斧子死亡,由此产生的碎片被周围的胶质清除。如果对右天线进行单方面消融,则右斧束被切断,将拆卸,并在受伤后7天完全清除产生的碎屑(图5B,野生类型,单边消融,7天受伤后,箭头),与先前的调查结果13一致。或者,左右天线都可以消融,这将切断斧子束,受伤后7天,斧子及其突触消失(图5B,野生类型,双边消融,7天后受伤,箭头)。相反,高线突变体右天线的单方面消融导致断甲苯在受伤后保留7天,与先前的发现11、14(,14图5B、高线、单边消融、7天伤后、箭头)一致。这些结果表明,被切断的野生型斧子会经历斧子死亡,结果的碎片在7天内被清除,而斧子死亡缺陷高线突变体没有经历斧子死亡,在形态上保存7天。
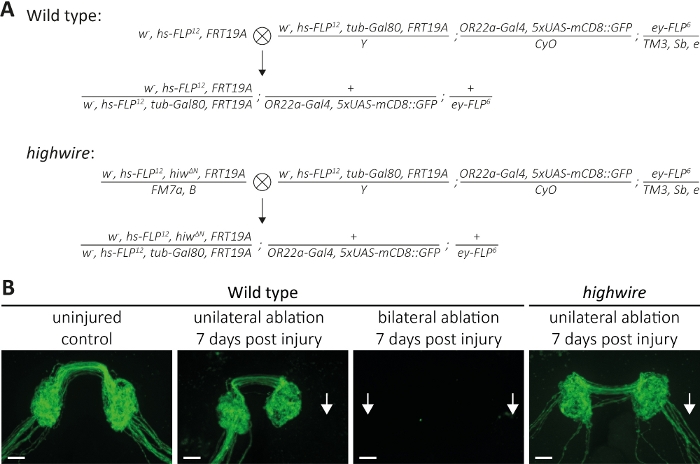
图5:研究大脑中GFP标记的感官神经元斧子的斧子死亡的方法。(A) 原理图交叉生成大脑中的野生类型和高线克隆(分别为 P0和 F1代)。处女在左边,男性在右边。有关基因型的详细信息,请参阅材料表。(B) 控制和受伤的 GFP 标记的斧子的示例。从左到右:未受伤的野生类型控制,野生类型7天后单边天线消融,野生类型7天后双边天线消融,和高线突变体7天后单方面天线消融,分别。箭头表示断的斧子束,比例条 = 10 μm。请点击这里查看此图形的较大版本。
第三种方法允许在CNS中观察被切断的斧子及其突触的功能保存。它依赖于位于第2天线段的JO神经元子集的操纵,这足以诱导天线梳理。在JO神经元中表达红移通道多普辛(CsChrimson),加上所有跨视网膜的膳食补充,足以在红灯照射12、30,30时引起简单的突触后修饰行为。在这里,我们执行十字架来生成野生类型JO神经元,JO神经元过度表达dnmnat (dnmnatOE)(图6A)。野生型苍蝇或含有JO神经元的苍蝇与衰减的斧子死亡(dnmnatOE),都怀有一种有效的美容行为,在受伤前。然而,7天后受伤(例如,第2天线段的双边消融),由于损伤引起的斧头和突触退化,野生型苍蝇的光遗传学无法引起梳理,而具有衰减的斧头死亡的动物继续梳理(图6B,电影1,2)。因此,衰减的斧子死亡能够功能性地保存被切断的斧子及其突触7天。

图 6:在轴管切除术后可视化轴突和突触功能的方法。(A) 原理图交叉生成野生类型和dnmnat过度表达 JO 感觉神经元(分别为 P0和 F1代)。处女在左边,男性在右边。有关基因型的详细信息,请参阅材料表。(B) 光遗传学引起的梳妆行为个体等报。顶部:野生苍蝇的个别类象形图在受伤前和7天后(蓝色)。底部:在JO神经元中,在JO神经元中dnmnat,在JO神经元(红色)中,苍蝇的个别非表达量图(dnmnatOE)。每个条柱指示 1 秒内至少有 1 个修饰行为。黑线表示所有条柱的总和。(C) 梳理行为的量化。数据显示为平均值 = 标准差,p > 0.001(单向 ANOVA,与 Tukey 的后临时测试进行多重比较)。请点击此处查看此图形的较大版本。
电影1:具有代表性的野生类型梳理行为,由光遗传学在天线消融后7天引起。请点击这里下载此视频。
电影2:在JO神经元中,在JO神经元中过度表达的苍蝇的光遗传学引起的代表性修饰行为,在天线消融后7天。请点击这里下载此视频。
讨论
这里描述的协议允许对形态的可靠和可重复的观察,以及斧子及其突触的功能,从德罗索菲拉的细胞体分离出来。机翼测定有助于在PNS14中并排观察未受伤的控制斧头的斧头死亡,而天线测定有助于观察GFP标记的斧子及其突触的整个神经束,以评估大脑(CNS)12的形态和功能。12在设计实验时,研究形态学的每种方法都有关键步骤和某些优势。
为了观察机翼PNS中的斧子形态,由于机翼的透明度,实验可以很容易地进行:它允许绕过解剖和免疫组织化学。然而,由于缺乏固定,机翼必须立即图像后,安装14。目前,两个不同的Gal4驱动程序经常使用,要么ok371Gal4或dpr1Gal4,并且两个参考提供了量化退化14,26,26的不同方法。推荐使用"具有可抑制细胞标记(MARCM)的马赛克分析"14,31,,31作为六角形态的分辨率是前所未有的,建议对几个神经元进行稀疏标记。相反,在翅膀上不可能观察到突触,它们位于苍蝇胸部内的腹神经线。此外,免疫组织化学无法想象额外的六核标记:蜡状角质使固定剂和抗体无法扩散到底层组织。
为了观察中枢神经系统中的斧子和突触形态,必须进行大脑解剖。它们提供了使用免疫作用化学来可视化额外的六核和突触标记的优点,在相同的视场10、13,13中,突触可以和斧头一起观察到。大量特征嗅觉受体神经元(ORN)Gal4驱动器是现成的32,而且经常,OR22aGal4是首选的驱动因素。对于天线消融,OR22a神经元的细胞体位于第3段(图2B)。荧光强度的定量用于量化斧子或突触13的退化。相反,由于脑解剖和抗体染色,实验非常耗时。
为了在轴突手术后可视化轴突和突触功能,光遗传学用于触发天线梳理:它用作分断轴子及其突触12的功能保存的读出。梳理电路和相应的感官,间和运动神经加尔4驱动器已被彻底描述29,30。29,GMR60E02Gal4标记约翰斯顿的器官 (JO) 感觉神经元的子集,这些神经元是培养29、30,30的所必需的和足够的。对于天线消融,JO神经元的细胞体位于第2天线段(图2B)。光遗传学设置可以很容易地从头开始构建,或者调整现有设置。重要的是,实验必须在黑暗的房间里进行,从而用红外 (IR) LED 聚光灯进行可视化飞行。当使用CsChrimson作为一个通道,这是至关重要的是提供食物的所有跨视网膜和红色LED聚光灯,以激活JO神经元29。或者,蓝色光敏通道和蓝色LED聚光灯,或TrpA1通道和温度可用于神经元激活29,33。29,梳理行为的量化已经描述12,29。12,
当这些测定用于专门研究斧子死亡时,重要的是要注意,形态学或功能保存的表型应该随着时间的推移而健壮。在有些情况下,斧子死亡导致形态保存34、35,35中一致但不太明显的表型,而且这种表型是否转化为功能保存仍有待确定。
在果蝇幼虫发育过程中,在神经元中也观察到了Axon死亡表型,其中神经被压碎,而不是受伤11,23。,23在这里,我们特别关注完成发育的成人果蝇神经元。在这种情况下,RNA干扰36,或组织特异性CRISPR/Cas937的使用可以很容易地实现。重要的是,上述技术可用于一个斧子死亡独立语境:它们促进神经元维持因子38的表征,斧路迁移39,年龄依赖的斧子线粒体变化40,和体量线粒体41的形态。
披露声明
提交人声明,他们没有什么可透露的。
致谢
我们要感谢整个Neukomm实验室的贡献。这项工作得到了瑞士国家科学基金会(SNSF)助理教授奖(176855年)、国际截瘫研究基金会(IRP、P180赠款)、SNSF Spark(190919年赠款)以及洛桑大学和洛桑大学和基础神经科学系(沃州)到LJN。
材料
| Name | Company | Catalog Number | Comments |
| Tweezers (high precision, ultra fine) | EMS | 78520-5 | Antennal ablation |
| MicroPoint Scissors (5-mm cutting edge) | EMS | 72933-04 | Wing injury |
| 1.5 mL microcentrifuge tube | Eppendorf | 30120086.0000 | |
| 35mm tissue culture dish | Sarstedt | 83.3900 | |
| Cover Slips, Thickness 1 | Thermo Scientific™ | BB02400600A113MNT0 | |
| Superfrost Microscope Slides | Thermo Scientific™ | AA00008032E00MNT10 | |
| High-Sensitivity USB 2.0 CMOS Camera, 1280 x 1024, Global Shutter | Thorlabs | DCC1240M | Camera setup |
| SM1 Retaining Ring for Ø1" Lens Tubes and Mounts | Thorlabs | SM1RR | |
| 25mm 1/1.2" C mount Lens | Tamron | M112FM25 | |
| Adapter with External M27 x 0.5 Threads and Internal SM1 Threads | Thorlabs | SM1A36 | |
| Aspheric Condenser Lens, Ø25 mm, f=20.1 mm, NA=0.60, ARC: 650-1050 nm | Thorlabs | ACL2520U-B | |
| Ø25.0 mm Premium Longpass Filter, Cut-On Wavelength: 700 nm | Thorlabs | FELH0700 | |
| SM1 (1.035"-40) Coupler, External Threads, 0.5" Long | Thorlabs | SM1T2 | |
| SM1 Lens Tube Without External Threads, 1" Long, Two Retaining Rings Included | Thorlabs | SM1M10 | |
| 850 nm, 900 mW (Min) Mounted LED, 1200 mA | Thorlabs | M850L3 | IR LED spotlight |
| SM1 (1.035"-40) Coupler, External Threads, 0.5" Long | Thorlabs | SM1T2 | |
| SM1 Lens Tube Without External Threads, 2" Long, Two Retaining Rings Included | Thorlabs | SM1M20 | |
| Aspheric Condenser Lens, Ø25 mm, f=20.1 mm, NA=0.60, ARC: 650-1050 nm | Thorlabs | ACL2520U-B | |
| Ø25.0 mm Premium Longpass Filter, Cut-On Wavelength: 850 nm | Thorlabs | FELH0850 | |
| SM1 Retaining Ring for Ø1" Lens Tubes and Mounts | Thorlabs | SM1RR | |
| 660 nm, 940 mW (Min) Mounted LED, 1200 mA | Thorlabs | M660L4 | Red LED spotlight |
| Aspheric Condenser Lens, Ø25 mm, f=20.1 mm, NA=0.60, ARC: 650-1050 nm | Thorlabs | ACL2520U-B | |
| SM1 (1.035"-40) Coupler, External Threads, 0.5" Long | Thorlabs | SM1T2 | |
| SM1 Lens Tube Without External Threads, 2" Long, Two Retaining Rings Included | Thorlabs | SM1M20 | |
| 15 V, 2.4 A Power Supply Unit with 3.5 mm Jack Connector for One K- or T-Cube | Thorlabs | KPS101 | LED control |
| T-Cube LED Driver, 1200 mA Max Drive Current | Thorlabs | LEDD1B | |
| 150 mm x 300 mm x 12.7 mm Aluminum Breadboard, M6 Double-Density Taps | Thorlabs | MB1530/M | Mount base |
| Ø12.7 mm Universal Post Holder, Spring-Loaded Locking Thumbscrew, L = 75 mm | Thorlabs | UPH75/M | Mount, 3x (IR LED, red LED, cam) |
| Ø1.20" Slip Ring for SM1 Lens Tubes and C-Mount Extension Tubes, M4 Tap | Thorlabs | SM1RC/M | |
| Ø12.7 mm Optical Post, SS, M4 Setscrew, M6 Tap, L = 150 mm | Thorlabs | TR150/M | |
| Ø12.7 mm Optical Post, SS, M4 Setscrew, M6 Tap, L = 40 mm | Thorlabs | TR40/M | |
| Right-Angle Clamp for Ø1/2" Posts, 5 mm Hex | Thorlabs | RA90/M | |
| M6 x 1.0 Stainless Steel Cap Screw, 16 mm Long, Pack of 25 | Thorlabs | SH6MS16 | screws for mount onto base |
| USB-6001 14-Bit 20 kS/s Multifunction I/O and NI-DAQmx | National Instruments | 782604-01 | Red LED spotlight controller |
| 20k Ohm 1 Gang Linear Panel Mount Potentiometer | TT Electronics/BI | P230-2EC22BR20K | fintuner for indicator |
| IR (860nm) emitter, 100 mA radial | Osram | 475-1365-ND | Red light indicator |
| cable | - | - | Misc |
| All-trans retinal | Sigma | R2625 | |
| Ethanol absolute | Vwr | 20821.296 | |
| Halocarbon Oil 27 | Sigma | H8773 | |
| Mowiol | Merk | 81381 | |
| Paraformaldehyde | Sigma | F8775 | |
| Phosphate buffered saline (PBS) | Sigma | P5493 | |
| Sylgard 184 silicone elastomer base | Dow Corning Corp | 4019862 | |
| Sylgard 184 silicone elastomer curing agent | Dow Corning Corp | 4019862 | |
| Triton X-100 | Sigma | T8787 | |
| Chicken anti-GFP antibodies | Rockland | 600-901-215 | Antibodies |
| Goat Dylight anti-Chicken | Abcam | ab96947 | |
| FM7a, B | BDSC | RRID:BDSC_785 | X chromosome |
| FRT19A[hs-neo] | BDSC | RRID:BDSC_1709 | |
| hiw[ΔN] | BDSC | RRID:BDSC_51637 | |
| hs-FLP[12] | BDSC | RRID:BDSC_1929 | |
| tub-Gal80[LL1] | BDSC | RRID:BDSC_5132 | |
| w[1118] | BDSC | RRID:BDSC_3605 | |
| 20xUAS-IVS-CsChrimson::mVenus | BDSC | RRID:BDSC_55135 | 2nd chromosome |
| 5xUAS-Gal4[12B] | Kyoto | RRID:Kyoto_108492 | |
| 5xUAS-HA::dnmnat | BDSC | RRID:BDSC_39702 | |
| 5xUAS-mCD8::GFP[LL5] | BDSC | RRID:BDSC_5134 | |
| ase-FLP[2d] | Freeman laboratory | Neukomm et al., 2014 (PNAS) | |
| CyO | BDSC | RRID:BDSC_2555 | |
| dpr1-Gal4 | BDSC | RRID:BDSC_25083 | |
| OR22a-Gal4 | BDSC | RRID:BDSC_9952 | |
| ey-FLP[6] | BDSC | RRID:BDSC_5577 | 3rd chromosome |
| GMR60E02-Gal4 | BDSC | RRID:BDSC_39250 | |
| TM3,Sb,e | BDSC | RRID:BDSC_3644 |
参考文献
- Matsuda, W., et al. Single Nigrostriatal Dopaminergic Neurons Form Widely Spread and Highly Dense Axonal Arborizations in the Neostriatum. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 29 (2), 444-453 (2009).
- Wedel, M. J. A Monument of Inefficiency: The Presumed Course of the Recurrent Laryngeal Nerve in Sauropod Dinosaurs. Acta Palaeontologica Polonica. 57 (2), 251-256 (2012).
- Mariano, V., Domínguez-Iturza, N., Neukomm, L. J., Bagni, C. Maintenance mechanisms of circuit-integrated axons. Current Opinion in Neurobiology. 53, 162-173 (2018).
- Conforti, L., Gilley, J., Coleman, M. P. Wallerian degeneration: an emerging axon death pathway linking injury and disease. Nature reviews Neuroscience. 15 (6), 394-409 (2014).
- Neukomm, L. J., Freeman, M. R. Diverse cellular and molecular modes of axon degeneration. Trends in Cell Biology. 24 (9), 515-523 (2014).
- Gustavsson, A., et al. Cost of disorders of the brain in Europe 2010. European Neuropsychopharmacology: The Journal of the European College of Neuropsychopharmacology. 21 (10), 718-779 (2011).
- Waller, A. Experiments on the Section of the Glossopharyngeal and Hypoglossal Nerves of the Frog, and Observations of the Alterations Produced Thereby in the Structure of Their Primitive Fibres. Philosophical Transactions of the Royal Society of London. 140, 423-429 (1850).
- Rosell, A. L., Neukomm, L. J. Axon death signalling in Wallerian degeneration among species and in disease. Open Biology. 9 (8), 190118(2019).
- Mack, T. G., et al. Wallerian degeneration of injured axons and synapses is delayed by a Ube4b/Nmnat chimeric gene. Nature Neuroscience. 4 (12), 1199-1206 (2001).
- Osterloh, J. M., et al. dSarm/Sarm1 is required for activation of an injury-induced axon death pathway. Science. 337 (6093), New York, NY. 481-484 (2012).
- Xiong, X., et al. The highwire ubiquitin ligase promotes axonal degeneration by tuning levels of nmnat protein. PLoS Biology. 10 (12), 1001440(2012).
- Neukomm, L. J., et al. Axon Death Pathways Converge on Axundead to Promote Functional and Structural Axon Disassembly. Neuron. 95 (1), 78-91 (2017).
- MacDonald, J. M., et al. The Drosophila cell corpse engulfment receptor Draper mediates glial clearance of severed axons. Neuron. 50 (6), 869-881 (2006).
- Neukomm, L. J., Burdett, T. C., Gonzalez, M. A., Zuchner, S., Freeman, M. R. Rapid in vivo forward genetic approach for identifying axon death genes in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 111 (27), 9965-9970 (2014).
- Lu, T. Y., et al. Axon degeneration induces glial responses through Draper-TRAF4-JNK signalling. Nature Communications. 8, 14355(2017).
- Lunn, E. R., Perry, V. H., Brown, M. C., Rosen, H., Gordon, S. Absence of Wallerian Degeneration does not Hinder Regeneration in Peripheral Nerve. The European Journal of Neuroscience. 1 (1), 27-33 (1989).
- Adalbert, R., et al. A rat model of slow Wallerian degeneration (Wld(S)) with improved preservation of neuromuscular synapses. The European Journal of Neuroscience. 21 (1), 271-277 (2005).
- Martin, S. M., O'Brien, G. S., Portera-Cailliau, C., Sagasti, A. Wallerian degeneration of zebrafish trigeminal axons in the skin is required for regeneration and developmental pruning. Development. 137 (23), Cambridge, England. 3985-3994 (2010).
- Feng, Y., et al. Overexpression of Wld(S) or Nmnat2 in Mauthner Cells by Single-Cell Electroporation Delays Axon Degeneration in Live Zebrafish. Journal of Neuroscience Research. 88 (15), 3319-3327 (2010).
- Gilley, J., Coleman, M. P. Endogenous Nmnat2 is an essential survival factor for maintenance of healthy axons. PLoS Biology. 8 (1), 1000300(2010).
- Babetto, E., Beirowski, B., Russler, E. V., Milbrandt, J., DiAntonio, A. The Phr1 ubiquitin ligase promotes injury-induced axon self-destruction. Cell Reports. 3 (5), 1422-1429 (2013).
- Gerdts, J., Summers, D. W., Sasaki, Y., DiAntonio, A., Milbrandt, J. Sarm1-mediated axon degeneration requires both SAM and TIR interactions. The Journal of Neuroscience. 33 (33), 13569-13580 (2013).
- Gerdts, J., Brace, E. J., Sasaki, Y., DiAntonio, A., Milbrandt, J. SARM1 activation triggers axon degeneration locally via NAD+ destruction. Science. 348 (6233), New York, NY. 453-457 (2015).
- Bridge, P. M., et al. Nerve crush injuries--a model for axonotmesis. Experimental Neurology. 127 (2), 284-290 (1994).
- Maxwell, W. L., Bartlett, E., Morgan, H. Wallerian Degeneration in the Optic Nerve Stretch-Injury Model of Traumatic Brain Injury: A Stereological Analysis. Journal of Neurotrauma. 32 (11), 780-790 (2015).
- Fang, Y., Soares, L., Teng, X., Geary, M., Bonini, N. M. A novel Drosophila model of nerve injury reveals an essential role of Nmnat in maintaining axonal integrity. Current Biology. 22 (7), 590-595 (2012).
- Janelia Farm Adult Drosophila Brain Dissection. , Available from: https://www.janelia.org/project-team/flylight/protocols (2015).
- Cold Spring Harbor. Mowiol mounting medium. Cold Spring Harbor Protocols. 2006 (1), (2006).
- Seeds, A. M., et al. A suppression hierarchy among competing motor programs drives sequential grooming in Drosophila. eLife. 3, 02951(2014).
- Hampel, S., Franconville, R., Simpson, J. H., Seeds, A. M. A neural command circuit for grooming movement control. eLife. 4, 08758(2015).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker for studies of gene function in neuronal morphogenesis. Neuron. 22 (3), 451-461 (1999).
- Vosshall, L. B., Wong, A. M., Axel, R. An olfactory sensory map in the fly brain. Cell. 102 (2), 147-159 (2000).
- Hampel, S., McKellar, C. E., Simpson, J. H., Seeds, A. M. Simultaneous activation of parallel sensory pathways promotes a grooming sequence in Drosophila. eLife. 6, (2017).
- Farley, J. E., et al. Transcription factor Pebbled/RREB1 regulates injury-induced axon degeneration. Proceedings of the National Academy of Sciences of the United States of America. 23 (6), (2018).
- Wang, H., et al. Rapid depletion of ESCRT protein Vps4 underlies injury-induced autophagic impediment and Wallerian degeneration. Science Advances. 5 (2), 4971(2019).
- Dietzl, G., et al. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 448 (7150), 151-156 (2007).
- Port, F., et al. A large-scale resource for tissue-specific CRISPR mutagenesis in Drosophila. bioRxiv. 102, 636076(2019).
- Vagnoni, A., Hoffmann, P. C., Bullock, S. L. Reducing Lissencephaly-1 levels augments mitochondrial transport and has a protective effect in adult Drosophila neurons. Journal of Cell Science. 129 (1), 178-190 (2016).
- Vagnoni, A., Bullock, S. L. A cAMP/PKA/Kinesin-1 Axis Promotes the Axonal Transport of Mitochondria in Aging Drosophila Neurons. Current Biology. 28 (8), 1265-1272 (2018).
- Cao, X., et al. In vivo imaging reveals mitophagy independence in the maintenance of axonal mitochondria during normal aging. Aging Cell. 16 (5), 1180-1190 (2017).
- Smith, G. A., et al. Glutathione S-Transferase Regulates Mitochondrial Populations in Axons through Increased Glutathione Oxidation. Neuron. 103 (1), 52-65 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。