需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
含脂脂的微流体生产-温度敏感脂质体
摘要
该协议提出了使用交错的刺骨微流体器装置制备热敏脂质体的优化参数。这还允许将多索鲁比辛和丁氨酸绿色共同封装到脂质体中,并产生光热触发的多索鲁比素释放,用于控制/触发药物释放。
摘要
所提出的协议支持高通量连续制备低温敏感脂质体(LTSLs),能够加载化疗药物,如多索鲁比辛(DOX)。为此,将乙醇脂质混合物和硫酸铵溶液注射到交错的刺骨微混剂(SHM)微流体装置中。SHM 可快速混合该解决方案,为脂质体自组装提供均匀的溶剂环境。收集的脂体首先退火,然后透析去除残留的乙醇。通过使用尺寸排除色谱,通过外部溶液的缓冲液交换,建立了硫酸铵 pH 梯度。然后,DOX 以高封装效率(> 80%)远程加载到脂体中。获得的脂质体大小均匀,Z平均直径为100nm。它们能够在轻度高热(42°C)的情况下,通过温度触发的封装DOX的突发释放。Indocyanine 绿色 (ICG) 也可以共同加载到脂质体中,用于近红外激光触发 DOX 释放。微流体方法可确保 LTSL 的高通量、可重复性和可扩展的制备。
引言
LTSL制剂是一种临床相关的脂质体产品,已开发用于提供化疗药物多索鲁比辛(DOX),并允许在临床上达到的轻度高热(T = 41°C)1高效突发药物释放。LTSL配方包括1,2-二甲酰-sn-甘油-3-磷胆碱(DPPC),脂质脂1-stearoyl-2-羟基-sn-甘油-3-磷脂酰胆碱(MSPC;M 代表"单体") 和 PEGylates 脂质 1,2-二聚氨酯-sn-甘油-3-磷乙醇胺-N-甲氧(聚乙烯乙二醇)-2000+ (DSPE-PEG2000)。达到相变温度(Tm = 41 °C)时,脂质脂和DSPE-PEG2000一起促进膜孔的形成,导致药物2的爆裂释放。LTSL的制备主要采用批量自上而下的方法,即脂质膜水化和挤出。重新制备具有相同特性和足够数量的大批量用于临床应用仍然具有挑战性3。
微流体学是一种新兴的制备脂体技术,提供可调纳米颗粒大小、可重现性和可扩展性3。一旦优化制造参数,吞吐量可以通过并行化进行扩展,其性能与台秤3、4、5中准备的属性相同。微流体与传统的散装技术相比,一个主要优势是能够处理小液体体积,在空间和时间上具有高可控性,通过小型化,允许更快的优化,同时以连续和自动化的方式运行6。使用微流体装置生产脂质体是通过自下而上的纳米沉淀方法实现的,这种方法更具有时间和能效,因为同质化过程(如挤出和声波)是不必要的。通常,脂质的有机溶液(如乙醇)与混合无溶剂(如水和亲水有效载荷)混合。当有机溶剂与非溶剂混合时,脂质的溶解度降低。脂质浓度最终达到临界浓度,在沉淀过程触发7。脂质的纳米沉淀物最终成种,并接近于脂质体。决定脂质体大小和均匀性的主要因素是非溶剂体与溶剂之间的比率(即水与有机流动率;FRR)和溶剂环境的均匀性,在脂质自组装成脂质体8。
因此,微流体中的高效流体混合对于制备同质脂质体至关重要,混合器的各种设计已应用于不同的应用9。交错的刺骨微混频器 (SHM) 代表新一代无源混合器之一,可实现高通量(在 mL/min 范围内),具有低稀释系数。这优于传统的微流体流体动力混合装置8,10。SHM已经图案的刺骨槽,它迅速混合流体通过混沌对流9,11。SHM 的短混合时间刻度(< 5 ms,小于 10–100 ms 的典型聚合时间刻度)允许脂质自组装发生在均匀的溶剂环境中,产生尺寸均匀分布为3、12的纳米颗粒。
然而,与传统的脂质体制剂相比,由于胆固醇8缺乏,LTSL的制备并不简单,没有胆固醇8,脂质二层就容易受到乙醇引起的三位一体13、14、15的相互作用的影响。到目前为止,残留乙醇在脂质体微流体生产过程中的影响还没有得到很好的理解。大多数报告的配方本质上对间念(含胆固醇或不饱和脂质)16具有抵抗力,这与LTSL不同,它们既饱和又不含胆固醇。
此处介绍的协议使用 SHM 为温度触发释放药物输送准备 LTSL。在所提出的方法中,我们通过动态光散射(DLS)确保微流体制备的LTLS是纳米尺寸(100nm)和均匀(分散<0.2)。此外,我们使用跨膜硫酸铵梯度法(也称为远程装载)17封装了 DOX,以验证 LTSL 脂质双层体的完整性。DOX 的远程加载需要脂质体保持 pH 梯度,以实现高封装效率 (EE),如果没有完整的脂质双层,这种情况不太可能发生。在这种方法中,与典型的微流体脂质体制备方案不同,在去除乙醇之前,需要退火步骤,以实现远程加载能力;即恢复脂质双层的完整性。
如前所述,在形成LTSL期间同时封装有效载荷的初始解决方案中,也可以引入亲水和疏水性有效载荷。作为概念验证,一种FDA批准的近红外荧光染料(也是一种有前途的光热剂)被引入到初始脂质混合物中,并成功共同加载到LTSLs中。808 nm 激光器用于照射 DOX/ICG 加载 LTSL,并在 5 分钟内成功诱导多氟辛克光热触发的 DOX 爆发释放。
所有仪器和材料均可上市,即使用即用,无需定制。由于配制LTSL的所有参数都进行了优化,按照此协议,对微流体没有事先了解的研究人员也可以准备LTSL,作为热敏药物输送系统的基础。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 设备设置
- 组装注射器泵和 SHM,如下所示。
- 使用泵到泵网络电缆(图1,黄色)将辅助注射器泵的"到计算机"端口连接到主注射器泵的"到网络"端口(泵01,用于乙醇脂质溶液)。
- 使用 PC 泵网络电缆将主泵的"到计算机"端口连接到计算机的"RS232 串行"端口(图1,蓝色)。
- 使用螺母和套圈将油管连接到 SHM 的每个入口和出口。使用另一个螺母和套圈以及工会组件将两个入口的管的端子转换为母 Luer。入口管的较长,更容易连接到注射器(图2)。
- 设置泵控制软件。
- 使用注射器泵的"设置"按钮,分别将主注射器泵和辅助注射器泵的地址分配给"Ad:01"和"Ad:02"。这只需要第一次完成。
- 打开计算机上的泵控制软件。应自动检测两个注射器泵,然后发出蜂鸣音。否则,单击"泵"并搜索泵以更新连接。(图3)
- 通过选择"HSW 规范-Ject 5 cc (Dia=12.45)"将直径分配给 12.45 (mm)。
- 为泵 01(乙醇脂质溶液)分配速率为 0.25 mL/min,为 02 泵(水溶液)分配速率为 0.75 mL/min。流速对应于总流速 (TFR) 1 mL/min 和水-乙醇流速比 (FRR) 3。
- 将音量分配给高于 5 mL 的任何值。
注:考虑到油管的空隙体积,目标输注体积设置大于加载的液体体积。 - 为两个泵选择INF(输注)模式。
- 按"设置"以确认设置。
2. 准备 LTSL
- 准备 LTSL10 或 LTSL10-ICG 脂质混合物(见表 1)。
- 使用两个 5 mL Luer 锁注射器提取 1 mL 的脂质混合物和至少 3 mL 的 (NH4)2SO4溶液。
- 将注射器的筒形法兰滑到泵的注射器固定器上,将注射器的柱塞法兰滑到泵的推杆块上,将两个注射器安装在直立位置(图 4)。
- 用水溶液将加热胶带的末端包裹到注射器上。用脂质溶液将加热胶带的另一端和恒温器的温度探头包裹在注射器周围。使用空注射器练习此步骤有助于简化装配过程(图 5A)。
- 将两个注射器连接到 SHM 相应入口的母 Luer 适配器。确保含有脂质混合物和(NH4)2SO4溶液的注射器分别连接乙醇入口和水入口。调整柱塞位置以去除注射器上的气泡(图5B)。
注:确保注射器仍牢固地放置在泵的注射器固定器上。 - 使用加热胶带使用 10 s 加热会话将注射器加热到 51°C 以上。让恒温器更新注射器的温度。在以下步骤中重复此步骤,以保持输注期间的温度。
注意:10 小时后关闭加热胶带,以防止温度过冲,并允许恒温器更新实际温度。加热胶带在温度上升非常快时也应小心处理。由于恒温器更新测量温度的时间延迟,持续加热可能会损坏设备和注射器。 - 一旦温度高于 51°C,通过按泵控制软件中的"全部运行"来运行注射器泵(图 3)。
- 确保流体流动无气泡和任何泄漏。将出口中的初始液体体积(约 0.5 mL)作为废物处理。
注:此初始废物量不确定,取决于设置的内部体积,即液体从注射器通过管道和 SHM 到出口所需的体积。 - 将液体的其余部分作为脂体样品收集到微离心管或双流小瓶中。
- 当任一注射器中的液体几乎为空时,暂停/停止输注。
注:泵应手动停止,因为当注射器空着时,泵可能无法准确检测位置。 - 将收集的脂体溶液放入60°C水浴中,以退火1.5小时。
注: 此步骤对于使药物加载到脂体中至关重要。 - 将溶液转移到透析管。在37°C下对1 L的240 mM (NH4)2SO4进行透析,至少4小时,以获得纯化脂体。
注: 可以在此处暂停该协议。这一步的脂质体在磷脂的5mM。纯化脂体可储存在4°C。 - 要清洁 SHM 以重复使用,请用去离子水、乙醇和氮气按顺序冲洗 SHM。
3. 通过跨膜 pH 梯度将 DOX 远程加载到 LTSL
- 通过使用尺寸排除色谱 (SEC) 建立跨膜 pH 梯度,将 LTSL 的外部缓冲液交换到 HEPES 缓冲盐水 (HBS)。
- 在 SEC 列的顶部添加总计 25 mL 的 HBS 以准备该列。允许所有洗脱物通过柱洗脱并释放洗脱物。
- 将步骤 2.12 中准备的 1 mL 的透析脂质体添加到柱中,并释放洗液。
- 将 1.5 mL 的 HBS 添加到柱中并释放洗头。
- 将 3 mL 的 HBS 添加到柱中,并收集 3 mL 的洗机。
注: 可以在此处暂停该协议。脂质体在此步骤中收集,磷脂为1.67 mM。缓冲交换的脂体可储存在4°C。
- 用多索鲁比素 (DOX) 孵育 LTSL 并纯化 LTSL。
- 将DOX溶液以1:20 DOX-磷脂摩尔比加入1mL的缓冲液交换脂质体溶液(1.67毫摩尔)中,包含在双焦小瓶中。这可以通过添加48.4 μL的1mg/mL DOX溶液(83.4μmol)来实现。
- 将双焦小瓶放入 37°C 水浴中 1.5 小时,以便 DOX 加载到脂体中。
- 将10μL的脂体与170 μL的HBS和20μL的1%(v/v)Triton X-100溶液混合在黑色96孔板中。对三口井重复上述步骤。这些井对应于"净化前"DOX含量。
- 在制备 LTSL10-ICG 时,将 40 μL 的脂体与 160 μL 的 DMSO 混合在一个清晰的 96 孔板中。对三口井重复上述步骤。这些井对应于"净化前"ICG含量。
- 如步骤 3.1 所述,纯化脂体溶液。
注:要重复使用该列以供将来纯化,请先添加 1 mL 的稀释 0.5 M NaOH 溶液,然后再执行步骤 3.1.1,从而从免费 DOX 中清洁该列。免费的DOX红色将变成紫蓝色,并迅速通过柱。 - 将30μL的纯化脂体溶液与150μL的HBS和20μL的1%(v/v)Triton X-100溶液混合在黑色96孔板中。对三口井重复上述步骤。这些井对应于"纯化后"DOX含量。
- 在 LTSL10-ICG 的情况下,将 40 μL 的纯化脂体溶液与 160 μL 的 DMSO 混合在一个清晰的 96 孔板中。对三口井重复上述步骤。这些井对应于"纯化后"ICG含量。
- 使用微孔板读片器(μex = 485 nm,μem = 590 nm)测量井前(步骤 3.2.3)和之后(步骤 3.2.5)的 DOX 荧光强度。
- 通过取纯前和纯后荧光强度的比率,计算DOX(DOX EE)的封装效率。
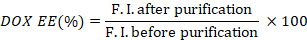
- 使用微孔板读卡器(600 至 1000 nm)测量净化前后井的 ICG 吸光度。
- 在纯化前后,考虑到净化过程中的稀释系数(3倍),考虑792nm的吸收率,计算ICG(ICG EE)的封装效率。

4. 动态光散射 (DLS)
- 将50μL的脂体溶液(步骤2.12)加入450μL的去离子水。
- 将比色皿放在 DLS 仪器内,并根据制造商的说明进行测量。
- 记录每个样品的三个测量值的平均 Z 平均直径和分散度。
5. 差分扫描热度 (DSC)
- 将1 mL的脂质体样品(步骤2.12)与离心滤芯单元浓缩至0.5 mL(最终脂质浓度为10 mM)。使用固定角度转子,在 7500 x g下旋转约 15 分钟。
- 将 20 μL 的 (NH4)2SO4溶液和脂体样品转移到两个相应的 DSC 盘中。使用 DSC 样品按压套件使用 DSC 密封盖密封平底锅。
- 使用差分扫描热量计以 1 °C/min 的加热速率测量从 30°C 到 60°C 的样品。
- 使用适当的软件分析数据。以相变温度(Tm)作为相变(熔融峰)的开始,通过最大斜率点切线的x截距进行测量。
6. 多索鲁比辛释放
- 使用水浴在指定温度(37 或 42°C)预热 HBS。准备一个冰水浴,用于淬火样品。
- 在微离心管中加入100 μL的纯化DOX载脂体(步骤3.2.5)到1.9 mL的HBS中。将管子放入指定温度的水浴中。
- 立即从管子中取出200 μL的样品,并迅速将其放入冰水浴中,以淬火任何随后的药物释放。此示例对应于初始 (t = 0) 时间点。
- 在后续时间点(t = 5、10、15、30、60 分钟)提取 200 μL 的样品,并迅速将其放入冰水浴中,以淬火任何药物释放。
- 将每个时间点的 50 μL 样品与 150 μL 的 HBS 混合在黑色 96 孔板中。使用板式读取器测量 DOX 荧光强度。
- 将 20 μL 的 1%(v/v) Triton X-100 添加到步骤 6.5 中制备的随机选定井中。使用板式读取器测量这些孔的 DOX 荧光强度。这些值对应于完全释放的时间点(t = = = 100% 释放)。
- 通过插值每个时间点 (I(t)的荧光强度(与初始 (I(0))和完全释放 (I(*)的值相比,计算和绘制释放的 DOX 百分比。
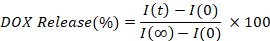
7. 激光加热和触发释放
- 将水浴温度设置为 37°C,使温度稳定。
- 将 200 μL 的 DOX 加载 LTSL10-ICG ([ICG] = 10 μg/mL) 添加到一个清澈的 96 孔板中,然后将其放入水浴中,使底部浸入水中。
- 将激光系统的电流设置为 2.27 A.将激光系统的准直器垂直放置在 96 孔板表面上方 5 厘米处,这相当于 0.5 W/cm2的能量通量 [ 图6] 。
注意:激光系统的操作应符合相关的激光安全措施。 - 打开激光,使用光纤温度探头每分钟监控温度。
- 在 5 和 10 分钟内,从清澈的 96 孔板中取出 10 μL 激光辐照脂体,并与 190 μL 的 HBS 混合,在黑色 96 孔板中为三口孔。
- 将10μL的脂体与170 μL的HBS和20μL的1%(v/v)Triton X-100溶液混合,用于黑色96孔板中的三口。这些井对应于"100% 释放"DOX 内容。测量 DOX 荧光强度并计算步骤 6.7 中所述的 DOX 释放。
Access restricted. Please log in or start a trial to view this content.
结果
微流体制备LTSL需要DPPC/MSPC/DSPE-PEG2000的脂质组成(80/10/10,摩尔比;LTSL10)。图 7A(左图)显示了步骤 2.9 中已制备的 LTSL10 作为透明且非粘性液体的外观。LTSL10配方是从传统配方LTSL4(DPPC/MSPC/DSPE-PEG 2000,86/10/4,摩尔比)开发的,因为LTSL4形成凝胶状粘性样品,如样品中捕获的大量气泡所示(图7...
Access restricted. Please log in or start a trial to view this content.
讨论
提出的协议描述了使用交错的刺骨微混频器(SHM)制备低温敏感脂质体(LTSLs)。LTSL10配方可在临床上达到的42°C高热温度下,在5分钟内释放多索鲁比辛。Indocyanine 绿色 (ICG) 也可以共同加载用于光热加热触发 DOX 的释放。该方法依赖于:(i) 在SHM11中乙醇和硫酸铵溶液的快速混沌混合所提供的均质溶剂环境下,将磷脂自行组装成脂质体;(二) 脂质体退火,以保持多药装载所必...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
我们感谢英国前列腺癌(CDF-12-002奖学金)和工程和物理科学研究委员会(EPSRC)(EP/M008657/1)的资助。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine (DPPC) | Lipoid | PC 16:0/16:0 (DPPC) | |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (DSPE-PEG2000) | Lipoid | PE 18:0/18:0-PEG 2000 (MPEG 2000-DSPE) | |
| 1-stearoyl-2-hydroxy-sn-glycero-3-phosphocholine (MSPC) | Avanti Polar Lipid | 855775P-500MG | Distributed by Sigma-Adrich; also known as Lyso 16:0 PC (Not to be confused with 14:0/18:0 PC, which is also termed MSPC) |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | Sigma-Aldrich | H3375-100G | |
| Adapters, Female Luer Lock to 1/4"-28UNF | IDEX Health & Science | P-624 | Requires 2 units. For the inlets |
| Adapters, Union Assembly, 1/4"-28UNF | IDEX Health & Science | P-630 | Requires 2 units. (One unit included 2 nuts and 2 ferrules) |
| Ammonium Sulfate ((NH4)2SO4) | Sigma-Aldrich | 31119-1KG-M | |
| Bijou vial | VWR | 216-0980 | 7 mL, clear, polystyrene vial |
| Centrifugal Filter Unit | Sigma-Aldrich | UFC801008 | 10 kDa MWCO, Amicon Ultra-4 Centrifugal Filter Unit |
| Centrifuge | ThermoFisher Scientific | Heraeus Megafuge 8R | With HIGHConic III Fixed Angle Rotor |
| Cuvette | Fisher Scientific | 11602609 | Disposable polystyrene cuvette, low volume, for DLS measurement |
| Dialysis Kit - Pur-A-Lyzer Maxi | Sigma-Aldrich | PURX12015-1KT | 12-14 kDa MWCO |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | 34943-1L-M | |
| DLS Instrument | Malvern Panalytical | Zetasizer Nano ZS90 | |
| Doxorubicin Hydrochloride (DOX) | Apollo Scientific | BID0120 | |
| DSC Instrument | TA Instruments | TA Q200 DSC | |
| DSC Tzero Hermetic Lids | TA Instruments | 901684.901 | For DSC measurement |
| DSC Tzero Pans | TA Instruments | 901683.901 | For DSC measurement |
| DSC Tzero Sample Press Kit | TA Instruments | 901600.901 | For DSC measurement |
| Ethanol | VWR | 20821.330 | Absolute, ≥99.8% |
| FC-808 Fibre Coupled Laser System | CNI Optoelectronics Tech | FC-808-8W-181315 | FOC-01-B Fiber Collimator included. |
| Ferrule, 1/4"-28UNF to 1/16" OD | IDEX Health & Science | P-200 | For the outlet |
| Fibre Optic Temperature Probe | Osensa | PRB-G40 | |
| Glass Staggered Herringbone Micromixer (SHM) | Darwin Microfluidics | Herringbone Mixer - Glass Chip | |
| Heating Tape | Omega | DHT052020LD | Can be replaced by other syringe heater such as "HTC" or "SRT series" for slower heating. Manual wiring to a 3-pin plug required for 240V models |
| Indocyanine Green | Adooq | A10473-100 | Distributed by Bioquote Limited (U.K.) |
| Luer-lock Syringe, 5 mL | VWR | 613-2043 | Hanke Sass Wolf SOFT-JECT 3-piece syringes, O.D. 12.45 mm |
| Microplate Reader | BMG Labtech | FLUOstar Omega | Installed with 485 nm (exictation) and 590 nm (emission) filters |
| Microplate, 96-well, Black, Flat-bottom | ThermoFisher Scientific | 611F96BK | For fluorescence measurement in microplate reader |
| Microplate, 96-well, Clear, Flat-bottom | Grenier | 655101 | For absorbance measurement microplate reader |
| Nut, 1/4"-28UNF to 1/16" OD | IDEX Health & Science | P-245 | For the outlet |
| PC to Pump Network Cable for Aladdin, 7ft | World Precision Instruments | NE-PC7 | Optional: Syringe pumps can be operated manually |
| Pump control software - SyringePumpPro Software License for 2 | World Precision Instruments | SYRINGE-PUMP-PRO-02 | Optional: Syringe pumps can be operated manually |
| Pump to Pump Network Cable for Aladdin, 7 ft | World Precision Instruments | NE-NET7 | Optional: Syringe pumps can be operated manually |
| Size exclusion chromatography (SEC) column | GE Life Science | 17085101 | Sephadex G-25 resin in PD-10 Desalting Columns |
| Sodium chloride (NaCl) | Sigma-Aldrich | 31434-1KG-M | |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | S5881-500G | |
| Syringe Pumps & Cable (DUAL-PUMP-NE-1000) | World Precision Instruments | ALADDIN2-220/AL1000-220 | |
| Thermostat Temperature Controller | Inkbird | ITC-308 | Can be replaced by other syringe heater kit/thermostat |
| Triton X-100 | Sigma-Aldrich | X100-100ML | |
| Tubing, ETFE (1/16" OD) | IDEX Health & Science | 1516 | |
| USB To RS-232 Converter | World Precision Instruments | CBL-USB-232 | Optional: For computer without RS-232 port |
| Water Bath | Grant Instruments Ltd. | JB Nova 12 |
参考文献
- Needham, D., Park, J., Wright, A. M., Tong, J. Materials characterization of the low temperature sensitive liposome (LTSL): effects of the lipid composition (lysolipid and DSPE-PEG2000) on the thermal transition and release of doxorubicin. Faraday Discussions. 161, 515-534 (2013).
- Ickenstein, L. M., Arfvidsson, M. C., Needham, D., Mayer, L. D., Edwards, K. Disc formation in cholesterol-free liposomes during phase transition. Biochimica et Biophysica Acta - Biomembranes. 1614 (2), 135-138 (2003).
- Valencia, P. M., Farokhzad, O. C., Karnik, R., Langer, R. Microfluidic technologies for accelerating the clinical translation of nanoparticles. Nature Nanotechnology. 7 (10), 623-629 (2012).
- Chen, D., et al. Rapid discovery of potent siRNA-containing lipid nanoparticles enabled by controlled microfluidic formulation. Journal of the American Chemical Society. 134 (16), 6948-6951 (2012).
- Forbes, N., et al. Rapid and scale-independent microfluidic manufacture of liposomes entrapping protein incorporating in-line purification and at-line size monitoring. International Journal of Pharmaceutics. 556, 68-81 (2019).
- Dittrich, P. S., Manz, A. Lab-on-a-chip: microfluidics in drug discovery. Nature Reviews Drug Discovery. 5 (3), 210-218 (2006).
- Capretto, L., Carugo, D., Mazzitelli, S., Nastruzzi, C., Zhang, X. Microfluidic and lab-on-a-chip preparation routes for organic nanoparticles and vesicular systems for nanomedicine applications. Advanced Drug Delivery Reviews. 65 (11-12), 1496-1532 (2013).
- Cheung, C. C. L., Al-Jamal, W. T. Sterically stabilized liposomes production using staggered herringbone micromixer: Effect of lipid composition and PEG-lipid content. International Journal of Pharmaceutics. 566, 687-696 (2019).
- Suh, Y. K., Kang, S. A. Review on Mixing in Microfluidics. Micromachines. 1 (3), 82-111 (2010).
- Jahn, A., Vreeland, W. N., Gaitan, M., Locascio, L. E. Controlled Vesicle Self-Assembly in Microfluidic Channels with Hydrodynamic Focusing. Journal of the American Chemical Society. 126 (9), 2674-2675 (2004).
- Stroock, A. D. Chaotic Mixer for Microchannels. Science. 295 (5555), 647-651 (2002).
- Belliveau, N. M., et al. Microfluidic Synthesis of Highly Potent Limit-size Lipid Nanoparticles for In Vivo Delivery of siRNA. Molecular Therapy - Nucleic Acids. 1 (8), 37(2012).
- Patra, M., et al. Under the influence of alcohol: The effect of ethanol and methanol on lipid bilayers. Biophysical Journal. 90 (4), 1121-1135 (2006).
- Komatsu, H., Rowe, E. S., Rowe, E. S. Effect of Cholesterol on the Ethanol-Induced Interdigitated Gel Phase in Phosphatidylcholine: Use of Fluorophore Pyrene-Labeled Phosphatidylcholine. Biochemistry. 30 (9), 2463-2470 (1991).
- Lu, J., Hao, Y., Chen, J. Effect of Cholesterol on the in Lysophosphatidylcholine Formation of an Interdigitated Gel Phase and Phosphatidylcholine Binary. Journal of Biochemistry. 129 (6), 891-898 (2001).
- Vanegas, J. M., Contreras, M. F., Faller, R., Longo, M. L. Role of unsaturated lipid and ergosterol in ethanol tolerance of model yeast biomembranes. Biophysical Journal. 102 (3), 507-516 (2012).
- Haran, G., Cohen, R., Bar, L. K., Barenholz, Y. Transmembrane ammonium sulfate gradients in liposomes produce efficient and stable entrapment of amphipathic weak bases. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1151 (2), 201-215 (1993).
- Sadeghi, N., et al. Influence of cholesterol inclusion on the doxorubicin release characteristics of lysolipid-based thermosensitive liposomes. International Journal of Pharmaceutics. 548 (2), 778-782 (2018).
- Lawaczeck, R., Kainosho, M., Chan, S. I. The formation and annealing of structural defects in lipid bilayer vesicles. Biochimica et Biophysica Acta (BBA) - Biomembranes. 443 (3), 313-330 (1976).
- Komatsu, H., Okada, S. Ethanol-induced aggregation and fusion of small phosphatidylcholine liposome: participation of interdigitated membrane formation in their processes. BBA - Biomembranes. 1235 (2), 270-280 (1995).
- Marsh, D., Bartucci, R., Sportelli, L. Lipid membranes with grafted polymers: physicochemical aspects. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1615 (1-2), 33-59 (2003).
- Hood, R. R., Vreeland, W. N., DeVoe, D. L. Microfluidic remote loading for rapid single-step liposomal drug preparation. Lab on a Chip. 14 (17), 3359-3367 (2014).
- Dalwadi, G., Benson, H. A. E., Chen, Y. Comparison of diafiltration and tangential flow filtration for purification of nanoparticle suspensions. Pharmaceutical Research. , (2005).
- Roces, C., Kastner, E., Stone, P., Lowry, D., Perrie, Y. Rapid Quantification and Validation of Lipid Concentrations within Liposomes. Pharmaceutics. 8 (3), 29(2016).
- Kim, S. -H., Kim, J. W., Kim, D. -H., Han, S. -H., Weitz, D. A. Enhanced-throughput production of polymersomes using a parallelized capillary microfluidic device. Microfluidics and Nanofluidics. 14 (3-4), 509-514 (2013).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。