需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
大鼠中三极重化控制体积过载的图像引导透射斜线阀传单穿刺模型
摘要
据报道,一种由斜体反光性导致左心体积过载的啮齿动物模型。通过超声波引导,将一根定义尺寸的针推进到跳动的心脏的斜体瓣膜的前单张中,从而诱导控制严重程度的斜体再加重。
摘要
斜体再加重 (MR) 是一种广泛流行的心脏瓣膜病变,导致心脏重塑并导致充血性心力衰竭。虽然未矫正MR的风险及其不良预后是已知的,但心脏功能、结构和重塑的纵向变化却不完全被理解。这种知识差距限制了我们对 MR 校正最佳时间的理解,以及早期和晚期 MR 修正对左心室的好处。为了研究在MR设置中左心室重塑的分子机制,动物模型是必要的。传统上,主囊瘘骨模型被用来诱导体积过载,这与临床相关的病变(如 MR. MR) 代表低压体积过载血液动力学压力器不同,后者需要模拟此情况的动物模型。在这里,我们描述了一个严重MR的啮齿动物模型,其中大鼠斜体瓣膜的前单张在跳动的心脏中用23G针穿孔,带有超声心动图像指导。MR的严重程度通过回声心动图进行评估和确认,并报告模型的可重复性。
引言
斜体再退(MR)是一种常见的心脏瓣膜病变,诊断为美国普通人口的1.7%和9%的老年人口超过65岁1岁。在这个心脏瓣膜病变中,在systole中,斜体瓣膜传单的不当关闭,导致血液从左心室回流到左中庭。MR 可能发生由于各种病因;然而,与继发性MR2相比,斜线瓣膜(原发MR)的主要病变的诊断和治疗更为频繁。分离的原MR通常是斜线瓣膜肌瘤变性的结果,导致传单或弦弦肌腱的伸长,或一些和弦断裂,所有这些都导致瓣膜收缩的丧失。
这种瓣膜病变引起的MR会提高每个心跳中填充左心室的血液量,增加末端舒张壁应力,并提供螺旋动力学压力,从而引发心脏适应和重塑。心脏重塑在这个病变中通常的特点是显著膨胀33,4,4轻度壁肥大,长期保持收缩功能。由于弹出分数通常保留,使用手术或转导器手段的 MR 校正通常被推迟,直到出现症状,如呼吸困难,心力衰竭和心律失常。然而,未校正的 MR 与心脏不良事件的高风险相关,尽管目前对于这些事件背后的超结构变化的了解尚不得而知。
MR的动物模型为研究心脏的这种超结构变化和研究这种疾病的纵向进展提供了一个有价值的模型。此前,研究人员通过制造外心室-心房分流5、心内和弦破裂6或传单穿孔7,在猪、狗和绵羊等大型动物中诱导MR。虽然手术技术在大型动物中更容易,但由于在大型动物中进行此类研究的成本很高,这些研究仅限于小样本大小的亚慢性随访。此外,由于这些模型中组织的分子分析通常具有挑战性,因为物种特异性抗体有限,并且为对齐而对基因组库进行了批带分析。
MR的小型动物模型可以提供一个合适的替代研究这个瓣膜病变及其对心脏重塑的影响。历史上,使用心脏体积超载的肛门瘘(ACF)的大鼠模型。1973年,Stumpe等人8年首次描述,一种动脉静脉瘘被手术创建,以绕过高压动脉血从下降的主动脉到低压劣质的静脉卡瓦。瘘管的高流速导致心脏两侧剧烈的体积超载,导致右、左心室肥大和功能障碍在创建ACF9的几天内发生。尽管成功,ACF并不模仿MR的力学,一种低压体积过载,它提高了预载荷,但也减少了后载。由于 ACF 模型的这种局限性,我们寻求开发和描述一种更好地模拟低压体积过载的 MR 模型。
在这里,我们描述了一个模型斜体瓣传单穿刺,在大鼠10,11,11创建严重的MR协议。在实时超声心动导指导下,将皮下针引入跳动的大鼠心脏,并推进到前线体瓣膜传单中。该技术具有很强的可重复性,是一个相对好的模型,模仿MR,如在患者身上看到的。MR 严重性由用于穿孔的线粒体传单的针头大小控制,MR 的严重程度可以使用跨食管波多心动图 (TEE) 进行评估。
研究方案
Emory 大学动物护理和使用计划根据协议号 EM63Rr(批准日期 06/06/2017)批准了程序。
1. 手术前准备
- 蒸汽消毒手术前手术器械。
- 在手术当天,将大鼠从外壳转移到手术室,并称重。
- 根据重量提取术前和术后药物:两剂卡普罗芬(每剂2.5毫克/千克),一剂金塔霉素(6毫克/千克)和一剂丁丙诺啡(0.02毫克/千克)。
- 确保气体混合器中有足够的西露拉内体积,并且水箱中的氧气可用于手术。一个满的氧气罐(24英尺3)通常足够。
2. 动物制剂
注:本研究使用了体重350-400克的成年斯普拉格-道利雄性大鼠。手术技术是适合稍微小或更大的动物,如果需要的话。
- 将大鼠在感应室中与 5% 的二氧结合在 1 LPM(升/分钟)100% 氧气中混合。在目视观察下,从较慢的呼吸速率中确定足够的镇定水平,并在捏住大鼠脚趾时失去抽搐。
- 用16G血管插管大鼠,作为内切管使用。
- 使用光镜可视化气管和声带,并使用棉尖施用器清除咽喉分泌物。
- 将0.034英寸导丝上的内切管引入声带。一旦管被适当放置在气管中,将管向内推并拔下导线(图1)。
- 将大鼠放在保持 37°C 的加热手术垫上,并将内切管连接到机械呼吸机。将大鼠的重量输入呼吸机控制软件,用于计算通风速率和潮汐体积。本研究使用了每分钟66次呼吸,潮汐体积为1 mL/100 g,体重为1mL/100 g。Figure 1D
- 使用 100% 氧气 (1 LPM) 与 2-2.5% 异丙酮混合作为吸入性麻醉剂,并确认麻醉水平与下颌音损失和对脚趾捏失去反应。
- 请注意,如果插管正确,胸部运动应与呼吸机同步。
- 如果插管不当,胸部运动不会与呼吸机同步。要测试插管不当,请压缩大鼠腹部,从而对呼吸机产生背压,产生过压报警。在这种情况下,轻轻地收回血管,并将大鼠用5%的isoflurane返回到诱导室几分钟,以确保大鼠充分麻醉并重新插管大鼠。
- 正确插管后,用4-0丝缝合线将管的近端缝合到大鼠的脸颊上,以避免在手术过程中外插,从而固定内切管。
- 插入直肠温度探头以监测体温,插入四端心电图以在整个过程中监测心电图。
- 如果手术平台的热量不足,请使用头顶加热灯。如果体温上升到 37 °C 以上,请关闭灯。
- 视觉评估心电图是否有任何心律失常或心肌缺血的迹象。如果没有存在,请记录基线心电图。
- 为基线心脏功能执行跨胸回波心动图 (TTE) (图 2A)。
- 将大鼠置于偏后位置,并扫描胸部左侧。要获得清晰的回声视图,请使用脱毛霜去除头发。
- 使用任何频率足够多的超声波系统进行高心率成像。在这项研究中,我们使用带有21 MHz探测器的Visualsonics 2100系统,该系统适用于大鼠的心脏成像。
- 在准线长轴平面上获取 B 模式图像,以计算左心室体积。在同一平面中,获取 M 模式图像以测量墙尺寸。
- 将探头旋转 90°,并在中毛孔级别获取 B 模和 M 模式准轴视图,以测量横截面壁尺寸。
- 执行跨管波超心动图(TEE)进行基线成像(图2B)。
- 将大鼠置于右侧的位置,并将一个 8 Fr 心内超声探头( 8 MHz )插入大鼠的食道,并将少量凝胶涂在尖端上。ICE(心内回声心动图)探针的频率足以获得每个心跳4-6帧,足以可视化瓣膜运动。
注:GE Vivid I 或西门子 SC2000 优质系统可用于 ICE 成像。 - 获取高食管视图,以获得心脏左侧的双室视图。此视图非常适合可视化左中庭、斜体阀和左心室。放置探头,以便前张和后传单被可视化,并协调中心。此角度还允许多普勒测量斜线阀,无需角度校正。
- 在此视图中测量左心房区域和斜线阀环形尺寸。
- 执行彩色多普勒成像,以确认阀门能力和基线时缺乏 MR。执行脉冲波和连续波多普勒成像,以量化斜体流入,并确认缺乏回流。
- 对主动脉执行 B 模式和脉冲波多普勒成像,以测量主动脉根径并计算主动脉流。
- 对肺静脉进行脉冲波多普勒成像,以测量肺静脉流动。
- 将大鼠置于右侧的位置,并将一个 8 Fr 心内超声探头( 8 MHz )插入大鼠的食道,并将少量凝胶涂在尖端上。ICE(心内回声心动图)探针的频率足以获得每个心跳4-6帧,足以可视化瓣膜运动。
- 注射单剂量的卡普罗芬(2.5毫克/千克,SQ,非类固醇消炎),根塔霉素(6毫克/千克,SQ,抗生素)和无菌盐水(1 mL,SQ),以先发制人地补偿手术期间的血液损失。
- 根据需要将胸部左侧除去手术现场中剩余的毛发。剃须从下颈部区域到xyphoid,从左臂下到中腹应足以确保一个没有头发的场,并降低手术部位污染的风险。
- 用浸泡在 Betadine 中的纱布擦洗手术区域,然后用 70% 乙醇浸泡的纱布。以圆形运动擦擦皮肤上的区域,使纱布不会接触先前擦洗的区域。
- 重复此步骤三次,以实现手术的完全无菌场。
- 用无菌盖给动物,打开一扇窗户进入无菌手术区。
3. 左胸切除术
- 使用无菌技术执行整个外科手术,在 1 LPM 氧气中保持 2-2.5% 的异氧酶。将所有仪器放入无菌托盘中,每次使用后放回托盘中。
- 在整个手术过程中,外科医生戴上无菌手套、面罩和手术帽。无菌手术服也可以穿,但它是可选的,除非污染预期。
- 使用带无#15刀片的手术手术刀在胸部左侧进行皮肤切口,约 1 厘米接近 xyphoid。使用钝化解剖尖端剪刀将皮肤层与肌肉层分离,并进行纵向切口。
- 以同样的方式解剖肌肉层,直到肋骨暴露。
- 小心地在第五间空间进行2-3厘米的纵向切口,足以插入缩回器并露出心脏。
- 使用细尖钳抬起心外膜,用微型剪刀将其切除在心脏顶点周围的区域。此步骤有助于避免心脏在手术后粘附到胸壁和隔膜。
注:避免手术切口靠近胸腔,以尽量减少出血。横断沿着胸骨的内乳腺动脉,可能导致过度出血。如果遇到这种出血,识别出血器并烧灼。
4. 回声引导MR程序(图3和图4)
- 使用 6-0 前柱缝合线和微针支架,在左心室的顶点上放置一个钱包串缝合线。如果需要,使用微钳稳定心脏。
- 轻轻地系住尖质缝合线以稳定顶点,并将 23 G 针(用盐水冲洗,并在其远端处用止动塞)插入钱包串缝合的中心,插入左侧心室腔。
- 一只手稳稳地握住并引导针头,另一只手同时操作跨视距回波探头,以实现最佳的回声视图,以可视化针,如上所述。
- 通过实时超声波引导,将针头朝前斜面传单的心室侧推进。一旦在超声波上确认针头位置,通过阀门传单以一个精细运动推进针头。如果感觉到阻力,在针头进入传单中时扭动针头以穿孔。
注:将针头推进到左侧中庭太远可能导致左心房穿孔,导致过度出血和动物死亡。针应随时在超声波上可视化。 - 将针头缩回左心室,远离斜线阀,并通过打开彩色多普勒成像来确认 MR。
- 如果在彩色多普勒成像上看不到 MR,请重复步骤 4.4 和 4.5。如果需要,请调整回声探头以获得更好的视图。在少数大鼠练习后,可以诱导一个针的一个动作,诱导一个孔的大小是针的外径。这在老鼠心脏的尸检后得到了证实。
- 确认 MR 后,将针从左心室腔中缩出,并轻轻系上钱包串缝合线。
- 使用无菌纱布浸泡顶点和胸腔中的任何血液。
注:用手术手套触摸回声探头可能会导致无菌环境的污染。用70%乙醇喷洒手套,或用新手套代替手套,恰如其分。
5. 动物康复和术后护理
- 在5-10分钟稳定的心脏功能(正常心电图和心率)后,用4-0维里尔关闭胸膜切除术,同时减少分泌体。
- 使用中断的缝合线近似肋骨,将二分流保持在 2%。将胸管插入第六个隔热空间,并将其固定到无菌窗帘中,以避免意外将管推进到胸腔中。
- 使用连续缝合线关闭肌肉层,将肌体保持在 1.5%。
- 使用连续缝合线关闭皮肤层,将二分流素保持在 1%。
- 将 10 mL Luer 锁止阀倾斜的注射器连接到胸管,然后从胸腔排出 10-12 mL 的空气,然后拆下胸管。
- 施用最终剂量的卡普罗芬(2.5毫克/千克,SQ),并关闭阿芬拉内。
- 在大鼠麻醉时继续机械通气,监测生命体征(SO2和心率)。在自发呼吸时,关闭通风以测试大鼠保持这种呼吸的能力和良好的SpO2。
- 如果 SpO2水平开始下降到 90%以下,请打开呼吸机。一旦大鼠能够在没有通风的情况下保持SpO2水平,内切管的锚定缝合被切断,动物准备进行切除。
- 一旦大鼠表现出警觉的迹象,包括胡须或眼动,排泄动物。
- 放置一个100%氧气的鼻锥,直到大鼠被放气。
- 将大鼠转移到干净的笼子,用最少的床上用品,并继续使用手持式SpO2监视器监测生命体征,放在大鼠的脚或尾巴上,直到老鼠被流动。
注:如果观察到手术的不良反应,动物的恢复时间可能更长,可能需要更长的时间才能保持高SpO2水平。如果发生这种情况,可以应用100%氧气的鼻锥,直到 SpO2水平稳定。 - 为了降低手术部位受伤的风险,避免感染风险,手术后单户大鼠。
- 在大鼠清醒并充分流动后3小时内施用丁丙诺啡。在术后恢复期早期施用时,丁丙诺啡可能导致呼吸窘迫,从而延迟至大鼠呼吸困难。
- 手术后,所有动物接受以下药物:根卡米胺(6毫克/千克,SQ,SID POD 1-3)和里马迪尔(5毫克/千克,SQ,SID POD1-3)。所有动物在手术后五天内每天观察一次,检查切口部位,手术后头两周每天观察一次,以进行疼痛评估。
6. 用回声心动图验证MR严重性(图5)
- 手术后两周重复TEE,使用第2.7节中指定的相同步骤。手术后两周是止动器稳定的充分时间。
- 使用跨视管超声成像在 2 室视图中获得彩色多普勒成像,从而可视化左心室和左心房。测量左中庭和 MR 喷射的区域。使用 MR 喷射区域分数计算
 (1)
(1)
严重 MR 定义为 MR 喷射区域 = 30%。 - 使用针的外径计算 23 G 针的面积,近似回流孔的面积。此方程假定回流孔的面积等于 23G 针的面积。
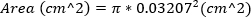 (2)
(2) - 在回流式喷气式飞机的孔口处,通过多普勒门获得连续波多普勒成像。跟踪波形以计算反胃喷头的 VTI。MR 音量可用于估算
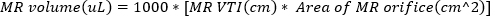 (3)
(3)
严重 MR 定义为 MR 体积 = 95 μL。 - 顺时针旋转回波探头,获得脉冲波多普勒肺静脉成像。测量收缩波和舒张波速度,并使用以下方程计算比率。
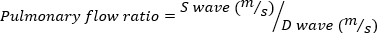 (4)
(4)
负肺流量比表示严重 MR。
7. 沙姆手术
- 执行第 1-3 节,如所述。
- 修改第4节,使23 G针插入左心室,通过左心室顶面的套筒串缝合,但不推进到斜线阀产生MR。 将针插入左心室并立即缩回,随后收紧和关闭心室顶点。
- 执行第 5 节,如所述。
- 执行第 6 节中所述的斜线阀评估。但是,MR 不应存在于任何动物中,因此无需进行所述量化。
结果
可行性和可重复性
建议的MR模型具有很强的可重复性,在这项研究中使用的100%的大鼠中,在斜线传单中实现了一个定义明确的孔洞。图 6A描述了针头插入斜线阀时的方向。图6B描绘了在手术后2周内从一只代表性大鼠中挖出的斜体瓣膜传单上的一个洞。
讨论
报告采用可重复的可复制的严重MR型,具有良好的存活率(手术后存活率为93.75%),术后无明显并发症。实时成像与跨食管波多心动图和引入针头到跳动的心脏刺穿斜线传单是可行的,可以教。在这项研究中,用23G针大小产生严重MR,使用更小或更大的针头可以根据需要变化。此模型中诱导的 MR 在左心室上产生低压体积过载,这是临床观察的斜线瓣膜病变的更好表示。本模型MR发病后两周内观察严...
披露声明
M.P 是心脏修复技术 (HRT) 的顾问,他已为此收取了咨询费。HRT在这项研究中没有任何作用,也没有提供任何资金来支持这项工作。
致谢
这项工作由美国心脏协会向D提供19PRE34380625和14SDG20380081资助。 科科兰和M.帕达拉分别从国家卫生研究院向M.帕达拉提供HL135145、HL133667和HL140325,以及埃默里大学医院中城凯雷弗雷泽心脏中心向M.帕达拉提供的基础设施资金。
材料
| Name | Company | Catalog Number | Comments |
| 23G needle | Mckesson | 16-N231 | |
| 25G needle, 5/8 inch | McKesson | 1031797 | |
| 4-0 vicryl | Ethicon | J496H | |
| 6-0 prolene | Ethicon | 8307H | |
| 70% ethanol | McKesson | 350600 | |
| ACE Light Source | Schott | A20500 | |
| ACUSON AcuNav Ultrasound probe | Biosense Webster | 10135936 | 8Fr Intracardiac echo probe |
| ACUSON PRIME Ultrasound System | Siemens | SC2000 | |
| Betadine | McKesson | 1073829 | |
| Blunted microdissecting scissors | Roboz | RS5990 | |
| Buprenorphine | Patterson Veterinary | 99628 | |
| Carprofen | Patterson Veterinary | 7847425 | |
| Chest tube (16G angiocath) | Terumo | SR-OX1651CA | |
| Disposable Surgical drapes | Med-Vet | SMS40 | |
| Electric Razor | Oster | 78400-XXX | |
| Gentamycin | Patterson Veterinary | 78057791 | |
| Heat lamp with table clamp | Braintree Scientific | HL-1 120V | |
| Hemostatic forceps, curved | Roboz | RS7341 | |
| Hemostatic forceps, straight | Roboz | RS7110 | |
| Induction chamber | Braintree Scientific | EZ-1785 | |
| Injection Plug, Cap, Luer Lock | Exel | 26539 | |
| Isoflurane | Patterson Veterinary | 6679401725 | |
| Mechanical ventilator | Harvard Apparatus | Inspira ASV | |
| Microdissecting forceps | Roboz | RS5135 | |
| Microdissecting spring scissors | Roboz | RS5603 | |
| Needle holder | Roboz | RS6417 | |
| No. 15 surgical blade | McKesson | 1642 | |
| Non-woven sponges | McKesson | 446036 | |
| Otoscope | Welch Allyn | 23862 | |
| Oxygen | Airgas Healthcare | UN1072 | |
| Pulse Oximeter | Nonin Medical | 2500A VET | |
| Retractor, Blunt 4x4 | Roboz | RS6524 | |
| Rodent Surgical Monitor | Indus Instruments | 113970 | The integrated platform allows for monitoring of vital signs and surgical warming |
| Scale | Salter Brecknell | LPS 150 | |
| Scalpel Handle | Roboz | RS9843 | |
| Silk suture 3-0 | McKesson | 220263 | |
| Small Animal Anesthesia System | Ohio Medical | AKDL03882 | |
| Sterile saline (0.9%) | Baxter | 281322 | |
| Sugical Mask | McKesson | 188696 | |
| Surgical cap | McKesson | 852952 | |
| Surgical gloves | McKesson | 854486 | |
| Syringe 10mL | McKesson | 1031801 | |
| Syringe 1mL | McKesson | 1031817 | |
| Ultra-high frequency probe | Fujifilm Visualsonics | MS250 | |
| Ultrasound gel | McKesson | 150690 | |
| VEVO Ultrasound System | Fujifilm Visualsonics | VEVO 2100 |
参考文献
- Nkomo, V. T., et al. Burden of valvular heart diseases: a population-based study. Lancet. 368 (9540), 1005-1011 (2006).
- Zamorano, J. L., et al. Mechanism and Severity of Mitral Regurgitation: Are There any Differences Between Primary and Secondary Mitral Regurgitation?. The Journal of Heart Valve Disease. 25 (6), 724-729 (2016).
- Grossman, W., Jones, D., McLaurin, L. P. Wall stress and patterns of hypertrophy in the human left ventricle. Journal of Clinical Investigation. 56 (1), 56-64 (1975).
- Carabello, B. A. Concentric versus eccentric remodeling. Journal of Cardiac Failure. 8 (6), S258-S263 (2002).
- Braunwald, E., Welch, G. H., Sarnoff, S. J. Hemodynamic effects of quantitatively varied experimental mitral regurgitation. Circulation Research. 5 (5), 539-545 (1957).
- Sasayama, S., Kubo, S., Kusukawa, R. Hemodynamic and angiocardiographic studies on cardiodynamics: experimental mitral insufficiency. Japanese Circulation Journal. 34 (6), 513-530 (1970).
- Hennein, H., Jones, M., Stone, C., Clark, R. Left ventricular function in experimental mitral regurgitation with intact chordae tendineae. Journal of Thoracic and Cardiovascular Surgery. 105 (4), 624-632 (1993).
- Stumpe, K. O., Sölle, H., Klein, H., Krück, F. Mechanism of sodium and water retention in rats with experimental heart failure. Kidney International. 4 (5), 309-317 (1973).
- Abassi, Z., Goltsman, I., Karram, T., Winaver, J., Hoffman, A. Aortocaval fistula in rat: A unique model of volume-overload congestive heart failure and cardiac hypertrophy. Journal of Biomedicine and Biotechnology. 2011 (January), 1-13 (2011).
- Corporan, D., Onohara, D., Hernandez-Merlo, R., Sielicka, A., Padala, M. Temporal changes in myocardial collagen, matrix metalloproteinases, and their tissue inhibitors in the left ventricular myocardium in experimental chronic mitral regurgitation in rodents. American Journal of Physiology - Heart and Circulatory Physiology. 315 (5), H1269-H1278 (2018).
- Onohara, D., Corporan, D., Hernandez-Merlo, R., Guyton, R. A., Padala, M. Mitral Regurgitation Worsens Cardiac Remodeling in Ischemic Cardiomyopathy in an Experimental Model. The Journal of Thoracic and Cardiovascular Surgery. , (2019).
- Garcia, R., Diebold, S. Simple, rapid, and effective method of producing aortocaval shunts in the rat. Cardiovascular Research. 24 (5), 430-432 (1990).
- Brower, G. L., Janicki, J. S. Contribution of ventricular remodeling to pathogenesis of heart failure in rats. American Journal of Physiology-Heart and Circulatory Physiology. 280 (2), H674-H683 (2001).
- McCutcheon, K., et al. Dynamic changes in the molecular signature of adverse left ventricular remodeling in patients with compensated and decompensated chronic primary mitral regurgitation. Circulation Heart Failure. 12 (9), (2019).
- McCutcheon, K., Manga, P. Left ventricular remodeling in chronic primary mitral regurgitation. Cardiovascular Journal of Africa. 29 (1), 51-64 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。