需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
氢-铀交换质谱仪(HDX-MS)平台,用于研究肽生物合成酶
摘要
在肽天然产品的生物合成过程中,兰西肽合成器催化多步反应。在这里,我们描述了一个连续的,自下而上的,氢-钚交换质谱仪(HDX-MS)的工作流程,可用于研究兰西肽合成器的构象动力学,以及肽天然产品生物合成中涉及的其他类似酶。
摘要
氢-铀交换质谱仪(HDX-MS)是酶构象变化和酶基质相互作用生物物理特征的有力方法。HDX-MS 的诸多优点中,仅消耗少量材料,无需酶/基质标签即可在近原生条件下进行,并且可以提供酶构象动力学空间解决信息−甚至用于大型酶和多蛋白复合物。该方法由将兴趣酶稀释到 D2O 中准备的缓冲器中启动。这触发了肽键(N-H)与铀(N-D)的蛋白交换。在所需的交换时间点,反应液被淬火,酶被蛋白酶分解成肽,肽通过超性能液相色谱 (UPLC) 分离,并且每个肽的质量变化(由于氢气交换为铀)由 MS 记录。每种肽吸收的钚量在很大程度上取决于该肽的局部氢结合环境。肽存在于酶交换的非常活跃的区域非常快,而从有序区域提取的肽的交换速度要慢得多。通过这种方式,HDX 速率报告了局部酶构象动力学。然后,在不同配体存在的情况下,对脱脂吸收水平进行扰动,可用于绘制配体绑定位点的地图,识别同位素网络,并了解构象动力学在酶功能中的作用。在这里,我们说明了我们如何使用HDX-MS来更好地了解一种叫做兰西肽的肽天然产品的生物合成。Lanthipeptides 是基因编码肽,通过大型、多功能、符合性动态酶进行转化后进行修饰,这些酶很难用传统的结构生物学方法进行研究。HDX-MS 为研究这些类型的酶的机械特性提供了一个理想且适应性的平台。
引言
蛋白质是结构动力学分子,在时间尺度上采样不同的构象,从女性到第二级的键振动到整个蛋白质域的重新排列,这些排列可以在多秒1内发生。这些构象波动通常是酶/蛋白质功能的关键方面。例如,由配体结合引起的构象变化通常对于调节酶功能至关重要,无论是组织催化所需的活动站点残留物、在顺序动能机制中定义基板结合位点、保护反应中间体免受环境影响,还是通过全石器网络调节酶功能。最近的研究还表明,在整个进化过程中可以保存符合性动力学,而对保存分子运动的扰动可以与基质特异性的变化和新酶功能2、3的出现相关。
近年来,氢-铀交换质谱仪(HDX-MS)迅速成为探索蛋白质构象景观如何对配体结合或突变4、5、6、7等扰动做出反应的有力技术。在典型的HDX-MS实验(图1)中,一种感兴趣的蛋白质被放入D2O制备的缓冲器中,这触发了可溶剂交换质子与 deuteria 的替代。肽债券的交换率在很大程度上取决于pH度、局部氨基酸序列和8号辣椒的局部结构环境。从事氢粘结相互作用的中位(如存在于α螺旋和β片中)的交换速度比暴露于散装溶剂的蛋白质非结构化区域中的中位要慢。因此,铀吸收的程度反映了酶的结构。符合动态的酶,或在配体结合后进行结构转换的酶,将有望产生可测量的HDX响应。
结构化中间体缓慢汇率的机械基础见图25、8、9。为了进行HDX,结构区域必须首先对展开的构象进行瞬时采样,以便通过特定的酸/碱基化学机制促进HDX交换的溶剂分子能够进入可交换的中间体。最终,化学汇率(k化学)的相对幅度和折叠和重折叠率(k打开和k关闭)决定了实验5、8中测量的HDX汇率。从这个简单的动能模型中,很明显,铀吸收的程度将反映潜在的构象动力学(如k开和k关闭的定义)。大多数HDX-MS实验都是在自下而上的工作流程中进行的,在交流反应之后,兴趣蛋白被消化成肽,每个肽的吸乳量被测量为质量7的增加。通过这种方式,HDX-MS 允许在肽的局部空间尺度上映射酶构象动力学的扰动,使研究人员能够评估扰动如何改变感兴趣的酶不同区域的动力学。
HDX-MS方法用于阐明蛋白质结构动力学的优点是多种多方面的。首先,该方法可以在具有第四纪结构10的系统中用少量的原生蛋白质或蛋白质复合物进行。只要自下而上的HDX-MS工作流程提供足够数量的自信识别肽,涵盖感兴趣的蛋白质序列,就根本不需要在检测中使用的酶制剂进行高度纯化。此外,HDX-MS可以提供近原生条件下的构象动力学信息,而无需像单分子荧光研究13中那样使用部位特异性蛋白质标签,并且对可以研究的蛋白质或蛋白质复合物没有大小限制(这使得核磁共振[NMR]光谱学等方法具有挑战性)7,14。最后,可以采用时间解决的HDX-MS方法来研究内在紊乱的蛋白质,这些蛋白质很难用X射线晶体学15、16、17、18来研究。HDX-MS 的主要限制是数据结构分辨率低。HDX-MS 数据可用于指出构象动力学的变化位置,并揭示耦合的构象变化,但它们通常不会提供对驱动观测变化的精确分子机制的深入了解。电子捕获分离方法与蛋白质HDX-MS数据相结合的最新进展表明,将交换点绘制为单一氨基酸残留物19有希望,但还需要进行后续生化和结构研究,以便为HDX-MS数据转发的结构模型提供清晰度。
下面,提出了一个详细的协议,为开发HDX-MS检测是20。下面介绍的样品制备协议通常应适用于在水性缓冲中表现出良好溶解性的任何蛋白质。更专业的样品制备方法和HDX-MS工作流程可用于蛋白质比需要检测在洗涤剂或磷脂的存在21,22,23,24。HDX-MS 数据收集的仪器设置被描述为高分辨率四倍飞行时间质谱仪与液相色谱系统相结合。可以在一些市售的液相色谱-质谱 (LC-MS) 系统中的任何一个系统上收集具有类似复杂性和分辨率的数据。还提供了使用市售软件包进行数据处理的关键方面。此外,我们亦提供与更广泛的HDX-MS社区12的建议相一致的数据收集及分析指引。所述协议用于研究HalM2的动态结构特性,HalM2是一种促进抗菌肽天然产品20的多步成熟。我们说明了如何使用 HDX-MS 来揭示基板绑定站点和未采用以前特征的异体特性。近年来,关于蛋白质HDX-MS的其他几项协议已经发表25,26。结合目前的工作,这些早期的贡献应该为读者提供一些实验设计的灵活性。
研究方案
1. 准备脱毒试剂和酶库存解决方案
- 将 HDX 反应所需的试剂(包括任何缓冲器、盐、基板、配体等)准备为 D2O 中的 100 −200x 浓缩库存解决方案(99.9% 原子分数 D)。准备至少 50 mL 的缓冲库存解决方案。
注:对于HalM2的描述, 准备了以下解决方案: 500 mM MgCl2,100 mM 三 (2- 卡盒乙基) 磷酸 (TCEP), 750 mM ATP (在 HEPES 缓冲区), 800 m HEPES pD 7.1, 500μM 哈拉2 和 500 m M AMPPNP. - 冻结和溶解库存解决方案的干燥。
- 在 D2O 中重新溶解,并重复至少一次的同化周期,以尽可能多地用脱硫剂替换尽可能多的可交换质子。
- 将已除名的 HEPES 缓冲库存的 pD 调整为具有集中 NAOD/DCl 的预期值,请记住以下关系27:
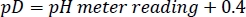
注:中间硬盘速率在很大程度上取决于解决方案(pL = pH或pD)5的pL。需要以相同的方式准备、存储和使用不同批次的缓冲库存解决方案,以避免实验之间出现轻微的 pL 漂移。 - 计算 300 μL HDX 测定所需的每个试剂的数量,并在 -80 °C 下作为一次性引用存储。
- 使用离心滤清器(材料表)或等效设备,在催化酶存储缓冲器中准备浓缩酶库存溶液(约 100 −200 μM)。
注:确切的缓冲器和离心过滤器分子重量的截止取决于感兴趣的蛋白质/酶。HalM2 储存在 50 mM HEPES、pH 7.5、100 mM KCl 和 10% 甘油中。10 kDa 过滤器用于制备浓缩酶。 - 将酶加入一次性使用部分,并储存在-80°C。
注意:这可能是一个停止点。第 1 节中描述的所有库存解决方案均可在 HDX 反应之前准备。如果存储在 -80 °C,大多数酶/脱酸库存解决方案将稳定数月。
2. HDX 淬力音量校准
- 使用第 1 节中准备的脱脂试剂和浓缩酶库存,在 D2O 中准备 300 μL HDX 反应。
- 使用1−5微米的最终酶浓度。
- 使用至少 50− 100 mM 的最终脱水 HEPES 缓冲浓度。
- 确保其他组件的浓度足以保持所需的酶活性/功能。
- 准备 1 升 HDX 淬斗溶液(100 m M 磷酸盐,0.8 M 瓜尼丁-HCl,pH 1.9)。冻结和存储在 50 mL 部分(长期库存)和 1 mL 部分(一次性报价)。
注:淬头缓冲器的确切组成将取决于自下而上的 HDX-MS 工作流(步骤 3.3.3)的蛋白酶。此处给出的淬热缓冲器与 pepsin 兼容,肽是 HDX-MS 最常用的蛋白酶。如果使用其他蛋白酶,请与蛋白酶供应商核实,以确保缓冲区兼容性。 - 校准淬火缓冲器的体积,将淬火 HDX 反应混合物的最终 pL 调整为 2.3 的 pH 表读数值。
注:肽在N-H键中的溶剂H/D汇率是一个pH依赖的过程,同时受酸和碱基催化。最低汇率为 pH 2.5 值(50:50H2 O:D 2 O 混合物的 pH 仪表读数 =2.3)。因此,接近 2.5 的最终 pL 值将最大限度地减少自下而上的 LC-MS 分析过程中发生的氢背交换,从而保留肽中的 deuterium 标签。- 将步骤 2.1 中的 HDX 反应混合物的 50 μL 与 50 μL 的淬火缓冲液混合,用微尖电极测量淬火混合物的 pL。
- 根据需要增加淬当解决方案的体积,将最终 pH 值读数调整为 2.3。
- 确定适当的淬火量后,使用 HDX 反应(步骤 2.1)中的新鲜 50μL aliquot 多次重复淬火过程,以确保在添加固定数量的淬火缓冲后实现一致的最终 pL。
3. 编制参考样本并优化自下而上的 LC-MS 工作流程
- 在 0.5 mL 管中为感兴趣的三位一体蛋白质准备未去位的参考样本。确保最终反应混合物条件与正宗 HDX 反应(步骤 2.1)中使用的条件相同,但响应是在 H2O 中使用也用 H2O 制备的试剂库存解决方案准备的。
- 通过添加适当的淬头缓冲器以将最终 pH 调整为 2.5,将样品按步骤 2.3 进行淬名。闪光将样品冻结在液氮中,储存在-80°C,直到准备好分析。
- 使用自下而上的 LC-MS 工作流分析蛋白酶参考样本。
注意:在执行这些步骤之前,应正确校准用于数据采集的 LC-MS 系统,并准备使用。必须严格控制自下而上 LC-MS 工作流程中所有步骤的时间和温度,以最大限度地减少样品之间背部交换的差异。使用本协议中使用的MS仪器(材料表 和 支持信息),大部分步骤可以通过仪器软件进行控制。为了确保精确复制的收集,建议尽可能多地自动实现工作流程中的步骤自动化。- 从冰柜中取出单个酶参考样品(按步骤 3.2 制备),在 37 °C 下解冻,在水浴中解冻 1 分钟。
- 在从冰柜中取出样品并解冻后整整 2 分钟,将淬火参考样品的 40 μL 部分注入超性能液相色谱 (UPLC) 列 (2.1 x 30 mm、300+ 、 5 μM),其中含有含有肽(酸稳定蛋白酶)的静止相位。
- 在 15 °C 时以 100μL/min 的流速消化样品 3 分钟,使用 H2O 中的 0.1% 的甲酸(pH = 2.5) 作为溶剂。
- 收集化粪肽,因为它们从肽列中流出到 C18 陷阱柱上,保持在 0.4 °C,以最大限度地减少背部交换。
- 将脱盐的化粪肽从陷阱柱传递到 C18 分析柱(1 mm x 100 mm、1.7 μM、130+)保持并操作在 0.4 °C 以分离化粪肽。
注:用于 HDX-MS 数据采集的某些 LC-MS 系统可以自动执行步骤 3.3.3−3.3.5。或者,这些步骤可以独立执行,请记住,需要仔细控制每个步骤的时间和温度,以实现持续的低背交换。 - 用丙酮三甲酸/水/0.1%的丙酸溶剂系统将C18列进行优雅。优化 LC 梯度以获得感兴趣的蛋白质,以最大限度地分离和保存败血肽中的 deuterium 标签。
注:梯度弹性详细信息在 支持信息中提供。 - 将消化液受制于电溅电传 (ESI) 质谱。
注: 支持信息 中提供的源条件将为大多数消化肽提供足够的电流。- 在MS仪器中电离后,使用氮作为缓冲气体进行气相离子移动分离,以提高该方法的峰值容量。
- 离子移动分离后,将消化肽前体离子受制于 MSE 工作流,该工作流涉及低碰撞能量 (4 V) 和高碰撞能量 (21−40 V) 的交替循环。
注:交替的低碰撞和高碰撞能量系统允许与 MSMS 数据(高碰撞能量)同时收集 MS 数据(低碰撞能量)。这反过来又允许前体离子与各自的碎片离子的时间相关性。这种相关性对于第 4 节中描述的自信肽识别至关重要。 - 使用具有至少 20,000 解析能力的质量分析仪检测肽前体和碎片离子。
- 在数据采集的同时,获取 [Glu-1] -纤维肽 B (GluFib) 外部标准的 MS 数据。
注:步骤 3.3.7 中描述的 MS 工作流称为 MSE协议。支持信息中提供了适合自下而上的 HDX-MS 的 MSE协议的完整工具设置。
- 评估 LC-MS 数据的质量。
注:使用上述协议和支持信息中提供的仪器设置,参考样本应产生总离子色度图,最大信号强度约为1×108。在3−9分钟(图3A−C)之间应该有很多怀疑论者肽。 - 注入 40 μL 的空白样品(水中 0.1% 的丙酸),以清洁肽和分析 C18 列。
注:一般来说,2−3个空白应该足够了。 - 每个三方参考蛋白样本重复步骤 3.3.1−3.3.9。
4. 处理参考数据并定义肽列表
- 使用蛋白质组学软件(材料表)分析原始 MSE数据(步骤 3.3.7)。使用蛋白质组学软件,导航到库|蛋白质序列数据库通过导入感兴趣的蛋白质的氨基酸序列来定义蛋白质数据库。
注:此步骤的目标是搜索从兴趣蛋白中提取的怀疑肽的参考 MS 数据,并使用 MSMS 数据(与 MS 数据同时获取)来验证任何假定肽识别。 - 给感兴趣的蛋白质序列起个名字。导入蛋白质序列(以 FASTA 格式)。该软件将对数据库蛋白质进行硅化消化,以生成用于搜索LC-MS数据的肽列表。
- 定义处理参数(位于 库 菜单下)。选择 电子喷雾 MSE 作为数据采集类型。在充电 2 字段 的锁定质量 中,输入 785.8426, 用于 [Glu-1] -纤维肽 B (GluFib) 的 2+ 离子的 m/z,然后单击 完成。
- 定义 工作流 参数(位于 库 菜单下方)。
- 选择 电子喷雾 MSE 进行搜索类型。在 工作流程 下| 数据库搜索查询 标题,选择数据 库 字段中第 4.2 步创建的数据库蛋白质。
- 将主文摘试剂更改为非特定,并通过在单击卡巴米多姆甲基 C时按住Ctrl按钮清除固定修饰剂试剂字段。
- 通过导航到选项来指定输出目录|自动化设置|身份 E.检查Apex 3D 和肽 3D 输出和离子会计输出的框,并指定所需的目录。
- 处理参考样本数据。
- 在蛋白质组学平台工作区的左侧工具栏上,通过右键单击 Microtiter 板创建新板。突出显示微油板中的三口井(第 3 节收集的每个参考样本一口)。左键单击一口井,按住并拖至三口井。
- 右键单击并选择 添加原始数据。在显示的窗口中,导航到包含第 3 节中的三个参考文件的目录,并同时选择它们。
- 单击 下一步 ,然后选择步骤 4.3 中定义的处理参数。单击 下一步 ,然后选择步骤 4.4 中定义的工作流参数。然后点击 完成。
- 一旦将原始数据、处理参数和工作流程参数分配给板上的每口井,油井将呈蓝色。选择油井,右键单击并选择 处理最新的原始数据。单击窗口的右下角以跟踪数据的处理。消息 出现后,无需运行任何工作 ,处理将完全完成。
- 数据处理完成后,板中的油井将变绿。右键单击油井并选择 查看工作流结果。每个参考数据文件将打开一个单独的窗口。
- 检查数据,以确保参考样本数据中的大多数 MS 信号都成功地映射到从兴趣蛋白的硅中消化预测的肽。匹配肽将在输出光谱中为蓝色(图 4)。双击 OK 过滤器 ,检查覆盖率是否大于 99%。
注:处理后,数据输出将通过步骤 4.5 中指定的目录中的文件扩展(raw_data_file_name_IA_final_peptide)自动保存。 - 将蛋白质组学软件输出导入 HDX 处理软件(材料表),以获得额外的阈值。
- 单击 HDX 处理软件窗口左角 的数据 。单击 导入 PLGS 结果 并单击添加图标。通过导航到适当的目录,从步骤 4.9 中选择已处理的数据文件。
- 单击 "下一步" 并指定以下参数:最小连续离子≥ 2、质量错误 = 5 ppm 和文件阈值 = 3。点击 完成。
- 一旦满足阈值参数,保存 HDX 项目。所有 HDX 数据都将导入此项目进行分析和显示。
注:需要用相同的LC-MS工作流程处理下一节中描述的交换样品。因此,在进行 HDX 检测(第 5 节)之前,确保样本制备(第 2 节)、自下而上的 LC-MS 工作流(第 3 节)和数据处理工作流(第 4 节)提供目标蛋白质所需的可重复性和序列覆盖范围。如果需要更改其中任何一个过程以改善覆盖范围,建议返回到步骤 2.1,在三脚架中准备新的参考样本,并重复第 2 −4 节(同时对协议进行必要的调整),以确保每个肽可以重复生成和检测。
5. 进行高清反应
- 为 HDX 反应准备工作空间。
- 将淬灭前缓冲区放入正确标记的 0.5 mL 管中。为要分析的每个时间点、每个复制品和每个生化状态准备不同的管子。使用所需的步骤 2.2 中的适当量淬热缓冲器,将 HDX 反应中 50μL 部分的最终 pH 值调整为 2.3。
- 简要离心机 0.5 mL 浴缸将所有淬热缓冲器转移到管子底部。把管子放在冰上。
- 用液氮填充小德瓦尔,并保持与工作空间相邻。
- 准备HDX反应。确保有足够的反应量来收集所需的交换时间点数(每个所需时间点一个 50μL 的单数)。收集至少 4 −5 个时间点超过 3−4 个数量级的时间尺度(例如,15 秒、60 秒、300 秒 [5 分钟]、1,800 秒 [30 分钟] 和 14,400 秒 [4 h] 的淬泄时间为大多数酶提供了足够的交换动态覆盖)。
- 在 D2O 中预混合步骤 1.1 中的所有去除组件(减去酶)。
- 要检查每个生化状态(自由酶、酶+利根德、酶+抑制剂等),请至少用三分位制备HDX反应。
- 在添加酶之前,在温度控制的水浴中将反应混合物在 25 °C 中孵化 10 分钟。
注意:酶应作为浓缩库存溶液(约 100− 200 μM,步骤 1.6)进行制备,以便最大限度地减少在 HDX 检测中添加钚。 - 将酶添加到 1−5 μM 的最终浓度后,启动定时器。使用 200 μL 移液器小心快速混合溶液,以确保酶均匀地分布在样品中。
- 在所需的交换时间点,从 HDX 反应中取出 50 个 μL 别名,并快速均匀地与 0.5 mL 管中预先引用的冰冷淬热缓冲器混合。
注意:混合体积和混合过程必须尽可能精确和可重复,以确保所有样品中快速实现所需的最终淬斗 pL。保持淬热缓冲冰冷将有助于尽量减少酶变性时的背部交换。 - 在淬火HDX样品后,立即将管子盖上盖子,并在液氮中闪光冻结。
- 继续收集时间点,直到完成所有检测,然后将样品转移到 -80 °C 冰柜进行存储。
注意:这可能是一个停止点。收集所有 HDX 时间点后,样品可存储在 -80 °C,直到准备好进行 LC-MS 分析。理想情况下,应在同一天对所有生化感兴趣的状态执行三倍HDX反应。至少,所有针对特定生化状态的复制 HDX 反应都应在同一天并行运行。
- 在收集所有淬火的 HDX 时间点后,将样品受受于步骤 3.3 中描述的优化自下而上的 LC-MS 工作流。以随机顺序注入 HDX 样品,样品之间有适当数量的空白,以确保任何肽的结运量都极小。
注:HDX 数据无需在 MSE 模式下收集。因此,高碰撞能量段(步骤 3.3.7.2)应从 MS 值周期中删除。这应该是对步骤 3.3 中描述的工作流程的唯一更改。 - 评估正在收集的 HDX 数据的质量。
- 确保未去除的参考样本的总离子色谱图中存在的色谱峰值同时出现在被除名的样品中(如图 3D−F)。
- 确保从参考和被除名的样品中总结出特定时间间隔的质谱显示脱硫的证据(即,在脱硫样品中将单个肽的同位素包络转移到更高的 m/z 值 [图 6])。
6. 处理高清数据
- 通过单击数据|,将 HDX 数据导入第 4.11 步创建 的 HDX 项目顶部工具栏中的 MS文件 。
- 根据需要单击 "新状态 "和 "新暴露", 以定义与分析相关的生化状态(如自由酶、酶 + 配体等)和钚暴露时间。
- 单击 "新原始" 以选择要分析的 HDX 数据文件。将适当的交换时间和生化状态分配给导入的每个原始数据文件。
注:数据可以分批导入和处理,也可以同时全部输入和处理。向项目添加数据不会撤消之前在该项目中执行的任何分析。
- 添加数据文件后,单击 "完成 "以开始数据处理。短暂延迟后,软件会询问用户是否希望在继续之前保存数据。单击 "是"。
注:初始处理可能需要长达几个小时,具体取决于分析样本的数量、最终肽列表中有多少肽(步骤 4.10)、色谱窗口的大小以及光谱采集频率。 - 如果需要,更改 配置 菜单中的处理参数以更改离子搜索参数。确保对给定项目中的所有数据使用相同的离子搜索参数。
7. HDX 数据的分析和可视化
注:完成原始数据的初始处理(第 6.2 步)后,HDX 处理软件将在所分析的每个原始数据文件中从肽列表(以步骤 4.10 生成)中找到肽。一旦列表中肽的同位素分布位于原始数据文件中,HDX 处理软件将用"棒"表示每个同位素(如 图 6C−E)。然后,用于计算特定肽棒的相对强化度,以计算相对于参考光谱的 deuterium 吸收量。虽然 HDX 处理软件在正确分配"棒"到大多数肽方面做得令人钦佩,但仍需要对 deuterium 吸收值进行大量人工策展。
- 导出两个生化状态之间的 HDX 差异数据,用于映射感兴趣的蛋白质的结构模型。
- 显示覆盖图中的兴趣差异。右键单击覆盖映射,将差异数据导出到.csv文件。通过导航到数据|导出状态 数据 (以.csv格式)主要工具栏中的 出口状态数据 。
注: 在支持信息中提供了差额数据和国家数据文件的适当格式。 - 将差异数据、状态数据和感兴趣的蛋白质的 pdb 文件导入 Deuteros28中。选择 99% 的置信区间,选择 启用总和,并处理数据。
注:必须安装在PC上才能运行德特罗斯。Deuteros 将使用数据集中的复制测量来计算每个肽的吸收数据的标准偏差。此标准偏差将用于定义重大交换的置信区间,该区间将显示在绘图上。 - 根据 PyMOL 选项,选择 出口吸收 | 导出 生成Pymol脚本,使用PyMOL软件将具有显著交换差异的区域映射到感兴趣的蛋白质的pdb结构上。
注意:使用本协议中描述的工作流程,给定肽在单个时间点显著的 deuterium 吸收差异的 99% 置信区间通常为 0.3−0.5 Da。所有交换时间点所总结的差额的 99% 置信区间通常为 0.7 −1.0 Da。
- 显示覆盖图中的兴趣差异。右键单击覆盖映射,将差异数据导出到.csv文件。通过导航到数据|导出状态 数据 (以.csv格式)主要工具栏中的 出口状态数据 。
结果
有必要评估蛋白催化消化的质量以及每组样品注射工作流程的可重复性。因此,在进行HDX-MS检测之前,必须为兴趣蛋白的蛋白分析、使用反相液相色谱和气体相离子流动性分离肽以及使用MS检测肽建立有效条件。为此目的,应首先调查感兴趣的蛋白质的参考样本(在没有贫血的情况下收集)(第3节)。图3A−C中的色谱数据显示了HalM2兰西肽合成酶三个参考样本的...
讨论
本协议中介绍的 HDX-MS 工作流程为绘制蛋白质结构动态元素的空间分布图和调查这些动力学如何因扰动(脂结合、酶突变等)而变化提供了非常强大的平台。HDX-MS 与其他通常用于研究构象动力学的结构生物学方法相比具有几个明显的优势。最值得注意的是,只需要少量的蛋白质。使用此处描述的工作流程,1 mL 1 μM 蛋白质样本为包含 5 个交换时间点的三方 HDX 反应提供了足够的材料。此外,兴趣蛋...
披露声明
我们没有什么可透露的。
致谢
这项工作得到了加拿大自然科学和工程研究理事会、魁北克自然与技术基金会、加拿大创新基金会和麦吉尔大学创业基金的支持。
材料
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| [glu-1]-fibrinopeptide B (Glu-Fib) | BioBasic | NA | |
| 0.5 mL Amicon Ultracel 10k centrifugal filtration device (Millipore) | Milipore Sigma | UFC501096 | |
| acetonitrile | Fisher | A955-1 | |
| AMP-PNP | SIGMA | A2647-25MG | |
| ATP | SIGMA | a2383-5G | |
| D2O | ALDRICH | 435767-100G | |
| formic acid | Thermo Fisher | 28905 | |
| guanidine-HCl | VWR | 97063-764 | |
| HEPES | Fisher | BP310-1 | |
| Magnesium chloride | SiGMA-Aldrich | 63068-250G | |
| Potassium chloride | BioBasic | PB0440 | |
| potassium phosphate | BioBasic | PB0445 | |
| TCEP Hydrochloride | TRC Canada | T012500 | peptide was synthesized upon request |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| software | |||
| Deuteros | Andy M C Lau, et al | version 1.08 | |
| DynamX | Waters | version 3.0 | |
| MassLynx | Waters | version 4.1 | |
| Protein Lynx Global Server (PLGS) | Waters | version 3.0.3 | |
| PyMOL | Schrödinger | version 2.2.2 | |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Instrument and equipment | |||
| ACQUITY UPLC BEH C18 analytical Column | Waters | 186002346 | |
| ACQUITY UPLC BEH C8 VanGuard Pre-column | Waters | 186003978 | |
| ACQUITY UPLC M-Class HDX System | Waters | ||
| HDX Manager | Waters | ||
| microtip pH electrode | Thermo Fisher | 13-620-291 | |
| Waters Enzymate BEH column or Pepsin solumn | Waters | 186007233 | |
| Waters Synapt G2-Si | Waters |
参考文献
- Karplus, M., McCammon, J. A. Molecular dynamics simulations of biomolecules. Nature Structural & Molecular Biology. 9 (9), 646-652 (2002).
- Campbell, E., et al. The role of protein dynamics in the evolution of new enzyme function. Nature Chemical Biology. 12 (11), 944-950 (2016).
- Tokuriki, N., Tawfik, D. S. Protein dynamism and evolvability. Science. 324 (5924), 203-207 (2009).
- Wales, T. E., Engen, J. R. Hydrogen exchange mass spectrometry for the analysis of protein dynamics. Mass Spectrometry Reviews. 25 (1), 158-170 (2006).
- Konermann, L., Pan, J., Liu, Y. H. Hydrogen exchange mass spectrometry for studying protein structure and dynamics. Chemical Society Reviews. 40 (3), 1224 (2011).
- Katta, V., Chait, B. T. Conformational changes in proteins probed by hydrogen-exchange electrospray-ionization mass spectrometry. Rapid Communications in Mass Spectrometry. 5 (4), 214 (1991).
- Zhang, Z., Smith, D. L. Determination of amide hydrogen exchange by mass spectrometry: a new tool for protein structure elucidation. Protein Science. 2 (4), 522 (1993).
- Smith, D. L., Deng, Y., Zhang, Z. Probing the non-covalent structure of proteins by amide hydrogen exchange and mass spectrometry. Journal of Mass Spectrometry. 32 (2), 135-146 (1997).
- Bai, Y., Milne, J. S., Mayne, L., Englander, S. W. Primary structure effects on peptide group hydrogen exchange. Proteins. 17 (1), 75-86 (1993).
- Xiao, K., et al. Revealing the architecture of protein complexes by an orthogonal approach combining HDXMS, CXMS, and disulfide trapping. Nature Protocols. 13 (6), 1403-1428 (2018).
- Smith, D. L., Deng, Y., Zhang, Z. Probing the non-covalent structure of proteins by amide hydrogen exchange and mass spectrometry. Journal of Mass Spectrometry. 32 (2), 135-146 (1997).
- Masson, G. R., et al. Recommendations for performing, interpreting and reporting hydrogen deuterium exchange mass spectrometry (HDX-MS) experiments. Nature Methods. 16 (7), 595-602 (2019).
- Liu, J., et al. An Efficient Site-Specific Method for Irreversible Covalent Labeling of Proteins with a Fluorophore. Scientific Reports. 5, 16883 (2015).
- Marion, D., et al. Overcoming the overlap problem in the assignment of proton NMR spectra of larger proteins by use of three-dimensional heteronuclear proton-nitrogen-15 Hartmann-Hahn-multiple quantum coherence and nuclear Overhauser-multiple quantum coherence spectroscopy: application to interleukin 1.beta. Biochemistry. 28 (15), 6150-6156 (1989).
- Balasubramaniam, D., Komives, E. A. Hydrogen-exchange mass spectrometry for the study of intrinsic disorder in proteins. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1834 (6), 1202-1209 (2013).
- Goswami, D., et al. Time window expansion for HDX analysis of an intrinsically disordered protein. Journal of the American Society for Mass Spectrometry. 24 (10), 1584-1592 (2013).
- Keppel, T. R., Howard, B. A., Weis, D. D. Mapping Unstructured Regions and Synergistic Folding in Intrinsically Disordered Proteins with Amide H/D Exchange Mass Spectrometry. Biochemistry. 50 (40), 8722-8732 (2011).
- Mitchell, J. L., et al. Functional Characterization and Conformational Analysis of the Herpesvirus saimiri Tip-C484 Protein. Journal of Molecular Biology. 366 (4), 1282-1293 (2007).
- Pan, J., Han, J., Borchers, C. H., Konermann, L. Hydrogen/deuterium exchange mass spectrometry with top-down electron capture dissociation for characterizing structural transitions of a 17 kDa protein. Journal of the American Chemical Society. 131 (35), 12801-12808 (2009).
- Habibi, Y., Uggowitzer, K. A., Issak, H., Thibodeaux, C. J. Insights into the Dynamic Structural Properties of a Lanthipeptide Synthetase using Hydrogen-Deuterium Exchange Mass Spectrometry. Journal of the American Chemical Society. 141 (37), 14661-14672 (2019).
- Hebling, C. M., et al. Conformational analysis of membrane proteins in phospholipid bilayer nanodiscs by hydrogen exchange mass spectrometry. Analytical Chemistry. 82 (13), 5415-5419 (2010).
- Duc, N. M., et al. Effective application of bicelles for conformational analysis of G protein-coupled receptors by hydrogen/deuterium exchange mass spectrometry. Journal of the American Society for Mass Spectrometry. 26 (5), 808-817 (2015).
- Canul-Tec, J. C., et al. Structure and allosteric inhibition of excitatory amino acid transporter 1. Nature. 544 (7651), 446-451 (2017).
- Reading, E., et al. Interrogating Membrane Protein Conformational Dynamics within Native Lipid Compositions. Angewandte Chemie International Edition. 56 (49), 15654-15657 (2017).
- Hentze, N., Mayer, M. P. Analyzing protein dynamics using hydrogen exchange mass spectrometry. Journal of Visualized Experiments. (81), e50839 (2013).
- Lento, C., et al. Time-resolved ElectroSpray Ionization Hydrogen-deuterium Exchange Mass Spectrometry for Studying Protein Structure and Dynamics. Journal of Visualized Experiments. (122), e55464 (2017).
- Schowen, K. B., Schowen, R. L. Solvent isotope effects on enzyme systems. Methods in Enzymology. 87, 551-606 (1982).
- Lau, A. M. C., Ahdash, Z., Martens, C., Politis, A. Deuteros: software for rapid analysis and visualization of data from differential hydrogen deuterium exchange-mass spectrometry. Bioinformatics. 35 (7), 3171-3173 (2019).
- Houde, D., Berkowitz, S. A., Engen, J. R. The utility of hydrogen/deuterium exchange mass spectrometry in biopharmaceutical comparability studies. Journal of Pharmaceutical Sciences. 100 (6), 2071 (2011).
- Burkitt, W., O'Connor, G. Assessment of the repeatability and reproducibility of hydrogen/deuterium exchange mass spectrometry measurements. Rapid Communications in Mass Spectrometry. 22 (23), 3893-3901 (2008).
- Rob, T., Gill, P. K., Golemi-Kotra, D., Wilson, D. J. An electrospray ms-coupled microfluidic device for sub-second hydrogen/deuterium exchange pulse-labelling reveals allosteric effects in enzyme inhibition. Lab on a Chip. 13, 2528-2532 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。