Method Article
使用 iDISCO + 和光片荧光显微镜对脊椎淋巴血管和+排水进行三维成像
摘要
提出了一种将组织清除与光片荧光显微镜 (LSFM) 相结合的协议,以获得收集脑脊液 (CSF) 和脊柱硬膜外液的淋巴血管和淋巴结 (LNs) 的三维和细胞分辨率图像。
摘要
与中枢神经系统 (CNS) 相关的淋巴系统包括围绕大脑、脊髓及其相关 LNs 旋转的淋巴血管。与CNS相关的淋巴系统参与CSF大分子和脑膜免疫细胞的排水,以向中枢神经系统排水的LN,从而调节中枢神经系统组织内的废物清除和免疫监测。呈现是一种新方法,可获取中枢机相关淋巴的三维(3D)和细胞分辨率图像,同时保持其周围组织内回路的完整性。iDISCO®协议用于免疫标记淋巴血管在分体和清除整个安装制剂的椎柱,随后用光片荧光显微镜 (LSFM) 成像。该技术揭示了淋巴网络的3D结构,将脊髓周围的脑膜和硬膜外空间与椎外淋巴血管连接。提供以前通过西斯特纳磁石或胸椎脊柱膜注入CSF的分子示踪剂的3D图像。iDISCO+/LSFM方法为探索中枢神经系统在神经血管生物学、神经免疫学、脑癌和椎癌、椎骨和关节生物学中的结构和功能带来了前所未有的机遇。+
引言
CNS 被 CSF 包围,覆盖着脑膜、硬膜外组织和骨骼层。总之,CSF为软脑和脊髓提供身体保护。它主要由胆结丛和脑膜(即皮娅母体、气管和杜拉母体)分泌。CSF脑膜复合体还建立了中枢组织和身体其他部位之间的功能接口,从而有助于中枢平衡。首先,CSF通过CNS副动脉空间穿透CNS,并通过淋巴(胶质淋巴)系统与间质流体(ISF)1动态相互作用,该系统由半血管空间和中枢神经系统周围2、3、4,3的星形细胞端脚,膜组成。代谢废物和多余的液体,然后最终清除通过内部血管内排水直接从脑膜瘤到系统循环3,以及准静脉空间向CSF和通过脑排淋巴血管,根据淋巴模型2,4。42CSF流出主要是通过淋巴系统,通过颅骨板和相关颅外淋巴血管5,6,7,6,以及5通过脑膜淋巴血管,其中收敛在脑力流失的LNs 8,9,10,11,12(,9,10,11,12图1)。7在CSF流出中,一个重要,虽然次要,角色是由颅气管,它穿透脑膜静脉鼻窦13的乳腺。
CFS排水电路已通过实验方法广泛研究,基于注射彩色/荧光示踪剂到中枢或CSF,随后在注射13后的不同时间点对中枢系统内和整个身体器官和组织进行成像。长期以来,CSF的外流被认为是完全由血液循环直接负责的,通过阿拉奇诺德维利投射到硬静脉鼻窦13。然而,CSF流出主要是由淋巴血管进行,最近近红外(NIR)动态成像CSF注射的示踪仪在小鼠9,10。109CSF排空淋巴血管,然后通过右亚克拉维安静脉将淋巴返回血液。补充性表检已经检测到颅外6,7,13,7,13和颅内9,10,11,12,10,11淋巴出口CSF注射的示踪,并建议CSF被两个淋巴通路吸收,一个外部,另一个在头骨和椎柱的内部。,12CSF排水的主要部分迅速发生通过淋巴血管位于玫瑰,在鼻粘膜的头骨外,通过通道的三叶草骨3,6,13,6,和,从口头上,通过尚未完全定性的7,14,14的淋巴脊道外。此外,在头骨的脑膜,杜拉母体直接吸收CSF和脑膜免疫细胞到支形淋巴收集器,穿过头骨,连接到CNS排水的LNs12,14。12,14这些脑膜淋巴血管在中枢神经系统病理生理学中扮演着重要角色,因为脑脑脑膜淋巴在老化时改变,也影响神经性脑疾病的结果,包括神经退化、神经炎和脑癌15、16、17。15,16,17因此,与CNS相关的淋巴血管(即排出CSF的硬部和周围淋巴血管)可能是对抗人类中枢神经系统疾病的有希望的新目标。
与免疫希学和高分辨率磁共振成像进行的融合研究表明,脑膜淋巴血管也存在于灵长类动物中,包括常见的马莫塞特猴子和人类7,11,13。,137,此外,脑膜淋巴血管不限于头骨,而是延伸到椎柱内到脊髓神经和拉米13,18,的表面。椎柱淋巴的三维(3D)成像,保留了标记的椎骨和脊柱样本的整体解剖,包括上部骨骼,肌肉,韧带,以及邻近的内脏组织,最近进行了14。iDISCO+ 协议 19,20用于免疫贴分分,清除整个椎柱的制剂与淋巴特异性抗体对膜受体 LYVE121 或转录因子 PROX122。然后使用光片荧光显微镜 (LSFM) 和 Imaris 软件进行图像采集和分析。LSFM允许通过照明的轴向限制对大型试样进行快速和微创的3D成像,从而减少光漂白和光毒性23。
iDISCO+/LSFM 方法允许对硬膜和硬膜外淋巴血管的不同层进行表征,以及此血管与椎外淋巴回路和椎柱相邻的 LNs 的连接。该协议适用于以前注射荧光示踪剂的组织,以证明椎道排水。本文详细介绍了 iDISCO+/LSFM 成像椎骨淋巴血管的方法,并说明了其与 CSF 和硬膜外流体排水研究的相关性。
研究方案
本研究中使用的所有体内程序均符合欧洲共同体实验动物使用指南(L358-86/609EEC)对动物试验和研究的所有相关伦理规定。该研究得到了INSERM伦理委员会(n=2016111126651)和ICM机构动物护理和使用委员会(Cerveau和Moelle-moelleépineinstitute)的道德批准。
1. 准备
- 准备手术的以下解剖工具:手术刀(1)、微力(2)、钳子(1)、解剖剪刀和米歇尔缝合夹。准备 26 G 针(0.45 毫米 x 13 毫米)、1 mL 注射器和 10 μL 微丝环。
- 在 67.5 °C 下用玻璃微移子拉拔器使用单步协议拉动微胶囊。每个注射准备两个微胶囊。
- 准备用于成像淋巴排水的试剂(表1):椭圆形溴亚历克萨氟555结合(OVA-A 555,2mg/mL在1x磷酸盐缓冲盐水[PBS])和抗LYVE1抗体(1毫克/mL在1xPBS)。555
- 为 iDISCO + 准备抗体 (表1) 。+对于原抗体,使用抗LYVE1兔多克隆抗体(1:1,600)和抗PROX1山羊多克隆IgG抗体(1:2,000)。对于二级抗体,使用亚历克萨氟尔驴抗兔-568,驴抗兔子-647,和驴抗山羊-647(1:2,000)。
2. 西斯特纳磁石 (ICM) 和thlb 注射的手术程序
- 动物手术的准备
- 使用成年男性和女性C57BL6/J小鼠,8~12周大。
- 用0.015毫克/mL丁丙诺啡溶液将小鼠注射内,在0.1毫克/千克、手术前15分钟稀释0.9%氯化钠。
- 用 2~3% 异氟气体在感应盒中麻醉鼠标。
- 麻醉动物的追踪剂注射准备
- 将麻醉鼠标及其加热垫放在立体仪器上。使用耳杆握住小鼠头部,以 [135° 角将身体与头部保持一定,或使用脊髓适配器将脊髓固定在 ThLb 椎骨水平 (Th12-L1) 上。用力捏尾巴或爪子,检查麻醉效率。
- 注射 IP 200 μL 0.9% 氯化钠用于小鼠水化。
- 使用手术刀刀片,做一个皮肤切口,要么在腹膜区域朝宫颈区域进行ICM注射,或在ThLb椎骨水平(Th10-L3)注射到ThLb脊柱膜瘤。
- 跟踪器喷射
- 丢弃覆盖颈部和柱的副曲和副脊髓肌肉,以可视化杜拉母体的表面,即脑垂体最外层的表面。
- 小心地将杜拉母体的中心区域进行双缝化,用 26 G 针在底上打磨。
- 微胶囊植入
- 切割 2 mm 的玻璃毛细管尖端(参见步骤 1.2),然后使用连接到连接到 10 μL 注射器的管的微胶囊,对 OVA-A555 或 LYVE1 抗体吸气 2+8 μL。
- 在 Dura 母体中射区以 30° 角引入 ICM 注射或 10° ThLb 脊柱注射的微胶囊,并推入 dura 母体以下 1.5 mm。
注:韧带被刺穿,但未进行拉明切除术。 - 加入10μL的手术胶,关闭玻璃毛细管周围的切口,等待其干燥。
- 以1μL/分钟缓慢注入荧光示踪剂。喷射量一次,保持毛细管就位 1 分钟。缩回微胶囊并添加手术胶以关闭注射孔。
- 注射后,用缝合夹关闭皮肤切口。将鼠标从立体热装置上取下,并将其放在37°C的外科后加热室中,直到其恢复。
3. 灌注和组织解剖
- 在CSF示踪剂注射后15分钟或45分钟,注射IP致命剂量(100μL)五巴比妥钠。捏尾巴或爪子,以验证没有反射。
- 用解剖剪刀,切开皮肤,打开腹腔层,从下腹部区域朝胸笼。用剪刀打开胸笼,进入心脏。
- 将 26 G 针插入心脏左心室,并在 2 mL/min 的 1x PBS 中用 20 mL 的冰冷 4% 半甲醛 (PFA) 开始穿行。使用剪刀快速切割右中庭并释放灌注液流。
- 用钳子完全去除皮肤,用剪刀割断四条腿。取出所有内脏器官,但要小心保持LNs完好无损。
注意:曼迪布拉LNs是肤浅的,所以在切断皮肤时注意不要去除它们。深颈LNS(dcLNs)位于气管的每一侧,与内颈静脉的侧表面接触,靠近立体肌。 - 切开肋骨以切除椎柱,脊髓内侧从颈椎到腰部部分。
- 将解剖组织浸入冰冷 4% PFA 中 1x PBS 中,在 50 mL 管中过夜(±18 h),温度为 4 °C。 将固定组织在 50 mL 的 1x PBS 中清洗 3 倍,5 分钟。
4. 椎段荧光镜
- 用相机将样品置于荧光立体动物园显微镜下(材料表)。概述示例或缩放特定区域。
5. 整个安装免疫污的样品制备
- 使用微切刀,横向切割头椎柱在腹椎和宫颈水平。
注:此解剖允许头部和颈椎区域与椎柱的其余部分隔离。 - 用微切刀片,将椎柱的颈椎、胸椎和囊区横向切成2~4个椎骨段,各约0.5厘米大小。
- 按与椎轴分离的顺序,沿着椎柱的整个颈椎和胸腔区域分离。将每个样品放在 2 mL 1x PBS 的管中。
6.iDISCO = 椎段的整个安装免疫
注:iDISCO + 协议的详细说明 可在http://www.idisco.info。
- 第1天:组织脱水
- 脱水椎组织样本(即椎段)连续浸入20%、40%、60%、80%和100%甲醇,在1x PBS中搅拌1小时。
- 在室温(RT)下,在33%甲醇/66%二氯甲烷(DCM)溶液中孵育样品过夜。
- 第2天:组织漂白
- 在RT.用100%甲醇将样品洗涤2x,在4°C下将样品在5%H2O2 中孵育为甲醇(30%H2O2 和甲醇1:5 v/v)。
- 第3天:脱钙和渗透步骤
- 在80%、60%、40%、20%甲醇中逐渐补充样品,然后在RT中用1x PBS(每个溶液1小时)搅拌。
- 在RT中通过孵育样品(柠檬酸10%和45%甲酸1:1 v/v)30分钟来保存骨骼结构,使椎骨分块分块。
- 用 1x PBS 冲洗样品 2x,在 PTx2 溶液中孵育 2x 1 小时(1x PBS 中的 0.2% Triton X-100,更新进行第二次孵育)在 RT 中搅拌。然后在渗透溶液中孵育预处理样品(PTx2,20%二甲基硫化物[DMSO]和2.3%w/v甘氨酸)24小时。
- 第 4 天:阻止步骤
- 在37°C下孵育样品(PTx2,6%驴血清和10%DMSO),24小时。
- 第5~16天:全安装免疫标记
- 在PTwH中稀释的原抗体中孵育样品(1x PBS含有0.2%Tween-20和0.1%肝素,在1xPBS中为10mg/mL),在37°C下稀释5%DMSO/3%驴血清6天。在RT的PTWH中清洗样品4~5倍,并搅拌过夜。
- 在PTwH的二次抗体稀释中孵育样品,在37°C下用3%驴血清孵育样品4天。在清理前,在RT中用PTW 4~5x清洗样品。在搅拌下,在搅拌下清洗样品。
- 第 17 天和第 18 天: idisco+ 组织清除
- 通过连续浸入 1x PBS,然后 20%、40%、60%、80% 和 2x 在 100% 甲醇中(每个溶液中 1 小时)中逐渐脱水样品。在33%甲醇/66%DCM溶液中孵育每个样品过夜。
- 在 100% DCM 中清洗 2x 15 分钟以去除甲醇。在二苯醚 (DBE) 中孵育, 直到清除 (4 小时) 不摇晃, 然后在成像前储存在 Rt 的 Dbe 中。
7. LSFM 成像
- 使用 LSFM 配备 4x/0.3 目标时,在横向平面上清除图像样本。
- 使用单面三张照明配置,固定 x 位置(无动态对焦)。使用调谐到 561 nm、100 mW 的 LED 激光器;和 639 纳米,70 mW。将光片数值光圈设置为 30%。
- 使用不同的发射过滤器:595/40 用于 Alexa Fluor-568 或 -555,使用 -680/30 表示 Alexa Fluor-647。
- 用 DBE 填充显微镜室。
- 与相机一起每步曝光 2.5 μm z 步数和 30 ms 曝光时间(材质表 ) 的 Aquire堆栈使用 x2 光学变焦可有效放大 (x8)、0.8 μm/像素,并在整帧上以 10% 的重叠执行镶嵌采集。
- 使用采集软件获取 .tif 格式的图像,然后使用文件转换软件将其转换为 3D 格式。
- 用拼接器软件(材料表)重建马赛克采集。打开图像并手动移动以重新构成整个镶嵌图像,使用图像之间的 10% 重叠作为参考线。
- 使用 3D 软件(材料表)生成数据的正交投影, 如图 1所示, 图 2,图 3和 图 4,并添加颜色代码属性到显示的淋巴血管和其他解剖结构。根据制造商的说明,将 Gamma 校正设置为 1.47,以从 LSFM 获得的原始数据。
结果
椎间淋巴血管的三D成像
图 1显示了 iDISCO+/LSFM 程序的步骤和 iDISCO + 治疗的 ThLb 椎骨血管+内淋巴回路的 LSFM 图像。iDISCO ®与LSFM 的组合保留了椎骨解剖结构,并捕获了周围骨骼、韧带、肌肉和神经神经神经神经神经神经神经神经内淋巴血管网络(即与从椎体体中侧身和横向退出的椎外血管相连的椎内血管) 的视图。
直流排水的荧光大显微镜成像
为了在中枢神经系统中成像大分子排水,大分子示踪器通过注射到CSF或脊柱膜瘤中,在体内进行管理。大分子示踪器可以很容易地传递到CSF在西斯特纳磁石。西斯特纳磁石位于小脑和梅杜拉长方形的后表面之间,在前卫巨无霸之上。大分子示踪剂也可以通过椎柱上不同级别的立体定向手术注射到脊柱膜中。
使用的大分子示踪剂要么直接标有荧光团,要么通过具有特定抗体的免疫组织化学检测后。图2A说明了跟踪OVA-A555的实验计划,这是一种红色荧光和小分子量示踪剂(约45kDa),被注射到CSF(图2B)或脊髓的ThLb区域(图2C)。
在大分子示踪剂注射后45分钟,小鼠被牺牲,与4%的PFA融合,并处理分离被解剖的头部脑干区和椎柱的解剖部分,这些片段被解剖和澄清。然后,通过收集CSF和硬膜外液体的LNs的荧光大显微镜成像,可以轻松评估大分子排水。如图 2 所示,OVA-A555 注射到脊髓的 CSF(图 2B)或 ThLb(图 2C)区域,导致 OVA-A555 在注射后 45 分钟积聚到 dcLNs 中。该观察表明淋巴系统吸收和排水荧光示踪剂;这是进行 iDISCO +/LSFM 程序之前的前提条件, 以成像椎骨淋巴排水。
椎间淋巴系统大分子排水的三D成像
基于在DCLAN中检测OVA-A555 标签,iDISCO+/LSFM程序可应用于从OVA-A555注射小鼠中分离的脱酸和预清除椎骨样本。这种方法允许在示踪剂注射后的特定时间点创建CSF和脊柱硬膜外液体淋巴排水的3D图。这种 3D 映射可以通过从注射点对椎柱各级别的连续 CNS 段进行成像。
图3A显示了OVA-A555注射到ThLb脊柱膜瘤的实验设计,以及由此产生的OVA-A555分布在颈椎和胸椎部分的3D模式,以及淋巴血管。在OVA-A555注射后45分钟,在脊髓组织和直流(图3B中的白色箭头)中检测到OVA-A555积累,与图2所示的显微镜观察一致。然而,在标有抗LYVE1抗体的宫颈和胸腔淋巴血管中未检测到。椎骨淋巴血管中缺乏CSF注射的示踪剂可能是由于淋巴血管内示踪剂的持久性短或淋巴血管缺乏对示踪剂的吸收(图3C)。
为了验证第一个假设,兔子抗LYVE1抗体被用作淋巴内皮细胞标签,以结合CNS相关淋巴血管。随后,注射的兔子抗LYVE1抗体被免疫组织化学检测出具有抗兔的二级抗体,而淋巴内皮细胞则被免疫标记与抗PROX1抗体。图 4表示将抗 LYVE1 注射到 ThLb 脊柱膜瘤(图4A)的实验设计,以及靠近注射部位的 ThLb 段中 LYVE1 抗体的 3D 分布模式(图+4B)。椎骨淋巴及其外椎淋巴连接均被注射的抗LYVE1抗体标记,这证实了椎间淋巴血管的示踪剂吸收和淋巴向椎外淋巴系统的排泄。THLb 区域中缺少 LN,因此无法在图像段中可视化。此外,沿淋巴血管观察到的LYVE1标记的不连续模式可能反映了LYVE1在淋巴血管中的不连续表达,如前面的研究14,21,所报告。总之,本研究的结果表明,在示踪剂注射后45分钟,LYVE1抗体,但不是OVA-A555,允许检测局部椎淋巴吸收,比OVA-A555更可作为局部椎间淋巴排水的持久标记。
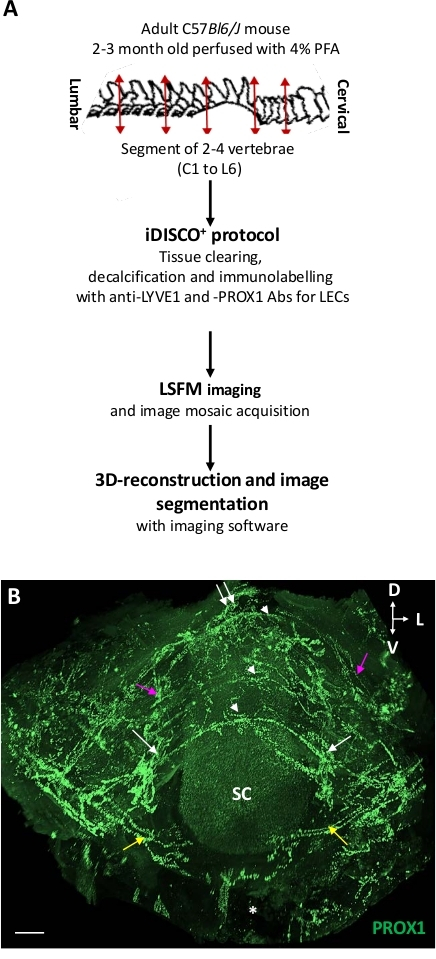
图1:椎骨淋巴血管的三维视图。(A) 协议的示意图。(B) 从前额视角对ThLb椎淋巴血管的3D视图进行平面投影。使用 iDISCO ® 协议,用抗 PROX1 抗体(绿色)进行免疫标记,+然后由 LSFM 成像。请注意三个连续椎骨(白色箭头)的椎道内血管的代谢样形态。除了半圆形后体(白色箭头)外,每个椎网还包括腹角分支(黄色箭头)、沿着脊柱拉米和甘拉利亚(白色箭头)的双边横向出口路径,以及中线处的后向出口路线(白色双箭头)。脊椎网与纵向容器(紫色箭头)相互连接。有关完整描述,请参阅 Jacob L. 等人18 SC = 脊髓;星号 = 腹椎体;D = 后L = 横向;V = 腹体;比例线 = 300 μm.请单击此处查看此图的较大版本。
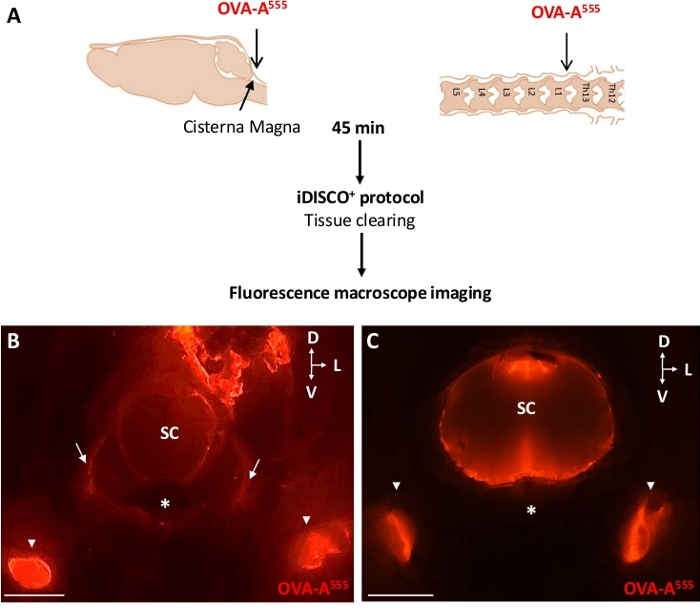
图2:dcLNs收集OVA-A555标记的CSF流体。(A) 实验设计方案.OVA-A555被注射到 ICM 或 ThLb 脊柱膜瘤中,然后小鼠在注射后 45 分钟被牺牲。通过荧光微镜成像(B、C)对样品进行清除和观察。从ICM-(B)和ThLb-(C)注射小鼠的颈椎B的荧光宏观镜图像。请注意,OVA-A555积聚在直流神经(B、C、白箭头)、颈椎和准血管空间(B、C)和ICM注射后,在C腹体出口路径上,可能沿颈神经(B、白箭)。CSC = 脊髓。星号 = 腹椎体;D = 后L = 横向;V = 腹体;B和C = 2 mm 中的缩放条。请单击此处查看此图的较大版本。
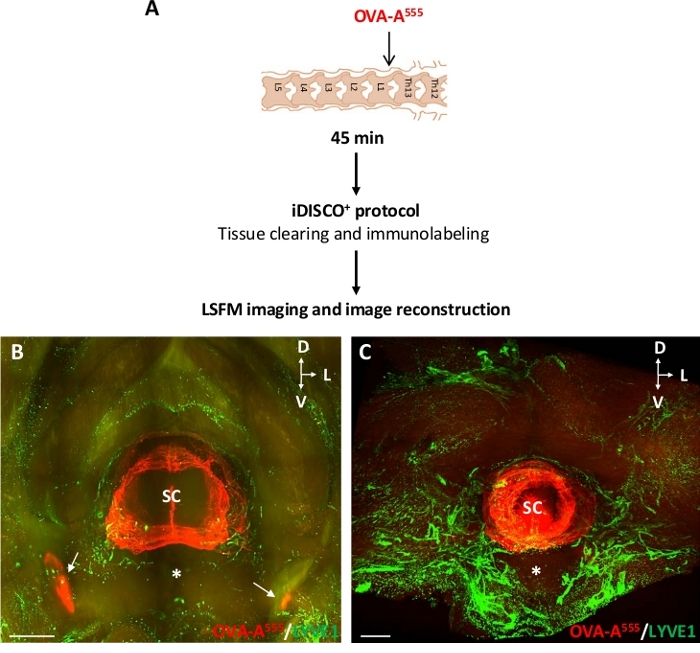
图3:在椎骨淋巴系统中检测OVA-A555标记的CSF液体。(A) 实验设计方案.OVA-A555 被注射到 ThLb 脊柱膜瘤中,然后小鼠在注射后 45 分钟被牺牲。这些样品使用 iDISCO+ 协议进行 处理,并用 LSFM 进行成像。(B,C)LSFM捕获的颈椎(B) 和胸椎 ( C ) 部分的正面3D视图的平面投影。OVA-A555 积累(红色)在脊髓组织和直流(B,白箭头)中检测到, 如图2所示,但在宫颈和胸腔淋巴血管免疫中未检测到,这里标记了抗LYVE1抗体(绿色)。SC = 脊髓;星号 = 腹椎体;D = 后L = 横向;V = 腹体;比例线 = 1 mm (B), 300 μm (C) 。 请单击此处查看此图的较大版本。
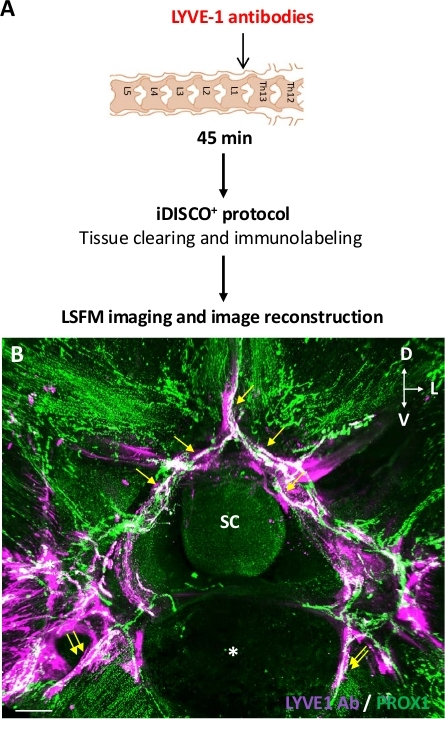
图4:在脊柱注射抗LYVE1抗体后发现椎骨淋巴引流。(A) 实验设计方案.抗LYVE1抗体被注射到ThLb脊柱膜瘤中,然后小鼠在注射45分钟后被牺牲。这些样品使用 iDISCO+ 协议进行 处理,并用 LSFM 进行成像。(B) 用 LSFM 捕获的 ThLb (B) 脊柱段正面 3D 视图的平面投影。抗 LYVE1 抗体检测与抗兔子抗体 (紫色) 和淋巴血管与抗 PROX1 抗体 (绿色).白色血管是PROX1+ 淋巴用抗LYVE1抗体(B);这些包括椎骨(黄色箭头)和椎外(双黄箭头)淋巴。SC = 脊髓;星号 = 腹椎体;D = 后L = 横向;V = 腹体;比例线 = 300 μm (B). 请单击此处查看此图的较大版本。
| 试剂 | 目标 | 图 | 协议步骤 | 评论 |
| OVA-A555 | CSF 跟踪器 | 图 2 和图 3 | 2. ICM 或 ThLb 注射 7. LSFM 成像。 | 水溶性强,易注射,高强荧光 |
| 抗 Lyve1 抗体 | LVs细胞的膜标记 | 图3 | 6. idisco® 整个安装 immnunostain 。 7. LSFM 成像。 | 对整个坐骑的高效抗体 |
| 硬膜外 LV 的跟踪排水 | 图4 | 2. ICM 或 ThLb 注射 6. idisco® 整个安装 immnunostain 7. LSFM 成像 | ||
| 抗 Prox1 抗体 | LVs细胞的核标记 | 图 1 和图 4 | 6. idisco® 整个安装 immnunostain 7. LSFM 成像 | 对整个坐骑的高效抗体 |
表1:研究中使用的抗体和示踪剂。
| 问题 | 可能的原因 | 解决 方案 | |
| 示踪剂注射手术 | 不想要的 CNS 组织病变 | 1. 玻璃毛细管插入缺乏控制 2. 玻璃毛细管插入深度不正确 | 1. 小心, 但完全, 在玻璃毛细管插入之前, 用 26 G 针的 dura 母体。 2. 降低玻璃毛细管插入的深度(<1.5 毫米从杜拉母体)。 3. 减少玻璃毛细管直径。 |
| 注射示踪剂进入硬膜外或椎外空间的有害污秽 | 跟踪器注入不正确 | 1. 检查玻璃微毛细管是否很好地插入了杜拉母体。 2. 在注射示踪剂之前,在玻璃微胶囊和周围组织之间添加手术胶。 | |
| 注入的示踪剂体积过大 | 减少注入的示踪剂的体积(<2 μL)。 | ||
| iDISCO® 免疫污染 | 组织内标签的缺失、异质性或过度背景 | 1. 原抗体浓度问题 2. 渗透不足 3. 洗涤不足 4. 清除不足 | 增加孵化步骤的数量和/或时间:渗透、黄体、原抗体和清除。请参阅http://www.idisco.info(常见问题解答和故障排除)。 |
| 去钙化不足 | 使用 EDTA21 或 Morse 溶液对头部组织使用更严格的脱钙处理。 | ||
| idisco® 结算 | 样品是不透明的或棕色的 | 漂白不足 | 使用新鲜的H2O2 溶液,增加体积和/或孵育时间。 |
| 氧化的存在 | 完全填充管子,以避免空气的存在。 | ||
| 清除不足 | 增加体积和/或孵育时间。请参阅http://www.idisco.info(常见问题解答和故障排除)。 | ||
| 跟踪器检测 | 无法检测到的跟踪器 | 所选跟踪器组合不正确 | 亚历克萨 555、 594 和,647 氟化物对 iDISCO® 协议 5、6、7、8、9、105,6,7,89具有抗药性。然而,FITC、GFP、RFP 氟化物的情况并非如此。 |
| 注射后牺牲时间点 | 首选 OVA-A555 用于局部椎骨淋巴的短期(15 分钟)排水分析。对于淋巴结排水分析,OVA-A555 和 Lyve1 抗体可用于长期(>45 分钟)分析。 | ||
| 成像:捕获和分析 | 淋巴回路的捕获图像不令人满意 | 解剖问题(淋巴结缺失) | 根据要图像的淋巴回路,在解剖样本中仔细包括椎骨/头骨相邻组织。 |
| 成像问题 | 1. 修改LSFM的采集参数:激光强度、光片数值孔径、光片厚度、展示时间。 2. 将样品放在支撑处,以减少光穿过组织的路径,直到目标。 3. 在采集过程中,确保组织样品内没有气泡。 |
表 2:协议每个步骤的故障排除建议,包括可能的问题和解决方案。
讨论
iDISCO+/LSFM 协议在细胞分辨率水平上提供其周围组织内 CNS 相关淋巴网络前所未有的 3D 视图。由于LSFM光学系统的局限性、工作距离的缩短以及高分辨率显微镜23商用物镜的较大尺寸,本协议很好地适应了中等尺寸的样品,而不是1.5厘米3。这种限制阻止捕获整个大脑相关的淋巴系统。需要注意的是,调查区域必须谨慎划定,必须仔细解剖中枢和周围组织,以便包括有助于整个淋巴电路的颅外淋巴血管和LN(表2)。
除了大小和解剖考虑外,周围间质组织的复杂性沿头骨和椎柱变化,这需要适应脱钙和预清治疗,以获得均匀的样本澄清,并允许光束在软等向异性生物组织内传播。在没有骨骼的情况下,大脑或脊髓组织的LFSM成像不需要脱钙步骤,所捕获图像的最终分辨率是最佳的19。上述协议,包括与莫尔斯溶液的轻度脱钙步骤,已很好地适应椎柱的LSFM成像,如图1和图4所示。相比之下,颈部区域显示一个特别复杂的骨骼解剖,除了多层肌肉、脂肪和腺体组织,这降低了捕获的LSFM图像的质量,如图3B所示。因此,通过更严格的组织治疗,可以改善颈部和颈椎区域的LSFM成像;例如,与 EDTA,如前面报告24。因此,脱钙步骤至关重要,在开始完整的 iDISCO ® 协议之前,必须先对使用的每个抗体进行脱钙条件测试(表2) 。
虽然 iDISCO=/LSFM 协议允许生成连接门膜和硬膜外空间和相关 LNs 之间的电路的 3D 视图, LSFM捕获的图像对淋巴血管的直接定量分析不可行,原因如下:1)由于淋巴标记表达的不连续模式,淋巴血管电路的划定不可靠,因为膜脑膜LYVE1是异源分布的21,PROX1具有核表达模式22;2) 抗体的异质渗透,以及由于不完全和异质脱钙和预清除而可能持续在生物组织中的各向异性。因此,LSFM成像需要通过虚拟现实工具进行扩展,这些工具可实现交互式可视化,从而促进淋巴血管(www.syglass.io)。值得注意的是,CNS相关电路的精确描述需要备份LSFM信息与通过传统免疫标记获得的高分辨率共生数据在薄(5~10μm)低温(5~10μm)低温或石蜡嵌入组织部分,特别是精确定位淋巴血管的位置与杜拉母体和CSF,如前面报道的11,14,18。,14,18
iDISCO=/LSFM 协议允许对 CNS 相关淋巴系统中的大分子排水进行三维可视化,如图3 和图4 所示。然而,淋巴排水功能评估要求,除了上面详细说明的 iDISCO+/LSFM 协议的建议外,还需要遵循严格的程序,因为最终结果取决于注射手术的质量、分娩地点的选择、使用的大分子标记的类型和注射量,以及追踪器管理后牺牲的时间(表2)。. 由于注射动物之间的示踪模式的变化,淋巴排水回路的表征需要大型实验组(按注射条件计算>10)。在提出的协议中,1) 注射前必须刺穿杜拉母体,以防止不必要的病变和渗透到中枢母体组织中;2) 注射体积必须小于2μL,以限制不必要的扩散通过注射孔,沿注射毛细管,进入硬膜外空间或椎外组织;3) 注射毛细管插入的深度必须限制在杜拉母体以下 2 mm 以下,以避免在 ICM 和中芯注射中分别出现 CNS 伤害或目标错误。另请注意,如上所示,需要对邻近的椎段进行补充性高分辨率共合分析,以评估淋巴血管内是否存在注射的示踪剂。此分析需要建立标记标记淋巴血管横截面的示踪图和淋巴标记的强度剖面图。这种方法以前用于证明 OVA555在注射后 15 分钟内被 ThLb 淋巴细胞吸收(Jacob 等人中的辅助图 5F)。14然而,本研究中尚未说明抗LYVE1示踪剂(图4)。
在可能的CSF示踪剂中,OVA-A555是一个很好的选择,因为它耐受 iDISCO®协议处理,并保持 LSFM 成像的高荧光。但是,请注意,跟踪器的类型必须根据分析时间点(表1 和表2)选择。如上所述,注射14后15分钟观察到局部椎间淋巴血管的OVA-A555标签。然而,与抗LYVE1抗体(图4 )相比,这些局部淋巴回路中不再检测到OVA-A 555(图3)。555
总之,iDISCO+/LSFM协议非常适用于研究中枢神经系统在生理和病理条件下的三D结构和排水,如中枢神经系统和椎柱癌,或椎骨和关节疾病。虽然整个程序很长,需要方法严谨,但它在使用虚拟现实工具和高分辨率共声成像进行互补分析时提供了有价值且独特的信息。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了国家医学研究所的支持, 国家 Recherche (ANR-17-CE14-0005-03),Cerveau(FRC 2017),卡诺特成熟(至L.J.),里约热内卢联邦大学(UFRJ代表J.B.)、NIH(R01EB016629-01)和耶鲁医学院。我们承认ICM平台:用于细胞成像的ICM-QUANT和用于免疫组织化学的ICM-HISics。所有动物工作都在PHENO-ICMice设施进行。核心得到2个"投资"(ANR-10-IAIHU-06和NR-11-INBS-0011-NeurATRIS)和"梅迪卡莱基金会"的支持。我们感谢尼古拉斯·雷尼尔的方法论建议和手稿阅读。
材料
| Name | Company | Catalog Number | Comments |
| Consumables | |||
| Centrifuge tubes: 0.2ml | Eppendorf | 30124359 | |
| Centrifuge tubes: 2ml | Eppendorf | 30120094 | |
| Conical centrifuge tubes: 15ml | Falcon | 352096 | |
| Conical centrifuge tubes: 50ml | Falcon | 352070 | |
| Microtome blade 80mm | Microm Microtech France | F/MM35P | |
| Needles 26G (0.45x13 mm) | Terumo | AN*2613R1 | |
| Syringe 1ml | Terumo | SS+01H1 | |
| Microscopes and imaging softwares | |||
| AxioZoom.V16 fluorescence stereo zoom microscope, equipped with an ORCA-Flash 4.0 digital sCMOS camera (Hamamatsu Photonics) or an OptiMOS sCMOS camera | Zeiss | ||
| Imspector Microscope controller software, Version v144 (acquisiton software) | Abberior instruments | ||
| Imaris File Converter x64 9.2.0(file convertion software) , Imaris stitcher software 9.2.0 (stitcher software), Imaris x64 9.2.0 (3D software) | OXFORD instruments | ||
| LED lasers (OBIS) LVBT Laser module 2nd generayion | COHERENT | ||
| Ultramicroscope II equipped with a sCMOS camera (Andor Neo) and a 4 × /0.3 objective lens (LVMI-Fluor WD6) | LaVision Biotec | ||
| Reagents | |||
| Alexa Fluor 568 Donkey anti Rabbit | Thermo Fisher | A10042 | |
| Alexa Fluor 647 Donkey anti goat | Jackson ImmunoResearch | 705-605-147 | |
| Alexa Fluor 647 Donkey anti Rabbit | Jackson ImmunoResearch | 711-605-152 | |
| Anti-LYVE1 polyclonal antibody | Angiobio | #11-034 | |
| Anti-PROX1 goat polyclonal IgG antibody | R&D systems | #AF2727 | |
| Buprenorphine Injection Ampoules (Buprecare solution, 0.3mg/ml) | Animalcare | Ampule 1ml | |
| Dibenzyl Ether 100% (DBE) | Sigma Aldrich | 108014 | |
| Dichloromethane 100% (DCM) | Sigma Aldrich | 270997 | |
| Formic acid 99% | CARLO ERBA | 405793 | |
| Glycine | Sigma Aldrich | G.7126 | |
| Heparine sodium salt from porcine | Sigma Aldrich | H4784 | |
| Hydrogen peroxide solution (H2O2 30%) | Sigma Aldrich | H1009 | |
| Isoflurane (Iso-Vet 100%) | Piramal | NDC 66794-013-10 | |
| Methanol 100% | Sigma Aldrich | 322415 | |
| Ovalbumin Alexa Fluor 555 Conjugate | Invitrogen | 11549176 | |
| Phosphate Buffer Solution PBS (stock solution 10X) | Euromedex | ET330-A | |
| Sodium Pentobarbital (Euthasol 400mg/mL) | Dechra | 08718469445110 | |
| Tri-sodium citrate | VWR | 6132-04-3 | |
| Surgical tools and equipments | |||
| Anaesthesia system | Univentor | Univentor 410 Anaesthesia Unit | |
| Glass micropipette puller | Narishige | PC-10 | |
| Heating pad | CMA Microdialysis AB | CMA 450 Temperature controller | |
| Microcapillaries (Glass Capillaries) | Harvard Apparatus | GC120-15 | |
| Microforceps, forceps,dissection scissors and Michel Suture Clips (7.5 × 1.75mm) | Fine Science Tool | 12040-01 | |
| Scalpel (sterile disposable scalpel 23) | Swann-Norton | 0510 | |
| Stereotaxic apparatus | KOPF | Model 940 | |
| Syringe Hamilton 10µl 701N | Hamilton | 28618-U | |
| Warm air System | Vet-Tech LTD | HE011 |
参考文献
- Plog, B. A., Nedergaard, M. The Glymphatic System in Central Nervous System Health and Disease: Past, Present, and Future. Annual Review of Pathology. 13, 379-394 (2018).
- Iliff, J. J., Goldman, S. A., Nedergaard, M. Implications of the discovery of brain lymphatic pathways. The Lancet Neurology. 14 (10), 977(2015).
- Engelhardt, B., et al. Vascular, glial, and lymphatic immune gateways of the central nervous system. Acta Neuropathologica. 132, 317-338 (2016).
- Benveniste, H., et al. The Glymphatic System and Waste Clearance with Brain Aging: A Review. Gerontology. , 1-14 (2018).
- Louveau, A., Da Mesquita, S., Kipnis, J. Lymphatics in Neurological Disorders: A Neuro-Lympho-Vascular Component of Multiple Sclerosis and Alzheimer's Disease. Neuron. 91 (5), 957-973 (2016).
- Ma, Q., Ineichen, B. V., Detmar, M., Proulx, S. T. Outflow of cerebrospinal fluid is predominantly through lymphatic vessels and is reduced in aged mice. Nature Communications. 8 (1), 1434(2017).
- Ma, Q., Decker, Y., Müller, A., Ineichen, B. V., Proulx, S. T. Clearance of cerebrospinal fluid from the sacral spine through lymphatic vessels. The Journal of Experimental Medicine. 216 (11), 2492-2502 (2019).
- Louveau, A., et al. Understanding the functions and relationships of the glymphatic system and meningeal lymphatics. The Journal of Clinical Investigation. 127 (9), 3210-3219 (2017).
- Louveau, A., et al. Structural and functional features of central nervous system lymphatic vessels. Nature. 523 (7560), 337-341 (2015).
- Aspelund, A., et al. A dural lymphatic vascular system that drains brain interstitial fluid and macromolecules. The Journal of Experimental Medicine. 212 (7), 991-999 (2015).
- Antila, S., et al. Development and plasticity of meningeal lymphatic vessels. The Journal of Experimental Medicine. 214 (12), 3645-3667 (2017).
- Ahn, J. H., et al. Meningeal lymphatic vessels at the skull base drain cerebrospinal fluid. Nature. 572 (7767), 62-66 (2019).
- Pollay, M. The function and structure of the cerebrospinal fluid outflow system. Cerebrospinal Fluid Research. 7, 9(2010).
- Jacob, L., et al. Anatomy and function of the vertebral column lymphatic network in mice. Nature Communications. 10 (1), 1-16 (2019).
- Louveau, A., et al. CNS lymphatic drainage and neuroinflammation are regulated by meningeal lymphatic vasculature. Nature Neuroscience. 21 (10), 1380-1391 (2018).
- Da Mesquita, S., et al. Functional aspects of meningeal lymphatics in ageing and Alzheimer's disease. Nature. 560 (7717), 185-191 (2018).
- Song, E., et al. VEGF-C-driven lymphatic drainage enables immunosurveillance of brain tumours. Nature. 577 (7792), 689-694 (2020).
- Absinta, M., et al. Human and nonhuman primate meninges harbor lymphatic vessels that can be visualized noninvasively by MRI. eLife. 6, 29738(2017).
- Renier, N., et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2014).
- Renier, N., et al. Mapping of Brain Activity by Automated Volume Analysis of Immediate Early Genes. Cell. 165 (7), 1789-1802 (2016).
- Jackson, D. G., Prevo, R., Clasper, S., Banerji, S. LYVE-1, the lymphatic system and tumor lymphangiogenesis. Trends in Immunology. 22 (6), 317-321 (2001).
- Wigle, J. T., Oliver, G. Prox1 function is required for the development of the murine lymphatic system. Cell. 98 (6), 769-778 (1999).
- Olarte, O. E., Andilla, J., Gualda, E. J., Loza-Alvarez, P. Light-sheet microscopy: a tutorial. Advances in Optics and Photonics. 10 (1), 111-179 (2018).
- Jing, D., et al. Tissue clearing of both hard and soft tissue organs with the PEGASOS method. Cell Research. 28 (8), 803-818 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。