需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
阳性肽载体软骨内运输特性的特征
摘要
该协议确定软骨中阳离子肽载体的均衡吸收、渗透深度和非平衡扩散率。运输特性的特性对于确保有效的生物反应至关重要。这些方法可用于设计最佳充电药物载体,以定位带负充电的组织。
摘要
体内一些带负电的组织,如软骨,由于其负充电的聚类药物密度高,对靶向药物的输送提出了障碍,因此,需要改进靶向方法,以增加其治疗反应。由于软骨具有高负固定电荷密度,因此药物可以用正电荷药物载体进行改性,以利用静电相互作用,从而增强软骨内药物的运输能力。因此,研究药物携带者的运输对于预测药物在诱导生物反应方面的有效性至关重要。进行了三个实验的设计,可以量化软骨外植中阳离子肽载体的均衡吸收、渗透深度和非均衡扩散率。均衡吸收实验提供了软骨内溶质浓度与周围浴池相比的测量,这对于预测药物载体在提高软骨药物的治疗浓度方面的潜力非常有用。使用共物显微镜进行渗透深度研究,允许从软骨表面扩散到深区对1D溶质扩散的视觉表示,这对于评估溶质是否到达其基质和细胞靶点非常重要。使用定制设计的运输室进行非均衡扩散率研究,通过描述在组织内荧光标记的溶解剂的扩散速率,可以测量与组织基质结合相互作用的强度;这有利于设计软骨的最佳结合强度载体。三种运输实验的结果共同为设计最佳电荷药物载体提供了指导,这些药物载体利用了药物输送应用中的弱和可逆电荷相互作用。这些实验方法也可以用于评价药物和药物载体结合的运输。此外,这些方法可以适用于瞄准其他带负功能的组织,如半月板,角膜和玻璃幽默。
引言
药物输送到体内带负电的组织仍然是一个挑战,因为药物无法深入组织以达到细胞和基质靶点1。其中几个组织由密集包装的负电荷聚集组成,在组织内产生高负固定电荷密度(FCD)2,并充当大多数大分子3,4,的传递屏障。然而,在带正电荷的药物携带者的协助下,这种带负电荷的组织屏障实际上可以通过静电电荷相互作用转化为药物库,以持续输送药物1、5、6、7(,5,6,7图1)。
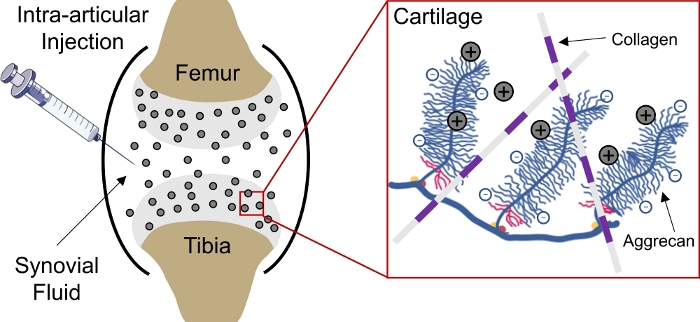
图1:基于电荷的软骨内软骨交付CPC。将CPC在关节空间的关节内注射。带正电荷的CPC和带负电荷的聚集组之间的静电相互作用,通过软骨实现快速和全深度渗透。这个数字已经修改了从维达达瓦米等人4。请单击此处查看此图的较大版本。
最近,短长度的阳离子肽载体(CPC)被设计为创建小型阳离子域,能够携带更大的治疗,以交付给负充电软骨4。为了有效地将药物输送到软骨,用于治疗流行的,8、9和退行性疾病,如骨关节炎(OA)10,药物的治疗浓度必须渗透到组织深处,其中大多数软骨细胞(胆囊细胞)位于组织深处。虽然有几个潜在的疾病修改药物可用,没有一个已获得FDA批准,因为这些不能有效地瞄准软骨12,13。12,因此,评估药物载体的运输特性是预测药物在诱导治疗反应方面的有效性所必需的。在这里,我们设计了三个独立的实验,可用于评估CPC4的均衡吸收率、渗透深度和非均衡扩散率。
为了确保软骨内有足够的药物浓度,可以提供最佳的治疗反应,吸收实验被设计成量化软骨4中的平衡CPC浓度。在此设计中,在软骨与其周围浴池之间的平衡之后,可以使用吸收比确定软骨内(与矩阵绑定或自由)的溶质总量。此比率的计算方法是将软骨内的溶解物浓度与平衡浴的溶解度标准化。原则上,中性溶解体,其通过软骨的扩散不由电荷相互作用辅助,其吸收比将小于1。相反,通过静电相互作用增强的阳离子溶解剂的吸收比大于1。但是,如 CPC 所示,使用最佳正电荷会导致更高的吸收比率(大于 300)4。
虽然软骨内的药物浓度高对于获得治疗效果很重要,但药物在软骨全部厚度中扩散也至关重要。因此,需要进行显示渗透深度的研究,以确保药物到达软骨深处,以便达到基质和细胞靶点,从而提供更有效的治疗。该实验旨在评估溶解液通过软骨的双向扩散,模拟药物在体内关节注射后扩散到软骨。使用共和显微镜进行荧光成像,可以评估渗透到软骨的深度。净粒子电荷在调节药物在基质中扩散的深度方面起着关键作用。需要基于组织 FCD 的最佳净电荷,以便进行阳离子颗粒和阳离子组织基质之间的弱可逆结合相互作用。这意味着任何相互作用都足够弱,使粒子可以脱离矩阵,但可逆的性质,以便它可以绑定到另一个矩阵结合位点在组织4的更深。相反,粒子的正净电荷过多会损害扩散,因为过强的基质结合会防止粒子从软骨表面区域的初始结合位点分离。这将导致生物反应不足,因为大多数目标位点位于组织11的深处。
为了进一步量化结合相互作用的强度,通过软骨分析药物扩散率是有利的。非平衡扩散研究允许比较不同溶解体之间的实时扩散速率。当药物扩散到软骨的浅层、中间和深层区域时,结合相互作用的存在可以极大地改变扩散率。当药物和软骨基质之间存在结合相互作用时,它被定义为有效的扩散性(DEFF)。在这种情况下,一旦所有结合位点被占用,药物的扩散速率由稳态扩散 (DSS ) 控制。不同溶质的DEFF 的比较决定了溶质与基质的相对结合强度。对于给定的溶质,如果 DEFF 和 DSS 在同一数量级内,则意味着在扩散过程中药物和基质之间存在最小的结合。但是,如果DEFF 大于DSS,则存在大量粒子与矩阵结合。
设计的实验单独允许通过软骨对溶质运输进行表征,但是,设计一个带最佳电检的药物载体需要包括所有结果的整体分析。电荷相互作用的弱和可逆性质控制粒子扩散率,并允许高平衡吸收和快速全深度穿透软骨。通过均衡吸收实验,应寻找通过非均衡扩散率研究可以验证的电荷相互作用能表现出高吸收的载体。然而,这些结合相互作用应该是弱和可逆的性质,以允许通过软骨的溶质全厚渗透。理想的药物载体将拥有最佳电荷,使强的结合吸收和高软骨内药物浓度,但不是太强,以阻碍全厚度扩散4。提出的实验将有助于针对药物携带者的电荷组织的设计特征。这些协议用于描述通过软骨4的C CPC运输,但是,这些协议也可以应用于各种药物和药物载体,通过软骨和其他带负电的组织。
研究方案
大学批准进行死组织实验。牛关节是从屠宰场商业获得的。
1. 软骨外植提取
- 使用手术刀(#10刀片),切除脂肪,肌肉,韧带,肌腱和所有其他结缔组织,以暴露软骨从牛膝盖关节的毛骨。
- 使用 3 mm 和 6 mm 皮肤冲孔,将垂直冲孔放入软骨以提取圆柱形塞。立即将插头插入包含 500 μL 1x 磷酸盐缓冲盐水 (PBS) 的 48 孔板的单个孔中,并辅以 1% v/v 抗生素抗霉菌。
- 将软骨插头的表层面朝下放入切片夹具中的井中(图 2)。使用剃须刀刀片,沿切片夹具表面切开插头,以获得 1 mm 厚的软骨外植,包括表面区域。对每个软骨插头重复一遍。
- 将软骨外植单独存放在含有 500 μL 1x PBS 的聚丙烯管中,并辅以蛋白酶抑制剂(PBS-PI,每 50 mL 1x PBS 1 个 PI 迷你片),温度为 -20°C。
- 在进行以下每个运输实验之前,在 37°C 水浴中解冻含有植物的小瓶 30 分钟。
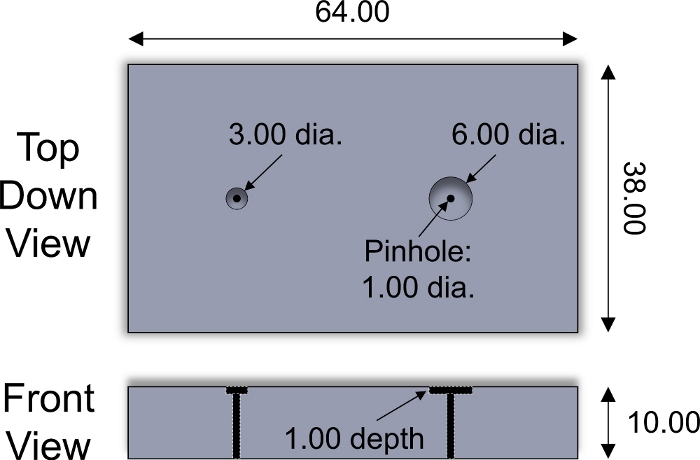
图2:定制设计的切片夹具。用于切片3和6毫米直径软骨外植的不锈钢切片夹具的设计参数。不同厚度的塑料刀片被放置在井内,以调整切片外植的厚度。直径为 <1 mm 的不锈钢圆柱销用于将外植装置从夹具中推开。所有数值以毫米 为单位显示。请点击这里查看这个数字的较大版本。
2. 软骨中CPC的均衡吸收
- 轻轻涂抹软骨外植(3 毫米直径 X 1 毫米厚),并擦拭细腻的任务,以去除外植表面多余的 1x PBS。使用平衡,快速记录每个外植的湿重,然后立即放在1x PBS浴中,以防止脱水。
- 在 1x PBS-PI 中制备 30 μM 溶液(每种植 300 μL)荧光标记 CPC。使用无 RNase 聚丙烯管进行重组。
- 在 96 孔板中,移液器 300 μL,每个 30 μM CPC 溶液放入单独的孔中。避免使用板边缘附近的油井以防止蒸发。使用铲子将每个外植转移到含有井的溶液中。
- 用 300 μL 的 1x PBS 填充周围油井,用盖子盖住井板。用柔性薄膜密封板的边缘,以最大限度地减少蒸发。
- 在 37°C 培养箱内,将板放在板摇床上以限制颗粒沉积。在温和旋转下孵育24小时(50 rpm,15毫米轨道),以允许软骨中CPC的均衡吸收(图3)。
- 生成荧光与 CPC 浓度相关性的标准曲线
- 在聚丙烯管中,从 30 μM = 0 μM(10 2 倍稀释)中制备 CPC 溶液的连续稀释。确保每个稀释至少存在 500 μL。
- 将每次稀释的 200 μL 添加到黑色 96 孔板中的连续孔中。在另一行中重复以增加样本大小。
- 使用板读卡器在荧光标签的激发和发射波长上使用板读卡器获取每个样品的荧光读数。
- 绘制荧光读数与 CPC 浓度,并派生曲线线性部分的方程。
注:为了限制荧光读数的变异性,在生成标准曲线之前,在与样品板相同的条件下孵化CPC库存溶液。
- 孵育24小时后,将平衡浴从每一个井中收集到单独的聚丙烯管中。
- 将每个溶液的 200 μL 转移到黑色 96 孔板的单独孔中。在相同的荧光设置下获取每个样品的荧光读数,与标准曲线相同。如有必要,将样品稀释为 1x PBS-PI,以确保读数在标准曲线的线性部分。
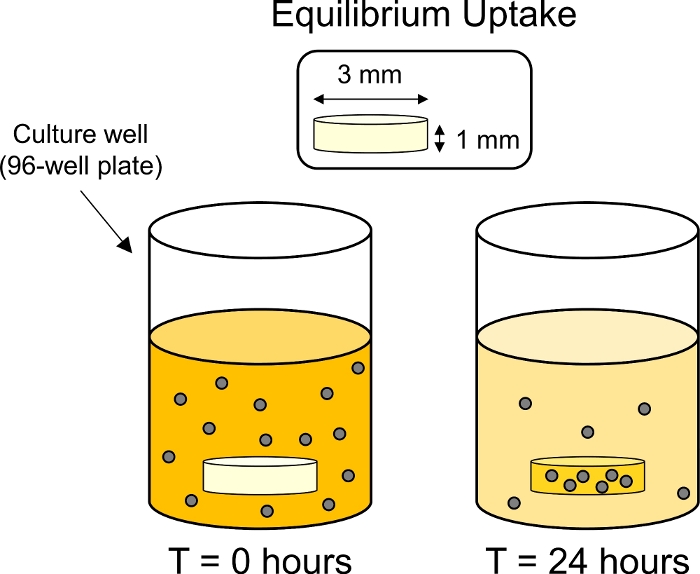
图3:平衡吸收实验的示意图。软骨外植(3 毫米直径 x 1 毫米厚)被放置在含有荧光标记 CPC 溶液的 96 孔板中的个体井中。24小时后CPC被软骨吸收,从而减少周围浴池的荧光。 请单击此处查看此图的较大版本。
3. 中高速度在软骨中的渗透深度
- 在 1x PBS-PI 中制备 30 μM 溶液(每种植 300 μL)荧光标记 CPC。使用无 RNase 聚丙烯管进行重组。
- 使用手术刀,将软骨外植物(直径6毫米 x 1毫米厚度)切成两半,使半圆盘。切割时,用一层 1x PBS-PI 保持外植水分。
- 使用环氧树脂将半盘外植粘附到定制设计的一维运输室的一个井的中间(图4,图5)。确保环氧树脂应用于外植的圆周(弯曲)侧。从井中去除多余的胶水,防止与软骨扩散表面积接触,并记下外植物的表面面。
- 将 80 μL 的 1x PBS-PI 添加到外植的两侧。从外植的一侧上下移液,检查泄漏到另一侧。如果发生泄漏,请重新调整外植,并根据需要应用环氧树脂。
- 用 80 μL 的 30 μM CPC 溶液从软骨表面表面(上游)的侧面更换 1x PBS-PI。在面对软骨深区(下游)的侧面保持 80 μL 的 1x PBS-PI。
- 小心地将运输室放在可盖容器中。用 1x PBS 层盖住容器底部,以避免溶液蒸发。确保上游和下游腔室的解决方案之间没有直接接触。
- 将盖有容器放在板摇床上,以限制颗粒沉积。在温和旋转(50 rpm,15 mm 轨道)下室温下孵育 4 或 24 小时。
- 孵育后,从腔室取出外植,从外植中心切出±100μm切片。
注:此横截面包括软骨的浅面、中间和深层区域。 - 将切片放在玻璃滑梯和盖玻片之间。用 1x PBS-PI 层水化切片。
- 在10倍放大时,通过切片的全厚度图像,使用共和显微镜获得 z 堆荧光图像。
- 使用 ImageJ 预测 z 堆栈中图像的平均强度,以确定 CPC 在软骨中的穿透深度。
- 单击"文件"| 打开 图像堆栈 |打开。
- 单击任务栏上的[图像],然后单击 "图像" |堆栈 |Z 下 拉菜单中的 Z 项目。
- 输入从 1 到最终切片的切片编号。在"投影类型"下选择" 平均强度"。单击"确定"。
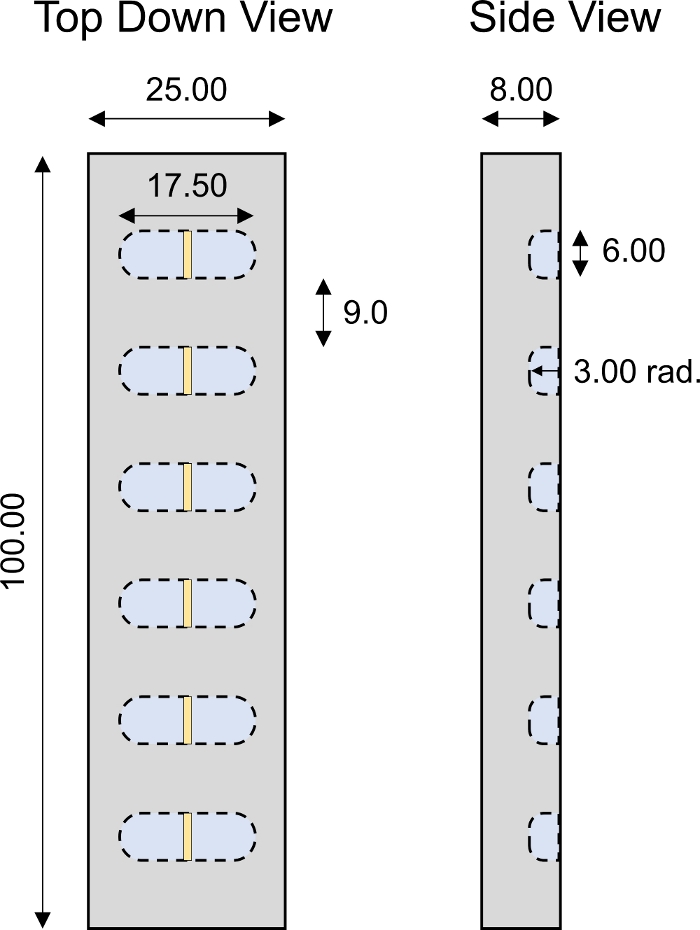
图4:定制设计的一-D运输室。PMMA 1D 运输室的设计参数,有 6 个单独的孔。所有数值以毫米 为单位显示。请点击这里查看这个数字的较大版本。
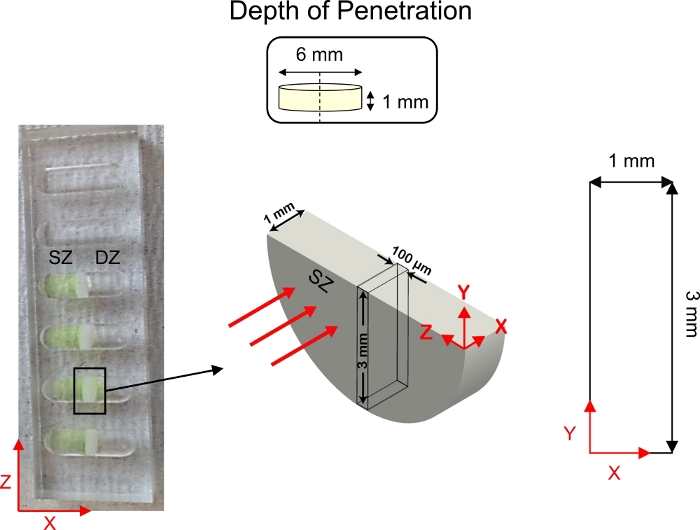
图5:渗透研究深度的示意图。软骨外植(直径6毫米×1毫米厚度)被切成两半,固定在1-D扩散运输井的中心。荧光标记的CPC溶液被添加到与软骨表面区域(SZ)接触的井的一侧。1x PBS-PI 被添加到与软骨深区 (DZ) 接触的井边。扩散后,使用共体显微镜对软骨横截面(3毫米×1毫米)进行成像。这个数字已经修改了从韦达达加瓦米等人4 和巴杰帕伊等人3请点击这里查看这个数字的更大版本。
4. 软骨中CPC的非均衡扩散率
- 将定制设计的运输室的两半 (图6) 放在一起组装和关闭腔室.使用垫圈、螺母和螺栓用扳手紧闭室。
注:运输室必须半透明,不得干扰荧光读数。本协议中使用的运输室由聚甲基丙烯酸酯(PMMA)组成。 - 在 1x PBS(每个腔室 2 mL)中用 0.5% w/v 无脂牛奶溶液将腔室的内部空间涂覆 15 分钟,以防止 CPC 与腔壁的非特异性结合。然后用 1x PBS(每个腔室 2 mL)冲洗腔室。
- 使用定制设计的切片夹具(图2)和剃须刀刀片,将直径为6毫米的软骨外植(横向平面)切成500-800μm的厚度,包括表面区域。用 1x PBS 保持外植水分。
- 使用锤子驱动的皮孔,从橡胶板创建垫片,如图 7 所示。
- 组装每个半运输室,包括 1 个大橡胶垫片、1 个 PMMA 刀片和 1 个小橡胶垫片。将外植物放在塑料刀片的孔中,表面区域朝向上游腔室。将两半夹在一起,用扳手拧紧组装并拧紧(图7)。
- 向上游腔室加注 2 mL 1x PBS-PI,并观察下游腔室中下游腔室中流体从上游腔室泄漏。如果存在泄漏,请重新组装腔室,调整垫片位置和螺钉的紧固度。如果没有泄漏,则同时向下游腔室加注 2 mL 1x PBS-PI。
- 在上流和下行腔室中添加一个迷你搅拌杆,并将腔室放在搅拌板上。对齐腔室,使分光光度计的激光聚焦在下游腔室的中心。将分光光光度计的信号接收器部分放在下游腔室后面(图8)。
注:分光光度计的激光和接收器必须配备适当的滤波器,以激发、发射和传输荧光标记蛋白的信号。在实验过程中使用黑匣子保护运输室免受光线影响,以避免荧光信号受到干扰。最佳做法是用柔性薄膜密封室顶部的开口,以避免蒸发。 - 收集实时下游荧光发射读数,确保信号稳定至少5分钟。
注:如果没有定制设计的分光光度计或半透明传输室,可以使用板读卡器获取和评估下游腔室的荧光。 - 将荧光标记CPC的预计算库存溶液移入上游腔室,以确保上游腔室内最终浓度为3μM。观察下游荧光信号,使溶质运输达到坡度的稳步增加。
注:较厚的软骨外植将需要较长时间才能达到稳定状态。 - 达到稳定状态后,从上游腔室中加入 20 μL 并添加到下游腔室("尖峰测试")。
注:将观察到下游荧光的峰值。这将允许荧光读数与 CPC 浓度之间的相关性。 - 收集实时下游荧光读数。
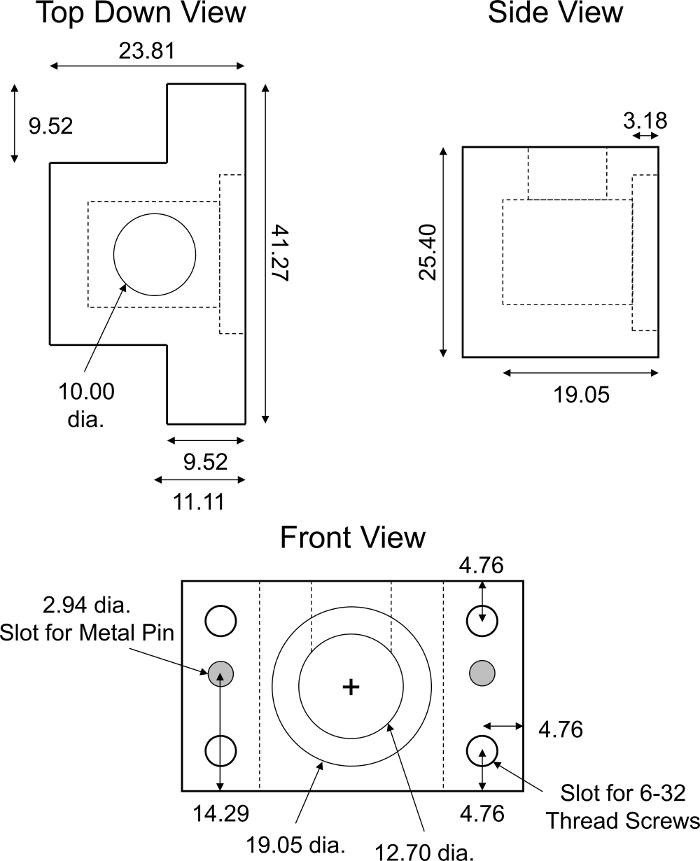
图6:定制设计的非平衡扩散传输室。PMMA非平衡扩散传输室的设计参数。腔室必须半透明,不得干扰荧光读数。完整的运输室由所示夹具的两个相同部分组成。需要两个圆柱形不锈钢销(直径约 2.94 毫米,长约 18 毫米),以确保对准和完全闭合室的两半。在腔室的每个角落都为 6-32 个螺纹螺钉制作了四个相同的插槽,用于螺钉紧固装配。所有数值以毫米为单位显示。 请单击此处查看此图的较大版本。
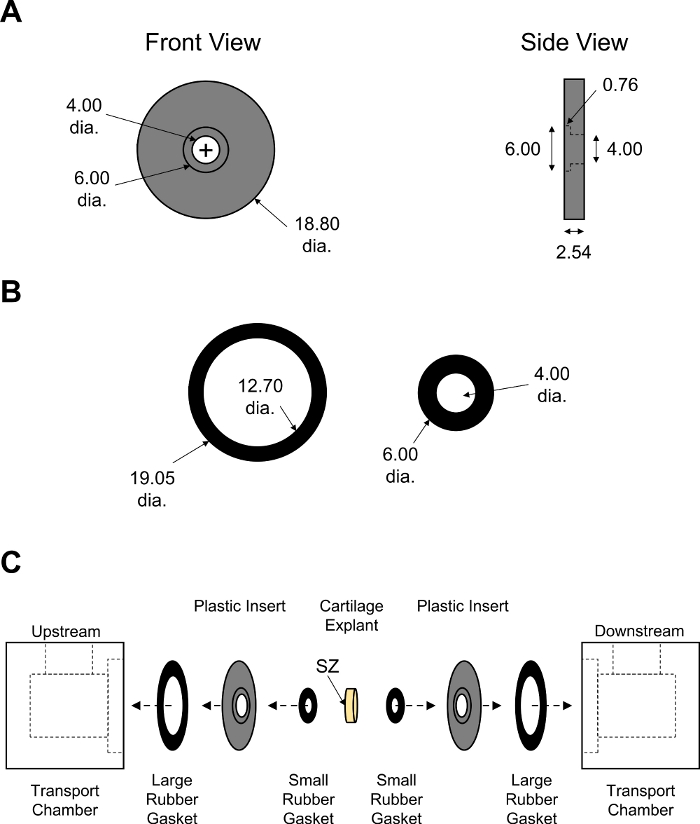
图7:非平衡扩散运输室的组装。设计参数的 (A) 黑色PMMA刀片和 (B) 大和小橡胶垫片.调整了橡胶垫片的厚度,以确保密封室。所有数值以毫米(C)表示,显示运输室两半的装配顺序,中间放置有软骨外植。SZ 表示面向上游腔室的软骨表面区域。 请单击此处查看此图的较大版本。
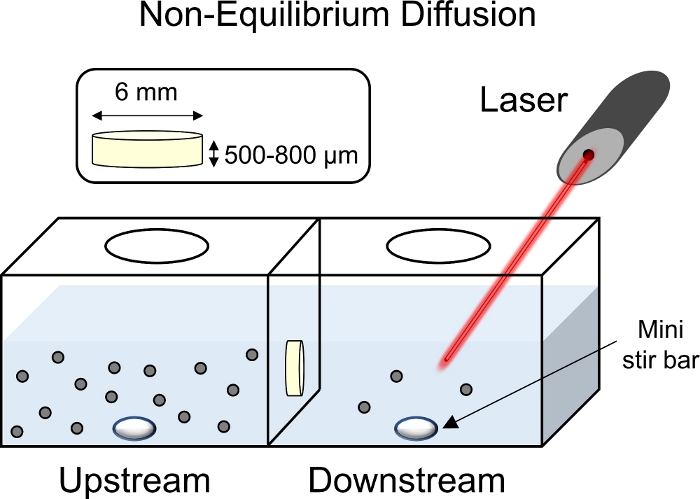
图8:非平衡扩散实验的示意图。软骨外植(直径 6 mm x 1 mm 厚度)被放置在运输室的中心,表面朝向上游腔室。腔室的上下游两侧都装满了 1x PBS-PI,并使用迷你搅拌棒混合。用激光指向下游腔室收集荧光读数,将荧光标记的CPC溶液添加到上游腔室中。 请单击此处查看此图的较大版本。
结果
在软骨对CPC进行平衡吸收后,当溶质被组织吸收时,浴荧光会减少。但是,如果最终浴池的荧光值仍与初始值相似,则表示没有/最小溶质吸收。溶质吸收的另一个确认是,如果组织已经明显改变颜色的荧光染料的颜色。在荧光值转换为浓度后,使用荧光值使用吸收比(RU)确定软骨中溶解的定量吸收率。使用初始浴浓度 (C浴,i)和平衡浴浓度 (C浴), 软骨内的溶质浓?...
讨论
此处描述的方法和协议对靶向带负电组织靶向药物输送领域非常重要。由于这些组织中存在带负电的聚集体高密度,因此会形成屏障,从而阻止药物到达其位于基质深处的细胞靶点。为面对这个突出的挑战,药物可进行改性,以纳入带正药的药载体,,可提高,,,药物在组织1、3、4、14、15、16、17、18、19,3,
披露声明
作者没有什么可透露的。
致谢
这项工作由美国国防部通过国会指导的医学研究计划(CDMRP)根据W81XWH-17-1-0085合同和国家卫生研究院R03 EB025903-1提供资金。AV由东北大学工程学院院长奖学金资助。
材料
| Name | Company | Catalog Number | Comments |
| 316 Stainless Steel SAE Washer | McMaster-Carr | 91950A044 | For number 5 screw size, 0.14" ID, 0.312" OD |
| 96-Well Polystyrene Plate | Fisherbrand | 12566620 | Black |
| Acrylic Thick Gauge Sheet | Reynolds Polymer | N/A | For non-equilibrium diffusion and 1-D diffusion transport chamber |
| Antibiotic-Antimycotic | Gibco | 15240062 | 100x |
| Bovine Cartilage | Research 87 | N/A | 2-3 weeks old, femoropatellar groove |
| Bovine Serum Albumin | Fisher BioReagents | BP671-1 | |
| CPC+14 | LifeTein | LT1524 | Custom designed peptide |
| CPC+20 | LifeTein | LT1525 | Custom designed peptide |
| CPC+8 | LifeTein | LT1523 | Custom designed peptide |
| Delicate Task Wipers | Kimberly-Clark Professional | 34155 | |
| Dermal Punch | MedBlades | MB5-1 | 3, 4 and 6 mm |
| Economy Plain Glass Microscope Slides | Fisherbrand | 12550A3 | |
| Flat Bottom Cell Culture Plates | Corning Costar | 3595 | Clear, 96 well |
| Flexible Wrapping Film | Bemis Parafilm M Laboratory | 1337412 | |
| Gold Seal Cover Glass | Electron Microscopy Sciences | 6378701 | # 1.5, 18x18 mm |
| Hammer-Driven Hole Punch | McMaster-Carr | 3427A15 | 1/2" Diameter |
| Hammer-Driven Hole Punch | McMaster-Carr | 3427A19 | 3/4" Diameter |
| Laser | Chroma Technology | AT480/30m | Spectrophotometer Laser Light |
| Low-Strength Steel Hex Nut | McMaster-Carr | 90480A007 | 6-32 Thread size |
| LSM 700 Confocal Microscope | Zeiss | LSM 700 | |
| Micro Magnetic Stirring Bars | Bel-Art Spinbar | F37119-0007 | 7x2 mm |
| Multipurpose Neoprene Rubber Sheet | McMaster-Carr | 1370N12 | 1/32" Thickness |
| Non-Fat Dried Bovine Milk | Sigma Aldrich | M7409 | |
| Petri Dish | Chemglass Life Sciences | CGN1802145 | 150 mm diameter |
| Phosphate-Buffered Saline | Corning | 21-040-CMR | 1x |
| Plate Shaker | VWR | 89032-088 | |
| Protease Inhibitors | Thermo Scientific | A32953 | |
| Razor Blades | Fisherbrand | 12640 | |
| R-Cast Acrylic Thin Gauge Sheet | Reynolds Polymer | N/A | Black transport chamber inserts |
| RTV Silicone | Loctite | 234323 | Epoxy, Non-corrosive, clear |
| Scalpel | TedPella | 549-3 | #10, #11 blades |
| Signal Receiver | Chroma Technology | ET515lp | Spectrophotometer Laser Signal Receiver |
| Snap-Cap Microcentrifuge Tubes | Eppendorf | 22363204 | 1.5 mL |
| Spatula | TedPella | 13508 | |
| Synergy H1 Microplate Reader | Biotek | H1M | |
| Zinc-Plated Alloy Steel Socket Head Screw | McMaster-Carr | 90128A153 | 6-32 Thread size, 1" Long |
参考文献
- Bajpayee, A. G., Grodzinsky, A. J. Cartilage-targeting drug delivery: can electrostatic interactions help. Nature Reviews Rheumatology. 13 (3), 183-193 (2017).
- Maroudas, A. Transport of solutes through cartilage: permeability to large molecules. Journal of Anatomy. 122, 335-347 (1976).
- Bajpayee, A. G., Wong, C. R., Bawendi, M. G., Frank, E. H., Grodzinsky, A. J. Avidin as a model for charge driven transport into cartilage and drug delivery for treating early stage post-traumatic osteoarthritis. Biomaterials. 35 (1), 538-549 (2014).
- Vedadghavami, A., et al. Cartilage penetrating cationic peptide carriers for applications in drug delivery to avascular negatively charged tissues. Acta Biomaterialia. 93, 258-269 (2019).
- Mehta, S., Akhtar, S., Porter, R. M., Önnerfjord, P., Bajpayee, A. G. Interleukin-1 receptor antagonist (IL-1Ra) is more effective in suppressing cytokine-induced catabolism in cartilage-synovium co-culture than in cartilage monoculture. Arthritis Research & Therapy. 21 (1), 238 (2019).
- Vedadghavami, A., Zhang, C., Bajpayee, A. G. Overcoming negatively charged tissue barriers: Drug delivery using cationic peptides and proteins. Nano Today. 34, 100898 (2020).
- Young, C. C., Vedadghavami, A., Bajpayee, A. G. Bioelectricity for Drug Delivery: The Promise of Cationic Therapeutics. Bioelectricity. , (2020).
- Felson, D. T. Osteoarthritis of the knee. New England Journal of Medicine. 354 (8), 841-848 (2006).
- Wieland, H. A., Michaelis, M., Kirschbaum, B. J., Rudolphi, K. A. Osteoarthritis - An untreatable disease. Nature Reviews Drug Discovery. 4 (4), 331-344 (2005).
- Martel-Pelletier, J. Pathophysiology of osteoarthritis. Osteoarthritis and Cartilage. 7 (4), 371-373 (1999).
- Sophia Fox, A. J., Bedi, A., Rodeo, S. A. The basic science of articular cartilage: Structure, composition, and function. Sports Health. 1 (6), 461-468 (2009).
- Chevalier, X., et al. Intraarticular injection of anakinra in osteoarthritis of the knee: A multicenter, randomized, double-blind, placebo-controlled study. Arthritis Care and Research. 61 (3), 344-352 (2009).
- Cohen, S. B., et al. A randomized, double-blind study of AMG 108 (a fully human monoclonal antibody to IL-1R1) in patients with osteoarthritis of the knee. Arthritis Research and Therapy. 13 (4), 125 (2011).
- Evans, C. H., Kraus, V. B., Setton, L. A. Progress in intra-articular therapy. Nature Reviews Rheumatology. 10 (1), 11-22 (2014).
- He, T., et al. Multi-arm Avidin nano-construct for intra-cartilage delivery of small molecule drugs. Journal of Controlled Release. 318, 109-123 (2020).
- Bajpayee, A. G., Scheu, M., Grodzinsky, A. J., Porter, R. M. A rabbit model demonstrates the influence of cartilage thickness on intra-articular drug delivery and retention within cartilage. Journal of Orthopaedic Research. 33 (5), 660-667 (2015).
- Bajpayee, A. G., Quadir, M. A., Hammond, P. T., Grodzinsky, A. J. Charge based intra-cartilage delivery of single dose dexamethasone using Avidin nano-carriers suppresses cytokine-induced catabolism long term. Osteoarthritis and Cartilage. 24 (1), 71-81 (2016).
- Zhang, C., et al. Avidin-biotin technology to synthesize multi-arm nano-construct for drug delivery. MethodsX. , 100882 (2020).
- Wagner, E. K., et al. Avidin grafted dextran nanostructure enables a month-long intra-discal retention. Scientific Reports. 10.1, 1-14 (2020).
- Troeberg, L., Nagase, H. Proteases involved in cartilage matrix degradation in osteoarthritis. Biochimica et Biophysica Acta - Proteins and Proteomics. 1824 (1), 133-145 (2012).
- Kirk, T. B., Wilson, A. S., Stachowiak, G. The effects of dehydration on the surface morphology of articular cartilage. Journal of Orthopaedic Rheumatology. 6 (2-3), 75-80 (1993).
- Ateshian, G. A., Maas, S., Weiss, J. A. Solute transport across a contact interface in deformable porous media. Journal of Biomechanics. 45 (6), 1023-1027 (2012).
- Arbabi, V., Pouran, B., Weinans, H., Zadpoor, A. A. Multiphasic modeling of charged solute transport across articular cartilage: Application of multi-zone finite-bath model. Journal of Biomechanics. 49 (9), 1510-1517 (2016).
- Arbabi, V., Pouran, B., Zadpoor, A. A., Weinans, H. An experimental and finite element protocol to investigate the transport of neutral and charged solutes across articular cartilage. Journal of Visualized Experiments. 2017 (122), (2017).
- Sampson, S. L., Sylvia, M., Fields, A. J. Effects of dynamic loading on solute transport through the human cartilage endplate. Journal of Biomechanics. 83, 273-279 (2019).
- Bajpayee, A. G., Scheu, M., Grodzinsky, A. J., Porter, R. M. Electrostatic interactions enable rapid penetration, enhanced uptake and retention of intra-articular injected avidin in rat knee joints. Journal of Orthopaedic Research : Official Publication of the Orthopaedic Research Society. 32 (8), 1044-1051 (2014).
- Bajpayee, A. G., et al. Sustained intra-cartilage delivery of low dose dexamethasone using a cationic carrier for treatment of post traumatic osteoarthritis. European Cells & Materials. 34, 341-364 (2017).
- Malda, J., et al. Of Mice, Men and Elephants: The Relation between Articular Cartilage Thickness and Body Mass. PLoS One. 8 (2), 57683 (2013).
- Frisbie, D. D., Cross, M. W., McIlwraith, C. W. A comparative study of articular cartilage thickness in the stifle of animal species used in human pre-clinical studies compared to articular cartilage thickness in the human knee. Veterinary and Comparative Orthopaedics and Traumatology. 19 (3), 142-146 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。