需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
癌症患者血浆样本中无细胞DNA检测
摘要
本文提出了非侵入性液体活检技术的详细方案,包括采血、血浆和缓冲涂层分离、cfDNA和生殖系DNA提取、cfDNA或生殖系DNA的量化以及cfDNA片段富集分析。
摘要
识别癌症患者肿瘤突变是疾病管理中非常重要的一步。这些突变是肿瘤诊断以及癌症患者治疗选择及其反应的生物标志物。目前检测肿瘤突变的黄金标准方法是通过肿瘤活检对肿瘤DNA进行基因检测。然而,这种侵入性方法很难反复执行,作为肿瘤突变的后续测试。液体活检是一种新的和新兴的技术,用于检测肿瘤突变,作为一种易于使用和非侵入性的活检方法。
癌细胞迅速繁殖。同时,许多癌细胞也发生凋亡。这些细胞的碎片被释放到患者的循环系统中,以及细碎的DNA片段,称为无细胞DNA(cfDNA)片段,携带肿瘤DNA突变。因此,为了使用液体活检技术识别基于 cfDNA 的生物标志物,从癌症患者身上采集血液样本,然后分离血浆和布菲涂层。接下来,血浆被处理用于cfDNA的分离,并处理相应的缓冲涂层,以隔离患者的基因组DNA。然后对两个核酸样品进行数量和质量检查:并使用下一代测序 (NGS) 技术分析突变。
在这份手稿中,我们提出了液体活检的详细方案,包括血液采集、血浆和缓冲涂层分离、cfDNA和生殖系DNA提取、cfDNA或生殖系DNA的量化以及cfDNA片段富集分析。
引言
技术进步导致数百个癌症基因组和转录体1的测序。这有助于了解不同癌症类型2的分子变化。对这些景观的进一步研究有助于描述与癌症或肿瘤进展有关的顺序体变和基因融合3, 通过连续破坏凋亡路径4。因此,体细胞突变和基因融合可以通过在特定肿瘤5型患者中作为生物标志物,识别现有原发性肿瘤预后6,根据分子变化7对继发肿瘤进行分类,确定可药性肿瘤靶点8,提供肿瘤信息。这些资料可方便选择癌症病人的个性化治疗,以及确定正面及负面的治疗反应。然而,获取肿瘤材料来识别肿瘤组织的基因组分析是一个侵入性的过程10。此外,肿瘤活检只包括异质肿瘤的一小部分:因此,可能不代表整个肿瘤11的分子特征。连续监测和肿瘤基因成型需要反复收集肿瘤组织,由于肿瘤活检程序的侵入性和此类程序产生的安全问题,通常不可行。
另一方面,液体活检技术在过去十年中在精密肿瘤学方面获得了极大的关注。这主要是由于这种技术的非侵入性,以及它在多个时间点重复的可能性,从而使疾病课程15,16易于使用和安全的监测技术。液体活检基于肿瘤细胞迅速繁殖的现象,同时许多肿瘤细胞发生凋亡和坏死。这导致凋亡细胞碎片释放到患者的血液中,以及DNA片段,在凋亡17期间被切成精确大小。非癌细胞的凋亡也导致其细胞碎片释放到血液中,然而,这些细胞的凋亡率相对低于肿瘤细胞18。液体活检技术的合理性是捕捉与肿瘤相关的分子,如DNA、RNA、蛋白质和肿瘤细胞14、19,这些分子在血液中持续循环。各种技术20可用于分析这些分子,包括下一代测序 (NGS)、数字液滴聚合酶链反应 (ddPCR)、实时 PCR 和酶相关免疫糖体检测 (ELISA)。液体活检技术能够识别肿瘤细胞特性的生物标志物。这些生物标志分子不仅从肿瘤的特定部位释放出来,而且从肿瘤21的所有部位释放出来。因此,在液体活检中发现的标记物代表整个异质肿瘤的分子分析,以及体内其他肿瘤,因此,与基于组织活检的技术22相比具有优势。
cfDNA在循环血液中有很短的半生时间,从几分钟到1-2小时23不等。然而,cfDNA的短半寿命通过评估治疗反应和动态肿瘤评估促进实时分析。肿瘤衍生的 cfDNA 水平表示肿瘤阶段/大小的预后,通过多项研究证明,这表明 cfDNA 水平与生存结果24之间的关系。此外,研究已经证明,cfDNA具有更好的预测能力比现有的肿瘤标记25。cfDNA的预测在癌症治疗后更加明显,治疗后cfDNA水平较高,与存活率降低和对治疗的抵抗力密切相关。然而,治疗后 cfDNA 水平较低通常与积极的治疗反应相对应。此外,与传统的检测方法相比,cfDNA 有助于早期检测治疗反应。
cfDNA增加了癌症相关突变的早期发现的可能性:在早期疾病15,症状26 的出现和癌症诊断之前长达2年27。由于 cfDNA 是从多个肿瘤区域或肿瘤区域释放出来的,其分析提供了它所代表的28个肿瘤基因组的全面视图。因此,cfDNA能够检测组织样本29中可能遗漏的体细胞突变。由于肿瘤内异质性和亚克隆突变可以通过对跨越数千个碱基的基因组区域进行深度测序来检测,因此对 cfDNA 的分析能够发现具有不同基因组特征的特定分子亚型13。为了通过组织样本获得类似水平的信息,需要进行许多固体活检。
此外,在手术治疗和/或化疗后,局部疾病(如结肠癌、卵巢癌和肺癌)患者的 cfDNA 水平证明是癌症复发和治疗结果20的强大预后标记。此外,在结肠癌、乳腺癌和肺癌患者中,从血液中分析cfDNA可以成功检测出肿瘤特异性变化,从而提前几个月准确预测复发。此外,治疗耐药性标志物,如KRAS突变的CRC患者接受抗EGFR治疗30:各种疗法治疗后乳腺癌患者的PIK3CA、MED1或EGFR等基因的VAF:和EGFR T790M耐药性突变的肺癌患者治疗EGFR靶向TKIs32也可以通过cfDNA分析识别。
总之,cfDNA分析可用于识别肿瘤学领域13,33的精确生物标志物。在此协议中,对3名胶质瘤患者的血液样本和3个健康对照进行了处理,以从血浆中获取WBCs和cfDNA的基因组DNA。在胶质瘤癌症中,IDH、TERT、ATRX、EGFR和TP53的突变作为诊断和预后标记,可能有助于胶质瘤肿瘤的早期诊断,分类不同类型的胶质瘤肿瘤,指导对个别患者的准确治疗,并了解治疗反应34,35。 这些基因的突变状态可以使用血液衍生的 cfDNA 来识别。在这份手稿中,我们提出了一个血浆衍生的cfDNA的详细协议,用于研究胶质瘤癌12的突变变化。本文中解释的基于 cfDNA 的液体活检方案可用于研究许多其他类型的癌症的突变变化。此外,最近的一项研究表明,cfDNA为基础的液体活检可以检测出50种不同类型的癌症36。
血液样本收集、储存和装运是本协议中的关键步骤,因为这些步骤期间不受控制的温度会导致 WBC 的裂解,导致基因组 DNA 从 WBC 释放到血浆中,并导致 cfDNA 样本的污染,从而影响其余过程37。由于不受控制的温度溶解会损害 cfDNA 的下游样品制备过程,例如 PCR 步骤38。血清含有高比例的细菌素cfDNA,而不是血浆,虽然它提出了肿瘤相关的cfDNA39的大背景噪音。因此,对于分离肿瘤相关的cfDNA,血浆是一个合适的样本39。在含有血液收集管的抗凝血剂中提取的血液应立即或在长达两个小时内离心,以分离血浆并避免 cfDNA 污染。在此协议中,使用专用的商业 cfDNA 保存采血管(见材料表),这是含有采血管的抗凝血剂的替代品。这些专用的血液收集管保存 cfDNA 和 cfRNA,并在环境温度下防止 WBCs 的裂解长达 30 天,在 37 °C 下最多 8 天。 这有助于在血液样本运输期间保持适当的温度,直到血浆和WBC分离40。
目前有三种类型的cfDNA提取方法:相隔离、基于硅膜的自旋柱和基于磁珠的分离41。与其他 cfDNA 提取方法42相比,基于硅膜的自旋柱法具有较高的完整性。
DNA定量评价是液体活检的一项基本要求,需要制定一个简单、经济、规范的程序,使之易于实施和广泛使用。cfDNA 量化的三种常用方法是光谱测量、氟化和 qPCR。氟化方法在传导的准确性、成本和易用性方面比其他方法更好。
cfDNA的完整性和纯度可以通过藻杉电泳或毛细纤维电泳来估计。阿加罗斯电泳既没有显示低浓度 cfDNA 的灵敏度,也没有高分辨率显示 cfDNA 的精确片段大小。另一方面,毛细细电泳通过克服相关挑战,比藻状电泳具有优势,因此,研究人员广泛用于 cfDNA 片段大小分析。在此协议中,使用自动毛细细电泳仪器估计了孤立的 cfDNA 的碎片大小分布(见 材料表)。
研究方案
在采血之前,需要并必须获得参与研究的受试者的知情同意。本手稿中描述的研究是按照拉宾医疗中心、以色列伦理委员会(伦理代码:0039-17-RMC)和德国伦理委员会(伦理代码:D 405/14)进行的。
1. 在 cfDNA 或 cfRNA 防腐剂管中采集和储存血液样本
- 正确标记保存管
- 收集约8 mL的血液到cf-DNA保存管(见 材料表),使用采血集和持有人,根据标准机构协议的静脉曲张如下所述。
注意:使用采血套件可以防止血液从管子中回流。- 将患者与手臂向下的位置对齐。
- 直立握住管子,盖子朝上,同时确保管内物品不接触盖或针尖。
- 当血液开始流入管子时,慢慢释放。
- 在管子充满血液(最大容量:8.4 mL 的全血)后,轻轻倒置管(将持有管子的臂手腕向下和向后转动 5 次),以稳定样本。
注:反转确保防腐剂与样品均匀混合。但是,即使在等离子体准备之前,也不要再次摇动内容。防腐剂与血液样本的混合不足导致成分不稳定和微血块或溶血的形成。在这个阶段,协议可以立即继续,血浆分离或充满血液的管子可以在环境温度(15-25°C)等待长达30天,在37°C长达8天。
2. 等离子体和浅黄色外套分离和存储
- 在室温下将充满血液的保鲜管在425 x g 下分离20分钟,以分离血浆。
注:步骤 2.2 和 2.3 应在生物安全柜中执行。 - 小心地将上等离子层移出到 1 mL 的插图中的新鲜管子中,而不会干扰下层。
- 小心地将下一层自助涂层转移到新鲜管子上(该层显示为 RBC 颗粒上方的环),同时避免下层的 RBC。
- 继续用等离子体进行第 3 步,第 4 步与布菲外套。如果需要,请将分离的内容存储在-80°C。
3. 从1mL等离子体中净化循环cfDNA
注:此步骤是用商业套件执行的(见 材料表)。所有缓冲区都配有套件。
- 制备缓冲区和试剂
注意:不要将酸性溶液或漂白剂直接添加到样品制备废物中。在裂解缓冲区、绑定缓冲区和洗涤缓冲区-1中存在的瓜尼丁盐与漂白剂或酸混合时,可产生高度反应的化合物。- 绑定缓冲区:将 300 mL 的绑定缓冲浓缩物与 200 mL 的 100% 异丙酚混合,使 500 mL 的工作绑定缓冲区。在室温下存放。
注:绑定缓冲区允许循环核酸与二氧化硅膜的最佳结合。500 mL 的绑定缓冲区足以分别处理 276、138、92、69 或 55 个 1、2、3、4 或 5 mL 等离子体样品,在室温下稳定 1 年。 - 洗涤缓冲区-1:混合19 mL的洗涤缓冲区-1浓缩物与25 mL的96-100%乙醇,使44 mL的工作洗缓冲区-1。在室温下存放。
注:洗涤缓冲区-1消除与二氧化硅膜结合的污染物。44 mL 的工作洗涤缓冲区-1 足以处理 73 个 1/2/3/4/5 mL 等离子体样品,并在室温下稳定 1 年。 - 洗涤缓冲区-2:混合好13 mL洗缓冲区-2浓缩物与30 mL的96-100%乙醇,使43 mL的工作洗缓冲区-2。在室温下存放。
注:洗涤缓冲区-2消除与二氧化硅膜结合的污染物。43 mL 的工作洗涤缓冲区-2 足以处理 +56 样品的 1/2/3/4/5 mL 等离子体,并在室温下稳定 1 年。 - 在包含 310μg 亲血杆菌载体 RNA 的管子上,添加 1,550 μL 的 Elution 缓冲液,以制备 0.2 μg/μL 的载体 RNA 解决方案。彻底溶解载体RNA后,将溶液划分为合适的方位,并存储在-30°C至-15°C。 不要冻结这些方位引用超过3次。在 Lysis 缓冲器中,如 表 S1所示,添加在 Elution 缓冲区中溶解的重组载体 RNA。
注:由于载体RNA不会直接溶解在裂解缓冲区,因此需要先在Elution缓冲区溶解,然后溶解在裂解缓冲区。首先,当样品中存在的目标分子很少时,硅膜核酸结合就会增强。其次,由于存在大量载体RNA,RNA退化的风险降低。
- 绑定缓冲区:将 300 mL 的绑定缓冲浓缩物与 200 mL 的 100% 异丙酚混合,使 500 mL 的工作绑定缓冲区。在室温下存放。
- 在开始隔离之前,将柱子和样品带到室温下,并在需要时将样品体积调整为 1 mL,并配以无菌磷酸盐缓冲盐水 (PBS)。预热 2 个水浴或加热块,分别包含 50 mL 离心管和 2 mL 收集管至 60 °C 和 56 °C。
- 在 50 mL 离心管中,加入 100 μL 蛋白酶 K、1 mL 等离子体和 0.8 mL 的 Lysis 缓冲液,其中含有 1.0μg 的载体 RNA(在步骤 3.1.4 中准备)。用盖子关闭离心管,通过脉冲涡流混合内容30s,同时确保管内有一个可见的涡流。内容的彻底混合对于高效裂解非常重要。
注:在漩涡后立即继续第3.4步,毫不拖延。 - 在 60 °C 下孵化溶液 30 分钟。
- 取下盖子,将 1.8 mL 的绑定缓冲器添加到管中,并在放置盖子后与脉冲涡流彻底混合 15-30 s。
- 在冰上孵化产生的混合物5分钟,并将二氧化硅膜柱插入连接到真空泵的真空装置中。然后,将 20 mL 管扩展器牢固地插入开柱中,以防止样品泄漏。
- 小心地将孵化的混合物倒入柱子的管扩展器中,然后打开真空泵。在所有的利酸盐混合物完全穿过柱子后,关闭真空泵,将压力释放到 0 mbar,并拆卸和丢弃管延长器。
注意:避免交叉污染,应小心丢弃管扩展器,以防止其扩散到相邻的柱子上。 - 从真空装置中取出柱子,插入收集管,在室温下以 11,000 x g 的 离心机进行 30 s,以去除任何残留的解液。丢弃流经。
- 在柱子中加入 600 μL 的 Wash Buffer-1,在室温下以 11,000 x g 的 离心机进行 1 分钟,丢弃流经。
- 将 750 μL 的 Wash Buffer-2 添加到柱子中,在室温下以 11,000 x g 的速度 离心,持续 1 分钟,然后丢弃流经。
- 加入 750μL 乙醇 (96-100%)到柱子,离心机在11,000 x g 在室温下1分钟,并丢弃流经。
- 将柱子放在一个干净的 2 mL 收集管中,以 20,000 x g 的速度离心 3 分钟。
- 将膜柱组件放入新的 2 mL 收集管中,盖子打开并在 56 °C 下孵育 10 分钟,从而完全干燥膜柱组件。
- 将柱子放在一个干净的 1.5 mL 洗发管中。在柱膜的中心,应用 20-150μL 的 Elution 缓冲液,并在室温下孵育 3 分钟,盖子关闭。
注意:确保Elution缓冲区平衡到室温。如果使用小于 50 μL 的 elution 缓冲区,请确保小心地将其分配到膜的中心。这有助于完全摆脱束缚的DNA。但是,选修量不是固定的,可以根据下游应用进行更改。回收的 eluate 可高达 5 μL,当然低于适用于柱子的流出体积。 - 在20,000 x g 的微中心中将回收的埃卢特离心,1分钟以排出核酸,并储存在-20°C。
4. 从布菲外套中净化基因组DNA
注:本协议中使用的商用套件在 材料表中提及。下文协议中提及的缓冲区和试剂,即裂解缓冲器 A、裂解缓冲液 B、洗涤缓冲器 X、洗涤缓冲液 Y、蛋白酶缓冲区、Elution 缓冲区和蛋白酶 K 是此商用套件的一部分。
- 制备缓冲区和试剂
注意:不要将酸性溶液或漂白剂直接添加到样品制备废物中。乳液缓冲液B和洗涤缓冲液X中存在的瓜尼丁盐与漂白剂或酸混合时,可产生高度反应的化合物。- 洗涤缓冲区 Y: 混合好 12 mL 的洗涤缓冲区 Y 浓缩物与 48 mL 乙醇 (96-100%)获得60 mL的工作洗涤缓冲区Y.存储在室温下。
注: 60 mL 的工作洗涤缓冲区 Y 足以处理 100 个布谷涂层样品,并且稳定 1 年。 - 蛋白酶 K: 通过将 30 毫克亲血蛋白酶 K 溶解到 1.35 mL 蛋白酶缓冲液中来准备蛋白酶 K 溶液。
注:蛋白酶K的总工作解决方案足以处理52个浅黄色外套样品。蛋白酶 K 工作解决方案可在 -20 °C 下存储至少 6 个月。
- 洗涤缓冲区 Y: 混合好 12 mL 的洗涤缓冲区 Y 浓缩物与 48 mL 乙醇 (96-100%)获得60 mL的工作洗涤缓冲区Y.存储在室温下。
- 启动程序之前的步骤
- 将薄薄的外套平衡到室温。
- 将热块或水浴设置为 56 °C。
- 在 Lysis 缓冲器 A 中悬挂浅黄色外套,以获得 200 μL 的最终体积。然后加入 25 μL 的蛋白酶 K 溶液和 200μL 的裂解缓冲液 B. 通过涡流混合,在 70 °C 下孵育 10-15 分钟。确保样品完全覆盖在裂解溶液中。
注:对于一系列样品的处理,蛋白酶K和裂解缓冲区A可以在手术前10-15分钟预混合,但在此之前不再,因为蛋白酶K自我消化在裂解缓冲区A没有基质。 - 在上述混合物中加入 210 μL 的 96-100% 乙醇,并大力搅拌涡流。
注:乙醇的添加可能形成细腻的沉淀:然而,这不会影响DNA分离。请务必在列上加载沉淀物,如以下步骤所示。 - 将整个样品加载到放置在收集管中的二氧化硅柱上。离心机1分钟,11,000 x g。将柱子放在一个新的收集管中,并丢弃前一根管子以及流经。
注:如果样本未完全通过矩阵绘制,请重复离心步骤。 - 加入 500 μL 的 Wash 缓冲区 X,在 11,000 x g 下离心机 1 分钟,然后丢弃流经。
- 将柱子放入收集管中,在柱子上添加 600 μL 的洗涤缓冲区 Y,在 11,000 x g 下离心 1 分钟,然后丢弃流经。
- 再次,将柱子放入收集管中,在 20,000 x g 下将柱子离心 1 分钟,以干燥硅膜。
- 在室温下孵化柱子1分钟,放入1.5 mL微中心管中,然后加入100μL的Elution缓冲液。然后,在 11,000 x g 下离心 1 分钟,并在 -20 °C 下储存,从而排泄 DNA。
5. 使用荧光计量化 cfDNA 和基因组 DNA
- 在启动协议之前,执行以下步骤。
- 用超纯无核素水以 1:10 的比例稀释 2 μL 的精英基因组 DNA(从步骤 4.9)。由于预期浓度较低,不要稀释步骤 3.15 的 cfDNA 样品。
- 将检测标准#1和检测标准#2平衡到室温。
- 准备总共 6 个薄壁透明管 0.5 mL 大小。
注:提交的协议是量化2 cfDNA和2基因组DNA样本,因此,4管4个样本,这个检测需要2个标准。 - 给管子的盖子贴上标签。
注意:在管子侧面贴上标签可能会干扰读数。此外,检测标准管经过仔细标记,因为氟计校准要求标准处于正确的顺序。 - 用检测缓冲器在 1:200 稀释检测试剂,以准备工作解决方案。对于 4 个样本和 2 个标准,请使用 6 μL 的检测试剂加 1,194 μL 的检测缓冲液,使工作解决方案达到 1,200 μL(每管 200μL)。
注意:不要使用玻璃容器,而应使用干净的塑料管。每个管子必须包含约 200μL 的最终体积(检测标准管必须包含 190μL 的工作解决方案,样本管必须包含 180-199 μL 的工作解决方案)。必须准备足够的工作解决方案,以适应所有检测标准和样品。 - 在工作检测标准管中,添加 190μL 的工作解决方案和 10 μL 检测标准,并通过涡流混合溶液 2-3 s。避免在解决方案内形成气泡。
- 在样品管中,添加 198μL 工作解决方案和 2 μL 的 cfDNA 或基因组 DNA。将溶液通过涡流混合2-3秒,并在室温下孵育2分钟。
- 在荧光计仪器的"主屏幕"中,按下"DNA"并选择"dsDNA高灵敏度检测",以显示"标准"屏幕,然后按"是"在荧光计"标准"屏幕上读取标准。
- 在样品室中,插入检测标准#1管,合上盖子,按"读取"。读数完成后(约 3 s)取出管子,并重复标准#2的相同步骤。
- 标定过程完成后显示示例屏幕,然后插入样本管并重复步骤"5.8"。然后,"样本屏幕"将显示与样品管稀释后样品浓度相对应的值。
- 对于每个示例重复步骤"5.9",直到读取所有示例。
- 使用以下方程来计算样品的实际浓度。
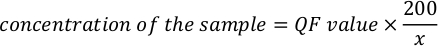
注:测定值为 ng/mL,对应于检测管稀释后的浓度。上述步骤 5.11 中提到的方程,QF 值是荧光计仪器给出的值 ,x 是添加到测定管中的微升样品数量。方程生成的 QF 值单位与荧光计提供的值相似。例如,如果荧光计的值为 ng/mL,则方程计算的浓度单位为 ng/mL。
6. dna 片段大小通过片段分析仪分配 cfDNA
- 启动手术前的步骤:将DNA染料浓缩物和DNA凝胶基质平衡到室温30分钟。
- 凝胶染料混合物的准备
注意:谨慎处理溶液,因为DMSO已知有助于有机分子进入组织。- 通过将脱氧核糖核酸染料浓缩瓶旋涡10s彻底解冻DMSO。将15μL的这种浓缩物放入DNA凝胶基质小瓶中,并在黑暗中储存在4°C。
- 再次,涡流盖瓶10s,直到凝胶和染料的混合被可视化。
- 将混合物倒在自旋滤镜上,倒入顶部容器。
- 在室温下,微中心将自旋滤光片在 2,240 x g ± 20%, 10 分钟。
- 根据良好的实验室做法,在管子中标记已制备的凝胶染料并丢弃过滤器。给管子贴上标签并记录准备日期。
注意:根据良好的实验室实践丢弃过滤。凝胶染料混合物可用于5高灵敏度(HS)DNA芯片。如果未使用超过1小时,请在4°C存储。 在黑暗中存储最多 6 周。
- 要加载凝胶染料混合物,请确保芯片启动站基板的位置,并在最低位置调整夹子。
- 将凝胶染料混合物平衡到室温30分钟,同时监测光线照射。
- 从密封袋中取出一个新的HS DNA芯片,并将其放置在芯片启动站上,然后取出凝胶染料混合物的9.0μL,并在芯片底部分配,标记为"G"。
注意:绘制凝胶染料混合物,避免可能积聚在小瓶底部的颗粒。同时将凝胶染料混合物很好地分配到HS DNA芯片中,完全插入移液器的尖端,以防止形成大气泡。此外,触摸油井边缘的移液器会产生不良效果。 - 将柱塞放置在 1 mL,并关闭芯片启动站。确保闩锁的锁单击并将定时器设置为 60 s,然后按下柱塞,直到它被剪辑按住,并且正好在 60 s 之后,用剪辑释放机制释放柱塞。
- 当柱塞至少退到 0.3 mL 标记时,等待 5 s,然后慢慢拉回 1 mL 位置,然后打开芯片启动站,再次取出凝胶染料混合物的 9.0 μL,并在 HS DNA 芯片底部分配,标记为"G"。
- 要加载 DNA 标记,将 5 μL 的 DNA 标记分配到井中,并标有梯子符号。重复所有 11 口样本井的程序。
- 要装载梯子和样品,在井中分配 1 μL 的 DNA 梯子,标记为梯子符号,然后在所有 11 口样品井中添加 1 μL 的样品(用过的油井)或 1 μL 的标记(未使用的井)。
- 通过将芯片水平放置在适配器中,以 2,400 rpm 的速度将 HS DNA 芯片调至 60 s。确保修复 HS DNA 芯片的凸起不会在涡流过程中损坏。
- 要将 HS DNA 芯片插入片段分析仪仪器中,请打开盖子并确保正确插入电极墨盒,并将芯片选择器定位为碎片分析仪仪中的"高灵敏度DNA"。
- 小心地将 HS DNA 芯片安装到容器中,该插座仅适合单向,然后通过确保电极墨盒完全适合 HS DNA 芯片的井而失去盖子。
- 片段分析器软件屏幕上的显示显示通过屏幕左上半部分的芯片图标表示插入的 HS DNA 芯片和关闭的盖子。
- 要启动 HS DNA 芯片运行,请从仪器屏幕上的"检测"菜单中选择 dsDNA 高灵敏度检测,然后通过馈送样本名称和注释等信息正确填充样本名称表,然后通过单击屏幕右上角的"开始" 按钮启动芯片运行。
- HS DNA 芯片运行后的电极清洁:一旦检测完成,立即取出用过的 HS DNA 芯片,并按照良好的实验室实践进行处置。执行以下程序,确保电极清洁,不会从以前的检测留下残留物。
- 将 350μL 的去离子化分析级水慢慢填充到其中一口电极清洁井中,然后打开盖子,然后关闭盖子,等待大约 10 s。
- 打开盖子,取出电极清洁剂,再等10下,电极上的水蒸发后再合盖。
结果
等离子体分离
在 cfDNA 或 cfRNA 防腐剂管中收集的 8.5-9 mL 血液的体积约为 4 mL 血浆。从 EDTA 管中收集的血液中分离的血浆体积可能因温度而异。在高于37°C的温度下接触含有血液的EDTA管会导致血浆体积减少44。
荧光计检测结果
胶质瘤患者#1和#3各1 mL血浆中的 cfDNA 浓度和健康对照#H1、#H2和#H3分别为 137 ng、12.6 ng、6.52 ng、2.26 ng 和 2.4...
讨论
在管子、装运和储存中收集患者的血液是液体活检的关键初始步骤。处理不当会损害血浆的质量,因此会干扰液体活检的结果。如果血液样本在EDTA血管中采集,血浆必须在采血后两小时内分离,以避免WBC裂解并将其基因组DNA释放到血浆48中。如果保存时间较长,WBCs 也可以在 EDTA 管中进行凋亡,由此产生的 cfDNA 片段可能会污染等离子体48中的?...
披露声明
作者宣称他们没有相互竞争的经济利益。
致谢
作者要感谢癌症基因组学和复杂疾病生物计算实验室的成员,感谢他们敏锐的观察投入,并参与了该项目不同阶段的多次讨论。资金支持包括以色列癌症协会(2017-2019年M.F-M的ICA赠款)和以色列创新局的卡明赠款(M.F-M.)。
材料
| Name | Company | Catalog Number | Comments |
| 2100 Bioanalyzer Instrument | Agilent Technologies, Inc. | G2939BA | The 2100 Bioanalyzer system is an established automated electrophoresis tool for the sample quality control of biomolecules. |
| Adjustable Clip for Priming Station | Agilent Technologies, Inc. | 5042-1398 | Used in combination with syringe to apply defined pressure for chip priming. |
| Agilent High Sensitivity DNA Kit | Agilent Technologies, Inc. | 5067-4626 | The High Sensitivity DNA assays are often used for sample quality control for next-generation sequencing libraries |
| cf-DNA/cf-RNA Preservative Tubes | Norgen Biotek Corp. | 63950 | Norgen's cf-DNA/cf-RNA Preservative Tubes are closed, evacuated plastic tubes for the collection and the preservation of cf-DNA, circulating tumor DNA, cf-RNA and circulating tumor cells in human whole blood samples during storage and shipping |
| Chip Priming Station | Agilent Technologies, Inc. | 5065-4401 | Used to load gel matrix into a chip with a syringe provided with each assay kit— used for RNA, DNA, and protein assays. Includes priming station, stop watch, and 1 syringe clip |
| Electrode Cleaner Kit | Agilent Technologies, Inc. | 5065-9951 | Prevents cross-contamination. Removes bacterial or protein contaminants from electrodes. |
| Filters for Gel Matrix | Agilent Technologies, Inc. | 185-5990 | Used for proper mixing of DNA dye concentrate and DNA gel matrix |
| IKA Basic Chip Vortex | IKA-Werke GmbH & Co. KG | MS-3-S36 | Used for proper mixing of DNA ladder and DNA sample on Bioanalyzer assay chips |
| NucleoSpin Tissue kit | MACHEREY-NAGEL | 740952.5 | With the NucleoSpin Tissue kit, genomic DNA can be prepared from tissue, cells (e.g., bacteria), and many other sources. |
| QIAamp circulating nucleic acid kit | Qiagen | 55114 | The QIAamp Circulating Nucleic Acid Kit enables efficient purification of these circulating nucleic acids from human plasma or serum and other cell-free body fluids. |
| QIAvac 24 Plus vacuum manifold | Qiagen | 19413 | The QIAvac 24 Plus vacuum manifold is designed for vacuum processing of QIAGEN columns in parallel. |
| QIAvac Connecting System | Qiagen | 19419 | In combination with the QIAvac Connecting System, the QIAvac 24 Plus vacuum manifold can be used as a flow-through system. The sample flow-through, containing possibly infectious material, is collected in a separate waste bottle. |
| Qubit 2.0 fluorometer | Invitrogen | Q32866 | The Qubit 2.0 Fluorometer is an easy-to-use, analytical instrument designed to work with the Qubit assays for DNA, RNA, and protein quantitation. |
| Qubit assay tubes | Thermo Fisher Scientific | Q32856 | Qubit assay tubes are 500 µL thin-walled polypropylene tubes for use with the Qubit Fluorometer. |
| Qubit dsDNA HS Assay Kit | Thermo Fisher Scientific | Q32851 | The Qubit dsDNA HS (High Sensitivity) Assay Kit is designed specifically for use with the Qubit Fluorometer. The assay is highly selective for double-stranded DNA (dsDNA) over RNA and is designed to be accurate for initial sample concentrations from 10 pg/µL to 100 ng/µL. |
| Vacuum Pump | Qiagen | 84010 | used for vacuum processing of QIAGEN columns |
| Miscellaneous | |||
| 50 ml centrifuge tubes | |||
| Crushed ice | |||
| Ethanol (96–100%) | |||
| Heating block or similar at 56 °C (capable of holding 2 ml collection tubes) | |||
| Isopropanol (100%) | |||
| Microcentrifuge | |||
| Phosphate-buffered saline (PBS) | |||
| Pipettes (adjustable) | |||
| Sterile pipette tips (pipette tips with aerosol barriers are recommended to help prevent cross-contamination) | |||
| Water bath or heating block capable of holding 50 mL centrifuge tubes at 60 °C |
参考文献
- Campbell, P. J., et al. Pan-cancer analysis of whole genomes. Nature. 578 (7793), 82-93 (2020).
- Liotta, L., Petricoin, E. Molecular profiling of human cancer. Nature Reviews Genetics. 1 (1), 48-56 (2000).
- Balamurali, D., et al. ChiTaRS 5.0: the comprehensive database of chimeric transcripts matched with druggable fusions and 3D chromatin maps. Nucleic Acids Research. 48 (1), 825-834 (2019).
- Trédan, O., et al. Molecular screening program to select molecular-based recommended therapies for metastatic cancer patients: Analysis from the ProfiLER trial. Annals of Oncology. 30 (5), 757-765 (2019).
- Oliveira, K. C. S., et al. Current perspectives on circulating tumor DNA, precision medicine, and personalized clinical management of cancer. Molecular Cancer Research. 18 (4), 517-528 (2020).
- Siegal, T. Clinical impact of molecular biomarkers in gliomas. Journal of Clinical Neuroscience. 22 (3), 437-444 (2015).
- Komori, T. The 2016 WHO Classification of Tumours of the Central Nervous System: The Major Points of Revision. Neurologia medico-chirurgica. 57 (7), 301-311 (2017).
- Duffy, M. J., O'Donovan, N., Crown, J. Use of molecular markers for predicting therapy response in cancer patients. Cancer Treatment Reviews. 37 (2), 151-159 (2011).
- Saenz-Antoñanzas, A., et al. Liquid Biopsy in Glioblastoma: Opportunities, Applications and Challenges. Cancers. 11 (7), 950 (2019).
- Marrugo-Ramírez, J., Mir, M., Samitier, J. Blood-Based Cancer Biomarkers in Liquid Biopsy: A Promising Non-Invasive Alternative to Tissue Biopsy. International Journal of Molecular Sciences. 19 (10), 2877 (2018).
- Pantel, K., Alix-Panabières, C. Liquid biopsy in 2016: Circulating tumour cells and cell-free DNA in gastrointestinal cancer. Nature Reviews Gastroenterology & Hepatology. 14 (2), 73-74 (2017).
- Bronkhorst, A. J., et al. The emerging role of cell-free DNA as a molecular marker for cancer management. Biomolecular Detection and Quantification. 17, 100087 (2019).
- Cescon, D. W., Bratman, S. V., Chan, S. M., Siu, L. L. Circulating tumor DNA and liquid biopsy in oncology. Nature Cancer. 1 (3), 276-290 (2020).
- Palmirotta, R., et al. Liquid biopsy of cancer: a multimodal diagnostic tool in clinical oncology. Therapeutic Advances in Medical Oncology. 10, 175883591879463 (2018).
- Cohen, J. D. J., et al. Detection and localization of surgically resectable cancers with a multi-analyte blood test. Science. 359 (6378), 926-930 (2018).
- Wan, J. C. M., et al. Liquid biopsies come of age: towards implementation of circulating tumour DNA. Nature Reviews Cancer. 17 (4), 223-238 (2017).
- Heitzer, E., Haque, I. S., Roberts, C. E. S., Speicher, M. R. Current and future perspectives of liquid biopsies in genomics-driven oncology. Nature Reviews Genetics. 20 (2), 71-88 (2018).
- Thierry, A. R., et al. Origins, structures, and functions of circulating DNA in oncology. Cancer and Metastasis Reviews. 35 (3), 347-376 (2016).
- Buscail, E., et al. High Clinical Value of Liquid Biopsy to Detect Circulating Tumor Cells and Tumor Exosomes in Pancreatic Ductal Adenocarcinoma Patients Eligible for Up-Front Surgery. Cancers. 11 (11), 1656 (2019).
- Heitzer, E., Ulz, P., Geigl, J. B. Circulating Tumor DNA as a Liquid Biopsy for Cancer. Clinical Chemistry. 61 (1), 112-123 (2015).
- Kustanovich, A., Schwartz, R., Peretz, T., Grinshpun, A. Life and death of circulating cell-free DNA. Cancer Biology and Therapy. 20 (8), 1057-1067 (2019).
- Crowley, E., Di Nicolantonio, F., Loupakis, F., Bardelli, A. Liquid biopsy: monitoring cancer-genetics in the blood. Nature Reviews Clinical Oncology. 10 (8), 472-484 (2013).
- Celec, P., et al. Cell-free DNA: the role in pathophysiology and as a biomarker in kidney diseases. Expert Reviews in Molecular Medicine. 20, (2018).
- Gautschi, O., et al. Origin and prognostic value of circulating KRAS mutations in lung cancer patients. Cancer Letters. 254 (2), 265-273 (2007).
- Bidard, F., et al. Detection rate and prognostic value of circulating tumor cells and circulating tumor DNA in metastatic uveal melanoma. International Journal of Cancer. 134 (5), 1207-1213 (2013).
- Chan, K. C. A., et al. Analysis of Plasma Epstein–Barr Virus DNA to Screen for Nasopharyngeal Cancer. New England Journal of Medicine. 377 (6), 513-522 (2017).
- Mao, L., et al. Detection of Oncogene Mutations in Sputum Precedes Diagnosis of Lung Cancer. Cancer Research. 54 (7), 1634-1637 (1994).
- De Mattos-Arruda, L., et al. Cerebrospinal fluid-derived circulating tumour DNA better represents the genomic alterations of brain tumours than plasma. Nature communications. 6 (1), 8839 (2015).
- Khier, S., Lohan, L. Kinetics of circulating cell-free DNA for biomedical applications: critical appraisal of the literature. Future science OA. 4 (4), 295 (2018).
- Misale, S., et al. Resistance to Anti-EGFR therapy in colorectal cancer: From heterogeneity to convergent evolution. Cancer Discovery. 4 (11), 1269-1280 (2014).
- Beddowes, E., Sammut, S. J., Gao, M., Caldas, C. Predicting treatment resistance and relapse through circulating DNA. Breast. 34, 31-35 (2017).
- Sacher, A. G., et al. Prospective Validation of Rapid Plasma Genotyping for the Detection of EGFR and KRAS Mutations in Advanced Lung Cancer. JAMA oncology. 2 (8), 1014-1022 (2016).
- Vaidyanathan, R., et al. Cancer diagnosis: from tumor to liquid biopsy and beyond. Lab on a Chip. 19 (1), 11-34 (2019).
- Kelly, P. Gliomas: Survival, origin and early detection. Surgical Neurology International. 1 (1), 96 (2010).
- Faria, G., Silva, E., Da Fonseca, C., Quirico-Santos, T. Circulating Cell-Free DNA as a Prognostic and Molecular Marker for Patients with Brain Tumors under Perillyl Alcohol-Based Therapy. International Journal of Molecular Sciences. 19 (6), 1610 (2018).
- Liu, M. C., et al. Sensitive and specific multi-cancer detection and localization using methylation signatures in cell-free DNA. Annals of Oncology. 31 (6), 745-759 (2020).
- Enko, D., Halwachs-Baumann, G., Kriegshäuser, G. Plasma free DNA: Evaluation of temperature-associated storage effects observed for roche cell-free DNA collection tubes. Biochemia Medica. 29 (1), 153-156 (2019).
- Streleckiene, G., et al. Effects of Quantification Methods Isolation Kits, Plasma Biobanking, and Hemolysis on Cell-Free DNA Analysis in Plasma. Biopreservation and Biobanking. 17 (6), 553-561 (2019).
- Thress, K. S., et al. Acquired EGFR C797S mutation mediates resistance to AZD9291 in non-small cell lung cancer harboring EGFR T790M. Nature Medicine. 21 (6), 560-562 (2015).
- Ward Gahlawat, A., et al. Evaluation of Storage Tubes for Combined Analysis of Circulating Nucleic Acids in Liquid Biopsies. International Journal of Molecular Sciences. 20 (3), 704 (2019).
- Lu, J. L., Liang, Z. Y. Circulating free DNA in the era of precision oncology: Pre- and post-analytical concerns. Chronic Diseases and Translational Medicine. 2 (4), 223-230 (2016).
- Iyapparaj, P., et al. Optimization of bacteriocin production by Lactobacillus sp. MSU3IR against shrimp bacterial pathogens. Aquatic Biosystems. 9 (1), 12 (2013).
- Ponti, G., et al. The value of fluorimetry (Qubit) and spectrophotometry (NanoDrop) in the quantification of cell-free DNA (cfDNA) in malignant melanoma and prostate cancer patients. Clinica Chimica Acta. 479, 14-19 (2018).
- Medina Diaz, I., et al. Performance of Streck cfDNA blood collection tubes for liquid biopsy testing. PLoS One. 11 (11), 0166354 (2016).
- Perkins, G., et al. Multi-Purpose Utility of Circulating Plasma DNA Testing in Patients with Advanced Cancers. PLoS One. 7 (11), 47020 (2012).
- Mouliere, F., et al. Multi-marker analysis of circulating cell-free DNA toward personalized medicine for colorectal cancer. Molecular Oncology. 8 (5), 927-941 (2014).
- Trigg, R. M., Martinson, L. J., Parpart-Li, S., Shaw, J. A. Factors that influence quality and yield of circulating-free DNA: A systematic review of the methodology literature. Heliyon. 4 (7), 00699 (2018).
- Risberg, B., et al. Effects of Collection and Processing Procedures on Plasma Circulating Cell-Free DNA from Cancer Patients. Journal of Molecular Diagnostics. 20 (6), 883-892 (2018).
- Markus, H., et al. Evaluation of pre-analytical factors affecting plasma DNA analysis. Scientific Reports. 8 (1), 7375 (2018).
- Chen, Z., et al. Comprehensive Evaluation of the Factors Affecting Plasma Circulating Cell-Free DNA Levels and Their Application in Diagnosing Nonsmall Cell Lung Cancer. Genetic Testing and Molecular Biomarkers. 23 (4), 270-276 (2019).
- Schwarzenbach, H., Hoon, D. S. B., Pantel, K. Cell-free nucleic acids as biomarkers in cancer patients. Nature Reviews Cancer. 11 (6), 426-437 (2011).
- Malyuchenko, N. V., et al. PARP1 Inhibitors: antitumor drug design. Acta Naturae. 7 (3), 27-37 (2015).
- Fleischhacker, M., Schmidt, B. Circulating nucleic acids (CNAs) and cancer-A survey. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. 1775 (1), 181-232 (2007).
- Jung, K., Fleischhacker, M., Rabien, A. Cell-free DNA in the blood as a solid tumor biomarker—A critical appraisal of the literature. Clinica Chimica Acta. 411 (21-22), 1611-1624 (2010).
- Frenkel-Morgenstern, M., et al. ChiTaRS: a database of human, mouse and fruit fly chimeric transcripts and RNA-sequencing data. Nucleic Acids Research. 41, 142-151 (2013).
- Frenkel-Morgenstern, M., et al. ChiTaRS 2.1--an improved database of the chimeric transcripts and RNA-seq data with novel sense-antisense chimeric RNA transcripts. Nucleic Acids Research. 43, 68-75 (2015).
- Gorohovski, A., et al. ChiTaRS-3.1-the enhanced chimeric transcripts and RNA-seq database matched with protein-protein interactions. Nucleic Acids Research. 45 (1), 790-795 (2017).
- Tate, J. G., et al. COSMIC: the Catalogue Of Somatic Mutations In Cancer. Nucleic Acids Research. 47 (1), 941-947 (2019).
- Brennan, C. W., et al. The somatic genomic landscape of glioblastoma. Cell. 155 (2), 462-477 (2013).
- Szopa, W., Burley, T. A., Kramer-Marek, G., Kaspera, W. Diagnostic and Therapeutic Biomarkers in Glioblastoma: Current Status and Future Perspectives. BioMed Research International. 2017, 1-13 (2017).
- Salesse, S., Verfaillie, C. M. BCR/ABL: from molecular mechanisms of leukemia induction to treatment of chronic myelogenous leukemia. Oncogene. 21 (56), 8547-8559 (2002).
- Frenkel-Morgenstern, M., Valencia, A. Novel domain combinations in proteins encoded by chimeric transcripts. Bioinformatics. 28 (12), 67-74 (2012).
- Frenkel-Morgenstern, M., et al. Chimeras taking shape: Potential functions of proteins encoded by chimeric RNA transcripts. Genome Research. 22 (7), 1231-1242 (2012).
- Simon, M., et al. TERT promoter mutations: a novel independent prognostic factor in primary glioblastomas. Neuro-Oncology. 17 (1), 45-52 (2015).
- Waitkus, M. S., Diplas, B. H., Yan, H. Isocitrate dehydrogenase mutations in gliomas. Neuro-Oncology. 18 (1), 16-26 (2016).
- Kindler, T., Meyer, R. G., Fischer, T. BCR-ABL as a target for novel therapeutic interventions. Expert Opinion on Therapeutic Targets. 6 (1), 85-101 (2002).
- Overman, M. J., et al. Use of research biopsies in clinical trials: are risks and benefits adequately discussed. Journal of Clinical Oncology Official Journal of the American Society of Clinical Oncology. 31 (1), 17-22 (2013).
- Vanderlaan, P. A., et al. Success and failure rates of tumor genotyping techniques in routine pathological samples with non-small-cell lung cancer. Lung Cancer. 84 (1), 39-44 (2014).
- Stewart, C. M., Tsui, D. W. Y. Circulating cell-free DNA for non-invasive cancer management. Cancer Genetics. 228-229, 169-179 (2018).
- Normanno, N., et al. The liquid biopsy in the management of colorectal cancer patients: Current applications and future scenarios. Cancer Treatment Reviews. 70, 1-8 (2018).
- Hufnagl, C., et al. Evaluation of circulating cell-free DNA as a molecular monitoring tool in patients with metastatic cancer. Oncology Letters. 19 (2), 1551-1558 (2020).
- Petit, J., et al. Cell-Free DNA as a Diagnostic Blood-Based Biomarker for Colorectal Cancer: A Systematic Review. The Journal of Surgical Research. 236, 184-197 (2019).
- Poulet, G., Massias, J., Taly, V. Liquid Biopsy: General Concepts. Acta Cytologica. 63 (6), 449-455 (2019).
- Alix-Panabières, C. The future of liquid biopsy. Nature. 579 (7800), 9 (2020).
- Eisenstein, M. Could liquid biopsies help deliver better treatment. Nature. 579 (7800), 6-8 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。