Method Article
在伊蚊中传播微孢子寄生虫Edhazardia aedis
摘要
培养微孢子寄生虫Edhazardia aedis的规程。寄生虫从一代伊蚊通过幼虫阶段的水平转移传递到下一代,随后在成人阶段垂直传播。活的精子在受感染的卵子中长期存活。
摘要
Edhazardia aedis是伊蚊的微孢子寄生虫,伊蚊是一种传播多种病毒的病媒,每年导致数百万例疾病病例。E. aedis导致蚊媒的死亡和繁殖能力下降,并已被探索其作为生物控制剂的潜力。我们为培养E.aedis而呈现的协议基于其自然感染周期,它涉及蚊子宿主不同生命阶段的水平和垂直传播。ae. aegypti蚊子在幼虫阶段暴露在孢子中。这些受感染的幼虫然后成熟成成人,并将寄生虫垂直传至后代。然后,受感染的后代被用作孢子的来源,用于未来的水平传播。鉴于寄生虫的生命周期的复杂性,培养E.aedis对未启动者可能具有挑战性,该协议提供了详细的指导和视觉辅助工具,用于澄清。
引言
伊蚊是多种病毒(如登革热、寨卡、黄热病)的蚊媒,估计每年可导致数亿例疾病病例,12人死亡3万多人。这些病原体引起的疾病的治疗仅限于支持性护理,而且未来3日可能会出现更多的病毒。因此,控制蚊媒是首要的,因为它有效地防止了当前和新出现的病原体的传播。传统上,病媒控制战略主要使用化学杀虫剂,但对许多常用杀虫剂的抗药性推动了对病媒控制新方法的需求。一个潜在的代理,已被探索的生物控制性质对艾吉普提是寄生虫Edhazardia aedis5,6。
E.aedis,1930年由库多首次确定为诺塞玛伊迪斯,是一种微型寄生虫,是7种阿吉普提蚊子的微生物寄生虫。 E.aedis的开发和繁殖是比较复杂的,其生命周期可以以多种方式进行7、8、9。一个常见的发育周期在贝克内尔等人,1989年7日深入描述,并用于实验室传播(图1)8。简言之,当Ae.aegypti卵子垂直感染E.aedis孵化成受感染的幼虫时,这个周期就开始了,幼虫体内会形成单核孢子,通常以幼虫或幼虫死亡。从死幼虫中释放的核孢子污染了栖息地,并由健康的Ae. aegypti 幼虫摄入。这些孢子主要在消化道发芽,感染暴露的幼虫的消化组织,导致水平传播。水平感染的幼虫发育成成人(父母生成),在那里形成双核孢子。在女性中,这些双核糖孢子侵入生殖道,其相关的孢子体感染发育中的卵细胞。这些卵子然后孵化成受感染的幼虫(孝长),导致寄生虫的垂直传播和循环的延续,如上所述。
多项研究已经调查了E.aedis在生物控制方面的潜力。感染E.aedis已经证明会导致10岁女性繁殖能力下降。此外,在半场实验中,E.aedis的淹没释放导致完全消灭了保存在筛选的外壳6中的一个测试Ae. aegypti 种群。虽然E.aedis能够在多种蚊子中经历一些发展阶段,但只在E.aegypti中垂直传播,表明宿主特异性11,12。同样,在实验室评估与E.aedis相关的潜在环境风险时,微孢子寄生虫未能感染非目标水生动物,包括摄入感染E.aedis13的食肉动物。这些结果突出了E.aedis在针对自然Ae. aegypti 种群的生物控制策略中使用的潜力。
尽管E. aedis 在矢量控制中显示出了使用的希望,但大规模培养和部署它却面临挑战。E. aedis孢子在低温(即5°C)下不到一天就会失去感染性。即使在温暖的温度(即25°C)下,孢子在三周14日之间迅速失去感染力。此外,必须培养活的艾吉普提蚊子和控制给健康的幼虫蚊子给,以确保完成生命周期,并防止用于培养8的人口崩溃。体内培养的要求提出了挑战;然而,最近蚊子大规模饲养和机器人技术(如马萨罗等人15)的进步可能允许大规模生成E.aedis孢子。我们预计,这种方法的可视化将增加对E.aedis饲养协议的可访问性,并允许更多的研究人员研究该系统的基本生物学和应用潜力。我们还预计,这将促进与工程师、机器人学家和更广泛的技术部门加强合作,从而有助于改善E.aedis的大规模饲养。
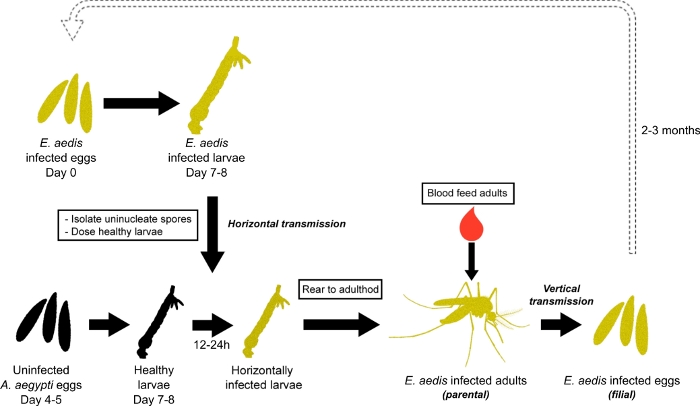
图1:E.aedis在艾吉普提的传播。 E.aedis 的传播始于孵化E. aedis 感染的卵子。受感染的幼虫被饲养到第4个星,E.aedis孢子从这些幼虫中分离出来,孢子用于口头感染健康的2/3第三星幼虫,这些幼虫从未受感染的卵子(水平传输)中饲养。这些口头感染的幼虫然后被饲养到成年(父母一代),并产卵感染E.aedis(垂直传播)。受感染的卵子(孝生代)然后孵化,以继续感染周期和寄生虫培养。请单击此处查看此图的较大版本。
研究方案
1. 第 0 天
- 将 1升(DI) 水放入幼虫饲养托盘中,将蛋类蛋与 E.aedis 感染。加入50毫克的鱼食。
注:在出版时 ,E.aedis的实验室 菌株只能从积极研究寄生虫的实验室获得, 因为E.aedis 不能长期储存,受感染的卵子目前不储存在储存库中。有兴趣与 E.aedis合作的研究人员 可以联系相应的作者,请求受感染的卵子。
注:通常不需要孵化大量受感染的鸡蛋; 10个E.aedis 感染的 E.aegypti 幼虫足以给1000≥剂量。
注:对于本协议的所有部分,我们在以下条件下安置蚊子:14 小时/10 小时光/暗循环、27 °C 温度和 80% 相对湿度。
2. 第 1 天
- 孵化后,将幼虫密度降低至每托盘+100幼虫,必要时制作新托盘(也用1升DI水)。
- 在每个托盘中加入一块干猫粮。耗尽食物后补充食物,但不提供过量的食物。每三天一块猫粮(约200毫克)就足够了。
注:根据特定的饲养条件调整食物量(即,如果水变得浑浊或幼虫死亡,减少食物;如果幼虫发育严重延迟,则减少食物)。可以使用此处建议的其他喂养方案和/或饲养条件,但可能需要调整此标准协议的时间安排。
3. 第 4 天\u20125
- 当受感染的幼虫是3~4星时,在一个新的托盘中孵化出健康/未受感染的Ee.aegypti卵子。
- 后方的密度, 使健康的 Ae. aegypti 达到2 + 3第 三星在 48 - 72 小时。在我们手中,这可以通过密度200\u2012300幼虫每1升水与 副利比 图姆获得食物。多日孵化一批健康卵子可以保证幼虫在需要的时候处于正确的阶段。
4. 第 7 天\u20128: 水平传输
注:在感染幼虫中,在单核孢子数量高(1 x 104 = 1 x 106 6,每个幼虫)中,不能对健康的幼虫进行对健康的幼虫的给给。这发生在第4星阶段的后期(图2)。
- 收获和量化单核孢子。
- 使用转移移液器(可能需要将尖端切到更宽的直径)将 10 个受感染的幼虫移动到 1.5 mL 微离心管。
- 用转移移液去除育种水,加入±1 mL的清洁DI水洗一次。用移液去除洗涤水,在10个幼虫中加入500μL的清洁DI水,并使用害虫和机械均质器均质化。
- 使用血细胞计以 400 倍的放大倍率量化孢子。
注:核糖孢子可以通过其独特的火种形状(即梨形)来识别;图2A)。
- 剂量 健康 Ae. aegypti 幼虫与 E. aedis.
- 混合1.2克肝粉、0.8克啤酒酵母和100 mL水,制作新鲜的幼虫食品浆料。
注:如果食物被自动保存并储存在4°C,直到使用,就不需要新鲜。 - 将 1002 – 3第 3 个星健康 Ae. aegypti 幼虫转移到 150 mL 烧杯或标本杯中。
- 剂量每个烧杯100幼虫与5 x 104 × 1 x 105 孢子。
- 将 2 mL 的幼虫食物浆料和 DI 水加入到 100 mL 的最终体积中。
- 混合1.2克肝粉、0.8克啤酒酵母和100 mL水,制作新鲜的幼虫食品浆料。
- 在12~24小时暴露后,按照标准的饲养方案16将暴露的幼虫转移到饲养托盘和成年后。
5. 监测和垂直传输
- 监测被点幼虫的幼崽,并在它们发育到笼子里出现杯时,将幼虫转移到它们。糖饲料成人广告(根据16,17)。与成人接触的成人将被感染。
- 血液喂养成人(根据16,17)和收集鸡蛋。E. aedis 的垂直传输在此步骤中发生。
注:如果一旦卵巢完成就提供额外的血餐,女性在成人遭受(通常是突然)高死亡率之前,至少可以多产一组卵子。 - 使用这些 感染 E. aedis 的 Ae. aegypti 卵子 ,从本协议的第 1 步开始继续繁殖。
注:鸡蛋在适当条件下可储存2~3个月。 - 用 10% 漂白剂和高压灭灭(如果可能)清洁所有与 E. aedis 接触的材料,以防止污染。
结果
E. aedis感染了Ae. aegypti利物浦 (LVP1b12) 鸡蛋孵化,如上述协议所述。在第4个星形阶段,可以观察到感染的视觉迹象,包括整个受感染幼虫的脂肪体中的白孢子囊肿(图2B所示)。核糖孢子是在500μL DI水中均质10幼虫,从第4个星体幼虫中收获的。这些孢子是火种(梨形),在400倍时很容易看到(图2A)。使用血细胞计计算孢子计数为4.05 x 103孢子/μL。100个健康的Ee.aegypti幼虫随后在100 mL水中水平感染50,000个孢子,最终剂量为500个孢子/幼虫。幼虫被饲养到成年(父母一代)和血液喂养使用除颤的兔血加上1%(v/v)100 mM腺苷三磷酸盐。垂直感染的卵子被收集(孝代)和孵化,以继续E.aedis繁殖和量化感染成功。
在孵化后7天,25个孝感代幼虫被转移到单独的1.5 mL微离心管中,用DI水洗涤一次。在250μL的DI水和感染状态中,个体幼虫均质化,使用血细胞计评估E.aedis负载。发现孝感代E.aedis的垂直感染率为96%,孵化后7天感染者平均孢子负荷为3.31×105(范围:3.25×104 ~1.47×106;图3.
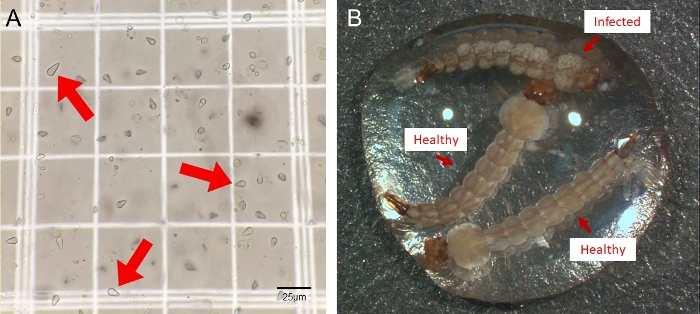
图2:Ae.aegypti蚊子的E.aedis感染的可视化。(A ) E. aedis单核状孢子.10个E.aedis感染的第4个星幼虫在孵化后大约7天在500μL的DI水中均质化。10 μL 的均质被加载到血细胞计上,以 400 倍的速度查看。红色箭头表示具有代表性的单核E. aedis孢子。(B) E.aedis感染第4个星体幼虫在其脂肪体中形成独特的白色孢子囊肿18。他们通常也有畸形和扩张的腹部部分。请单击此处查看此图的较大版本。
图3:文化协议导致孝感 代有效 感染。孝感代的 Ae. aegypti 幼虫 (n = 25) 在 250 μL DI 水中单独均质,10 μL 的均质被加载到血细胞计上。单核孢子的存在表明感染呈阳性,孢子被量化为所有阳性样本。(A) 孝感幼虫感染的流行率。灰色对应于未感染的幼虫,黑色对应于感染。每个段上显示的数字给出每个组中个人的绝对计数。(B) 每个感染者的孢子负载。黑点表示每个幼虫的日志 10 转化的单核孢子计数。 请单击此处查看此图的较大版本。
讨论
我们在这里介绍最初在亨布里和瑞安中描述的方法,1982年8月8日,在艾艾普提蚊子中饲养E.aedis微孢子。 本研究中使用的E.aedis菌株来源于1979年19月19日斯蒂芬·亨布里在泰国的原始现场收集。该方法利用水平传播,这自然发生在E.aedis7的传输周期,以受控的方式传播寄生虫。对于不熟悉孢子外观、幼虫感染症状或成功完成多阶段饲养/给法协议所需的协调的新人,此方法可能具有挑战性。我们希望,伴随该协议的视觉辅助工具将减少研究人员的进入障碍,他们希望培养E.aedis。
我们如上文所述在艾吉普提传播了E.aedis,并量化了孝顺一代寄生虫的成功。简言之,我们孵化了E.aedis感染的E.aegypti卵子,把它们饲养到第4个星,从受感染的幼虫中收集了单核E.aedis孢子。然后,我们通过口服摄入用这些孢子水平感染健康幼虫,并饲养水平感染的幼虫到成年。我们用血喂养受感染的成年人(父母一代),并采集卵子(孝生一代),我们假设这些卵子会垂直感染E.aedis寄生虫。我们从孝感一代孵化出卵子,在幼崽是第4个星时,采集并同化了一部分幼虫。我们量化了感染E.aedis的幼虫百分比和所有感染者的总孢子数。我们发现绝大多数(96%)被感染者,被感染幼虫平均孢子负荷为+105。我们的结论是,我们的饲养协议在艾吉普提蚊子中非常成功地传播了E.aedis。
此协议有多个方面对未启动的用户可能特别具有挑战性。我们提供以下一些可能提供帮助的其他信息。对于一般蚊子饲养的问题,Ae. aegypti菌落维护的完整指南超出了本协议的范围。然而,许多常见问题可以通过来自生物防御和新兴感染研究资源库16,17的资源可以解决,包括卵子孵化,一般饮食需求,住房和环境条件,以及血液喂养。关于感染的时间表,从受感染的卵子中孵化的幼虫直到4号星期后期才出现感染迹象。在1~2天中,核糖孢子迅速出现。幼虫在孵化后6天可能看起来几乎未感染,但在第7天或第8天孵化后感染高度。此外,在均质样品中可视化孢子可能具有挑战性,因为整个蚊子同质质中存在许多其他微生物,包括与E. aedis单核孢子大小相类似的其他真核单细胞生物(例如酵母)。E.aedis孢子的独特形状(图2A)是一种高度可靠的识别方法,有助于将E.aedis与同质质的其他微生物区分开来。虽然不需要进行鉴定或定量,但如果需要孢子纯化,可以通过胶体二氧化硅密度梯度离心实现,从而允许将E.aedis孢子与同质质的其他污染元素分离。这个过程在Salter等人20中详细描述了。
在饲养实践中使用的温度和饮食在实验室之间通常有所不同,但变异仍可能产生成功的寄生虫传播。幼虫食物类型的细微差异不会干扰成功感染,尽管我们没有明确测试此协议中不同的食物类型。温度对感染的影响已经过测试,在21日的广泛温度下,发现 E.aedis 感染是健壮的。最大孢子产量发生在30.8 °C,但在饲养温度低至20°C时仍然强劲。 孢子计数在较高的饲养温度(36°C)下显著减少,因此本协议应避免这些温度。
在使用寄生虫时,污染始终是一个问题。 E. aedis 是 Ae. aegypti 的一种成功的寄生虫 ,因此必须与未受感染的实验室菌落分开以防止污染。如果可能,我们建议将受感染的蚊子储存在单独的孵化器中。我们还建议,用于微孢子工作的材料(如幼虫托盘、转移移液管、笼子、鸡蛋收集杯)指定用于微孢子工作,而不是在整个昆虫中更广泛地使用。所有饲养材料应在使用后用 10% 漂白剂消毒,并可用于补充漂白剂灭菌。
披露声明
作者没有什么可透露的。
致谢
我们要感谢斯宾塞·布兰肯希普在蚊子饲养方面的帮助。我们还感谢詹姆斯·拉德尔和多米尼克·马吉斯特拉多对手稿的有益反馈。
材料
| Name | Company | Catalog Number | Comments |
| 120 mL Specimen cup | McKesson | 911759 | Inexpensive alternative to beaker |
| 150 mL beakers | VWR | 10754-950 | For larval dosing |
| 2 oz round glass bottle | VWR | 10862-502 | Bottle for 10% sucrose in adult cages |
| 3 oz. emergence cup | Henry-Schein | 1201502 | For transfer of pupae to cage |
| Adult mosquito cages | Bioquip | 1462 or 1450ASV | For adult housing |
| Autoclave | For sterilization | ||
| Bleach | For sterilization | ||
| Brewer’s yeast | Solgar | For feeding larvae during dosing | |
| Controlled rearing chamber | Tritech | DT2-MP-47L | Inexpensive small rearing chamber |
| Cotton roll | VWR | 470161-446 | Wick for sugar bottles |
| Defibrinated rabbit blood | Fisher | 50863762 | For blood feeding adults |
| Disodium ATP, crystalline | Sigma-Aldrich | A26209-5G | For blood feeding adults |
| Dry cat food | 9Lives | Indoor Complete | For general larval rearing |
| Fish food flakes | TetraMin | For general larval rearing | |
| Hemocytometer | Fisher | 267110 | For counting spores |
| Homogenizer/mixer motor | VWR | 47747-370 | For homogenizing infected larvae |
| Larval rearing trays | Sterillite | 1961 | Overall dimensions are 11" x 6 5/8" x 2 3/4" |
| Liver powder | NOW foods | 2450 | For feeding larvae during dosing |
| Pipette 1 - 10µL | VWR | 89079-962 | For larval dosing |
| Pipette 100 - 1000µL | VWR | 89079-974 | For food during larval dosing |
| Pipette tips 1 - 10µL | VWR | 10017-042 | For larval dosing |
| Pipette tips 100 - 1000µL | VWR | 10017-048 | For food during larval dosing |
| Plastic pestles | VWR | 89093-446 | For homogenizing infected larvae |
| Sucrose, crystalline | Life Technologies | 15503022 | For adult feeding |
| Transfer pipet | VWR | 414004-033 | For larval transfer, must trim ends |
参考文献
- Yellow fever. World Health Organization Available from: https://www.who.int/en/news-room/fact-sheets/detail/yellow-fever (2019)
- Dengue and severe dengue. World Health Organization Available from: https://www.who.int/en/news-room/fact-sheets/detail/dengue-and-severe-dengue (2020)
- Weaver, S. C. Prediction and prevention of urban arbovirus epidemics : A challenge for the global virology community. Antiviral Research. 156, 80-84 (2018).
- Rather, I. A., Parray, H. A., Lone, J. B., Paek, W. K., Lim, J., Bajpai, V. K., Park, Y. H. Prevention and Control Strategies to Counter Dengue Virus Infection. Frontiers In Cellular and Infection Microbiology. 7, 336 (2017).
- Becnel, J. J. Edhazardia aedis (Microsporidia: Amblysporidae) as a biocontrol agent of Aedes aegypti (Diptera: Culicidae). Proceedings and abstracts, Vth International Colloquium on Invertebrate Pathology and Microbial Control. , 20-24 (1990).
- Becnel, J. J., Johnson, M. A. Impact of Edhazardia aedis (Microsporidia: Culicosporidae) on a seminatural population of Aedes aegypti (Diptera: Culicidae). Biological Control. 18 (1), 39-48 (2000).
- Becnel, J. J., Sprague, V., Fukuda, T., Hazard, E. I. Development of Edhazardia aedis (Kudo, 1930) N. G., N. Comb. (Microsporida: Amblyosporidae) in the mosquito Aedes aegypti (L.) (Diptera: Culicidae). Journal of Protozoology. 36, 119-130 (1989).
- Hembree, S. C., Ryan, J. R. Observations on the vertical transmission of a new microsporidian pathogen of Aedes aegypti from Thailand. Mosquito News. 42, 49-54 (1982).
- Johnson, M. A., Becnel, J. J., Undeen, A. H. A new sporulation sequence in Edhazardia aedis (Microsporidia: Culicosporidae), a parasite of the mosquito Aedes aegypti (Diptera: Culicidae). Journal of Invertebrate Pathology. 70 (1), 69-75 (1997).
- Becnel, J. J., Garcia, J. J., Johnson, M. A. Edhazardia aedis (Microspora: Culicosporidae) effects on the reproductive capacity of Aedes aegypti (Diptera: Culicidae). Journal of Medical Entomology. 32 (4), 549-553 (1995).
- Becnel, J. J., Johnson, M. A. Mosquito host range and specificity of Edhazardia aedis (Microspora: Culicosporidae). Journal of the American Mosquito Control Association. 9 (3), 269-274 (1993).
- Andreadis, T. G. Host range tests with Edhazardia aedis (Microsporida: Culicosporidae) against northern Nearctic mosquitoes. Journal of Invertebrate Pathology. 64 (1), 46-51 (1994).
- Becnel, J. J. Safety of Edhazardia aedis (Microspora: Amblyosporidae) for nontarget aquatic organisms. Journal of the American Mosquito Control Association. 8 (3), 256-260 (1992).
- Undeen, A. H., Becnel, J. J. Longevity and germination of Edhazardia aedis (Microspora: Amblyosporidae) spores. Biocontrol Science and Technology. 2, 247-256 (1992).
- Massaro, P., Sobecki, R., Behling, C., Criswell, V., Zha, T., Devenzengo, R. T. Automated mass rearing system for insect larvae. , (2018).
- Methods in Aedes Research. BEI Resources Available from: https://www.beiresources.org/Portals/2/VectorResources/Methods_20in_20Aedes_20Research_202016.pdf (2016)
- Methods in Anopheles Research. BEI Resources Available from: https://www.beiresources.org/portals/2/MR4/MR4_Publications/Methods_20in_20Anopheles_20Research_202014/2014MethodsinAnophelesResearchManualFullVersionv2tso.pdf (2014)
- Desjardins, C. A., et al. Contrasting host-pathogen interactions and genome evolution in two generalist and specialist microsporidian pathogens of mosquitoes. Nature Communications. 6 (1), 1-12 (2015).
- Hembree, S. C. Preliminary Report of some mosquito pathogens from Thailand. Mosquito News. 39 (3), 575-582 (1979).
- Solter, L. F., Becnel, J. J., Vávra, J. Research methods for entomopathogenic microsporidia and other protists. Manual of Techniques in Invertebrate Pathology. , 329-371 (2012).
- Becnel, J. J., Undeen, A. H. Influence of temperature on developmental parameters of the parasite/host System Edhazardia aedis (Microsporidia: Amblyosporidae) and Aedes aegypti (Diptera: Culicidae). Journal of Invertebrate Pathology. 60, 299-303 (1992).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。