Method Article
使用机器人微注射操作脑片中单神经干细胞和神经元
* 这些作者具有相同的贡献
摘要
该协议演示了使用机器人平台对单个神经干细胞和脑切片中的神经元进行微注射。该技术用途广泛,提供一种跟踪高空间分辨率组织中细胞的方法。
摘要
发育神经生物学的一个核心问题是神经干和祖细胞如何形成大脑。要回答这个问题,需要标记、操纵和跟踪脑组织中具有高分辨率的单个细胞。由于大脑中组织的复杂性,这项任务极具挑战性。我们最近研制出一种机器人,利用显微镜获得的图像将脑电图解量转化为单细胞,引导微注射针进入脑组织。机器人操作增加,总产量比手动微注射大一个数量级,并允许精确标记和灵活操作活组织中的单个细胞。有了这个,一个人可以在一个单一的器官切片中微分数百个细胞。本文演示了微注射机器人对脑组织切片中神经祖细胞和神经元的自动微注射的用途。更广泛地说,它可用于任何上皮组织,其表面可以通过移液器到达。一旦设置,微注射机器人每分钟可以执行15个或更多微注射。微注射机器人由于其吞吐量和性能,将使微注射成为一种简单明了的高性能细胞操作技术,用于生物工程、生物技术和生物物理学,用于在器官脑切片中进行单细胞分析。
引言
该协议描述了使用机器人瞄准和操纵脑组织切片中的单个细胞,特别是单神经干细胞和神经元。机器人被开发为了解决发育神经生物学中的一个核心问题,即神经干细胞和祖细胞如何对大脑形态发生1、2、3、4、5的贡献。为了回答这个问题,人们需要标记和跟踪单个神经干细胞,并跟踪其随时间变化的血统进展,将单细胞行为与组织形态生成关联。这可以通过不同的方式实现,例如,通过电吸收脑组织在子宫内或使用脂嗜血模具标记单个细胞。虽然功能强大,但这些方法缺乏精确的单细胞分辨率(电穿孔)和/或操纵细胞内空间(嗜脂染料)的可能性。微注射到单细胞被开发,以克服这一挑战6,7,8。在微注射期间,移液器被短暂地插入到完整组织内的单个细胞中,压力为微注射性脑细胞量的试剂9。我们之前曾描述过在器官组织中对单个神经干细胞进行微输入的手动程序(图1A)10,11。神经干细胞的微注射依赖于使用插入单个神经干细胞的微管,以注射含有荧光染料的溶液以及其他感兴趣的分子。神经干细胞的选择性靶向是通过心室表面(或心室,见图1A中的卡通)接近发育中的电头脑,这是由蛋白祖细胞的蛋白血浆膜形成的(图1A中的卡通)。对于实验者希望注入的每个细胞,必须重复此过程。此外,微注射的成功取决于对组织中微管注射的深度和持续时间的精确控制。因此,尽管具有独特的优势,手动微注射是非常繁琐的,需要大量的实践,以合理的吞吐量和产量执行,使这种技术难以以可扩展的方式使用。为了克服这一限制,我们最近开发了一种图像引导机器人,自动注射器12(或微注射机器人),可以自动执行微注射到单个细胞。
微注射机器人利用显微成像和计算机视觉算法精确定位组织内三维空间中特定位置进行微注射(图1B)。通过对现有微注射设置进行相对简单的修改,可以构建微注射机器人。微注射机器人的整体示意图如图 1C所示。移液器安装在连接到三轴操纵器的移液器支架中。显微镜相机用于获取组织和微注射针的图像。定制压力调节系统用于控制移液器内部的压力,使用可编程微操纵器控制微显微移液器的位置。组织和微注射移液器的相机图像用于确定微注射移液器尖端的空间位置以及需要执行微注射的位置。然后,该软件计算在组织内移动移液器所需的轨迹。所有硬件都由我们之前开发的软件控制。所有软件都是用编码语言编写的(例如,Python 和 Arduino),并且可以从https://github.com/bsbrl/Autoinjector下载。图形用户界面 (GUI) 允许用户对组织和微管进行成像,并自定义微注射的轨迹。我们的系统可以通过相对简单的修改来建立,这种显微镜配备有亮场和脱光滤光片。
首先,我们提供关于准备脑器官组织切片进行微注射的说明。然后,该协议说明了启动微注射机器人,然后是准备步骤,如移液器运动校准,需要在微注射之前完成。然后是定义喷射参数。在此之后,用户可以定义微注射机器人使用的轨迹,并开始注射过程。微致组织(本例中为脑有机体组织切片)可根据实验设计10、11的不同时间在培养中保存。组织可以处理,以跟踪和研究注射细胞及其后代的身份和命运。或者,可以使用实时成像跟踪微分细胞。在该协议范围内,我们演示了机器人在小鼠E14.5后脑细胞的器官细胞中自动进行微注射神经祖细胞的使用。该机器人进一步能够微注射到小鼠脑电脑的新生儿神经元,以及人类胎儿脑电12。
总之,我们描述了一个机器人平台,可以用来跟踪和操纵组织中的单细胞。该平台利用压力,因此,它对于注射化合物的化学性质具有极其通用性。此外,它可以适应干细胞以外的目标细胞。我们期望我们的系统也能够轻松适应其他模型系统。
研究方案
所有动物研究都是按照德国动物福利立法进行的,并且从德国德累斯顿动物实验区域伦理委员会(德累斯顿地区动物实验道德委员会)获得必要的许可证。从E14.5或E16.5 C57BL/6小鼠胚胎脑(Janvier实验室)中准备的有机切片。
1. 软件安装
- 按照说明安装软件,请https://github.com/bsbrl/Autoinjector。
2. 试剂和移液器的制备
- 阿加罗斯:分别在两个200 mL玻璃瓶中,在100 mL的细胞培养级PBS中分别溶解3克宽范围加糖和3克低熔点加糖,以补充3%的加糖。在室温下储存长达3个月。
- 泰洛德溶液:在1L蒸馏水中溶解1克碳酸氢钠和泰洛德盐(使用整个瓶子的含量)和13 mL 1 M HEPES。将 pH 调整为 7.4。通过 0.2 μm 瓶顶过滤器过滤溶液。
- 切片培养培养素(SCM):加入10mL大鼠血清, 1 mL 的 2 mM 谷氨酰胺,1 mL 青霉素链霉素 (100 倍),1 mL 的 N-2 补充剂 (100x),2 mL 的 B27 补充剂 (50x) 和 1 mL 的 HEPES (pH 7.3) 缓冲液到 84 mL 的神经基础介质。将 5 mL 的 SCM 分成 15 mL 管。储存在-20°C。
- CO2- 独立微注射介质(CIMM):通过溶解200 mL蒸馏水中的粉末,准备5倍DMEM改性低葡萄糖溶液(无酚红色)。通过 0.2 μm 瓶顶过滤器过滤溶液(对于 DMEM 粉末,请使用整个瓶子的含量)。要准备 100 mL 的 CIMM, 混合20 mL的5xDMEM改性溶液,1 mL的海蛋白缓冲液,1 mL的N2补充剂(100x),2mL的B27补充剂(50x),1mL的青霉素链霉素(100x),1mL的2mM谷氨酰胺和74mL的蒸馏水。将溶液储存在4°C。
- 重组缓冲液:在蒸馏水中溶解262 mM NaHCO3、0.05N NaOH、200 mM HEPES来准备重组缓冲液。通过瓶顶 0.22 μm 过滤系统将溶液消毒到无菌玻璃瓶中。将500μL的重组缓冲液放入气密微离心管中。储存在4°C。
- 微注射染料库存:在 RNase 自由蒸馏水中溶解荧光标记的 Dextran(最终浓度 10 μg/μL)。准备 5 μL 等分,储存在 -20 °C 下,直到使用。
- 使用微移子拉拔器从硅酸盐玻璃毛细管(1.2 mm 外径,0.94 mm 内径)中拉出微注射移液器。保护移液器免受灰尘的污染。请勿在超过 2 ~ 3 天内存放移液器。对于本实验,拉力参数为热:斜坡温度+1 ~5;拉动: 100;VEL: 110;德尔: 100。HEAT 和 VEL 是影响移液器形状和尺寸最多的参数。
注:最佳微注射移液器具有长而灵活的尖端,以避免微注射期间细胞损伤。
3. 组织切片制备
- 在脑组织解剖之前,使用微波炉融化3%宽范围的阿加罗斯。在嵌入之前,不要让水浴在37°C下凝固。确保移液器免受灰尘的污染。请勿在超过 2 ~ 3 天内存放移液器。
- 使用水浴将 SCM 的等分和加热 10 ~ 12 mL CIMM 和 20 mL 的 Tyrode 溶液解冻至 37°C。
- 将荧光示踪剂(Dextran-3000 或 Dextran-10000-Alexa 结合;最终浓度为 5 ~ 10 μg/μL)与其他要注射的化学物质混合。在 4 °C 下,将微注射溶液在 16,000 x g 下离心 30 分钟。 收集上一液并转移到一个新的管。将微注射溶液放在冰上直到使用。
- 使用 E13.5 + E16.5 小鼠胚胎的头来准备脑电图的器官组织切片。去除皮肤,用钳子打开头骨,沿中线移动。从开放的头骨中解剖胚胎大脑,从大脑的腹侧取出覆盖脑组织的脑管。将解剖的整个大脑留在泰洛德溶液中,放在 37°C 加热块上。
注:3.4 中描述的所有解剖步骤都必须在预谋的 Tyrode 解决方案中执行。 - 将广范围熔化的阿加罗斯倒入一次性嵌入模具中。当阿加罗斯冷却至38~39°C时,使用巴斯德移液器小心地将大脑(最多4个)转移到其中。始终使用此步骤的切割提示。
- 用铲子或一对杜蒙的钳子搅拌组织周围的#1,无需接触组织。让加糖在室温下凝固。一旦糖凝固,修剪组织周围的多余的阿加罗斯。
- 用 PBS 填充缓冲纸盒。用垂直于托盘的组织玫瑰花轴定向大脑(用作标志性,表示大脑的旋转部分)。使用振动器切割 250 μm 切片。
- 用 2 mL 的预谋介质填充 3.5 厘米的培养皿。使用塑料巴氏移液器,将切片(10 - 15)转移到这道菜中。完成后,将带切片的培养皿移入切片培养箱。在含有 40% O 2 / 5% CO 2 / 55%N 2 的加湿大气中,将切片保持 37 °C,直到使用。
4. 微注射
- 打开计算机、显微镜、显微镜相机、操纵器、压力钻机和压力传感器。通过单击从GitHub 下载的主文件夹中的文件"launchapp.py"加载应用程序,并在弹出窗口中指定设备设置(有关安装说明,请参阅步骤 1.1)。
- 在将移液器淹没到溶液中之前,创建向外压力以防止不必要的堵塞。要对移液器施加压力,请将补偿 压力条 滑动到 24 ~ 45%,然后单击 "设置值"。接下来,将机械压力阀旋钮转动至压力传感器指示的 1 + 2 PSI(69 ~ 138 mbar),将压力调到足够压力。
- 将切片转移到含有 2 mL 预热 CIMM 的 3.5 厘米培养皿中。将切片放在培养皿的中心进行微缩。将培养皿转移到预热 (37 °C) 微注射阶段。
- 使用长尖塑料移液器,用 1.4 ±1.6 μL 的微注射溶液(从步骤 3.3 开始)加载微注射移液器。将微注射移液器插入移液器支架上。
- 使用显微镜上的最低放大倍率,将切片聚焦到焦点,并将微移子引导到此视场 (FOV),以便它聚焦在与切片目标相同的平面上。将显微镜的输出切换到摄像机,以查看应用程序中的 FOV。
- 单击界面左上角的放大按钮以启动设备校准。窗口将提示选择放大倍率。选择 10 倍放大倍率,或将镜头设置为的任何放大倍率(例如,4 倍、10 倍、20 倍、40 倍),然后按 "确定"。该软件假设内部客观透镜为10倍(最常见的客观透镜放大倍率)。
- 使用显微镜的微量滚轮重新聚焦移液器尖端,然后用光标单击移液器尖端。接下来,按步骤 1.1按钮,然后按弹出窗口中的"确定"。移液器将朝 Y 方向移动。单击移液器的尖端,然后按步骤 1.2按钮。最后,在"点线"角度框中输入 45,然后按"设置角度"。
- 在自动微注射控制面板中输入所需的参数。对于对蛋白原的微注射,将注射距离设置为 20 × 40 μm,深度设置为 10 ~ 15 μm。对于神经元的微注射,将注射距离设置为 30 × 40 μm 从基底侧,深度设置为 10 × 30 μm,具体取决于目标。始终将速度设置为 100%。单击"设置值"。
注:接近距离是移液器在移动到下一个注射距离之前从组织中拉出的距离,深度是微注射到组织的深度,间距是顺序注射之间的直线距离,速度是移液器的速度在μm/s。 - 单击 "绘制 边缘"按钮,沿弹出窗口中的所需轨迹拖动光标以定义喷射轨迹。对于微向前细胞干细胞,脑积层表面的腹侧是靶向,如图 2A所示。将移液器带到线路的开始,然后单击移液器的尖端。单击 "运行 轨迹"开始微分。对目标注射的每个平面重复此步骤(通常对 3 + 4 平面执行,每个平面有 40 ~ 75 次注射)。
5. 免疫荧光组织培养和组织切片处理
- 准备胶原蛋白混合物(1.5毫克/mL):在管中加入1.25 mL的基质溶液,0.5 mL的蒸馏水,0.5 mL的5xDMEM-F12溶液和0.25 mL的重组缓冲液。放在冰上直到使用。
- 从切片培养培养室获取含有微插入切片的培养皿,将切片浸入胶原蛋白混合物中。
- 将切片与 200 ~ 300 μL 的胶原蛋白混合物一起转移到 35 mm 玻璃底盘的 14 mm 井中。确保切片覆盖在非常少的胶原蛋白。这种设置允许营养和氧气吸收的最佳条件。
- 使用两对钳子调整切片方向,同时确保切片之间有足够的空间。在37°C下用加热块孵育培养培养皿5分钟,使胶原蛋白凝固。将这次视为切片区域性的 t = 0。
- 将培养皿移回切片培养箱,额外 40 分钟。然后添加 2 mL 的预战 SCM。切片保存在区域性中,直到所需的时间点。
- 将切片从切片培养箱中取出,并吸走 SCM。用 1x PBS 清洗胶原蛋白嵌入切片。加入4%(wt/vol)的甲状甲醛(在120mM磷酸盐缓冲液中,pH 7.4),将组织留在RT下30分钟。然后移动到4°C,以便进行隔夜固定。
- 第二天吸气甲醛溶液,进行1次PBS洗涤。要从胶原蛋白中去除切片,请使用两对钳子在立体显微镜下轻轻提取切片。
- 使用微波熔化 3% (wt/vol) 低熔点 agarose,用于处理微开冰片。将融化的阿加罗斯倒入一次性嵌入模具中,冷却至约38~39°C。
- 使用塑料巴斯特移液器将组织切片从步骤 5.7 转移到含有低熔化气液的模具中。确保切片的皮亚尔侧向上,心室表面朝下。如果需要,可以相应地定向。让阿加罗斯冷却到 Rt 凝固。
- 修剪切片周围的额外加糖。定向 agarose 块,确保切割表面与振动器的切割刀片平行。使用振动器,切割50μm厚的部分。
- 用 1x PBS 填充 24 个井盘。使用细尖画笔将部分转移到此盘中。根据标准协议执行免疫荧光。
结果
微注射用于跟踪和操纵单个神经干细胞及其在活组织中的后代,并在生理环境中跟踪其血统进展。本文演示了微注射机器人对小鼠脑电图的靶向和自动微注射的器官切片的使用。 图2显示了 成功注射的祖细胞的代表性图像, 图3说明了 注射的新生神经元。当注射德斯特兰亚历克萨-488(或Alexa-A555)染料时,细胞似乎充满了染料。至于表祖(图2)共生成像,可以用高空间分辨率重建细胞形态,存在或不存在的细胞和基质附着,并将形态学探究与标记表达式相结合。通过结合这些标准,用户可以为微受感染的细胞及其后代分配特定的细胞命运。对于神经元注射,用户可以重建神经元形态,包括突起树突和斧头的结构和特征。与手动微注射相比,自动微注射可提供更高的吞吐量(图2B)。此外,EdU 标签确认细胞生存能力不受自动化影响(图 2C)。保持区域性中的有机切片允许微基因细胞的后继法进展(我们在图 2D 中显示了 4 - 24h)。如果微注射溶液含有遗传物质(DNA、mRNA、CRISPR-Cas9指南)或重组蛋白,则允许研究是否以及血统进展是否受到操纵的影响。
对组织中单神经干细胞的微注射提供了出色的单细胞分辨率,因此它被用来解剖神经干细胞进展和命运转变的细胞生物学(图3A)。微注射允许交付复杂的化学品混合物。我们之前利用这一功能,通过将间隙结渗透与间隙结接不渗透荧光染料12混合,研究神经祖细胞中的结耦合。我们通过研究新生神经元的交联耦合,通过注射路西法黄与Dextran-A555(图3B)扩展了先前的工作。如图 3B所示,一定比例的新生金字塔神经元通过间隙结与相邻神经元耦合。这种观察与不成熟的神经元通过间隙结13,14进行交流的想法是一致的。此外,靶向神经元表明,微注射机器人的使用可以推广到发育中的哺乳动物大脑中的几种细胞类型。这种实验装置将有助于解剖组织中神经元的细胞生物学,例如通过提供特定的寡肽来干扰蛋白质-蛋白质的相互作用。
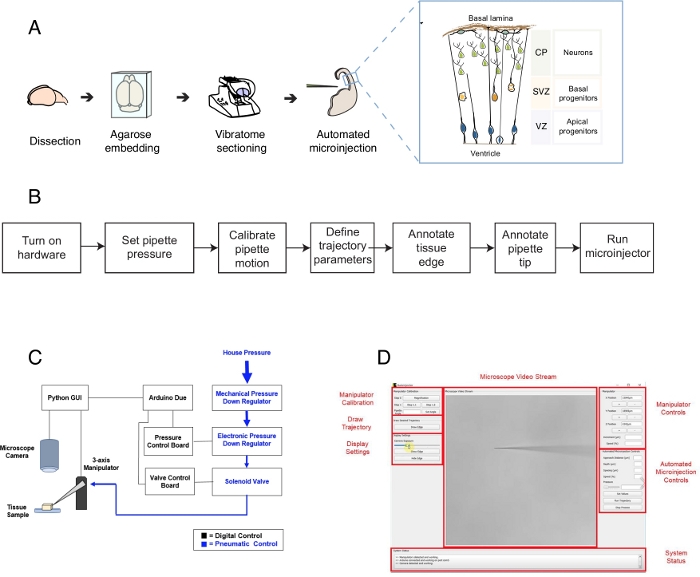
图1:自动微注射设置和协议。(A) 使用微注射机器人进行组织准备和自动微注射的总体方案。右插入: 小鼠 Telencephalon 的卡通示意图, 用于此协议中的微注射。(B) 自动微注射步骤的流程图。(C) 微注射机器人硬件的示意图.(D) 用于控制和操作微注射机器人的软件的图形用户界面(GUI)。这个数字是根据参考文献12。请单击此处查看此图的较大版本。
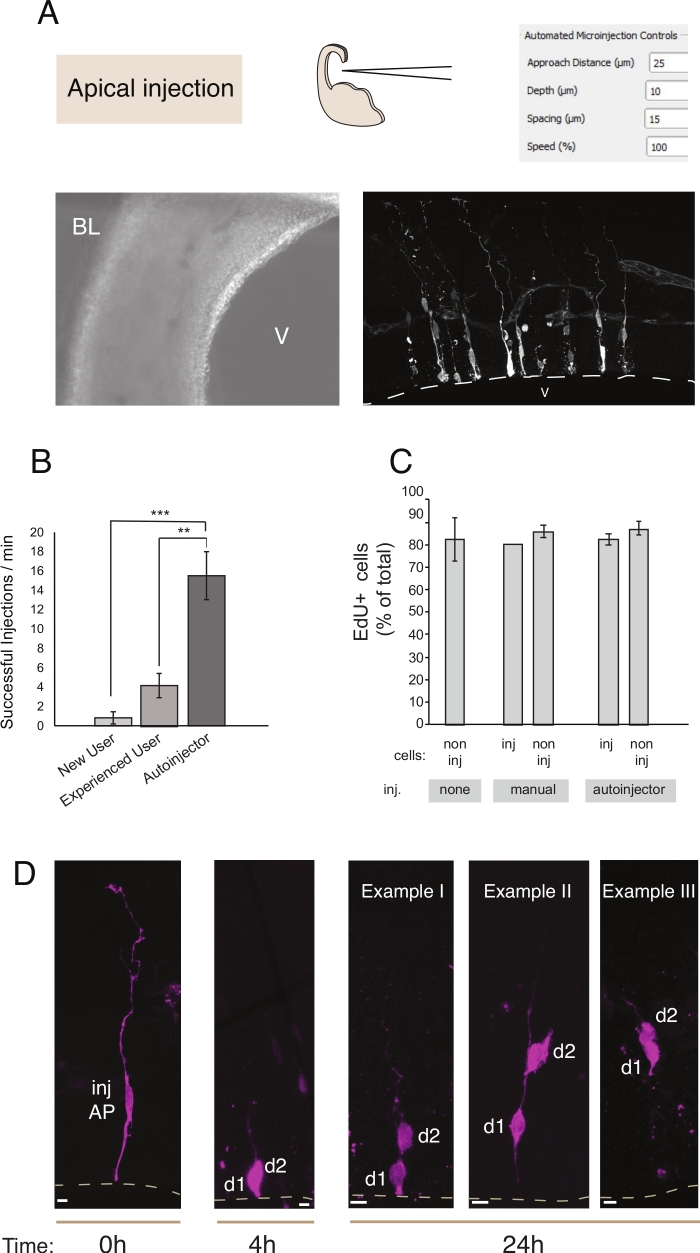
图2:机器人微注射成蛋白祖。使用微注射机器人通过面图(喷射注射)瞄准前祖(AP)时,会取得预期结果。(A) 顶行。在左侧:流程的示意图。右侧:具有用于喷注的相关参数的 GUI。底行。左侧:注射过程中拍摄的相位对比度图像(V:心室;BL: 基底拉米纳)。右侧:显示微信息的 AP 的代表性结果。虚线表示心室 (V)。比例杆:10 μm. (B) 为手动微注射系统新手用户、手动微注射系统经验丰富的用户和微注射机器人每分钟成功注射。(C) EdU在注射区域的微注射细胞和非注射细胞中合并。使用 Dextran-A488(用于手动和自动注射器),小鼠 E14.5 后脑电头的有机切片要么 (i) 未注射,要么 (ii) 接受手动或自动微注射(注入切片)。切片在 Edu 的存在下保存为 24 小时, 然后它们被固定和染色为 Dapi 和 Edu 。注射区域中的注射和非注射细胞被评分为EdU的积极性。(D) 使用微注射机器人血统追踪。荧光染料(Dx3-A555,品红色)被注射到单神经干细胞中(t = 0h)。荧光染料在分膜形成过程中被分割成子细胞(d1,d2)。这允许跟随注射细胞的后代(t = 4小时和24小时),并揭示随着时间的推移的血统进展。对于 t = 24 h,我们显示了几个后代的后代示例。比例线:10 μm。B 和 C 中的图形取自参考文献 12请单击此处查看此图的较大版本。
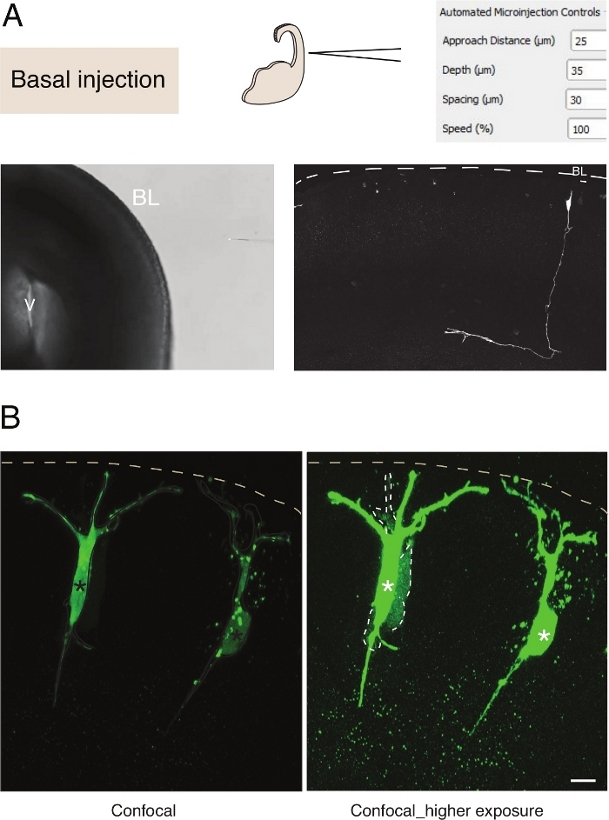
图3:机器人微注射到神经元。使用微注射机器人通过基底表面(基础注射)瞄准金字塔神经元 (N) 时,将结果和预期结果进行。(A) 顶行。在左侧:流程的示意图。右侧:GUI 与基础注入的相关参数。底行。左侧:注射过程中拍摄的相位对比度图像(V:心室;BL: 基底拉米纳)。在右侧:显示微数字的 N. Dashed 行的代表性结果表示基底层 (BL)。比例杆:10μm. (B) 使用自动注射器研究组织中的间隙结交通信。金字塔神经元被注射一种含有两种染料的溶液:间隙结-不渗透Dx-A555(未显示)和间隙结渗透路西法黄色(绿色)。Dx-A555 被限制在目标单元格(星号)中,而 LY 会扩散到通过间隙交汇点连接到目标单元格的单元格(虚线)。左面板:曝光率低,只有微暴露的细胞可见。右面板:高曝光允许可视化注入的单元格以及耦合单元格(虚线)。比例线: 10 μm. 请单击此处查看此图的较大版本。
补充文件:排除微注射过程中出现的一些常见错误。请点击这里下载此文件。
讨论
对组织中单神经干细胞的微注射提供了出色的单细胞分辨率,因此它被用来解剖神经干细胞进展和命运转变的细胞生物学(图2;另见10,11,12)。自动微注射程序可以在胚胎小鼠和人脑组织的其他类型细胞上执行。图3显示了以脑电基脑基底表面为目标对新生神经元进行微注射的代表性结果。
这里确立的原理可以应用于胚胎小鼠大脑和人类大脑中几种不同细胞类型。我们之前已经表明,微注射机器人也可以用来瞄准小鼠后脑和脑电和新生神经元中的小鼠和人类发育的新皮质12中的单个祖细胞。为了获得注射过程的最佳效果,在开始注射之前,应优化所有步骤。重要的是要仔细考虑和优化从脑组织中存活和保存良好的组织切片的制备(图1)。在图1所示的解剖和切片过程中快速 进行至关重要。对于面向 AP 的喷射,应选取显示面图理想方向的切片。对于 AP 注射,理想的方向是垂直于培养皿底部的平面。任何其他方向也将是允许的,但是,垂直于Petri盘的平面面为注射提供了更宽的表面面积,从而增加了注射的成功率。对于注入神经元,切片的方向几乎没有效果。
选择要注入的切片后,每个切片的注入过程大约需要 5 分钟。考虑到一个人与活组织工作,强烈建议加快注射程序。为此,我们建议在组织准备就绪之前,通过 GUI(图 1D)设置所有注射参数,以减少任何不必要的等待时间。有关故障排除,请参阅 补充文件。
在长期切片培养的情况下,自动微注射程序后的步骤会影响细胞的健康,从而影响实验。因此,强烈建议运行质量控制测试并优化切片培养条件。为了评估切片和注射过程后细胞的生存能力,我们在培养过程中进行了EdU标记,并量化了培养物中皮克诺蒂核(凋亡细胞的代理)的数量,并注射了组织12。这些定量没有显示微注射对组织生存能力的任何显著影响(图2C)。我们建议在实验室中建立器官组织切片和微注射管道时运行类似的质量控制。
与手动微注射相比,微注射机器人具有若干优点。首先,与手动注入相比,用户的学习曲线要小一些:新用户在有限的会话(通常为 1 或 2)后,会达到高熟练程度。其次,在手动微注射的情况下,可比的熟练程度需要几个月的培训。注射过程更快、更高效(图2B)。我们量化了这些参数,发现微注射机器人在注射成功(注射成功率/注射总数)和每单位时间注射总数12方面优于熟练的手动用户。与熟练用户相比,微型注射机器人的注射效率(成功注射/分钟数)总体提高了 300%。将微注射机器人与初学者用户进行比较时,效率的提高更为明显,达到700%。最后,但并不是最不重要的,微注射机器人可以很容易地编程,以系统地探索所有空间参数。当使微注射机器人适应新的细胞或组织时,或者当将微注射机器人用于需要不同空间分辨率的目的时,这尤其有利。
构建微注射机器人需要对现有荧光显微镜12进行最小的改变。我们之前在一次调整时曾https://github.com/bsbrl/Autoinjector。设置硬件后,此协议提供成功进行自动微输入的关键方法详细信息。总体而言,微注射机器人的注射成功率为15.52~2.48次注射/分钟,比没有经验的用户(1.09±0.67注射/分钟)高15倍,比专家用户(4.95±1.05次注射/分钟)高3倍。成功注射率的这种改进使新手和专家用户能够更短的时间内注射更多的细胞,这对保持组织活力至关重要。此外,微注射机器人是可定制的,可以使用GUI调整轨迹、注射深度、注射次数、注射间隔。这些功能允许微注射机器人作为工具,以优化以前费力的实验,并探索需要比之前更高的产量的根本新的实验。
我们在这里描述的微注射过程的主要局限性与组织切片的制备有关,这是需要广泛优化的关键步骤。此外,微注射依赖于玻璃移液器可以接近的表面的存在。此功能限制使用当前设置可通过微注射定位的组织和组织位置的类型。
微注射机器人目前使用亮场成像,并已被用于体外脑切片制剂。将来,微注射机器人可以与2光子成像相结合,以增加体内单细胞靶向的特异性,用于分子或染料标记。对于单细胞电生理学15、16,已经做出了这样的努力。当前设备需要手动观察微注射程序。未来的版本可能包括清洁堵塞的微注射移液器17的策略,或集成流体处理机器人18多路复用,完全自主的微注射。这些设备可以增加微注射的规模数量级。适应算法并行控制多个微注射移液器19可以在同一实验中将数十种染料和分子试剂多路复用地传递到同一细胞中。这有可能为组织中的分子筛选开辟新的途径。
微注射机器人可用于使用DNA或RNA条形码标记功能识别的细胞。这反过来可以与其他单细胞分析技术相结合,如单细胞RNA测序(scRNAseq)和电子显微镜。我们的初步结果表明,微受感染细胞及其后代可以通过组织分离,然后进行FACS排序(Taverna,未发表的结果)进行恢复和分离。然后,FACS 排序的单元格可用于 scRNAseq。此外,初步结果表明,微注射机器人的单细胞分辨率能力可与电子显微分析相结合,以高空间分辨率探索组织中神经干细胞的细胞生物学(Taverna和 Wilsch-Brüuninger,未发表结果)。这些数据表明,微注射机器人可以作为组织内相关光和电子显微镜的工具,在更广泛的意义上,用于组织中细胞特性和行为的多式联运分析。
微注射依赖于压力的使用,人们能够负担得起高分子复杂性的注射溶液(例如,整个转录组)。过去,微注射的这一特点已被利用来隔离和克隆配体门受体20。沿着这条线,微注射机器人可用于建模和研究多基因特征在细胞水平。结合亚池策略,微注射机器人也可以用作一个平台,以确定驱动特定特征/细胞行为的最小基因集。到目前为止,微注射机器人已经被用来操纵细胞的生物化学通过提供mRNA,DNA或重组蛋白10,21,22。我们预见到微注射机器人在探测细胞内空间的生物物理学方面的应用,例如,通过提供纳米材料或纳米机器,可以感应和/或操纵细胞内空间的生物物理特性。
披露声明
作者没有什么可透露的。
致谢
作者要感谢诺米斯基金会(ET)。SBK 确认机械工程部的资金, 明尼苏达大学明尼苏达高等教育系、国家卫生研究院 (NIH) 1R21NS103098-01、1R01NS111028、1R34NS1111654、1R21NS112886 和 1R21 NS111196 的 MnDRIVE RSAM 计划GS得到了国家科学基金会研究生研究研究金和国家自然科学基金组织IGERT培训基金的支持。
材料
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Agarose, Low Melt | Carl Roth | Cat# 6351.2 | |
| Agarose, Wild Range | Sigma-Aldrich | Cat# A2790 | |
| Best-CA 221 Glue | Best Klebstoffe GmbH & Co.KG | Cat# CA221-10ml | |
| B-27 Supplement | Thermo Fisher Scientific | Cat# 17504044 | |
| Cellmatrix Type-IA (Collagen, Type !) | FUJIFILM Wako Chemicals | Cat# 637-00653 | |
| Distilled Water | |||
| DMEM-F12, CO2 independent (w/o Phenol red) | Sigma-Aldrich | Cat# D2906 | |
| DMEM-F12, CO2 independent (with Phenol red) | Sigma-Aldrich | Cat# D8900 | |
| HEPES-NAOH, pH 7.2, 1M (HEPES buffer) | Carl Roth | Cat# 9105.3 | |
| L-Glutamine, 200 mM | Thermo Fisher Sientific | Cat# 25030024 | |
| Mowiol 4-88 | Sigma-Aldrich | Cat# 81381 | |
| N-2 Supplement | Thermo Fisher Scientific | Cat# 17502048 | |
| Neurobasal Medium | Thermo Fisher Scientific | Cat# 21103049 | |
| Nuclease-free water | Thermo Fisher Scientific | Cat# AM9937 | |
| O2 (40%), CO2 (5%), N2 (55%) Mix, 50 liters | |||
| Paraformaldehyde | Merck | Cat# 818715 | |
| PBS | |||
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | Cat# 15140122 | |
| Rat serum | Charles River Laboratories | ||
| Japan | |||
| Sodium bicarbonate (NaHCO3) | Merck | Cat# 106323 | |
| Sodium hydroxide (NaOH) | Merck | Cat# 106482 | |
| Tyrode’s salt | Sigma | Cat# T2145-10x1L) | |
| Equipment | |||
| Borosilicate glass capillaries, 1.2 mm outer diameter x 0.94 mm inner diameter | Sutter Instruments | Cat# BF-120-94-10 | |
| Bottle-top filter system, 500 mL | Corning | Cat# 430769 | |
| Computer PC | |||
| Custom pressure rig | Custom pressure rig | ||
| Electronic pressure regulator | Parker Hannifin | Cat# 990-005101-002 | |
| Falcon tubes, 15 mL | Corning | Cat# 430791 | |
| Falcon tubes, 50 mL | Corning | Cat# 430829 | |
| Fine-tip paintbrush | |||
| Flaming/ Brown micropipette puller | Sutter Instruments | Cat# P-97 | |
| Forceps, Dumont no. 3 | Fine Science Tools | Cat# 11231-30 | |
| Forceps, Dumont no. 5 | Fine Science Tools | Cat# 11255-20 | |
| Forceps, Dumont no. 55 | Fine Science Tools | Cat# 11252-20 | |
| Heating block | Labtech International | Cat # Dri block Digi2 | |
| Inverted fluorescence microscope | Zeiss | Cat# Axiovert 200 | |
| Light source | Olympus | Cat# Highlight 3100 | |
| Manual pressure regulator | McMaster Carr | Cat# 0-60 PSI 41795K3 | |
| Microloader Tips | Eppendorf | Cat# 5242956.003 | |
| Microcontroller | Arduino | Cat# Arduino Due | |
| Microscope camera Hamamatsu Orca Flash 4.0 V3 | |||
| Motorized stage XY for microscope | |||
| Multiwell plate, 24 wells | Nunc | Cat# 142475 | |
| Pasteur pipettes, plastic | |||
| Petri dish, 60 x 15 mm | Greiner | Cat# 628102 | |
| Petri dish, 35 x 10 mm | Nunc | Cat# 153066 | |
| Petri dish, 34 x 14 mm, including Microwell no. 1.5 cover glass | MatTek | Cat# P35G-1.5-14-C | |
| Pipette holder | Warner Instruments | Cat# 64-2354 MP-s12u | |
| Pipette and tips | |||
| Puller filament, 3.0-mm square box filament | Sutter Instrument | Cat# FB330B | |
| Slice culture incubation box | MPI-CBG | Cat# custom made | |
| Solenoid valve | Cat# LHDA053321H-A | ||
| Stereomicroscope | Olympus | Cat# SZX12 | |
| Tabletop centrifuge | Heraeus | Cat# 5431622 | |
| Thermometer | |||
| Three-axis Manipulator | Sensapex Inc | Cat# tree-axis uMP | |
| Vibratome | Leica | Cat# VT1000s | |
| Whole-embryo-culture-system incubator | Ikemoto Company | Cat# RKI-10-0310 | |
| Waterbath | |||
| Software and Algorithms | |||
| Arduino | Arduino | ||
| Fiji | RRID: SCR_002285 | ||
| Python | Python Software foundation | Python 2.7.12 | |
| ZEN | RRID: SCR_013672 |
参考文献
- Taverna, E., Götz, M., Huttner, W. B. The Cell Biology of Neurogenesis: Toward an Understanding of the Development and Evolution of the Neocortex. Annual Review of Cell and Developmental Biology. 30 (1), 465-502 (2014).
- Götz, M., Huttner, W. B. The cell biology of neurogenesis. Nature Reviews Molecular Cell Biology. 6 (10), 777-788 (2005).
- Di Lullo, E., Kriegstein, A. R. The use of brain organoids to investigate neural development and disease. Nature Reviews Neuroscience. 18 (10), 573-584 (2017).
- Lancaster, M. A., Knoblich, J. A. Organogenesisin a dish: Modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Kretzschmar, K., Clevers, H. Organoids: Modeling Development and the Stem Cell Niche in a Dish. Developmental Cell. 38 (6), 590-600 (2016).
- Pepperkok, R. et al. Automatic microinjection system facilitates detection of growth inhibitory mRNA. Proceedings of the National Academy of Sciences of the United States of America. 85 (18), 6748-6752 (1988).
- Pepperkok, R., Lowe, M., Burke, B., Kreis, T. E. Three distinct steps in transport of vesicular stomatitis virus glycoprotein from the ER to the cell surface in vivo with differential sensitivities to GTPγS. Journal of Cell Science. 111 (13), 1877-1888 (1998).
- Pepperkok, R. et al. β-COP is essential for biosynthetic membrane transport from the endoplasmic reticulum to the Golgi complex in vivo. Cell. 74 (1), 71-82 (1993).
- Ansorge, W., Pepperkok, R. Performance of an automated system for capillary microinjection into living cells. Journal of Biochemical and Biophysical Methods. 16 (4), 283-292 (1988).
- Taverna, E., Haffner, C., Pepperkok, R., Huttner, W. B. A new approach to manipulate the fate of single neural stem cells in tissue. Nature Neuroscience. 15 (2), 329-337 (2012).
- Wong, F. K., Haffner, C., Huttner, W. B., Taverna, E. Microinjection of membrane-impermeable molecules into single neural stem cells in brain tissue. Nature Protocols. 9 (5), 1170-1182 (2014).
- Shull, G., Haffner, C., Huttner, W. B., Kodandaramaiah, S. B., Taverna, E. Robotic platform for microinjection into single cells in brain tissue. EMBO Reports. 20 (10), e47880 (2019).
- Jabeen, S., Thirumalai, V. The interplay between electrical and chemical synaptogenesis. Journal of Neurophysiology. 120 (4), 1914-1922 (2018).
- Nagy, J. I., Pereda, A. E., Rash, J. E. Electrical synapses in mammalian CNS: Past eras, present focus and future directions. Biochimica et Biophysica Acta - Biomembranes. 1860 (1), 102-123 (2018).
- Suk, H.J. et al. Closed-loop real-time imaging enables fully automated cell-targeted patch-clamp neural recording in vivo. Neuron. 95 (5), 1037-1047 (2017).
- Annecchino, L. A. et al. Robotic automation of in vivo two-photon targeted whole-cell patch-clamp electrophysiology. Neuron. 95 (5), 1048-1055 (2017).
- Kolb, I. et al. Cleaning patch-clamp pipettes for immediate reuse. Scientific Reports. 6, 35001 (2016).
- Holst, G. L. et al. Autonomous patch-clamp robot for functional characterization of neurons in vivo: development and application to mouse visual cortex. Journal of Neurophysiology. 121 (6), 2341-2357 (2019).
- Kodandaramaiah, S. B. et al. Multi-neuron intracellular recording 1 in vivo via interacting autopatching 2 robots. ELife. 7, 24656 (2018).
- Lubbert, H. et al. cDNA cloning of a serotonin 5-HT1c receptor by electrophysiological assays of mRNA-injected Xenopus oocytes (RNA fractionation/hybrid depletion/hybrid selection/choroid plexus/voltage clamp). Neurobiology. 84 (2) 4332-4336 (1987).
- Florio, M. et al. Human-specific gene ARHGAP11B promotes basal progenitor amplification and neocortex expansion. Science. 347 (6229), 1465-1470 (2015).
- Kalebic, N. et al. CRISPR/Cas9-induced disruption of gene expression in mouse embryonic brain and single neural stem cells in vivo. EMBO Reports. 17 (3), 338-348 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。