Method Article
肝癌的仿生模型,用于研究具有可调生物物理特性的3D环境中的肿瘤-斯特罗马相互作用
摘要
该协议提供了一个3D仿生模型与伴随的纤维频闪隔间。用生理上相关的水凝胶配制,比例模仿频闪细胞外基质的生物物理特性,是细胞相互作用、肿瘤生长和转移的活性介质。
摘要
肝细胞癌(HCC)是慢性肝病后发展为一种原发性肝肿瘤。慢性肝病和炎症导致纤维化环境积极支持和推动肝癌发生。因此,从肿瘤频闪微环境与肿瘤细胞之间的相互作用来看,对肝癌发生机制的洞察具有相当的重要性。三维(3D)细胞培养模型被提出为当前体外2D细胞培养模型和体内动物模型之间的缺失联系。我们的目标是设计一个新的3D生物仿生HCC模型与伴随纤维频闪室和血管。生理上相关的水凝胶,如胶原蛋白和纤维蛋白原被纳入模仿肿瘤ECM的生物物理特性。在此模型中,嵌入在水凝胶基质中的 LX2 和 HepG2 细胞被播种到倒置的跨膜插入物上。然后,HUVEC细胞被播种到膜的对面。制备了三种配方,由嵌入细胞的ECM-水凝胶组成,生物物理特性由流变学决定。细胞存活率是由细胞生存能力测定在21天内决定的。化疗药物多索鲁比辛的效果在2D共生和我们的3D模型中评估了72h。流变结果表明,纤维化、胆汁和HCC肝的生物物理特性可以成功模仿。总体而言,结果表明,与传统 2D 文化相比,这种 3D 模型更能代表体内环境。我们的3D肿瘤模型显示化疗反应下降,模仿HCC患者通常看到的耐药性。
引言
肝细胞癌(HCC)占所有原发性肝癌的90%1,2。每年有81万人死亡,85.4万新发病例,目前排名世界第五,死亡率最高。HCC的发展主要归因于与慢性肝病有关的炎症,即病毒性肝炎、慢性过量饮酒、代谢综合征、肥胖症和糖尿病1、3、4。 与这些病理条件相关的炎症导致肝细胞损伤和各种细胞因子的分泌,激活和招募肝细胞和炎症细胞,以启动纤维化5。肝细胞在肝纤维化的启动、进展和回归中起着关键作用。激活后,它们分化成肌纤维细胞,如具有收缩、亲炎和亲纤维化特性的细胞6、7、8。由此产生的纤维化反过来又导致细胞外基质重塑酶活性的调节不力,造成一种环境,其特点是整体刚度增加,同时生长因子分泌,这进一步促成了HCC发病机理9,10。正是这种肝细胞和频闪环境之间的连续致病反馈回路,助长了癌症的发病,上皮到间质过渡(EMT),血管生成,转移潜力,和改变药物反应11,12,13。 因此,从机械学角度,而且从治疗角度,从肿瘤与肿瘤微环境的相互作用来看,对肝癌发生机制的洞察具有相当的重要性。
体外细胞培养模型的二维(2D)主要被80%的癌细胞生物学家使用。然而,这些模型并不代表真正的肿瘤微环境,它影响化疗反应14,15,16。目前96%的化疗药物在临床试验中失败14. 药物流失率的高发病率可归因于体外预检模型不能完全代表我们目前对HCC复杂性和微环境16的洞察和理解。相反,在体内动物模型存在免疫系统受损和肿瘤和微环境之间的相互作用差异相比,人类16,17。平均而言,只有8%的动物研究结果可以可靠地从临床前转换到临床环境16,17。因此,很明显,HCC的评价需要开发一个体外平台,有效地回顾肿瘤的复杂性,而且微环境。这些平台将补充目前可用的体外临床前筛查模型,并在未来7,14减少动物研究的数量。
其中一个平台是先进的三维(3D)细胞培养模型。在过去的十年里,许多研究HCC的先进3D模型已经出现,并且已经发表了各种评论。可用于研究 HCC 的 3D 模型包括多细胞球体、器官、脚手架模型、水凝胶、微流体和生物打印。其中,多细胞球体是肿瘤发育研究中最著名的模型之一。球状体是一个廉价的模型,技术难度低,同时有效地模仿体内肿瘤结构18,19,20。多细胞球体为HCC17、21、22的丰富信息做出了贡献。然而,由于多细胞球体在文化中保存在7至48天之间,因此缺乏标准化的文化时间。增加文化时间非常重要。艾伦贝格尔发现,球形年龄的差异深刻地影响索拉菲尼布(一种用于治疗肝癌的激酶抑制剂)的扩散性和毒性23。虽然弗热辛斯基和费伊发现,3D肝细胞球形需要18天,以重建关键的生理肝功能后,尝试,并继续显示稳定的功能,长达24天后,这种恢复24,25。
一些更先进的 3D HCC 模型包括使用人类去细胞化肝脚手架和生物打印脚手架。Mazza和他的同事利用不适合移植的去细胞化人类肝脏,为HCC建模创造了一个天然的3D脚手架。这些天然脚手架可以成功地重新填充21天,由肝类恒星和肝母细胞共同培养,同时保持关键的细胞外基质组件的表达,如胶原蛋白I型、III型、IV型和纤维素。除疾病建模外,该模型还具有功能器官移植和临床前药物和毒性筛查26的优点。随着 3D 生物打印的进步,3D 细胞外矩阵脚手架现在也可以进行生物打印。 马和他的同事,生物打印的细胞外矩阵脚手架具有可变的机械特性和生物仿生微构造使用水凝胶工程师从去细胞化细胞外矩阵27。毫无疑问,这些都是优秀的3D HCC模型。然而,人类肝脏的缺乏和获得必要设备和材料所涉及的费用使这些模型处于不利地位。此外,这些方法在技术上都是先进的,需要广泛的培训,可能不是很容易提供给所有研究人员。
基于 HCC 的复杂性和现有 3D 模型,我们努力开发一个包罗万象的 3D HCC 模型。我们的目标是通过结合可调水凝胶刚度值来回顾前期和肿瘤微环境的模型。 此外,我们还包括肝细胞和频闪相关细胞系,这些细胞系在HCC的发病机制中起着关键作用。其中包括内皮细胞、肝细胞和恶性肝细胞,它们生长在由生理相关水凝胶组成的微环境中。与选定的水凝胶,胶原蛋白I型和纤维蛋白原,纳入的比例可与生物物理变化在HCC的启动和进展期间看到肝脏僵硬。 此外,我们的目标是建立一种可以长期保存在文化中的模式。我们设想了一个模块化、经济高效的模型,可以配备基本设备、最少的培训和经验以及现成的材料。
研究方案
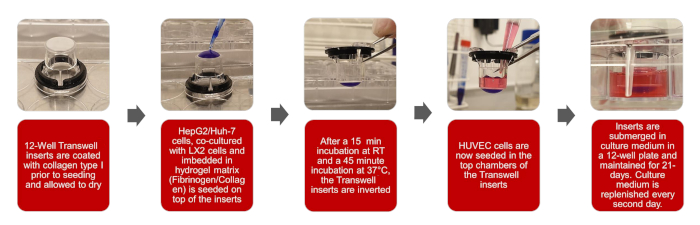
图1:3D仿生HCC模型创建的图形描述请点击这里查看此图的较大版本。
注:此协议的总体工作流程在图 1的插图中规定
1. 制备纤维蛋白原库存溶液
- 准备一个100万氯化钙(CaCl2)库存溶液,重量2.21克CaCl2, 并将其添加到20毫升蒸馏水(dH2O)。库存解决方案可存储在室温 (RT) 下。
- 通过称重 5 毫克丙汀并将其添加到 20 mLdH2 O. Aliquot 库存溶液中,将 20 mL 阿普罗汀库存溶液 (1218.75 KIU/mL) 添加到 1 mL 阿普洛汀库存溶液中,并在 -20 °C 下存储。
- 准备一个10 mL的80毫克/mL纤维蛋白原库存溶液。
- 在 50 mL 管添加 7.849 mL 磷酸盐缓冲盐水 (PBS), 2.051 mL 蛋白库存 (1218.75 KIU /mL)为最终蛋白浓度为250 KIU/mL和100μL CaCl 2(1M),最终CaCl2浓度为10m。
- 体重800毫克纤维蛋白原。
- 重量 200 毫克氯化钠 (NaCl) 的股票溶液包含 2% w/v NaCl.
- 将纤维蛋白原和NaCl以增量添加到含有PBS、蛋白和CaCl2的50 mL管中。不要剧烈搅拌或摇动,因为这将导致纤维蛋白原凝胶和肿块在溶液中形成。
- 将纤维蛋白原库存溶液的 50 mL 管水平放置在摇床上,并在 300 rpm 的低设置下摇动。
- 溶液溶解后,使用 0.22 μm 注射器滤镜或瓶顶滤清器进行过滤,具体取决于体积。重要的是,不要高压纤维蛋白原溶液,因为这将破坏纤维蛋白原。
注:协议的这一部分可以采取2至5小时,这取决于库存解决方案的数量,这一次应在实验设置期间考虑。
2. 在将水凝胶播种到插入物上之前用胶原蛋白涂覆插入物
- 在层压流罩或组织培养罩中,使用消毒钳子,从盘子中取出插入物,倒置到板盖上。
- 通过将 115μL 的冰川醋酸添加到 25 mL 的 dH 2 O 中,准备 100 mL 的20mM 冰川醋酸库存溶液,并使用0.22 μm 注射器滤清溶液,并调整到 100 mL 的最终体积。使用 0.22 μm 注射器滤清溶液。库存解决方案可存储在RT。
- 通过在 2.2 中准备的 20 mM 冰川醋酸库存溶液中加入 40 μL 的 5 毫克/mL 胶原蛋白溶液,从 5 毫克/mL 胶原蛋白溶液中准备 100 微克/mL 胶原蛋白溶液 2 mL。
- 将 100μg/mL 胶原蛋白溶液用 2.3 制备的插入物涂上,将 100 μL 的溶液管道输送到每个插入物上。让空气在层流罩或组织培养罩内干燥2至3小时。
- 一旦插入已干洗每个插入 3 倍与 PBS。在 12 个井板的每口井中加入 1 mL 的 PBS,将带胶原蛋白涂层的插入物朝下放入井中,从井中取出 PBS 并重复该过程。让在层流罩内插入空气干燥1至2小时。
警告:醋酸对细胞有毒,插入物应用PBS彻底清洗。 - 在插入物上添加自定义的 3D 打印隔板,一旦凝胶挂在插入物上以防止它们接触板的底井(图 2),则有必要这样做。

图2:自定义3D打印间隔器请点击这里查看此图的较大版本。
- 用板的底部盖住倒置的插入物,放入孵化器中,直到细胞嵌入水凝胶中并准备播种。
3. 嵌入水凝胶中的种子细胞插入插入
注: 表1 提供了3种不同浓度纤维蛋白原的配方的描述,这些配方将被制备。配方一对应于肝纤维化开始,两个肝硬化和三个HCC,每个配方的刚度值在协议优化期间用流变学确定。
| 制定 | 最终纤维蛋白原浓度(毫克/mL) | 最终胶原蛋白浓度(毫克/mL) | 细胞 (LX2 + HepG2 共培养 1:1) | 肝脏阶段 | 文献肝刚度值 (kPa) | 流变学 (kPa) 的模型刚度值 | 制定 | 要添加的纤维蛋白原 (mL) | 胶原蛋白添加 (mL) | 10 % DMM (mL) | 血栓(μL) | 参考 s |
| 1 | 10 | 2 | 2 x 106 细胞/mL | 纤维 化 | ≥2 | 3 | 1 | 1 | 0.8 | 0.2 | 4 | 28;29;30 |
| 2 | 30 | 2 | 2 x 106 细胞/mL | 肝硬化 | 6 | 2 | 0.75 | 0.8 | 0.45 | 3 | ||
| 3 | 40 | 2 | 2 x 106 细胞/mL | 肝癌 | ≥10 | 10 | 3 | 0.25 | 0.8 | 0.95 | 1 | 28;31;32 |
表1:将嵌入水凝胶中的播种细胞的配方描述到插入物上
- 通过将 3.99 克 NaOH 添加到 dH2O 的 100 mL 中,准备 1 M 氢氧化钠库存溶液。 然后,可以使用 0.22 μm 注射器过滤器过滤该解决方案。将库存解决方案存储在RT。
- 将 5 毫克/mL 胶原蛋白和 10 mL 的 1 M NaOH 放在冰上。
- 预热 50 mL PBS, 15 mL 试金石, 70 mL 10% DMEM, 和纤维蛋白原库存溶液, 在第 1 节中准备, 到 37 °C 在水浴中 20 分钟。
- 准备单元格悬架。
- 用10毫升PBS两次清洗T175培养囊中的肝细胞(LX2)和肝癌(HepG2)细胞。
- 在37°C下用6 mL试金石试用4分钟的细胞。
- 用 6 mL 的 10% DMEM 激活试金石。
- 收集细胞悬架在15 mL管和离心机3分钟在300 x g。
- 离心后,吸气超纳坦,并在5 mL的10%DMEM中重新悬浮每个细胞系。
- 使用自动单元格计数器数细胞:将每个单元悬架的 10 μL 添加到计数室幻灯片中,并将幻灯片插入细胞计数器。细胞计数显示为细胞/mL。
- 使用步数 3.4.6 将每个细胞系中的细胞稀释到每 mL1 x 10 6 个细胞,放入标记清晰的 15 mL 管中。离心稀释3分钟,在300 x g。
- 离心后,吸气超纳坦,并根据 表1在每15 mL管中添加10%DMEM,表中提供的值是每个配方的2mL。
- 用 10 μL/mL NaOH (1 M) 中和胶原蛋白的量,并将中和胶原蛋白添加到细胞悬架中,10% 的 DMEM 存在将变黄,一旦悬架通过用切尖的管道彻底混合,它就会变成明亮的粉红色。
- 根据表1 将纤维蛋白原蛋白添加到胶原蛋白细胞悬架中,使用切割移液器尖端,彻底混合悬架。
- 最后加入血栓素胶原纤维蛋白原细胞悬浮液,每10毫克纤维蛋白原0.1 KIU血栓。
- 从孵化器中取出第 2 节中准备的预涂层倒置插入物,并使用切割的 200μL 移液器尖端、预制悬架的移液器 200 μL 到指定的插件上。允许凝胶在层流罩内交叉链接 15 分钟。
- 15 分钟后,轻轻地将板的底部放在凝胶上,并将它们移动到孵化器,使凝胶在 37 °C 下交叉链接 45 分钟。
- 凝胶交叉链接后,再次倒置插入物,并将 2 mL 的 10% DMEM 添加到板的每个底井中。
4. 播种内皮细胞
- 预热 25 mL 汉克斯平衡盐溶液 (HBSS), 10 mL 试金石, 10 mL 汤匙抑制剂和 50 mL 内皮生长介质, 到 37°C 20 分钟在水浴.
- 准备内皮(HUVEC)细胞悬浮液。
- 用10 mL HBSS两次清洗T175培养瓶中的HUVEC细胞。
- 在37°C下用6 mL试金石试用4分钟的细胞。 用 6 ml 三丁酶抑制剂灭活试金石。收集细胞悬浮在15 mL的管和离心机3分钟在200 x g。
- 离心后吸气超纳坦,并暂停细胞在5 mL内皮生长介质。
- 使用自动单元格计数器计算之前描述的 3.4.6 中的单元格。
- 使用细胞计数器中的细胞计数,在内皮生长介质中准备1.0×104 细胞/mL的播种密度。
- 将 HUVEC 细胞悬架的种子 500 μL 放入插入顶部的每个井中,每个插入的最终体积为 5.0 x 103 个细胞。
5. 维护
- 每隔一天更换一次生长介质,从油井和插入物中吸气消费生长介质。在含有凝胶的油井中加入 2 mL 10% DMEM,在包含 HUVEC 细胞的插入物中加入 0.5 mL 内皮生长介质。
- 在实验前将模型保持 21 天。
6. 流变学
- 使用风湿计测量凝胶配方的存储粘合物,以指示刚度值,在 0.267% 和 37°C 下执行 0.1-20 Hz 的频率扫描,使用 8 毫米直径的平行板不锈钢几何测量恒定轴向力 0.1N。
7. 可行性和药物反应
- 确定 2D 共生和 3D 模型中的药物反应和可行性。
- 种子 HepG2 (5.0 x 103 细胞/mL) 和 LX2 (5.0 x 103 细胞/mL) 细胞在 1:1 的比例为 2D 共培养成黑色透明底部 96 井板,播种密度为 1.0 x 104 细胞/mL。 允许细胞在一夜之间连接。
- 设置 3D 模型,以对应于刚度值为 6 kPa 的热环境。 在多克索鲁比辛治疗前保持模型 21 天。
- 在多克索鲁比辛治疗前两小时,从2D和3D模型中吸食培养基。用 PBS 清洗两个型号两次。将饥饿介质(DMEM 辅以 1% v/v 抗霉抗生素溶液)添加到 2D 共培养(每口井 200μL)和 3D 模型(含水凝胶的井中 2 mL,插入 500 μL)。
- 将多克索鲁比辛管理到 2D 和 3D 型号。 剂量如下:分别与IC25、50和75值对应0.5、1和1.5 mM。 治疗两种型号72小时。
注:多索鲁比辛,一种托莫索酶II抑制剂,是HCC使用的第一批化疗药物之一,也是治疗HCC33,34中最活跃的化疗剂之一。 - 72小时后,从2D和3D模型吸气文化介质。通过用 PBS 两次清洗两种型号,确保删除任何剩余的培养介质。
- 根据制造商的建议准备AlamarBlue,并添加到2D和3D型号的油井中。为 2D 文化每口井添加 150μL,为 3D 文化每口井添加 2 mL,为 3D 文化添加 500 μL。 在37°C下孵育过夜。
- 孵化后将 150μL 的 AlamarBlue 从 3D 设置的每口井转移到黑色透明底部 96 井板中。阿拉玛蓝可以直接从 2D 型号的板中读取。
- 阅读荧光与微板读取器在激发波长和发射波长分别为485和550nm。
- 使用以下公式计算两个模型的百分比细胞可行性:
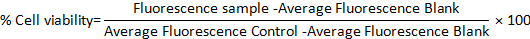
结果
浓度范围和播种量
协议优化,以获得最终的功能协议发生根据图3中提出的示意图。两个生理上相关的水凝胶,胶原蛋白I型和纤维蛋白原,通过文献搜索35,36鉴定。 从大鼠尾胶原蛋白 I 型开始,将一系列浓度(4、3、2 和 1 毫克/mL)播种在倒置插入物上,以确定它们一旦倒置成功粘附插入器的能力。在这个范围内的所有浓度都能够形成凝胶,然而胶原蛋白凝胶似乎扁平化,并有各种气泡被困在其中,因为处理和管道,见图4和图5。为了确定最佳播种量,以提高胶原蛋白凝胶的质量,播种量范围(100,150和200μL),被播种到倒置插入,见图5。 播种量对凝胶的外观或凝胶内存在气泡没有影响。因此,决定200μL是生产最充分凝胶的最佳播种量。纤维蛋白原还被评估为能够产生凝胶,可以长期粘附在插入物上。 制备了浓度范围(70、50、40、30、20、10、5、1毫克/mL),并以200微升的体积播种到12口井板的盖子上,见图6。播种后20分钟内,所有浓度都能成功形成凝胶。然而,浓度 5 和 1 毫克/mL 被排除在外,因为形成的凝胶具有类似稠度的液体,在保持在 37 °C 过夜后开始从盖子中分离。
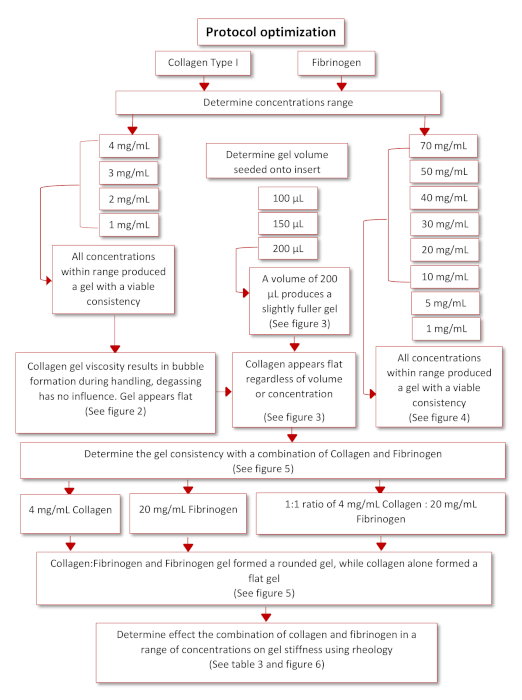
图3:协议优化的示意图。请点击这里查看此数字的较大版本。

图4:胶原蛋白凝胶4毫克/mL,含有1.0 x 105 细胞/mL种子到显示凝胶中存在的气泡的插入物上。 左边的插入物在冰上浸没了15分钟,而右边的插入物没有脱糖。脱气对凝胶中的气泡没有任何影响。 请点击这里查看此数字的较大版本。
图5:胶原蛋白凝胶4毫克/mL,含有1.0×105 细胞/mL种子到不同体积的插入物上。 (A) 在播种后直接插入左 100 μL、中间 150 μL 和右 200 μL。凝胶中的气泡仍然存在。(B) 插入左 200 μL,中间 150μL 和右 100 μL,交叉连接 60 分钟后。无论体积如何,所有凝胶仍呈平整。 请点击这里查看此数字的较大版本。

图6:纤维蛋白原(200μL)的浓度范围从70毫克至1毫克/mL种子到12井板的盖子上。 (A) 播种后直接凝胶。(B) 凝胶播种后20分钟。(C) 凝胶保存过夜。所有凝胶看起来都圆润,5毫克/mL和1毫克/mL凝胶被排除在外,因为它们似乎有一个更流畅的一致性20分钟后播种,并开始从盖子后,保持过夜。 请点击这里查看此数字的较大版本。
胶原蛋白和纤维蛋白原蛋白的组合
根据胶原蛋白和纤维蛋白原浓度范围的结果,评估胶原蛋白和纤维蛋白原结合的效果。设置了以下三个插入物,4毫克/mL胶原蛋白,20毫克/mL纤维蛋白原和胶原蛋白(4毫克/mL)和纤维蛋白原(20毫克/mL)的1:1配给,见 图7。直接播种水凝胶后,我们观察到,仅胶原蛋白的插入物仍然具有扁平的外观,并结合凝胶内气泡的发生。带纤维蛋白原的插入物产生了一个完整的和圆润的凝胶,胶原蛋白和纤维蛋白原的组合的插入也是如此。在 37 °C 交叉连接 60 分钟后,所有凝胶都附着在插入物上,并在 37 °C 过夜孵化后保持连接。

图7:胶原蛋白和纤维蛋白合二为一的效果。 (A) 胶原蛋白 4 毫克/mL 种子在左侧插入,纤维蛋白原 20 毫克/mL 种子插入中间和胶原蛋白 4 毫克/mL, 纤维蛋白原 20 毫克/mL (1:1 配给) 种子插入在右边。所有凝胶种子在200μL的体积包含1.0 x 105 细胞/mL,所有凝胶交叉链接60分钟在37°C(B)胶原蛋白4毫克/mL 60分钟后交叉链接,凝胶出现平坦,有气泡。(C) 插入左纤维蛋白原20毫克/mL,凝胶呈圆形,不存在气泡,插入右胶原蛋白4毫克/mL,纤维蛋白原20毫克/mL凝胶,凝胶圆润良好,无气泡。(D) 胶原蛋白4毫克/mL凝胶在37°C保存过夜后,凝胶仍含有大量的气泡,凝胶出现了一些肿胀。(E) 纤维蛋白原 20 毫克/毫升保持过夜在 37 °C (F) 胶原蛋白 4 毫克/毫升, 纤维蛋白原 20 毫克/毫升凝胶保持过夜在 37 °C. 请点击这里查看这个数字的更大版本。
确定细胞播种密度
根据以前与水凝胶合作的经验,建立了一个实验,以确定最佳细胞播种密度(数据未显示)37。细胞嵌入胶原蛋白和纤维蛋白原的组合在以下浓度范围内 (7.5 x 105,8.5 x 105,9.5 x 105,1.0 x 106,1.5 x 106 和 2.0 x 106 细胞/mL), 2.0 x 106 细胞/mL 被发现是最佳的播种密度。
流变
纤维蛋白原和胶原蛋白水凝胶组合的十种配方通过流变学进行评估,见表2。目的是确定这些配方中哪一种可以模仿HCC发展过程中看到的肝脏僵硬。文献为大鼠、小鼠和人类在纤维化、肝硬化和HCC期间提供了已知的肝僵硬值,目的是尽可能接近这些值28、29、30、31、32。表2中规定的10种配方是三元制制的,每个配方的存储模组都是用测温仪确定的,结果见图8。
| 制定 | 纤维蛋白原(毫克/毫升) | 胶原蛋白(毫克/毫升) |
| 1 | 60 | 2 |
| 2 | 50 | 2 |
| 3 | 40 | 2 |
| 4 | 30 | 2 |
| 5 | 20 | 2 |
| 6 | 10 | 2 |
| 7 | 20 | 5 |
| 8 | 20 | 4 |
| 9 | 20 | 3 |
| 10 | 20 | 1 |
表2:用流变学评估的各种浓度的胶原蛋白和纤维蛋白原组合,以确定刚度值
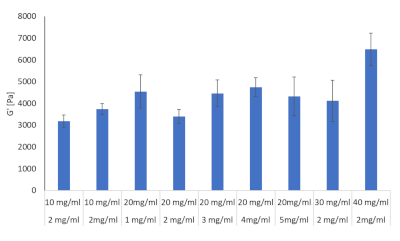
图8:用流变学评估的各种浓度的胶原蛋白和纤维蛋白原组合的水凝胶刚度值。 存储模组和损损模组通过发现 HR-2 混合流光计(n = 3、错误条 = SD)在 37 °C 和 1Hz 下确定。 请点击这里查看此数字的较大版本。
从这十个公式中选出三个公式继续。其中包括2毫克/mL胶原蛋白I型和10毫克/mL纤维蛋白原对应肝僵硬值在纤维化开始, 2毫克/mL胶原蛋白I型和30毫克/mL纤维蛋白原对应肝硬化和2毫克/mL胶原蛋白I型和40毫克/mL纤维蛋白原对应HCC,见图9。
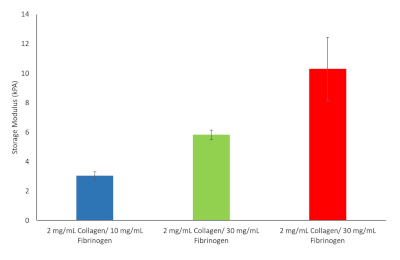
图9:选择继续进行的各种纤维蛋白原/胶原蛋白水凝胶配方的水凝胶刚度值。 存储模组和损损模组确定为37°C和1 Hz(n=3,错误条=SD)。 请点击这里查看此数字的较大版本。
可行性、药物反应和转移潜力
AlamarBlue检测结果表明,2D共生细胞的细胞存活率总体下降,低于已知的IC 25、50和75值的预期,与未经处理的对照相比,见 图10。这可能是由于我们共同培养的LX2细胞对多克索鲁比辛治疗更敏感。然而,在我们的3D模型中,我们注意到并增加了多索鲁比辛耐药性,证实了3D模型系统中经常看到的化疗潜力的降低。与对照组相比,使用学生 T 测试(双尾)评估了统计学意义,P<0.05 被认为是显著的。
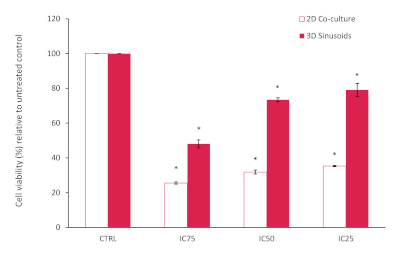
图10:与3D模型相比,2D共培养模型的细胞存活率在72h的不同浓度下使用多克索鲁比辛。 结果与未经处理的控制(n=3,错误条=SD)(*=p<0.0001)相关。 请点击这里查看此数字的较大版本。
凝胶结构每天使用光显微镜进行目视检查,以跟踪不同浓度的水凝胶中的细胞生长。细胞以均匀和紧凑的方式填充水凝胶,从第7天起球体开始在矩阵内组装。
讨论
此协议描述了为 HCC 创建仿生模型的方法的开发。已建立明确的工作流程,并确定了所涉及的关键步骤。这些关键步骤包括:准备纤维蛋白原体液,用胶原蛋白涂覆插入物,将注入水凝胶的细胞播种。在纤维蛋白原库存溶液的制备过程中,在较高浓度下以较小的增量添加纤维蛋白原非常重要。这不仅会减少纤维蛋白原溶解所需的时间,而且还会防止纤维蛋白原像 图11中看到的不一致和过早地凝胶。纤维蛋白原凝胶的制备需要相当长的时间,这可能会影响整个实验成功。结果表明,一旦纤维蛋白原凝胶开始凝胶不一致,最好丢弃它。插入物应涂上胶原蛋白,用PBS清洗,并在层压流罩内干燥,然后播种嵌入水凝胶中的细胞。如果不能确保插入物干燥,将导致水凝胶溢出到插入器的边缘,导致凝胶不均匀。凝胶的不均匀性最终将影响扩散是一个因素的结果。
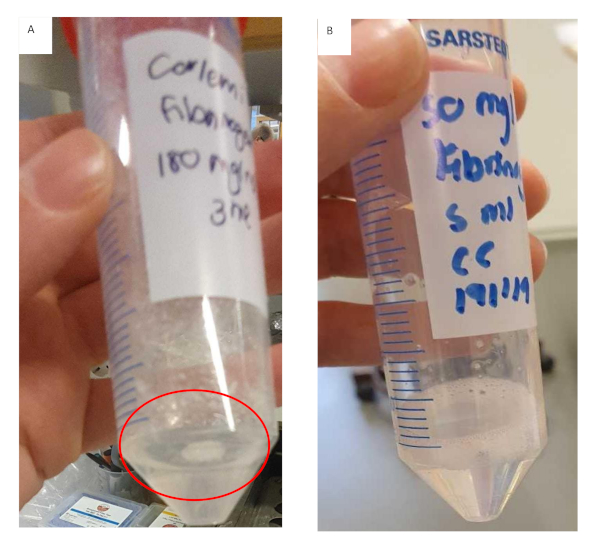
图11:为纤维蛋白原/胶原蛋白水凝胶配方制备纤维蛋白原凝胶。 (A) 纤维蛋白原凝胶溶液,已形成团块,并开始过早凝胶与未溶解的纤维蛋白原粘附在管子上。(B) 纤维蛋白原凝胶溶液已完全溶解,溶液清晰,粘性稍高。 请点击这里查看此数字的较大版本。
建议在将水凝胶细胞悬浮物播种到插入物上时尽可能快地工作,因为纤维蛋白原成分将开始与血栓添加交叉。 在高浓度的凝胶悬架下工作时,准备更小的工作量,以防止凝胶在播种时相互关联。后者将对每口井的分布和凝胶播种量产生影响。添加组件的顺序至关重要,在此协议中,我们提供了简化的工作流程,以防止凝胶过早交叉链接。 由于水凝胶悬架的粘度,在混合和测量过程中建议使用切割移液器尖端工作。 混合悬架时,请确保快速均匀地完成此工作,以创建均匀的悬架。不均匀的混合将导致异构凝胶,这将对结果产生负面影响,见图12。
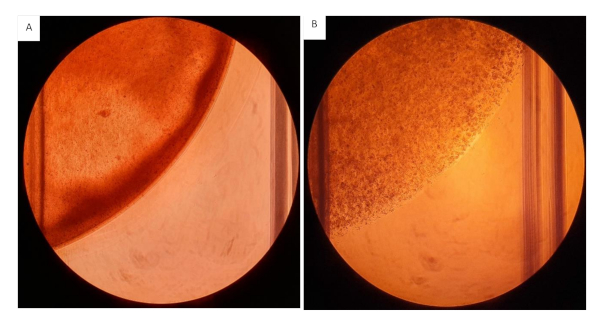
图12:胶原蛋白/纤维蛋白原凝胶种子到12个井板上。 所有凝胶的种子体积为 200μL,含有 2 毫克/mL 胶原蛋白和 20 毫克/mL 纤维蛋白原,具有 2.0 x 106 细胞/mL。(A) 具有异质稠度、可见不均匀分布的水凝胶的水凝胶。(B) 水凝胶均匀混合。 请点击这里查看此数字的较大版本。
在协议优化之后,对模型进行了评估,以确定模型的生物物理特性。流变学资料显示,我们的模型由生理上相关的细胞外基质组件组成,即胶原蛋白I型和纤维蛋白原,能够模仿纤维化、胆管和HCC肝28、29、30、31、32的生物物理特性。为 HCC 的 3D 模型回顾肝脏刚度非常重要,在模型开发过程中经常被忽视。肝僵硬增加与HCC38中的化疗耐药性、增殖性、迁移性和休眠性有关。虽然HCC中肝固态细胞的激活与细胞外基质刚度增加有关,但与这些肝固态细胞相关的几个信号通路显示机电敏度39。
在HCC的3D模型开发中,将肝细胞和内皮细胞等与频闪相关的细胞纳入其中,已变得越来越相关。研究表明,与PXT小鼠模型和人类HCC组织样本17相比,由肝细胞和HCC细胞组成的多细胞球体提高了化疗耐药性和侵入性迁移,同时模拟了体内的HCC肿瘤外观。Jung等人的类似研究,2017年发现由肝细胞癌(Huh-7)和内皮(HUVEC)细胞组成的多细胞球形促进血管化和侵略性22。与 Huh-7 单培养球形22相比,这些球形在多克索鲁比辛和索拉芬尼的浓度显著提高时显示出生存能力。与二维共生模型相比,我们模型的可行性和对多克索鲁比辛的反应(刚度值与 HCC 和加入频闪相关细胞 (LX2 和 HUVEC) 相符)的评价显示,与化疗相比,对化疗的反应也相应减少。 因此,有效模仿患者和其他 3D HCC 模型中常见的耐药性。
由于这是一个模块化系统,因此可以通过添加其他细胞外基质组件(即层压素和透明质酸)来强化该模型。或者,本模型中使用的当前水凝胶可以由合成水凝胶(如藻酸钠或奇托桑)取代。对当前模型的进一步修改可能是用原细胞培养物替换细胞系,以产生一个更与生理相关的模型,或者使用其他肿瘤和频闪细胞系的组合。
因此,我们成功开发了具有可调谐生物物理特性的3D模型,用于研究HCC中的肿瘤-频闪相互作用。 我们发现,与传统的 2D 文化相比,我们的模型更能代表体内情况,以应对多克索鲁比辛。然而,仍有许多工作要做,我们希望广泛描述这个模型,并探索模型作为一个可能的转移平台,以回答更复杂和紧迫的问题,留在研究HCC。
披露声明
作者没有什么可透露的。
致谢
这项研究的资金来自瑞典癌症基金会(癌症基金会,CAN2017/518)、瑞典医学研究协会(SSMF,S17-0092)、O.E.och Edla约翰松斯基金会和奥尔加·扬松斯基金会。 这些资金来源没有参与研究设计:数据的收集、分析和解释;编写报告;并在决定提交文章出版。本协议中使用的定制设计隔间的3D打印是在U-PRINT:乌普萨拉大学位于 U-PRINT@mcb.uu.se 医学和药学学科领域的3D打印设施进行的。我们要感谢保罗·奥卡拉汉对我们项目的宝贵投入。
材料
| Name | Company | Catalog Number | Comments |
| AlamarBlue (Resazurin sodium salt) | Sigma | 211-500 | Prepare according to manufacturesr recommendations |
| Antibiotic Antimycotic Solution (100×), Stabilized | Sigma | A5955-100ML | |
| Aprotinin Protease Inhibitor | Thermo Fisher Scientific | 78432 | |
| Calcium chloride (CaCl2) | Sigma | C1016-2.5KG | Anhydrous, granular, ≤7.0 mm, ≥93.0% |
| CO2 Incubator | Kebo Biomed Sweden | ||
| Corning Black, clear flat bottom 96-well plate | Sigma | CLS3904-100EA | |
| Corning HTS Transwell-24 well permeable supports | Sigma | CLS3396-2EA | HTS Transwell-24 units w/ 0.4 μm pore polycarbonate membrane and 6.5 mm inserts, TC-treated, sterile, 2/cs |
| Discovery Hybrid Rheometer 2 | TA instruments, Sollentuna, Sweden | ||
| DMEM, high glucose, GlutaMAX supplement (LX2 and HepG2 cells) | Thermo Fisher Scientific | 61965059 | Supplemented with 10% v/v FBS and 1% v/v antibiotic antimycotic solution |
| Endothelial Cell Growth Medium (500 ml) (HUVEC) | Cell Applications, Inc | 211-500 | |
| Fetal Bovine Serum, qualified, One Shot format, New Zealand | Thermo Fisher Scientific | A3160902 | |
| Fibrinogen type I-S from bovine plasma | Sigma | F8630-10G | |
| FLUOstar Omega plate reader | BMG Labtech | ||
| Hanks' balanced salt solution | Sigma | H9394-500ML | Modified, with sodium bicarbonate, without calcium chloride and magnesium sulfate |
| Labogene scanspeed 416 centrifuge | Labogene, Sweden | ||
| Laminar flow hood | Kebo Biomed Sweden | ||
| Mettler Toledo AG245 Analytical Balance | Mettler Toledo | ||
| Nikon TMS Light microscope | Nikon, Japan | ||
| Phosphate buffered saline tablet | Sigma | P4417-100TAB | Prepare according to manufacturers recommendation |
| Rat tail Collagen Type I 5 mg/mL | Ibidi | 50201 | |
| Sodium chloride (NaCl) | Sigma | S7653-1KG | |
| Sodium Hydroxide (NaOH) | Merck | B619298 | |
| TC20 Automated cell counter | BioRad | ||
| TC20 cell counter counting slides | BioRad | ||
| Thrombin from bovine plasma | Sigma | T9549 | Powder, suitable for cell culture, ≥1,500 NIH units/mg protein (E1%/280 = 19.5) |
| Trypsin (2.5%) 10x | Thermo Fisher Scientific | Dilute to 1x in PBS | |
| Trypsin inhibitor from Glycine max (soybean) | Sigma | T6414-100ML | Solution, sterile-filtered |
参考文献
- Galle, P. R., et al. EASL Clinical practice guidelines: Management of hepatocellular carcinoma. Journal of Hepatology. 69, 182-236 (2018).
- Marquardt, J. U., Andersen, J. B., Thorgeirsson, S. S. Functional and genetic deconstruction of the cellular origin in liver cancer. Nature Reviews Cancer. 15, 653-667 (2015).
- Balogh, J., et al. Hepatocellular Carcinoma: A review. Journal of Hepatocellular Carcinoma. 3, 41-53 (2016).
- Perumpail, R. B., Womg, R. J., Ahmed, A., Harrison, S. A. Hepatocellular carcinoma in the setting of non-cirrhotic non-alcoholic fatty liver disease and the metabolic syndrome: US experience. Digestive Diseases and Science. 60, 3142-3148 (2016).
- Baglieri, J., Brenner, D. A., Kisseleva, T. The role of fibrosis and liver associated fibroblasts in the pathogenesis of hepatocellular carcinoma. International Journal of Molecular Sciences. 20, 1723 (2019).
- Arriazu, E., et al. Extracellular matrix and liver disease. Antioxidants & Redox Signaling. 21 (7), 1078-1097 (2014).
- Malarkey, D. E., Johnson, K., Ryan, L., Boorman, G., Maronpot, R. R. New insight into functional aspects of liver morphology. Toxicologic Pathology. 33, 27-34 (2005).
- Moreira, R. K. Hepatic stellate cells and liver fibrosis. Archive of Pathology and Lab Medicine. 131, 1728-1734 (2007).
- Hernandez-Gea, V., Toffanin, S., Friedman, S. L., Llovet, J. M. Role of the microenvironment in the pathogenesis and treatment of hepatocellular carcinoma. Gastroenteroloy. 144, 512-527 (2013).
- Amicone, L., Marchetti, A. Microenvironment and tumor cells: two targets for new molecular therapies of hepatocellular carcinoma. Translational Gastroenterology and Hepatology. 3, 24 (2018).
- Rawal, P., et al. Endothelial cell-derived TGF-B promotes epithelial-mesenchymal transition via CD133 in Hbx-Infected Hepatoma cells. Frontiers in Oncology. 9 (308), 1-9 (2019).
- Yoo, J. E., et al. Progressive enrichment of stemness features and tumour stromal alterations in multistep hepatocarcinogenesis. PLoS One. 12 (3), 0170465 (2017).
- Landry, B. D., et al. Tumor-stroma interactions differentially alter drug sensitivity based on the origin of stromal cells. Molecular Systems Biology. 14, 8332 (2018).
- Le, B. D., et al. Three-dimensional hepatocellular carcinoma/fibroblast model on a nanofibrous membrane mimics tumor cell phenotypic changes and anticancer drug resistance. Nanomaterials. 8 (64), 1-11 (2018).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Three-dimensional cell culture: A powerful tool in tumor research and drug discovery (Review). Oncology Letters. 14, 6999-7010 (2017).
- Hoarau-Véchot, J., Rafii, A., Touboul, C., Pasquier, J. Halfway between 2D and animal models: Are 3D cultures the ideal tool to study cancer-microenvironment interactions. International Journal of Molecular Sciences. 19 (181), 1-24 (2018).
- Khawar, I. A., et al. Three Dimensional Mixed-Cell Spheroids Mimic Stroma-Mediated Chemoresistance and Invasive Migration in hepatocellular carcinoma. Neoplasia. 20, 800-812 (2018).
- Elliott, N. T., Yuan, F. A review of three-dimensional in vitro tissue models for drug discovery and transport studies. Journal of Pharmaceutical Sciences. 100 (1), 59-74 (2010).
- Nath, S., Devi, G. R. Three-dimensional culture systems in cancer research: focus on tumor spheroid model. Pharmacology Therapy. 163, 94-108 (2016).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: a systematic approach to enhance the biological relevance of data obtained. Scientific Reports. 6, 19103 (2016).
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Scientific Reports. 6, 25187 (2016).
- Jung, H. R., et al. Cell spheroids with enhanced aggressiveness to mimic human liver cancer in vitro and in vivo. Scientific Reports. 7, 10499 (2017).
- Eilenberger, C., Rothbauer, M., Ehmoser, E. -. K., Ertl, P., Küpcü, S. Effect of spheroidal age on sorafenib diffusivity and toxicity in a 3D hepg2 spheroid model. Scientific Reports. 9, 4863 (2019).
- Wrzesinski, K., Fey, S. J. After trypsinisation, 3D spheroids of C3A hepatocytes need 18 days to re-establish similar levels of key physiological functions to those seen in the liver. Toxicology Research. 2 (2), 123-135 (2013).
- Wrzesinski, K., et al. Human liver spheroids exhibit stable physiological functionality for at least 24 days after recovering from trypsinisation. Toxicology Research. 2 (3), 163-172 (2013).
- Mazza, G., et al. Decellularized human liver as a natural 3D-scaffold of liver bioengineering and transplantation. Scientific Reports. 5, 13079 (2015).
- Ma, X., et al. Rapid 3D bioprinting of decellularized extracellular matrix with regionally varied mechanical properties and biomimetic microarchitecture. Biomaterials. 185, 310-321 (2018).
- Mueller, S., Sandrin, L. Liver stiffness: a novel parameter for the diagnosis of liver disease. Hepatic Medicine: Evidence and Research. 2, 49-67 (2010).
- Wang, M. H., et al. In vivo quantification of liver stiffness in a rat model of hepatic fibrosis with acoustic radiation force. Ultrasound in Medicine & Biology. 35 (10), 1709-1721 (2009).
- Georges, P. C., et al. Increased liver stiffness of the rat liver precedes matrix deposition: implications for fibrosis. American Journal of Physiology - Gastrointestinal and Liver Physiology. 293, 1147-1154 (2007).
- Massironi, S., et al. et al. Liver stiffness and hepatocellular carcinoma: is it really useful. Journal of Hepatology. 58, 293 (2013).
- Singh, S., et al. Liver stiffness is associated with risk of decompensation, liver cancer, and death in patients with chronic liver diseases: A systematic review. Clinical Gastroenterology and Hepatology. 11, 1573-1584 (2013).
- Yang, T. S., Wang, C. H., Hsieh, R. K., Chen, J. S., Fung, M. C. Gemcitabine and doxorubicin for the treatment of patients with advanced hepatocellular carcinoma: a phase I-II trail. Annals of Oncology. 13, 1771-1778 (2002).
- Le Grazie, M., Biagini, M. R., Tarocchi, M., Polvani, S., Galli, A. Chemotherapy for hepatocellular carcinoma: the present and the future. World Journal of Hepatology. 9 (21), 907-920 (2017).
- Saneyasu, T., Akhtar, R., Sakai, T. Molecular cues guiding matrix stiffness in liver fibrosis. BioMed Research International. 2016, 1-11 (2016).
- Zuliani-Alvarez, L., Midwood, K. S. Fibrinogen-related proteins in tissue repair: how a unique domain with common structure controls diverse aspects of wound healing. Advances in Wound Care. 4 (5), 273-285 (2015).
- Smit, T., et al. Characterization of an alginated encapsulated LS180 spheroid model for anti-colorectal cancer compound screening. ACS Medicinal Chemistry Letters. 11 (5), 1014-1021 (2020).
- Schrader, J., et al. Matrix stiffness modulates proliferation, chemotherapeutic response, and dormancy in hepatocellular carcinoma cells. Hepatology. 53 (4), 1192-1205 (2011).
- Lachowski, D., et al. Matrix stiffness modulates the activity of MMP-9 and TIMP-1 in hepatic stellate cells to perpetuate fibrosis. Scientific Reports. 9, 7299 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。