Method Article
基于光二极管的光学成像,用于记录非转基因无脊椎动物的单神经元分辨率的网络动态
摘要
该协议提出了一种利用吸收电压敏感染料和光二极管阵列在非转基因无脊椎动物物种中单细胞分辨率成像神经元种群活动的方法。这种方法能够快速工作流程,其中成像和分析可以在一天的过程中进行。
摘要
转基因无脊椎动物制剂的发展,其中可用光记录和操纵可分辨神经元的活性,是研究行为神经基础的革命性进展。然而,这一发展的一个缺点是,它倾向于将调查人员集中在极少数的"设计者"生物(例如 ,C.elegans 和 D罗索菲拉)身上,这可能对许多物种进行比较研究产生负面影响,而这种研究对于确定网络功能的一般原则是必要的。本文阐述了非转基因胃足类大脑中具有电压敏感染料的光学记录如何能够快速(即在单个实验过程中)揭示其神经网络功能组织单细胞分辨率的特点。我们详细概述了我们的实验室在多个胃足类动物的CNS行为相关运动程序中获取数十到+150个神经元的行动潜在痕迹的解剖、染色和记录方法,其中包括一个神经科学的新方法——神经科 伯吉亚斯蒂芬妮亚。成像使用吸电电压敏感染料和 464 元素光二极管阵列进行,该阵列以 1,600 帧/秒的速度进行采样,速度足以捕获记录的神经元生成的所有动作电位。每次准备时可获得多分钟录音,很少或根本没有信号漂白或光毒。通过描述的方法收集的原始光学数据随后可以通过各种图示方法进行分析。我们的光学记录方法可以很容易地用于探测各种非转基因物种的网络活动,因此非常适合对大脑如何产生行为进行比较研究。
引言
无脊椎动物(如嗜血杆菌和C.elegans)转基因系的发展提供了强大的系统,在这种系统中,行为的神经基础可以进行光学审讯和操纵。然而,这些特殊的准备可能会降低对非转基因物种神经回路研究的热情,特别是在将新物种引入神经科学研究方面。只关注一两个模型系统不利于对网络功能一般原理的探索,因为比较研究是发现网络功能1、2、3、4的基本途径。我们在这里的目的是展示一种大规模成像方法,以便快速了解胃足神经网络的功能结构,以促进神经网络功能的比较研究。
胃足类软体动物,如阿普利西亚,莱姆奈亚,特里托尼亚,普鲁罗布兰查亚等,长期以来一直被用来研究神经网络功能的原则,在很大程度上是因为它们的行为是由位于黑帮表面的大型,往往单独识别的神经元调解,使他们很容易获得记录技术5。 在20世纪70年代,可以集成到等离子膜中的电压敏感染料(VSD)很快实现了对多个神经元6产生的运动潜力的首次无电极记录。在这里,我们展示了我们使用VSD来检查网络活动在几种胃足类,包括一个新的神经科学,伯格亚斯蒂芬妮。成像设备是一个商业上可用的464元素光二极管阵列(PDA),以1,600帧/秒(图1)取样,当与快速吸收VD一起使用时,揭示了所有记录的神经元7的动作潜力。所有二极管记录的信号在采集后立即显示,并叠加在PDA采集软件中的结节图像上,从而有可能在同一制备8、9中用尖锐的电极来研究感兴趣的神经元。
在原始的 PDA 数据中,许多二极管冗余地记录较大的神经元,许多二极管还包含来自多个神经元的混合信号。一个转折点是开发一种自动尖峰排序方法,使用独立的组件分析,以快速处理每个原始的464通道PDA数据集成一组新的痕迹,其中每个记录的神经元出现在一个单独的跟踪,只包含其行动潜力10,11。
在本文中,我们概述了从胃足神经系统获得具有光二极管阵列和快速吸收性VD的大规模行动潜在记录所涉及的基本步骤。 此外,我们还说明了分析方法,可用于聚类和映射光学记录的神经元,关于其功能合奏,并用于特征的人口水平特征,往往不明显,通过简单的检查发射痕迹12,13。
研究方案
注:下面概述的工作流程摘要为图2。
1. 尽量减少振动
- 如果可能,请确保钻机位于一楼,并使用基于弹簧的隔离台,该表比空气表减低更广泛的振动频率。
- 如果使用基于弹簧的表,请确保它是浮动的(每次添加或从表中取出某些东西时都需要调整它)。
- 尽可能减少成像室的振动噪声,甚至在必要时切断成像过程中的气流。尽量减少灌注系统中液体湍流产生的任何振动。
注:在采集过程中,神经制备不得移动。任何形式的运动都会导致二极管上的对比边缘变化,从而产生人工信号。如果程序在收购过程中涉及刺激,则不得诱导准备运动。
2. 运行针孔测试,使结石照片与 PDA 数据正确对齐
- 将一块铝箔放在显微镜滑梯上,其中有3个小孔。将三个孔的图像与数码相机安装在其镶边照片港。
- 使用 PDA 附带的成像软件,获取一个简短的文件(例如,5s)。在采集的中途,点击表以诱导针孔边缘周围非常可见的振动伪影,从而使针孔图像与光学数据精确对齐。
- 使用成像软件中的 叠加 功能,在菜单项"显示|中找到页面叠加|叠加痕迹与外部图像|叠加图像,"将二极管数据叠加到针孔照片上,然后反复调整照片的 x、y 和放大设置,直到针孔直接位于二极管数据中的针孔文物之上。
- 保存这些数字,以便在未来的实验中将与相机拍摄的制备图像与二极管数据对齐。
注:PDA 的针孔对齐仅在安装在显微镜上后执行一次,直到旋转或移除,此时必须再次执行。
- 保存这些数字,以便在未来的实验中将与相机拍摄的制备图像与二极管数据对齐。
3. 三种海洋胃足类的解剖
- 对于生长到大尺寸的物种,如 特里托尼亚 和 阿普利西亚,从较小的个体开始,这些个体具有更薄、更不透明的黑帮,从而轻松获得足够的光线,从而获得最佳的信号到噪声。
- 准备好过滤人工海水,用作解剖和成像实验的盐水。
注:在协议的所有后续步骤中,"盐水"表示人工海水。 - 特里托尼亚二重奏的解剖
- 将动物放在冰箱中约20分钟进行麻醉。
- 对于较大的动物,通过一只手握住动物来暴露大脑,让头部的末端披在食指上,露出"脖子"。对于较小的动物,在暴露大脑之前,将它们侧身固定在蜡衬里解剖盘中。
- 使用解剖剪刀,在动物的侧面,在腹膜质量(可以通过身体壁可以感觉到)上方,做一个3-4厘米的中线切口。
注:CNS的所需部分,由融合的双脑和踏板结节组成,是橙色的,外观与周围组织不同:它紧贴着犀牛的后背, 在布卡质量之上。 - 通过用钳子和微缩剪刀切断动物体内的神经,使连接中央黑帮的所有神经保持完好无损,从而切除CNS。留下长长度的踏板神经3(PdN3),或任何神经将受到刺激。
- 使用细枝末节针将 CNS 贴在充满盐水的弹性体衬里盘的底部,以便进一步解剖。使用反馈控制的在线 Peltier 冷却系统将盘子与盐水混合,将制备温度保持在 11 °C。
- 使用钳子和微分切刀,小心地从 CNS 周围去除结缔组织的松散粘附层。离开细护套紧紧粘附在黑帮。
- 简单地 (+10s) 浸入盐水中 0.5% 谷胱甘肽的溶液中。将甘利亚放回盐水香味的弹性体衬里盘中,让盐水在开始VSD染色之前洗去谷胱甘肽。
注:这种对结缔组织及其内在肌肉的光修复将有助于防止成像过程中的运动。
- 阿普利西亚·卡利波尼卡的解剖
- 通过通过腹腔表面(脚)向身体注射 ±20 mL 350 mM MgCl2, 麻醉约 40 克动物。
- 使用别针将动物腹腔侧向上放置在蜡衬解剖盘中。
- 使用解剖剪刀,沿着脚最前部的切口做一个2-3厘米的中线切口。将切口两侧的脚瓣固定下来,以显示部分 CNS 和 buccal 质量。
注:CNS的所需部分,由融合脑结节组成,并紧密结合,双边胸腔和踏板结节,为黄橙色,外观与周围组织不同:它坐在背和后背的球状肌肉布卡质量。 - 使用钳子和解剖剪刀仔细解剖块状物,揭示脑结节。
- 通过用钳子和微缩剪刀切断动物体内的神经,使连接中央黑帮的所有神经保持完好无损,从而切除CNS。留下长长度的踏板神经9(PdN9),或任何神经将受到刺激。
- 使用细枝末节针将 CNS 放置在充满盐水的弹性体衬里盘中。将盘中盐水通过 Peltier 冷却装置,将制备温度保持在 15-16 °C。
- 使用钳子和微切剪刀,从CNS中取出多余的结缔组织,并解剖结节或黑帮护套的表面部分,以成像。在此过程中要小心,不要在护套上打个洞,这会导致神经元从内部溢出。
- 简要 (+20s) 浸入盐水中 0.5% 谷胱甘肽的溶液中。将甘利亚放回盐水香味的弹性体衬里盘中,让盐水在开始VSD染色之前洗去谷胱甘肽。
- 贝尔吉亚·斯蒂芬妮亚的解剖
- 将动物放在冰箱中约20分钟进行麻醉。
- 使用充满室温盐水的弹性体衬里盘,将细枝末节固定在头部和尾部。
- 使用微分切剪刀,使一个5-7毫米的做向间切口表面到CNS。
注:眼睛,位于CNS旁边的动物内部的黑点,方便地标记所需部分CNS的位置,该部分由双融合的脑膜和踏板结节组成,位于胸膜质量之上。 - 用钳子和微缩剪刀切断动物体内的神经,切除CNS。让任何神经被刺激足够长的时间吸电极。
4. 用电压敏感染料染色制剂
- 准备 RH155(也称为 NK3041)或 RH482(也称为 NK3630 或 JPW1132)的库存解决方案。
- RH155: 溶解 5.4 毫克固体染料在 1 mL 100% EtOH, 管道 29 μL 到每个 34 微中心燃料管.将每根管子的内装物暴露在空气中,让它们在黑暗中通宵干燥。将产生的 RH155 固体报价(每个含 0.15 毫克)盖上盖子并放入 -20 °C 的冰柜中。
- RH482: 溶解 2 毫克固体染料在 100 μL 的 DMSO 中,将溶液分成 20 个 5 μL 的 20 个 μl 的溶液,每个 RH482 包含 0.1 毫克,并存放在 -20 °C 的冰柜中。
注:对于三角和阿普利西亚,浴灌注或压力应用可用于在制备中将VSD RH155加载到神经元的膜中。压力应用的优势在于将结石暴露在 VSD 中。
- 对于沐浴灌注,将上述两个固体 RH155 和涡流的盐水加入 5 mL,以溶液中产生包含 0.03 毫克/mL RH155 的 10 mL 组合溶液。
- 在黑暗中香水(以避免光出血)1至1.5小时在11°C的 特里托尼亚 和16°C的 阿普利西亚。通过 Peltier 冷却系统传递灌注液来保持温度。
- 对于压力应用,在 RH155 的一个盐水和涡流中加入 500 μL 盐水,以产生 0.3 毫克/mL 的染料浓度。
- 使用手持式微分配器将大约 200 μL 的溶液绘制到聚乙烯管中,确保管子直径与要染色的结节直径之间有良好的匹配。
- 使用微操纵器小心地将管子的末端放在目标结石上,降低管子,直到它在结石上形成紧贴的密封。使用上述冷却系统类型,使结胶保持在所需的温度。
- 调暗房间灯以避免光斑,每 5 分钟转动一次微分配器施用旋钮,以迫使更多的染料涂在结节上。
- 在 30 分钟内检查,确认是否发生了良好的污渍,然后继续进行大约 1 小时的总染色时间。
- 对于 在Bergghia的污渍,在RH482的冷冻盐水中加入1mL的盐水,然后漩涡溶解。
- 将 200 μL 的溶液转移到含有 800 μL 盐水和漩涡的微中心管中,在盐水中产生 0.02 毫克/毫升 RH482 的最终染色溶液,0.1% DMSO。
- 将整个CNS放入微中心管中,用铝箔包裹管,以避免光出血,每5-6分钟用手摇动约1小时。将剩余的 800 μL 第一个溶液存放在冰箱中,并使用长达 3 天以弄脏后续制剂。
5. 平整准备,设置神经刺激
注意:本节中的步骤应在最小照明或绿灯下执行,以尽量减少光出血。
- 染色后,将 CNS 浸入成像室内的盐水中,放在解剖显微镜下。
- 将硅胶片(用于 三叶草 或 阿普利西亚)或石油果冻斑块(用于 贝尔吉亚)放在结石/甘利亚的左右两侧进行成像。
- 将一块大小合适的玻璃或塑料盖片压在准备上,使其平整。按下牢固,但不是那么难损害神经元。
注:以这种方式平整制备的凸面将使更多的神经元焦化,从而增加记录的神经元数量,并进一步帮助在成像过程中固定制备。 - 如果刺激神经以引出一个虚构的运动程序,准备一个吸电电极,其前尖大约一样宽的神经直径。通过小心地将 PE-100 聚乙烯管的一段熔化在火焰上,同时轻轻地拉动管段的两端,然后在所需的点切割产生的锥形器来实现此目的。
- 通过聚乙烯吸电电极的锥形末端绘制少量盐水,然后通过在电极后端连接一长条厚壁、柔性聚合物管,并使用口腔吸力施加负压来刺激神经末端。
- 确认电极中的盐水缺乏可能中断电传导的气泡。
6. 成像准备和优化
- 将腔室移到成像设备。通过录音室开始盐水灌注,并将温度探头放在制备位置附近。设置温度控制器为被成像的物种所需的温度( 为特里托尼亚,11 °C, 为阿普利西亚,15-16°C,或 为贝尔吉亚,26-27°C)。
- 将一根氯化银线放入吸电电极下,确保它与电极中的盐水接触,并将另一根 Ag-AgCl 线(返回路径)放入吸电电极附近的浴盐水中。
- 将浸水透镜放入盐水中。关闭底座隔膜,然后提升或降低子舞台冷凝器并调整对焦,直到隔膜边缘处于锐利的对焦状态,从而产生 Köhler 照明。
- 关注待映的准备工作区域。偏向于较小的神经元而不是较大的神经元,因为源自较大神经元的光学信号比较小的神经元更有可能被注册,即使它们稍微失去焦点。
- 拍一张黑帮的照片,用镶眼的数码相机拍摄。
- 控制面板增益开关设置为 1 倍时,通过单击 "RLI"按钮并检查二极管的平均 RLI 来检查成像软件中的静止光强度 (RLI)。调整从刺激器发送到 LED 灯电源的电压水平,并继续检查平均 RLI 水平,直到它处于所需的范围内(通常约为 3-4 V)。
注:高 RLI,对应于 PDA 上的大约 3-4 V,是可取的。光线越高,光信号的信号与噪声比就越好,但是,这必须与较高的 RLI 的光亮率相平衡。使用高 NA 目标镜头可以最大限度地降低此风险。使用的浸水客观透镜为 10x/0.6 NA、20x/0.95 NA、40x/0.8 NA 和 40x/1.15 NA。
- 将控制面板增益开关设置为 100 倍以用于录制。
- 如果刺激神经,则将所需的电压、频率和持续时间设置在单独的刺激器上,与用于设置光位的电压、频率和持续时间设置。确认控制面板和刺激器之间的 TTL 触发已正确配置。
注:每个物种的样本神经刺激参数如下: 三角 PDN3,2s,10Hz脉冲列车5ms,10V脉冲: 阿普利西亚 PdN9, 2.5 s, 20 Hz 脉冲列车 5ms, 8 V 脉冲: 贝尔吉亚 踏板神经, 2 s, 10 Hz 脉冲列车 5 ms, 5 V 脉冲。 - 仔细检查弹簧或空气表是否漂浮。
7. 光学记录
- 关闭或调暗房间灯,包括任何头顶荧光灯。
- 设置所需的文件持续时间、路径和文件名称,然后单击成像软件中的"获取数据"按钮,获取到计算机可用 RAM 容量的文件。在光学记录过程中保持静止状态,因为小振动可以将大型人工制品引入光学记录数据。
注:对于超过计算机可用 RAM 的收购,可通过乔治敦大学的吴建英博士定制C++收购计划。 - 要在采集后立即查看数据,请使用成像软件中的 叠加 功能,将所有 464 二极管收集的数据叠加到准备7之前拍摄的结节图像上。单击软件中表示的任何二极管,以扩展它们在单独的跟踪屏幕上记录的内容。
- 通过输入以前由针孔测试确定的 x、y 和放大因子,实现二极管与制备的精确对齐。
- 为了最大限度地提高动作潜在可见性,提高后续尖峰排序14的神经元产量,请使用带通 Butterworth 滤波器,该滤波器具有 5 Hz 和 100 Hz 的截止时间(可在成像软件中提供),以消除低频和高频噪声。
- 为了保存过滤的光学数据作为文本文件,以便在科学计算平台中进一步分析,请首先在成像软件的"页面"屏幕下方选择"TP滤镜"框。然后,从"输出"选项卡中选择"保存页面作为 ASCII",并将所需的文件名输入显示的对话框。
结果
特里托尼亚
皮肤接触其海星捕食者触发特里托尼亚二恶英的逃生游泳,包括一个有节奏的一系列全身弯曲,推动它远离安全(图3A)。在孤立的大脑准备中,对踏板神经3(PdN3)的短暂刺激会引发有节奏的游泳运动程序(SMP)来表现这种行为,这在踏板结节的光学记录中很容易识别。图3B描绘了VSD成像实验的布局,该实验旨在记录神经元在左三角形踏板结石的正经表面的发射活动,PDA被定位在上面,作为对反向(右)PdN3的刺激,引起SMP。来自 PdN3 刺激之前、期间和之后的 20 个二极管记录活动的原始和过滤数据(带通巴特沃斯过滤器,5 和 100 Hz 截止点)分别显示在图 3C、D中。神经刺激在2分钟文件中20秒内传递。采集后,记录阵列中所有 464 个二极管测量的信号可在成像软件中准备的图像(图 3E)上进行地形显示。此时,许多痕迹包含来自相同神经元的冗余记录的尖峰,有些痕迹包含来自多个神经元的尖峰。用ICA对过滤的二极管痕迹进行尖峰分类后,产生了53个独特的神经元痕迹,其中30个出现在图3F中。图3G可以欣赏单个峰值的动能,该图扩展了图 3F(红色框)中的四个痕迹摘录:ICA尖峰分拣算法的准确性以前使用同时尖锐的电极记录进行验证,这表明排序痕迹中的所有尖峰都对应于来自单个神经元11、14的细胞内记录的尖峰。
阿普利西亚
强烈反感的尾部刺激 阿普利西亚卡利波尼卡 引起定型的两部分节奏逃生反应15。反应的第一阶段是头部肺和尾部拉动的几个周期的疾驰,使动物快速前进。这通常伴随着一段爬行期,包括反复的从头到尾肌肉收缩的波浪,以较慢的速度将动物向前推进几分钟(图4A)。为了在光学记录中捕获这些逃生电机程序,PDA 在孤立的大脑准备中专注于右踏板结节的正交表面,并在逆向(左)踏板神经 9 (PdN9) 上放置吸电电极: 图4B)。连续20分钟的光学记录(图4C)一分钟后,PdN9被刺激,以引起疾驰爬行电机程序序列。所有81个记录的神经元的概率高斯空间分布被映射到结石上(图4D)。应用于完整记录的尺寸减少显示,逃生程序的疾驰(青色)和爬行(深蓝色)阶段占据了不同的区域,并在主要组件空间(图4E)中分别形成了不同的轨迹、螺旋和环状。
根据图 4中描述的 Aplysia录制的三段视频演示了可以在此类数据集中执行的进一步类型的分析。视频 1动画所有录制的神经元的发射在录制的整个持续时间。逃生运动程序的初始刺激后期的特点是疾驰,其中在结节的活动以不同功能集群的交替爆发为标志(视频2)。疾驰随后过渡到爬行,其中整个神经元簇的活动保持大致相形,但在结石中假定逆时针旋转轨迹(视频3)。后两个视频还包含共识聚类,分别揭示了不同功能合奏的射击和位置,用于逃生响应的疾驰和爬行阶段。请注意,许多神经元分配到同一集群在疾驰和爬行阶段表现出物理接近彼此在结石,符合先前的发现12。
贝尔吉亚
阿奥利德·努迪布兰奇 ·贝尔吉亚·斯蒂芬妮亚 (图5A)代表了神经科学的新模型系统。典型的 Bergghia 实验的成像设置显示在 图5B中。为了引起广泛的神经元活动,在最突出的左踏板神经上放置了吸电极,并在2分钟的录音中将神经刺激30秒传递。ICA处理的痕迹显示55个神经元(图5C)的自发和刺激活动。通过共识聚类进行社区检测,确定了十个不同的功能组合,这些组合在 图 5D 网络图中和图 5E中描述,根据它们的聚类任务重组 图 5C 中显示的痕迹。所有记录神经元的高斯分布都叠加在 图 5F 中制备图像上,以指示所有 55 个记录神经元的位置。

图1:光学成像设备和光二极管阵列(PDA)的视图。(A) 光学成像设备,配备PDA、数码相机、显微镜和舞台。(B) PDA的内部设计,其中光纤将成像孔径连接到464光二极管。光二极管上方有一排放大器。(C) 成像孔径的六边形面,图像所聚焦的区域。 请单击此处查看此图的较大版本。

图2:说明获取光学记录的基本工作流程的流程图。 此流程图中描述了 VSD 成像协议中的关键步骤,从解剖到染色,以及成像的细节。 请单击此处查看此图的较大版本。
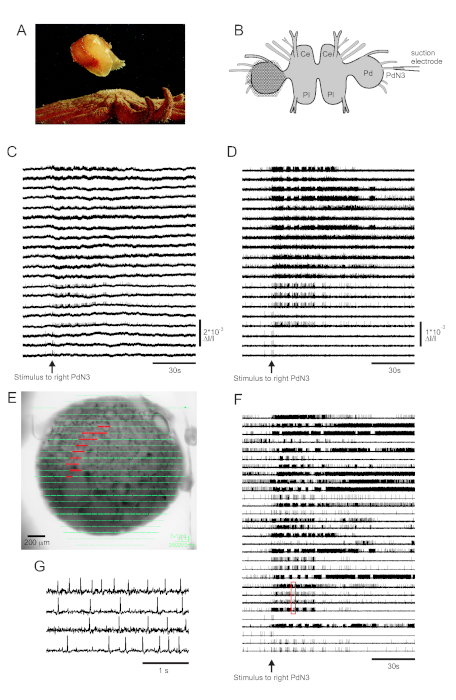
图3: 来自三角星的结果,说明原始、过滤和尖峰排序数据。 (A) 三角星 通过游泳从掠食性海星 皮诺波迪亚海连体 中逃出,游泳包括身体的交替做家和腹腔弯曲。(B) 成像设置的示意图。脑结节的脑叶;Pl = 脑结节的胸叶;Pd = 踏板结石。(C) 来自20个光电二极管的原始数据,显示左踏板结节的活动,以刺激逆向PDN3(箭头指示的刺激)。(D) 从与 C (5 和 100 Hz 带通巴特沃斯过滤器) 相同的二极管中过滤数据。(E) 成像软件输出,其中所有464个二极管收集的压缩痕迹在准备图像上以地形叠加。以 C 和 D 显示的 20 个二极管的位置以红色突出显示。(F) 通过 ICA 进行尖峰排序产生的 30 个选定的单神经元痕迹。(G) 四个单神经元痕迹的扩展视图,对应 于F中的红色框,以更高的时间分辨率显示它们的动作潜力。 请单击此处查看此图的较大版本。
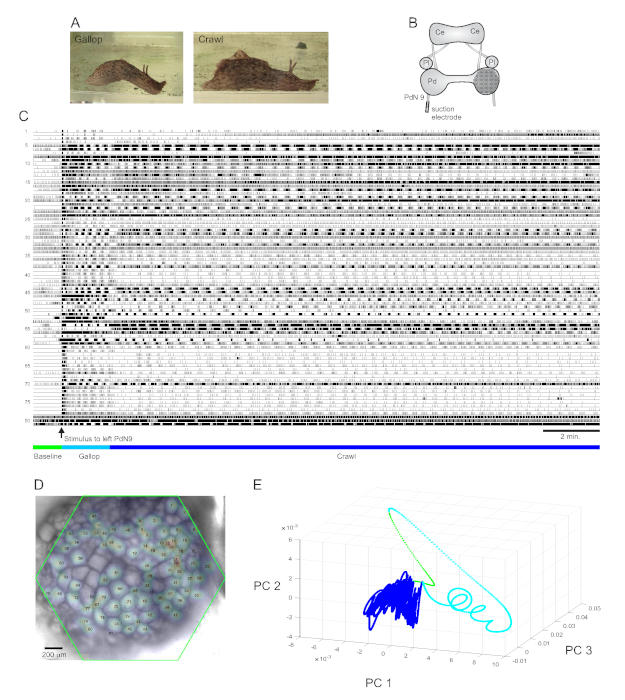
图4:来自阿普利西亚·卡利波尼卡的结果,说明长期记录、信号映射和维度降低。(A)阿普利西亚连续逃生电机程序的两个阶段,疾驰和爬行。(B) 成像设置的示意图。塞 = 脑结节;Pl = 胸结石;Pd = 踏板结石。(C) 20 分钟记录右踏板结节中的 81 个神经元,以响应对逆向 PdN9 的刺激(箭头指示)。痕迹下方的绿色、青色和深蓝色条分别表示预刺激期、疾驰期和逃生电机程序的爬行阶段。(D) 编制图像,绘制了由ICA确定的所有81个神经元信号源的位置的概率高斯分布图。绿色轮廓表示 PDA 的六角形面部对结节的位置。每个高斯的数字对应于C中的微量数字。(E) 在 20 分钟文件过程中,使用主要组件分析绘制前三个主要组件相互对立的尺寸减少。刺激前的基线、疾驰和爬行时代分别以绿色、青色和深蓝色显示。有关与此录制相对应的神经元激发动画,请参阅视频 1-3。请单击此处查看此图的较大版本。
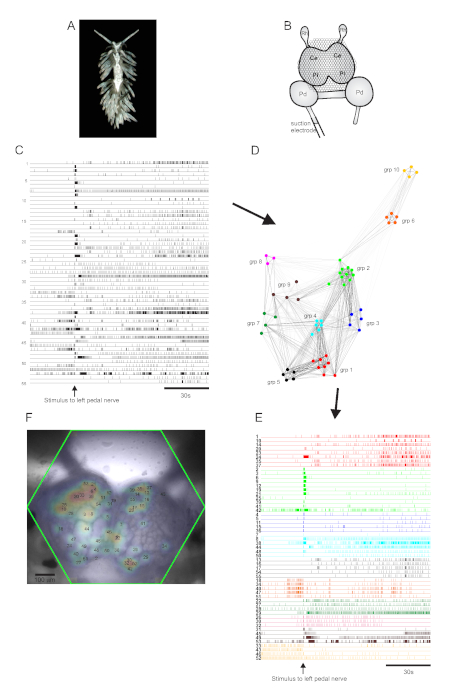
图5: 来自Bergghia斯蒂芬妮,神经科学的新物种,说明网络图形,功能聚类和双边信号映射的结果。(A) 贝尔吉亚 标本。(B) 成像设置的示意图。脑结节的脑叶;Pl = 脑结节的胸叶;Pd = 踏板结石;Rh = 犀牛结石。(C) 显示脑结节中55个双边神经元的自发和刺激活动(刺激的传递由箭头指示)的痕迹。(D) 显示十个功能合奏的网络图,每个组合分配一个独特的颜色,通过一致聚类识别。此图中的节点表示神经元,其中网络空间中的距离表示合奏内部和组合之间的发射相关性程度。(E) C 中的痕迹被重新排列,颜色编码(遵循 D的配色方案)到功能合奏中。(F) 准备图像,显示每个记录的神经元中信号的映射位置,以及它们对应的 C 和 E 中的微量数字。 请单击此处查看此图的较大版本。
视频1:动画的完整,20分钟的阿普利西亚逃生乐手程序。白色形状的不透明性过度地衬里了右踏板结石(左面板)中的 81 个单个神经元是由相应的神经元痕迹(右面板)驱动的,并且作为平均峰值速率的函数线性变化(在记录中每 0.61 秒进行一次绑定)。对于每个神经元,在记录期间,完全不透明被正常化为其最大发射速率。视频中一秒的实时时间表示 12.2 秒。刻度条对应于实时,跟踪下方的绿色、青色和深蓝色线分别表示逃生操作程序的预刺激基线、疾驰和爬行阶段。飞驰阶段周围的黄色框和爬行阶段的一部分表示用于在视频 2和3中生成动画的录制摘录。请点击这里查看此视频。(右键单击下载。
视频 2: 阿普利西亚 逃生运动程序的疾驰阶段的动画。 共识聚类执行所有81记录的神经元在电机程序的疾驰阶段,以获得功能合奏,使用的方法和软件描述和提供参考12。神经元合奏显示主要是补品或不规则的射击模式在这个阶段的逃生程序从本视频省略。在视频的音频轨道中可以听到属于黑色和橄榄绿合奏的神经元的动作潜力,并突出显示相应的神经元和痕迹。平均峰值率与 视频 1 一样正常化,并具有等量的装箱时间;视频中 1 s 的过去时间相当于 6.1 s 的实时时间。 请点击这里查看此视频。(右键单击下载。
视频 3: 阿普利西亚 逃生运动程序爬行阶段的动画。 在电机程序的爬行阶段,所有 81 个记录的神经元都进行了共识聚类,以获得功能合奏。在电机程序的这个阶段,主要表现出补品或不规则射击模式的合奏从此视频中被省略。平均峰值速率与 视频 1 和 2 一样正常化,并具有同等时间的装箱;视频中 1 s 的过去时间相当于大约 12.2 s 的实时时间。 请点击这里查看此视频。(右键单击下载。
讨论
实施大规模 VSD 成像方法的最重要细节之一是最大限度地减少振动,从而在二极管上产生对比边缘的运动,从而产生大量人工信号。由于吸收性VD在具有运动潜力的光强度上产生很小的百分比变化,振动伪体如果不被阻止,就会遮盖感兴趣的神经元信号。我们采用了几种方法来最大限度地减少振动。首先,我们的成像室位于一楼,将准备与建筑空气处理设备和许多其他来源相关的振动隔离开来。其次,使用了基于弹簧的隔离表,其他 PDA 用户已确认该表比较常见的空气表16提供更好的振动阻尼效果。第三,使用浸水目标,消除表面波纹引起的图像波动。第四,正在成像的制备被轻轻压在室盖唇底部和从上面压下来的覆盖唇碎片之间,硅胶塞或石油果冻保持到位,进一步稳定了制备。这也使结石或结石的凸面被成像,导致目标焦点平面上的神经元增加记录的神经元数量。
为了最大限度地提高因动作潜力导致的 VSD 光吸收程度的微小变化的信号与噪声比,必须通过准备到 PDA 实现近饱和光,同时最大限度地减少染料的光模糊。为此,我们通常以 3-4 V 的静息光强度工作,通过 PDA 控制面板在 1x 位置的增益开关(PDA 的 464 放大器在 10 V 光下饱和)进行测量。在数据采集过程中,增益系数更改为 100 倍。获得足够的光线,达到3-4 V的PDA测量可以通过几种方式完成。首先,使用超亮的 LED 光源,该光源提供适合使用中吸光染料的吸收特性的波长。因此,使用了 735 纳米 LED 共生灯,该灯与 RH155 和 RH482 的最佳吸收波长重叠。其次,如有必要,使用翻转式下台冷凝器,将光线从 LED 光源集中到较小的区域。第三,调整冷凝器高度,实现 Köhler 照明,确保高亮度、均匀度和最大图像质量。第四,确保光通路中没有热滤光片,从而减小 LED 灯的 735 纳米波长。第五,如果需要更多的光,从光学通路中取出扩散器。第六,使用高 NA 目标,提供高空间分辨率,并允许足够的光水平在低光强度下达到 PDA。这使我们能够最大限度地减少光出血,以便我们能够使用所有文件中相同的光强度,每次准备获得几个 10-20 分钟持续时间的采集文件,并且不会显著丧失信号振幅或需要重新染色。关键是,如果实验者希望跟踪这些较长文件中的神经元,则确保焦距平面不会发生变化,并且准备不会移动。最后,将足够的光线输送到PDA的另一种方法是使用更薄、因此不那么不透明的幼年动物。
我们时不时地发现,光学信号的信号与噪声比变质和/或电机程序节奏不理想(例如,慢速或异常)。当这种情况开始持续发生时,我们将 VSD 的新解决方案混合在一起。VSD 的 Aliquot 通常在 -20 °C 的冰柜中存活约 6 个月。相关方面,值得注意的是,对于 Berghia来说,迄今为止,吸收VSD RH482取得了最好的效果。由于RH482比RH155更嗜脂,它可能会更好地染色 Bergghia相对较小的神经元,或更有效地留在神经元膜中,在用于这个热带物种的较高记录盐水温度。
基于 PDA 的神经活动成像的一个限制与 100 倍预增步骤之前硬件中电压信号的交流耦合有关:尽管这是消除该技术所需的高静息光水平产生的大直流偏移的必要功能,但 PDA 固有的交流耦合排除了膜电位缓慢变化的测量, 例如那些与突触输入相关的输入。如果需要记录缓慢或稳定状态的潜在变化,则可以使用直流耦合 CMOS 相机成像系统来捕获子保持活动。伯恩和他的同事最近用RH155来描述神经元在阿普利西亚17、18的布卡勒结石中的活动。我们使用这两个系统,发现CMOS相机,由于其探测器密度高得多(128×128),产生50倍更大的数据文件为相同的成像时间7。PDA 的较小文件有助于更快地处理和分析。这也使扩展的单一试验录音(图4)和学习研究,其中来自多个试验的数据串联成一个大文件之前尖峰排序,允许网络组织跟踪学习发展19。
在其他基于摄像头的调查中,Kristan 和他的同事使用荧光 VSD 来检查水痘的细分结体中的网络功能。在一项有影响力的研究中,这导致了一个神经元的识别参与动物决定游泳或爬行20。在另一项研究中,Kristan等人研究了水痘的游泳和爬行行为是由多功能电路与专用电路21驱动的程度。最近,Wagenaar和他的同事使用双面显微镜进行电压成像,允许他们从几乎所有神经元中记录水痘段结节22。与许多基于相机的成像方法相比,我们基于 PDA 的成像方法的一个优点是 ICA 快速和公正地进行尖峰排序,这是一种盲源分离形式,不涉及对结果处理的神经元边界的决策。
关于VSD的选择,吸收染料RH155和RH482的一个优点是与它们相关的很少到没有光毒性23,24,使记录时间比荧光VD的典型更长的时间。此外,我们使用的快速吸收VD非常适合记录胃足量制剂中过冲的体细胞作用潜力,其振幅通常为80mV。如图3G所示,我们的光学方法可以记录动作电位下射(我们的记录均无跟踪平均):这表明我们使用的 VSD 应该能够识别其他模型系统中的动作电位,这些电位在一定程度上减弱,因此在到达索马时不会过冲。然而,我们的光学方法可能并不理想,因为已知在索马中记录时会表现出高度衰减的动作潜力的物种。
目前对神经网络的很多研究都集中在少数名牌转基因物种上。然而,神经科学受益于对各种不同植物物种的研究。研究许多不同的物种提供了关于电路如何演变25,26的见解,并阐明网络功能的原则,可能是常见的植物1,2,3,4,27。到目前为止,我们已经将我们的成像方法应用于一些胃足类动物,包括阿普利西亚卡利波尼卡8,11,12,13,14,28,特里托尼亚二恶英8,9,11,14,19,28,特里托尼亚节日28, 普鲁罗布兰查亚卡利科尼卡(未公布的数据),最近贝尔吉亚斯蒂芬妮(图5)。这种方法的吸引力在于,它可以很容易地应用于许多物种,而不需要转基因动物。我们希望承认,我们使用VSD成像与快速吸收染料和PDA的脚步,开拓性的工作,完成了这在半完整,行为纳瓦纳克斯29和阿普利西亚30准备。我们强调我们的方法的快速性,部分是回答担心许多研究人员可能越来越不愿意开始网络研究的新物种,因为担心多年的研究将有必要的特点的基本网络组织之前,能够探索科学问题,广泛感兴趣的神经科学31。因此,我们在这里的目标是展示一种技术,大大加快了这个过程 - 以至于可以从单一的准备中获得对网络组织的显著当日洞察。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了国家1257923和NIH 1U01NS10837的支持。作者希望感谢王让在实验室的帮助。
材料
| Name | Company | Catalog Number | Comments |
| Achromat 0.9 NA swing condenser | Nikon | N/A | |
| Bipolar temperature controller | Warner Instruments | CL-100 with SC-20 | Controls perfusion saline temperature |
| Chamber thermometer | Physitemp | BAT-12 with IT-18 microprobe | |
| Digital camera | Optronics | S97808 | |
| Dissecting forceps | Dumont | #5 | |
| Dissecting scissors | American Diagnostic Corp. | ADC-3410Q | |
| Imaging microscope | Olympus | BX51WIF | |
| Imaging perfusion chamber | Siskiyou | PC-H | |
| Instant Ocean | Instant Ocean | SS6-25 | Makes 25 gallons at a time |
| Master-8 pulse stimulator | A.M.P.I. | Master-8 | |
| Microdispenser | Drummond Scientific | 3-000-752 | Dye applicator for pressure staining |
| Microdissection scissors | Moria | 15371-92 | |
| Minutien pins (0.1 mm) | Fine Science Tools | NC9677548 | For positioning and stabilizing CNS |
| Motorized microscope platform | Thorlabs | GHB-BX | Gibraltar platform |
| NeuroPlex imaging software | RedShirtImaging | NeuroPlex | Compatible with the WuTech photodiode array |
| Objective lenses | Olympus | XLPLN10XSVMP, XLUMPLFLN20XW, LUMPLFLN40XW, UAPON40XW340 | |
| PE-100 polyethylene tubing | VWR | 63018-726 | Tubing to make suction electrodes |
| Perfusion pump | Instech | P720 with DBS062SDBSU tube set | |
| Petroleum jelly | Equate | NDC 49035-038-54 | |
| Photodiode array with control panel | WuTech Instruments | 469-IV photodiode array | Contact jianwu2nd@gmail.com for ordering information |
| RH155 | Santa Cruz Biotechnology | sc-499432 | Voltage-sensitive dye |
| RH482 | Univ of Conn. Health Center | JPW-1132 | Voltage-sensitive dye; special order from Leslie Leow |
| Silicone earplugs | Mack's | Model 7 | To be use for preparation compression |
| Staining PE tubing | VWR | 63018-xxx | Different sizes depending on fit |
| Sylgard 184 silicone elastomer kit | Dow Corning | Sylgard 184 silicone elastomer kit | |
| Thorlabs LED and driver | Thorlabs | M735L2-C1, DC2100 | LED lamp and driver |
| Tygon tubing | Fisher Scientific | 14-171-xxx | |
| Vibration isolation table | Kinetic Systems | MK26 | Spring-based |
参考文献
- Miller, C. T., Hale, M. E., Okano, H., Okabe, S., Mitra, P. Comparative Principles for Next-Generation Neuroscience. Frontiers in Behavioral Neuroscience. 13 (12), (2019).
- Brenowitz, E. A., Zakon, H. H. Emerging from the bottleneck: benefits of the comparative approach to modern neuroscience. Trends in Neuroscience. 38 (5), 273-278 (2015).
- Bolker, J. Model organisms: There's more to life than rats and flies. Nature. 491 (7422), 31-33 (2012).
- Carlson, B. A. Diversity matters: the importance of comparative studies and the potential for synergy between neuroscience and evolutionary biology. JAMA Neurology. 69 (8), 987-993 (2012).
- Chase, R. . Behavior and its neural control in gastropod molluscs. , (2002).
- Salzberg, B. M., Grinvald, A., Cohen, L. B., Davila, H. V., Ross, W. N. Optical recording of neuronal activity in an invertebrate central nervous system: simultaneous monitoring of several neurons. Journal of Neurophysiology. 40 (6), 1281-1291 (1977).
- Frost, W. N., et al. Monitoring Spiking Activity of Many Individual Neurons in Invertebrate Ganglia. Advances in Experimental Medicine and Biology. 859, 127-145 (2015).
- Frost, W. N., Wang, J., Brandon, C. J. A stereo-compound hybrid microscope for combined intracellular and optical recording of invertebrate neural network activity. Journal of Neuroscience Methods. 162 (1-2), 148-154 (2007).
- Frost, W. N., Wu, J. -. Y., Covey, E., Carter, M. Voltage-sensitive dye imaging. Basic Electrophysiological Methods. , 169-195 (2015).
- Brown, G. D., Yamada, S., Sejnowski, T. J. Independent component analysis at the neural cocktail party. Trends in Neuroscience. 24 (1), 54-63 (2001).
- Hill, E. S., Moore-Kochlacs, C., Vasireddi, S. K., Sejnowski, T. J., Frost, W. N. Validation of independent component analysis for rapid spike sorting of optical recording data. Journal of Neurophysiology. 104 (6), 3721-3731 (2010).
- Bruno, A. M., Frost, W. N., Humphries, M. D. Modular deconstruction reveals the dynamical and physical building blocks of a locomotion motor program. Neuron. 86 (1), 304-318 (2015).
- Bruno, A. M., Frost, W. N., Humphries, M. D. A spiral attractor network drives rhythmic locomotion. ELife. 6, 27342 (2017).
- Hill, E. S., Bruno, A. M., Vasireddi, S. K., Frost, W. N., Naik, G. R. ICA applied to VSD imaging of invertebrate neuronal networks. Independent Component Analysis for Audio and Biosignal Applications. , 235-246 (2012).
- Jahan-Parwar, B., Fredman, S. M. Neural control of locomotion in Aplysia: role of the central ganglia. Behavioral and Neural Biology. 27 (1), 39-58 (1979).
- Jin, W., Zhang, R. J., Wu, J. Y. Voltage-sensitive dye imaging of population neuronal activity in cortical tissue. Journal of Neuroscience Methods. 115 (1), 13-27 (2002).
- Neveu, C. L., et al. Unique Configurations of Compression and Truncation of Neuronal Activity Underlie l-DOPA-Induced Selection of Motor Patterns in Aplysia. eNeuro. 4 (5), 17 (2017).
- Cai, Z., Neveu, C. L., Baxter, D. A., Byrne, J. H., Aazhang, B. Inferring neuronal network functional connectivity with directed information. Journal of Neurophysiology. 118 (2), 1055-1069 (2017).
- Hill, E. S., Vasireddi, S. K., Wang, J., Bruno, A. M., Frost, W. N. Memory Formation in Tritonia via Recruitment of Variably Committed Neurons. Current Biology. 25 (22), 2879-2888 (2015).
- Briggman, K. L., Abarbanel, H. D., Kristan, W. B. Optical imaging of neuronal populations during decision-making. Science. 307 (5711), 896-901 (2005).
- Briggman, K. L., Kristan, W. B. Imaging dedicated and multifunctional neural circuits generating distinct behaviors. Journal of Neuroscience. 26 (42), 10925-10933 (2006).
- Tomina, Y., Wagenaar, D. A. A double-sided microscope to realize whole-ganglion imaging of membrane potential in the medicinal leech. ELife. 6, 29839 (2017).
- Chang, P. Y., Jackson, M. B. Interpretation and optimization of absorbance and fluorescence signals from voltage-sensitive dyes. Journal of Membrane Biology. 196 (2), 105-116 (2003).
- Parsons, T. D., Salzberg, B. M., Obaid, A. L., Raccuia-Behling, F., Kleinfeld, D. Long-term optical recording of patterns of electrical activity in ensembles of cultured Aplysia neurons. Journal of Neurophysiology. 66, 316-333 (1991).
- Katz, P. S. Evolution of central pattern generators and rhythmic behaviours. Transactions of the Royal Society of London, Series B. 371 (1685), 20150057 (2016).
- Moroz, L. L. Biodiversity Meets Neuroscience: From the Sequencing Ship (Ship-Seq) to Deciphering Parallel Evolution of Neural Systems in Omic's Era. Integrative and Comparative Biology. 55 (6), 1005-1017 (2015).
- Frost, W. N., Tian, L. -. M., Hoppe, T. A., Mongeluzi, D. L., Wang, J. A cellular mechanism for prepulse inhibition. Neuron. 40, 991-1001 (2003).
- Hill, E. S., Vasireddi, S. K., Bruno, A. M., Wang, J., Frost, W. N. Variable neuronal participation in stereotypic motor programs. PLoS One. 7 (7), 40579 (2012).
- London, J. A., Zecevic, D., Cohen, L. B. Simultaneous optical recording of activity from many neurons during feeding in Navanax. Journal of Neuroscience. 7 (3), 649-661 (1987).
- Wu, J., Cohen, L. B., Falk, C. X. Neuronal activity during different behaviors in Aplysia: A distributed organization. Science. 263 (5148), 820-823 (1994).
- Marder, E., North, G., Greenspan, R. J. Searching for insight. In Invertebrate Neurobiology. , 1-18 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。