Method Article
LQ α和β参数、辐射剂量模式和体内剂量沉积评估的辐照器调试和剂量测量
* 这些作者具有相同的贡献
摘要
辐射剂量为提高临床前实验的准确性和确保所提供的辐射剂量与临床参数密切相关提供了技术。该协议描述了在学前辐射实验期间每个阶段要采取的步骤,以确保适当的实验设计。
摘要
辐射剂量测量对于高转化相关性的学前模型中辐射方案的准确传递和可重复性至关重要。在进行任何体外或体内实验之前,必须评估辐照器和单个实验设计的具体剂量输出。使用电化室、电表和固体水设置,可以确定等中心宽场的剂量输出。在电化室中使用与放射性色膜类似的设置,还可以确定不同深度较小场的剂量率。针对放射治疗对癌细胞进行体外克隆生存检测是廉价的实验,通过将这些数据与传统的线性二次模型相配,提供细胞系固有的无线电敏感性的测量。从这些检测中估计的模型参数,结合生物有效剂量的原则,可以制定不同的放射治疗分馏时间表,在携带肿瘤的动物实验中提供同等的有效剂量。这是一个重要的因素,要考虑和纠正比较体内放射治疗时间表,以消除潜在的混淆的结果,由于交付的有效剂量的差异。综合起来,本文提供了一种一般方法,用于剂量输出验证前科动物和柜式辐照器、对无线电敏感性的体外评估以及小生物体的辐射传递验证。
引言
癌症在美国和全球许多国家共同代表第二大死因。放射治疗是许多肿瘤亚型治疗的基石,并给大约一半的癌症患者2,3。随着时间的推移,几乎所有癌症的患者结局都有所改善,用于提供放射剂量的设备稳步推进,并开发了一些有效的多式联运治疗方法,但某些类型的肿瘤患者的复发率和死亡率仍然很高7,8,9。因此,癌症放射治疗仍然是基础和临床研究的活跃领域。许多临床前放射治疗研究都使用小型放射器向体外或动物癌症模型提供辐射剂量。由于有许多潜在的实验来探索机械放射性生物学的细节或新的治疗方法,可能会遇到常见的陷阱,导致错误的结论,不良的可重复性和浪费的资源。这些陷阱存在于三个重要领域:辐照器位定、模型细胞线的体外特征化以及体内辐照剂的表征和设置。如果不事先注意放射治疗研究的这些基本方面,就很难从更先进的实验中取得准确和可重复的结果。
此处详细描述的议定书描述了避免或减轻这些问题的一般战略,并借鉴了以前开发的几种用于独立使用的方法。这些独特的方法已经合并,以便有兴趣开始或改进前科放射治疗实验的研究人员可以利用这作为一个强大的实验布局。建议的框架包括小型动物辐照器的调试方法,确定模型癌细胞系的基本放射性生物性质,以及适当设计和管理体内肿瘤模型的剂剂和分馏时间表的方法。
研究方案
西弗吉尼亚州摩根敦西弗吉尼亚大学机构动物护理和使用委员会批准了本议定书中涉及使用实验室动物的任何步骤,包括处理和程序(协议编号:1604001894)。
1. 确定剂量输出
- 使用此协议,基于美国物理学家协会医学任务组 (AAPM TG) 6110 的"幻象法"协议,与 Xstrahl 设置的调试协议类似,以确定小型动物照射器在以下设置条件下特定几何学的光束输出。
- 将辐照器设置为 220 kVp 和 13 mA 的辐射,开放场(17 厘米乘 17 厘米)位于等中心,或距离源头 35 厘米。此外,使用 0.15 mm Cu 滤光片过滤光束,并具有宽焦。有些蜂窝辐照器只含有放射源,此协议只能用于X射线辐照器。
- 按以下顺序对齐固体水幻影:1 厘米板、2 厘米带电化腔槽的板、2 厘米板、1 厘米板。按此顺序堆叠固体水幻影将电化室定位在 2 厘米的深度,允许 4 厘米以及反散射。有关文位设置的图形描述,请参阅图 1。
注:为了适应大型的、相当重的固体水堆,作者建议购买具有可变支撑的定制 3D 打印沙发,以确保幻象堆栈与材料表面的源头保持正确距离,而不仅仅是在中心。
- 使用测量设备(即ADCL校准电化室、电表)和使用校正因子的解释,可分别在 材料表 和 表1 中找到。
注:ADCL为不同的半值层(HVL,光束质量测量)提供几个点的Nk 值。协议中使用的 Nk 值应基于对单位测量 HVL 的 ADCL 值的插值。制造商测量了我们单位的 HVL,我们在剂量率输出确定中使用了 HVL。 - 设置幻象堆栈,按照步骤 1.1.2 的指定将电化腔室插入幻象中。
- 调整幻象堆栈,使源到表面距离 (SSD) 或从辐射源到第一表面的距离在适当调平时为 33 厘米。
注:作者建议创建一个定制的3D打印沙发,大到足以支持固体水板的尺寸。此外,本协议中使用的那个具有可调节的组件,用于调平幻影堆栈。
- 调整幻象堆栈,使源到表面距离 (SSD) 或从辐射源到第一表面的距离在适当调平时为 33 厘米。
- 以三个单独的 X 射线曝光的平均值为例,一分钟的读数与电表偏置电压设置为 300 V。结果将被称为M+。
注:辐照与仪器一起进行,以220千伏和13mA的速度提供辐射。接下来的两个步骤(步骤 1.5-1.6)也是如此。为保护用户安全,请确保在治疗期间门保持关闭状态。 - 执行另一组三个单独的 X 射线曝光,1 分钟读数,电表偏置电压设置为 -150 V。结果将被称为ML。
- 执行另一组三个单独的 X 射线曝光,1 分钟读数,电表偏置电压设置为 -300 V。结果将被称为MH,或也M-。
- 使用方程 1和方程2分别计算 Ppol和 P 离子,如下所述:
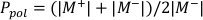 (方程 1)
(方程 1)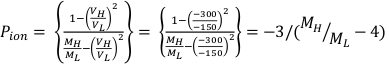 (方程 2)
(方程 2) - 使用校准的数字温度计和气压计测量照射器内的温度、摄氏度和 kPa 中的压力。然后,按照方程 3中所示计算 PTP。
注:此计算假定 ADCL 在说明其空气角校准因子值时使用了 22 °C 和 101.33 kPa 的标准温度和压力值。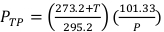 (方程 3)
(方程 3) - 通过乘以原始室读数 MH(按 Pelec、Ppol、P离子和 PTP)计算更正的腔室读数 M。此方程可在方程 4中找到。
注:此计算假定 ADCL 执行校准时将偏置电压设置为 -300V,这是相当常见的做法。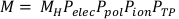 (方程4)。
(方程4)。 - 进一步乘以纠正室读数由Nk,[(μ en/p)w空气]水,PQ,香,和P护套。P护套仅用于在水中获得的测量。因此,对于此协议 P护套仅为 1。
注:使用本协议中的条件,后三个项目的值为 1.0731。此值取决于光束质量,因此必须知道 HVL 才能确定它。1.0731 的价值是特定于我们单位的,并举例说明。要确定 PQ、cham和 [(μen/p)w空气) 特定于您的单位的水的值,请使用表 VII 和表 VII 的测量 HVL 和插值,并根据 AAPM TG61 协议10中的图 3和图 4纠正参考字段大小。在我们的情况下,乘以Nk乘以1.0731提供剂量水,Dw,在Gy名义时间为1分钟,假设ADCL Nk值在Gy/库伦布斯给出。 - 确定正在使用的辐照器的最终效果。当 X 射线首次生成时,输出在有限的时间内上升到其全部值。同样,当 X 射线源关闭时,输出在一定有限的时间内会减少到零。
- 考虑此过渡的时间,或最终效果。这可以通过将电表偏置电压设置为 -300 V 的三个读数的平均值用于各种时间设置来完成。这样做6,12,18,24,30和60秒。
- 根据时间绘制电表读数,并找到最佳直线。1 分钟治疗的总时间可按 方程 5 计算:
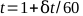 (方程5)。
(方程5)。
- 按 方程 6计算给定辐照器的剂量率:
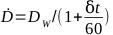 (方程 6)
(方程 6)
2. 创建射色膜校准曲线
- 有关所需材料的列表,请参阅 材料表。
- 使用与上一个协议几乎相同的设置,将薄膜放置在固体水幻影堆栈中 2 厘米深。固体水幻象的顺序是微不足道的,只要有2厘米以上的固体水和4厘米以下的固体水的积累和反散射效果。
- 使用协议 1 中委托的确定剂量,使用方程 7确定表 2中列出的剂量的治疗时间:
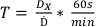 (方程 7)
(方程 7) - 准备几片胶卷,确保每部电影大小相同,并且从治疗到扫描采集保持相同的方向。这可以通过在左下角放置一个小对角线切口来完成。从这一点向前看的每部电影必须来自同一批次的电影。
注:为要评估的每个剂量点准备 3 个单独的复制品。 - 使用 48 位彩色照片扫描仪扫描剪切件,并关闭所有校正。确保每个薄膜都放置在扫描床的确切中心。获得的值是用于确定未曝光光学密度11、12的暴露前扫描。保存中的所有图像。Tiff 文件格式以避免压缩关键数据。
注:作者建议扫描电影三次,并使用获得的平均值作为给定胶片的单个值。 - 开始辐照薄膜,将一块薄膜放在4厘米的固体水之上,并将剩余的2厘米固体水放在上面,如本节中先前所述。
- 调整幻象集,使薄膜与电离室在确定剂量输出时与源部的距离相同。这是辐照器的同心点。
- 计划一个处方剂量在步骤 2.3 以上计算的治疗时间。
- 对 表2中列出的每种剂量重复治疗。
- 允许薄膜休息24小时,免受光线的照射。
- 以上述方式获取曝光后膜扫描。
- 将图像导入 ImageJ 分析软件,并在红色通道上执行所有测量。
- 将图像拖入 。蒂夫文件格式成图像J。
- 单击"图像"下拉菜单。从"图像"下拉菜单中选择颜色。从"颜色"选项中选择拆分通道。
- 仅使用红色图像通道,使用矩形工具绘制感兴趣的区域。按 下克特利姆。从结果窗口转录平均值。
- 对于所有扫描的胶片,重复步骤 2.12.1-2.12.4。
- 对于未曝光和裸露的薄膜,可在中央位置的 1 厘米乘 1 厘米方块中获取像素值。这些值将分别表示为光伏U(D) 和光伏(D), 可用于计算 方程 8中描述的净光学密度。
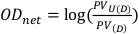 (方程 8)13
(方程 8)13
- 每对胶片图像的重复步骤 2.13,包括曝光前和曝光后。
- 绘制剂量与净光学密度的图形,并将曲线以 y = ax3 + bx2 + cx + d 的格式与立方多面体配合使用。图 2B中可以找到一个示例。
3. 通过克隆检测确定特定癌细胞系的α/β值
注:以下协议是弗兰肯等人描述的方法的修改版本,见图3。
- 将细胞生长到~80%的结合。避免为此实验使用过汇合的细胞源,因为细胞必须处于细胞生长的日志阶段。对于 图3C中显示的代表性克隆检测结果,脑热带MDA-MB-231乳腺癌细胞在杜尔贝科的改良鹰介质(DMEM)中培养,辅以10%的胎儿牛血清和青霉素/链霉素,并在加湿孵化器中孵育在37°C和5%二氧化碳。
- 以所需的密度播种细胞进行菌落测定。播种过程中的准确稀释对于确定测定电镀效率至关重要。请务必板多个复制。
- 如果放射治疗将在细胞电镀之前(图3A)进行,则继续这一步骤。或者,如果细胞电镀在放射治疗之前,请继续到步骤 3.4。
- 对培养瓶进行所需的放射治疗。任何额外的治疗(即药物治疗)可在此之前或之后的任何时候进行。对于 图3C中的代表性结果,辐射处理发生在电镀细胞之后,详见步骤3.4。
- 使用首选的尝试化方法提取细胞,并创建单个细胞悬架。去除培养基,加入重组酶(例如 TrypLE 快车),将细胞从烧瓶中分离出来。用这种酶孵育细胞约3分钟,直到用光显微镜检测出细胞分离。使用等量的细胞培养介质中和酶。离心细胞在300 x g 10分钟,并重新悬浮到培养基中所需的浓度。
- 在多个复制品中以所需的密度平板细胞。
- 替换为前24小时后的新媒体。
- 继续每2-3天更换一次媒体。
- 继续培养细胞,直到控制菌落超过每个殖民地50个细胞,~9-14天。控制菌落是那些没有辐射剂量的治疗组。对于使用药物治疗的实验,还需要使用药物剂量但无需放射治疗的另一组对照组。
- 在放射治疗前播种细胞时继续这一步骤(图3B)。
- 使用首选的尝试化方法提取细胞,并创建单个细胞悬架。
- 将细胞置于多个复制品中所需的密度。
- 允许细胞在一夜之间粘附在板上。
- 执行所需的辐射剂量。其他治疗,如药物给药,可以在此步骤之前或之后的任何时间进行,只要细胞附着在其治疗板上。对于 图 3C中的代表性结果,在治疗前镀了 1250 个脑热带 MDA-MB-231 细胞(步骤 3.4)。然后,在照射前3小时用15nM多索鲁比辛治疗细胞,用3 Gy的X射线。
- 在初始 24 小时后更换媒体。
- 每2-3天更换一次媒体。
- 培养经过处理的细胞,直到对照组菌落超过50个细胞,~9-14天。控制菌落是那些没有辐射剂量的治疗组。对于使用药物治疗的实验,还需要使用药物剂量但无需放射治疗的另一组对照组。
- 从水井或盘子中取出文化介质,然后用 PBS 清洗。
- 在冰川醋酸和甲醇的 1:7 (v:v) 溶液中修复细胞 15 分钟。
- 删除固定解决方案。
- 固定后,在室温下用蒸馏水和甲醇的4:1(v:v)溶液中含有2.5-5.0毫克/mL的水晶紫罗兰溶液,污渍细胞30分钟,或2小时。
- 去除染色溶液,在室温大的水浴中清洗电池。
注意:不要在自来水下清洗。 - 计算每个治疗组的菌落数量,并计算每个板的存活分数。
- 根据相应的剂量绘制生存分数,并将曲线与指数配合。
- 要估计α/β值,请使用上述图的指数拟合来估计下面找到的线性二次方程中每个可调参数的值:
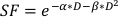 (方程 9)
(方程 9)
注:细胞的辐照通常可以在异位中心进行,无需任何校准,前提是场大小足够大,足以容纳好盘子或培养皿。此协议中的潜在陷阱可能包括产量,如没有菌群形成、细胞生长清晰但无真实菌落的重大细胞迁移,或非无菌辐照器室治疗造成的污染。
4. 确定可变实验设计的具体剂量输出
- 决定所需的字段大小和与源的距离。
注:无论准配器的大小或距离如何,合金都会改变剂量率。 - 使用固体水幻影提供积累和反散射,将一块薄膜定位在最能描绘实验设计的正确方向上。
注:对于任何实验设置,固体水可能无法提供给定设计的最准确表示。相反,我们建议使用实际实验的容器(即培养皿、井板、小动物幻象等)。 - 辐射电影1(N+3)和2(N+3)分钟。
- 允许薄膜休息24小时,免受光线的照射。
- 按照 第 2 节的程序确定每个薄膜的净光学密度。使用薄膜校准曲线从净光学密度中确定剂量。
- 确定剂量在 1 分钟, D1,作为输出剂量率, Ḋ, 此实验设置定义 方程 10 如下:
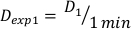 (方程 10)
(方程 10) - 同样,通过 方程 11 将剂量在 2 分钟时计算如下:
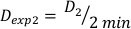 (方程 11)
(方程 11) - 由于最终效果,上述计算的剂量率可能略有不同。因此,要计算所需的实验设计的 Dexp,请使用方程 12中所示的单个 Dexp的平均值:
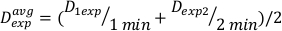 (方程 12)
(方程 12) - 使用此平均值,在 方程 13中定义用于此特定设置的任何所需剂量的治疗时间:
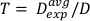 (方程 13)
(方程 13)
5. 在感兴趣的解剖位置治疗患有肿瘤的小鼠
- 麻醉鼠标与安全和人道的麻醉技术批准该机构的IACUC。
- 如所需的实验设计所示,将麻醉动物置于约束中。
- 此步骤是 可选的,如果不可用,请继续到第 5.6 步。 使用机载门户摄像头获取鼠标的无线电图,无需使用铝过滤器进行校准。
- 获得第二个无线电图与校准到位。
- 在 ImageJ 中叠加无线电图以演示光束定位。
- 使用预先确定的α/β值,确定提供最合理方法回答研究问题的剂量方案(即,如果想要模拟剂量 30Gy 在 3 Gy 的 10 个分数中传递的效果,但只希望给出 4 个分数)。使用 方程 14, 假定α/β值为 10(此值可确定为 协议 3中的单个癌细胞系)和类似于 30 Gy/10 F 的 BED,在 6 Gy 的 4 个分数中以 24 Gy 治疗。
- 治疗动物的指定时间给所需的剂量。
6. 体内剂量沉积的病理确认
- 按照协议5,在治疗后1小时内收集感兴趣的组织15,16。组织收获后,继续使用首选的免疫组织化学方案。下面给出一个示例。
- 用冰冷4%的准甲醛(PFA)来感知动物。
- 在 4 °C 的 PFA 中修复后。
- 固定后,在室温下24小时按顺序固定组织10%、20%和30%蔗糖。
- 将组织嵌入明胶中,并按顺序固定在 4% PFA 中,并在室温下分别在 10-30% 蔗糖中连续固定 24 小时。
- 修剪块和放置在-80°C 30分钟。
- 将组织切成 20-30 μm 部分。
- 免疫污渍幻灯片作为自由浮动部分在六个井板17,18。
- 洗三次,在摇床上渗透30分钟,1%的三顿中1.83%赖氨酸,4%的热灭活山羊血清。
- 用抗γH2AX抗体孵化24小时,然后用所需的二次抗体孵育2小时。
- 使用首选安装介质的带玻璃盖片的盖片滑梯。
- 荧光显微镜上的图像。
结果
按照协议1将提供Gy/min的剂量率,这是特定于正在使用的辐照器。然而,无论照射器的类型,与已知的剂量率校准曲线可以产生使用协议2产生类似的薄膜和类似的校准曲线,图 2A-B。从协议3中成功测定将产生不同、分明的细胞群落,这些细胞具有同质紫罗兰色。α/β的估计值可以与文献值或其他治疗组进行比较,以解释给定细胞系的无线电敏感性。利用协议 2 后开发并在 图 2B中显示的校准曲线,协议 4 将产生两个类似于 图 2A 的薄膜样本,可用于估计所需的实验辐照时间。如果机载门户成像相机可用于使用的辐照器,则可以获得小动物的无线电图,无论是否校准。叠加这些图像将证明与 图4A中描述的小动物相比,校准辐射束的确切位置。协议 5 中成功的剂量沉积可在协议 6 下确认。辐射沉积在体内或体外系统的一个迹象是通过检测双重搁浅的DNA断裂。 图4B中的图示,在 图4A中仅通过右半球治疗的同一只小鼠,仅在经过处理的半球显示阳性γH2AX染色。在这个数字中,核上沾满了DAPI,以显示两件事:1)整个大脑在组织学分析中应用抗γH2AX抗体,2)大脑未经处理的半球仍未染色。
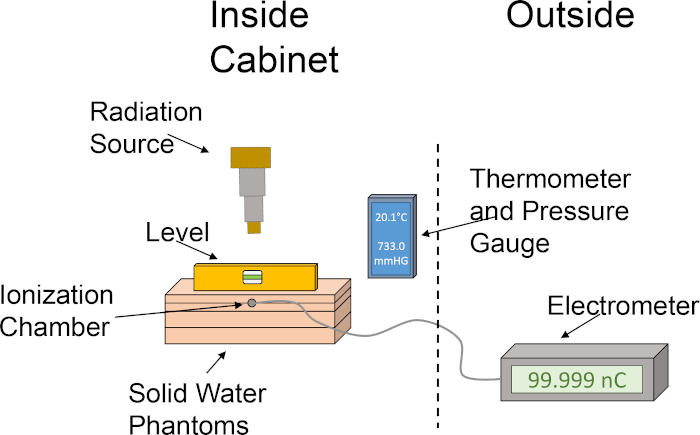
图1:为确定剂量输出而建立的电位室和水幻影的粗糙设置。象形图演示了使用电化室和辐照器柜内的固体水幻影进行测点所需的各种组件的基本设置。 请点击这里查看此数字的较大版本。

图2:使用射色膜的校准曲线的生成。(A) 放射性色膜的代表性颜色变化,剂量增加。左上(0 cGy):右下角(2000年cGy)。(B) 比较净光密度和剂量的潜在放射色膜校准曲线。 请点击这里查看此数字的较大版本。
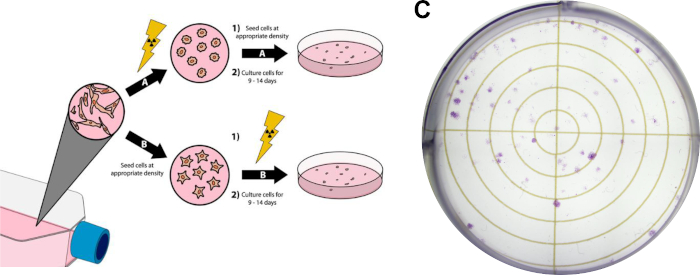
图3:癌细胞克隆分析。细胞的放射治疗可以在镀在六个井板/培养皿(A)或(B)之后进行。在面板(C)中,在遵循协议第 3 节后,显示具有代表性的图像,显示 MDA-MB-231 乳腺癌细胞的成功克隆检测。 请点击这里查看此数字的较大版本。
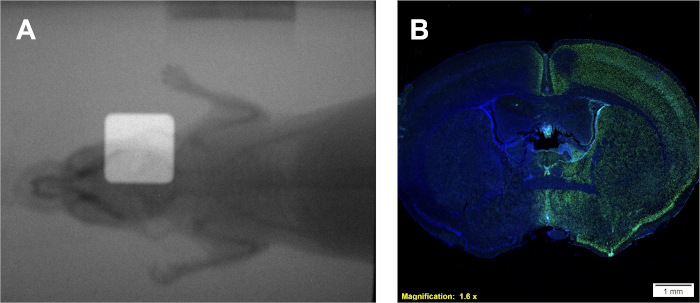
图4:使用双叠加的无线电图定位(如果可用)和阳性γH2AX免疫组织化学染色,以确认剂量沉积。(A) 代表叠加的无线电图,描绘辐射束的位置。(B) 代表结果显示剂量沉积到右半球,γH2AX强度增加就证明了这一点。 请点击这里查看此数字的较大版本。
| 更正因子 | 解释 | |
| Nκ | 空气角校准因子 | |
| [(μ恩/ρ)W空气]水 | 水对空气的大规模能量吸收系数的调和:约1.05 | |
| Pq, 查姆 | 室茎的校正会计,按腔影响光子流畅常数:约1.022 | |
| P护套 | 护套保护电化室的校正会计;价值1,因为房间是防水的 | |
| P波尔 | 修正因子占极性:在协议1中确定 | |
| P离子 | 离子重组的修正因子:在协议1中确定 | |
| PTp | 修正因子在实验当天的三叶草和压力:在协议1中确定 | |
表1:确定协议1中确定剂量率所需的修正因素。
| 剂量 | N |
| 0.5 | 3 |
| 1 | 3 |
| 2 | 3 |
| 3 | 3 |
| 4 | 3 |
| 6 | 3 |
| 8 | 3 |
| 10 | 3 |
| 12* | 3 |
| 15* | 3 |
| 20* | 3 |
| *仅对单个实验的剂量超过 10 的剂量是必要的。 | |
表2:用于射色膜校准曲线生成的剂量。
讨论
上述协议描述了辐射剂量的用户友好方法、癌细胞系中α/β值的确定,以及乳腺癌脑转移学前模型中辐照方法的简要示例。这些方法可用于研究任何癌症模型,不仅仅局限于乳腺癌的大脑转移。在这一节中,我们将讨论相关的复杂基础前放射治疗实验。
剂量测量包括两个部分:1) 用农民室校准输出,从而确定 X 射线单元的剂量率,2) 使用射色膜制备实用的剂量测量系统。在输出校准方面,TG-61在水中提供了可重复的方法。此处的协议使用 Gammex RMI 457 固体水,这是辐照器制造商 XStrahl 的建议。虽然相对剂量(剖面或深度剂量曲线正常化为最大剂量)分析与固体水,同意优于1%与水,有一个约3%至4%的绝对剂量的差异,由于固体水的质量能量吸收系数高于水。但是,由于 XStrahl 系统的所有安装都使用固体水协议进行输出校准,因此我们未能纠正这些差异。了解输出允许计算提供所需剂量所需的暴露时间。将薄膜置于与农家腔相同的设置中,使我们能够向影片提供已知剂量。然后扫描薄膜可提供光学密度。然后,可以根据相应的净光密度(暴露后和曝光前的光密度差异)绘制薄膜的剂量图。这会产生薄膜校准曲线。当我们改变实验设置时,在这种情况下的剂量率可能会改变,因为剂量率取决于场的大小、深度和被辐照的材料。暴露薄膜与实验设置为我们提供了一个净光密度,并使用薄膜校准曲线,然后我们可以确定相应的剂量。将此剂量除以膜照射时,我们获得剂量率。然后,此剂量率可用于计算暴露时间,为给定的实验设置提供所需的剂量。上面描述的协议处理与胶片位测量相关的几个细微差别。例如,暴露后,薄膜需要大约 24 小时才能几乎完成薄膜活动层中的化学反应。不等待此时间将导致较低的光学密度。
对于任何具有可重复的多西测定的研究,了解和理解给定辐照器的几个关键元素都很重要。特别是,向其他研究人员了解和详细说明所使用的辐照器的制造和型号至关重要, 源类型(X射线、放射性等)、能量、半值层、场大小、源到表面和源到等中心距离、辐照材料大小、辐照材料前后后衰减、实验特异性剂量率、分馏图、使用的确切剂量设备以及所使用的剂量协议。所有这些信息点都是在向任何动物或细胞19提供剂量之前,有凝聚力地描述给定辐照器的光束质量。本协议和其他协议的另一个相关信息点是, 协议1 中实现的剂量率只是所使用的辐照器的输出。对于任何给定的实验,重要的是要定义该特定设置的剂量率 (协议 4) 与生成的放射色膜校准曲线 (协议 2)相比。
体外实验提供了有关癌细胞系放射性生物行为的重要细节。体外克隆细胞生存分析准确估计和量化细胞线20固有的无线电灵敏度,有助于设计后续细胞或小型动物实验21的分馏时间表。具体来说,这些测定α和β用于线性二次模型的参数的近似值,根据方程预测细胞死亡,以响应放射治疗:
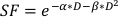 (方程 9)
(方程 9)
其中SF是克隆存活细胞的存活部分,D是Gy中的辐射剂量,α和β都装有参数22。α/β的比例提供了细胞无线电灵敏度的内在测量,更高的值与细胞线22的灵敏度增加相关。由于这种功能关系在剂量方面是非线性的,放射治疗分馏方案的生物效应不仅与总交付剂量有关,而且与分数23的数量和大小有关。生物有效剂量(BED)是衡量真正的生物剂量提供给组织,并允许直接比较不同的分数方案24,25。BED 方程只需要α/β的估计值,如下所示:
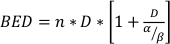 (方程 14)
(方程 14)
其中n是剂量D.克隆细胞生存测定数估计α/β,并有助于通过BED方程直接比较放射治疗分馏方案。如果治疗组的BED在实验中或实验之间不公平,则可能会得出关于组织或器官对放射治疗的反应(或放射治疗与其他方式的组合)的错误结论。例如,10 Gy 的 2 个分数与 5 Gy 的 4 个分数不产生相同的 BED,因此这些配给方案不能直接在生物反应方面进行比较。BED方程,虽然由于线性二次模型的固有局限性而不完美,但可靠地估计了各种实验治疗条件的公平效果24,25。
克隆细胞生存检测在研究癌症模型中的放射治疗效果方面显然起着重要作用,但体外实验提供了一些额外的选择,以进一步探索癌细胞放射生物学的机械细节。克隆细胞生存检测的简单修改用于确定一些放射敏化疗的行动模式,如帕利塔塞尔或异位素26,27。进一步的体外实验选项包括免疫细胞化学研究,以检查特定的细胞修复途径,如γ-H2AX foci和/或53BP1染色双链DNA断裂修复28。这些实验在将放射治疗作为单一模式与组合疗法进行比较时可能特别感兴趣,尤其是在对给定细胞系的机械细节进行探索时。其他实验方案包括细胞因子测量,以检查细胞对辐照的炎症反应的内在作用,或分析细胞死亡模式(即凋亡、坏死、线粒体灾难等),在不同的治疗条件下29、30、31。这种类型的实验可以补充或取代动物实验,并提供对癌细胞系放射生物学的更全面的了解。无论选择进行额外的实验,协议3中描述的标准克隆细胞生存检测是细胞系的重要初始放射性生物评估。
克隆检测和辐射剂量测量为研究人员提供了一种精确规划实验的方法,以更直接地类似于临床场景。随着前科癌症小啮齿动物模型的加入,可以单独或在体内的治疗计划的背景下研究对辐射的反应。在使用动物之前,重要的是要确定特定设置的相对剂量输出,如果它不同于用于确定剂量输出32,33的设置。当涉及到确定+lt:10 mm的场大小的剂量率时,由于小场内的对齐和部分体积平均效果33,电离室的使用变得不那么准确。过去16、34、35、36、37、38年,利用放射色膜与体内免疫缺血实验相结合确定输出,以确定产量和剂量沉积。
披露声明
作者没有披露。
致谢
作者要感谢 WVU 的显微镜和动物模型成像法西特使用其由赠款编号 P20GM103434 支持的设备。此外,这项工作还得到了国家普通医学研究所赠款编号P20GM121322、国家癌症研究所赠款号F99CA25376801和美兰主席捐赠基金的支持。
材料
| Name | Company | Catalog Number | Comments |
| Acetic acid, glacial | Sigma-Aldrich | A6283 | This or comparable glacial acetic acid products are acceptable. |
| Crystal Violet | Sigma-Aldrich | C6158 | This or comparable crystal violet products are acceptable. |
| Digital Baraometer | Fisher Scientific | 14-650-118 | For pressure and temperature measurements. |
| Electrometer | Standard Imaging | CDX 2000B | Calibrated by an ADCL; Need correction factor, Pelec |
| Film | Gafchromic | EBT3 Film | Comes in sheets of 25; calibration films and experimental films must come from same set |
| Ionization Chamber | Farmer | PTW TN30013 | Calibrated by an ADCL @ two calibration points |
| Methanol | Sigma-Aldrich | 34860 | This or comparable methanol products are acceptable. |
| Photo Scanner | Epson | Perfection V700 | Equivalent scanners are V800, V10000, V11000, V12000 |
| XenX | Xstrahl | NA | Irradiator used. |
参考文献
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2019. CA: A Cancer Journal for Clinicians. 69 (1), 7-34 (2019).
- Allen, C., Her, S., Jaffray, D. A. Radiotherapy for Cancer: Present and Future. Advanced Drug Delivery Reviews. 109, 1-2 (2017).
- Delaney, G., Jacob, S., Featherstone, C., Barton, M. The role of radiotherapy in cancer treatment: estimating optimal utilization from a review of evidence-based clinical guidelines. Cancer. 104 (6), 1129-1137 (2005).
- Chen, H. H. W., Kuo, M. T. Improving radiotherapy in cancer treatment: Promises and challenges. Oncotarget. 8 (37), 62742-62758 (2017).
- Le, Q. T., Shirato, H., Giaccia, A. J., Koong, A. C. Emerging Treatment Paradigms in Radiation Oncology. Clinical Cancer Research. 21 (15), 3393-3401 (2015).
- Baumann, M., et al. Radiation oncology in the era of precision medicine. Nature Reviews Cancer. 16 (4), 234-249 (2016).
- Leeman, J. E., et al. Patterns of Treatment Failure and Postrecurrence Outcomes Among Patients With Locally Advanced Head and Neck Squamous Cell Carcinoma After Chemoradiotherapy Using Modern Radiation Techniques. JAMA Oncology. 3 (11), 1487-1494 (2017).
- Coy, P., et al. Patterns of failure following loco-regional radiotherapy in the treatment of limited stage small cell lung cancer. International Journal of Radiation Oncology - Biology - Physics. 28 (2), 355-362 (1994).
- Achrol, A. S., et al. Brain metastases. Nature Reviews Disease Primers. 5 (1), 5(2019).
- Ma, C. M., et al. AAPM protocol for 40-300 kV x-ray beam dosimetry in radiotherapy and radiobiology. Medical Physics. 28 (6), 868-893 (2001).
- Wang, Y. F., Lin, S. C., Na, Y. H., Black, P. J., Wuu, C. S. Dosimetric verification and commissioning for a small animal image-guided irradiator. Physics in Medicine and Biology. 63 (14), 145001(2018).
- Wack, L., et al. High throughput film dosimetry in homogeneous and heterogeneous media for a small animal irradiator. Physical Medicine. 30 (1), 36-46 (2014).
- Devic, S. Radiochromic film dosimetry: past, present, and future. Physical Medicine. 27 (3), 122-134 (2011).
- Franken, N. A., Rodermond, H. M., Stap, J., Haveman, J., van Bree, C. Clonogenic assay of cells in vitro. Nature Protocols. 1 (5), 2315-2319 (2006).
- Ford, E. C., et al. Localized CT-guided irradiation inhibits neurogenesis in specific regions of the adult mouse brain. Radiation Research. 175 (6), 774-783 (2011).
- Zarghami, N., et al. Half brain irradiation in a murine model of breast cancer brain metastasis: magnetic resonance imaging and histological assessments of dose-response. Radiation Oncology. 13 (1), 104(2018).
- Nwafor, D. C., et al. Loss of tissue-nonspecific alkaline phosphatase (TNAP) enzyme activity in cerebral microvessels is coupled to persistent neuroinflammation and behavioral deficits in late sepsis. Brain, Behavior, and Immunity. , (2019).
- Amtul, Z., Hepburn, J. D. Protein markers of cerebrovascular disruption of neurovascular unit: immunohistochemical and imaging approaches. Reviews in Neuroscience. 25 (4), 481-507 (2014).
- Draeger, E., et al. A Dose of Reality: How 20 Years of Incomplete Physics and Dosimetry Reporting in Radiobiology Studies May Have Contributed to the Reproducibility Crisis. International Journal of Radiation Oncology - Biology - Physics. 106 (2), 243-252 (2020).
- Dunne, A. L., et al. Relationship between clonogenic radiosensitivity, radiation-induced apoptosis and DNA damage/repair in human colon cancer cells. British Journal of Cancer. 89 (12), 2277-2283 (2003).
- Yang, Y., Xing, L. Optimization of radiotherapy dose-time fractionation with consideration of tumor specific biology. Medical Physics. 32 (12), 3666-3677 (2005).
- Hall, E. J., Giaccia, A. J. Radiobiology for the radiologist. Eighth edition. , Wolters Kluwer. (2019).
- van Leeuwen, C. M., et al. The alfa and beta of tumours: a review of parameters of the linear-quadratic model, derived from clinical radiotherapy studies. Radiation Oncology. 13 (1), 96(2018).
- Fowler, J. F. 21 years of biologically effective dose. British Institute of Radiology. 83 (991), 554-568 (2010).
- Jones, B., Dale, R. G., Deehan, C., Hopkins, K. I., Morgan, D. A. The role of biologically effective dose (BED) in clinical oncology. Clinical Oncology journal | The Royal College of Radiologists. 13 (2), 71-81 (2001).
- Choy, H., Rodriguez, F. F., Koester, S., Hilsenbeck, S., Von Hoff, D. D. Investigation of taxol as a potential radiation sensitizer. Cancer. 71 (11), 3774-3778 (1993).
- Ng, C. E., Bussey, A. M., Raaphorst, G. P. Inhibition of potentially lethal and sublethal damage repair by camptothecin and etoposide in human melanoma cell lines. International Journal of Radiation Biology. 66 (1), 49-57 (1994).
- Kurashige, T., Shimamura, M., Nagayama, Y. Differences in quantification of DNA double-strand breaks assessed by 53BP1/gammaH2AX focus formation assays and the comet assay in mammalian cells treated with irradiation and N-acetyl-L-cysteine. Journal of Radiation Research. 57 (3), 312-317 (2016).
- Schaue, D., Kachikwu, E. L., McBride, W. H. Cytokines in radiobiological responses: a review. Radiation Research. 178 (6), 505-523 (2012).
- Mery, B., et al. In Vitro Cell Death Determination for Drug Discovery: A Landscape Review of Real Issues. Journal of Cell Death. 10, 1179670717691251(2017).
- Galluzzi, L., et al. Molecular mechanisms of cell death recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death & Differentiation. 25 (3), 486-541 (2018).
- Felix, M. C., et al. Collimator optimization for small animal radiation therapy at a micro-CT. Z Medical Physics. 27 (1), 56-64 (2017).
- Newton, J., et al. Commissioning a small-field biological irradiator using point, 2D, and 3D dosimetry techniques. Medical Physics. 38 (12), 6754-6762 (2011).
- Wong, J., et al. High-resolution, small animal radiation research platform with x-ray tomographic guidance capabilities. International Journal of Radiation Oncology - Biology - Physics. 71 (5), 1591-1599 (2008).
- Ghita, M., et al. Small field dosimetry for the small animal radiotherapy research platform (SARRP). Radiation Oncology. 12 (1), 204(2017).
- Biglin, E. R., et al. Preclinical dosimetry: exploring the use of small animal phantoms. Radiation Oncology. 14 (1), 134(2019).
- Munoz Arango, E. T., Peixoto, J. G., de Almeida, C. E. Small field dosimetry with a high-resolution 3D scanning water phantom system for the small animal radiation research platform SARRP: a geometrical and quantitative study. Physics in Medicine and Biology. , (2019).
- Murrell, D. H., et al. Evaluating Changes to Blood-Brain Barrier Integrity in Brain Metastasis over Time and after Radiation Treatment. Translational Oncology. 9 (3), 219-227 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。