需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在活体钙成像小鼠致病性甘里昂神经元对味觉刺激的反应
摘要
在这里,我们介绍如何暴露活的麻醉实验鼠的基因结石,以及如何使用钙成像来测量这些神经元的合奏对味道刺激的反应,允许使用不同的兴奋剂进行多次试验。这允许对哪些神经元对哪些塔斯特反应进行深入比较。
摘要
在过去十年中,基因编码钙指标(GECIs)的进步促进了活体功能成像的革命。这些技术使用钙作为神经元活动的代理,提供了一种实时监测大型神经元组合中单个细胞对各种刺激的反应的方法。我们和其他人已经应用了这些技术来成像单个基因结核神经元对活麻醉小鼠舌头的刺激的反应。原发性结肠由前舌和味觉内侧阵阵神经元的细胞体以及一些内侧的耳皮皮质的躯体感性神经元组成。通过GCaMP成像单个基因结石神经元的味觉反应,为野生型小鼠中这些神经元的调谐特征提供了重要信息,以及检测基因操纵小鼠周围味觉错误布线表型的方法。在这里,我们演示了暴露基因结石、GCaMP 荧光图像采集、数据分析的初始步骤和故障排除的外科手术。此技术可用于跨基因编码的 GCaMP 或 AAV 介质的 GCAMP 表达,并可修改为映像特定的遗传子集(即 Cre 介质 GCAMP 表达)。总的来说,在活体钙成像的原生结石神经元是一个强大的技术,用于监测外周阵风神经元的活动,并提供补充信息,更传统的全神经和弦丁帕尼录音或味觉行为测定。
引言
哺乳动物外周味系统的一个关键组成部分是原生结石。除了一些内侧的耳塞神经元外,基因还包括前舌和味觉内侧阵阵神经元的细胞体。与其他外周感觉神经元类似,原生结核神经元是伪单极神经元,长轴向外周投射到味蕾,并集中投射到孤独道1的脑干核。这些神经元主要通过味觉受体细胞释放ATP来激活,这些受体细胞对口腔中的味道刺激有反应。。。ATP是味觉信号的基本神经递质,阵风结石神经元表达的P2rx受体是激活4的必要条件。鉴于味觉受体细胞表达特定味觉受体的特定味觉模式(甜,苦,咸,乌玛米,或酸),它已被假设,阵风结石神经元的反应,味道刺激也将勉强调整5。
整个神经记录显示,和弦丁帕尼和更大的上级石油神经进行阵风信号代表所有五种口味模式的原生结石6,7。然而,这仍然留下了关于神经元对给定味道的反应的特异性的问题:如果有味道模式特定的神经元,多模式神经元,或两者的混合物。单纤维记录提供了有关单个纤维的活动及其化学敏感性的更多信息 8,9,10,但这种方法仅限于从少量纤维收集数据。同样,在个体大鼠的活体电生理记录中,生成结石神经元提供了有关单个神经元11、12、13的反应的信息,但仍丧失了种群的活性,每只动物的神经元记录相对较少。为了分析神经元合奏的反应模式,而不忽视单个神经元的活性,需要采用新技术。
钙成像,特别是使用基因编码的钙指标,如GCaMP,提供了这一技术突破14,15,16,17,18。GCaMP使用钙作为神经元活性的代名词,随着细胞内钙含量的升高,绿色荧光增加。继续开发新的GCaMP形式,以提高信号与噪声比,调整绑定动力学,并适应专业实验19。GCaMP 提供单个神经元分辨率,与整个神经记录不同,可以同时测量神经元组合的反应,不像单个纤维或单个细胞记录。基因结胶的钙成像已经提供了关于野生型小鼠16、20中这些神经元的调谐特征的重要信息,并已识别出基因操纵小鼠18中的外周味错配表型。
在活体钙成像技术中应用到基因结石中的一个主要困难是,它被封装在骨质的暴躁牛皮中。为了获得光学访问基因,需要精密的手术,以去除骨层,同时保持结节完好无损。为此,我们创建了此指南,以帮助其他研究人员访问基因结石,并成像这些神经元的 GCaMP 介导荧光反应,以品尝体内的刺激。
研究方案
动物协议由德克萨斯大学圣安东尼奥分校机构动物护理和使用委员会审查和批准。
1. 术前设置
注:请注意,此处没有处理设备的初始设置,因为根据泵系统、显微镜、相机和使用的成像软件,设备设置会有所不同。有关设置说明,请参阅设备供应商提供的教学材料。对于作者使用的设备,请参阅 材料表。
- 确保液体流经所有车辆(水)和干线。如果线路被阻塞,则断开并用水冲洗。如果线被扭结,按摩,直到液体流动。确保液体在提示下启动和停止。
- 一旦所有线路都确认疏通,运行车辆 10s 然后关闭所有阀门。
- 确保成像软件已准备好所有必需的变量(例如,试用长度、文件名称、帧速率等)。使用 μManager,一个开源图像采集软件包,输入 200 ms 到标记 曝光时间 的字段,每秒 5Hz 的帧,在 垃圾箱下选择 x2,然后按标记为 Live 的按钮。当视频开始时,按左侧标记 的ROI按钮。这将产生 512x512 视野。
2. 麻醉和固定动物
注:以下协议是针对体重为 18-35 克的两性小鼠优化的终端程序。建议与10至12周年龄的动物一起使用。它可能用于转基因动物表达基因编码钙指标 (GECI), 如 Snap25-GCaMP6s, 或动物立体注射病毒 GECI.手套、实验室外套和面罩应在整个协议中佩戴。
- 擦伤动物,并进行腹内注射氯胺酮(100毫克/千克)和西拉津(10毫克/千克)。在继续之前,通过脚趾捏评估麻醉的深度。
- 剃掉头顶,在颈部前部的手术区。
- 打开加热垫,将易受伤的动物放在垫子上。
- 将软膏涂在动物的眼睛上,以避免眼睛干燥。
- 在头部中线切口(+1厘米),露出动物的头骨。使用无菌拭子去除结缔组织,使裸骨容易获得。使用棉尖施用器确保头骨干燥。
- 将兽医债券涂在头骨上。一定要盖住裸露的头骨。等待胶水干燥。
- 在培养皿盖中,混合并涂抹一层牙科水泥到头骨上。第 2.5 步中使用的棉尖施用器的后端将适用于此过程。将头柱放在牙科水泥上,并应用第二层牙科水泥将头柱夹在头骨上。
- 让它坐到牙齿水泥干燥和固体。将棉尖施用器折成两半,并用尖端戳牙水泥进行测试。如果牙科水泥不屈服于被戳,动物可能会转向苏平位置。
3. 切除术
- 将手术前磨砂涂抹到手术区域。擦洗后,在喉咙皮肤上做一个中线切口 + 2 厘米,从胸骨到下巴。
- 收回皮肤和亚最大腺体,确保充分暴露肌肉。
- 在副切口肌肉中查找接缝,用钝解剖将其分离,并缩回打开。
- 小心地切开气管顶部的开口,大到足以容纳聚乙烯管(I.D. 0.86 毫米,O.D. 1.27 毫米)。不要在气管直径上切过一半。将管子插入气管朝向肺部。
- 重新定位再造器以释放副切除肌肉并收回亚磁性腺体。
- 用最少的兽医胶水将副切除肌肉粘合在管子上(见图1A)。
4. 打破暴躁的公牛
- 轻轻调戏所需的肌肉(左或右),拉开结缔组织。切在肌肉前端,避免血管,并拉回后,直到清除暴躁的公牛。
- 稍微向后倾斜头部, 抬起暴躁的公牛。将胡萝卜动脉前部的分支定位到深格肌肉的后插入点。感觉只是后到这个血管的凸结构的暴躁公牛。
- 在此位置的肌肉中寻找接缝(见 图 1B)。使用两套细钳,钝解剖接缝,直到廷帕尼亚牛皮的骨头是可见的。使用缩回器来保持对暴躁牛市的清晰视图。
- 找到前部运行到牛皮上后部的接缝(见 图1C)。使用手术探针,在这个接缝的中心戳一个骨头上的洞。使用一套细端剪刀在骨骼中切割圆形区域,注意不要切割前部、后部和牛皮下深处的血管。
5. 暴露基因
- 这个洞里是一块凸起的骨头,这就是科奇拉。前科拉是肌肉,紧张廷帕尼(见 图1D)。使用弹簧剪刀,切下拉伸器,并将其取出。
- 执行脚趾捏。如果动物有反应,给氯胺酮/西拉津混合物阿塔1/3剂量重做。
- 准备灌溉液和吸管线。使用手术探针,在耳蜗海角戳一个洞。立即灌溉流出的液体,并用吸力将其取出。从这一点开始,这种液体将或多或少地持续流动,需要定期处理。
- 放大科奇莱亚的洞。小心血管包围着猪皮到后边缘和横向边缘。
- 将鼠标的头向前倾斜。找到时间骨下的孔是什么科奇拉(见 图1E)。注意到这个洞的脊前,这个山脊直接位于第七神经上。
- 将手术探针插入孔中,小心地抬起时间骨,露出第七根神经(见 图1F)。盘点第七神经的可见度,如果基因没有完全暴露,将动物的头向后倾斜,并试图将骨头从前部拉到神经。
- 如果结石仍然不能完全可见,从下面拉起更多的骨头。要非常小心,不要把探针深埋在骨头下面,因为这样做可能会损害基因。
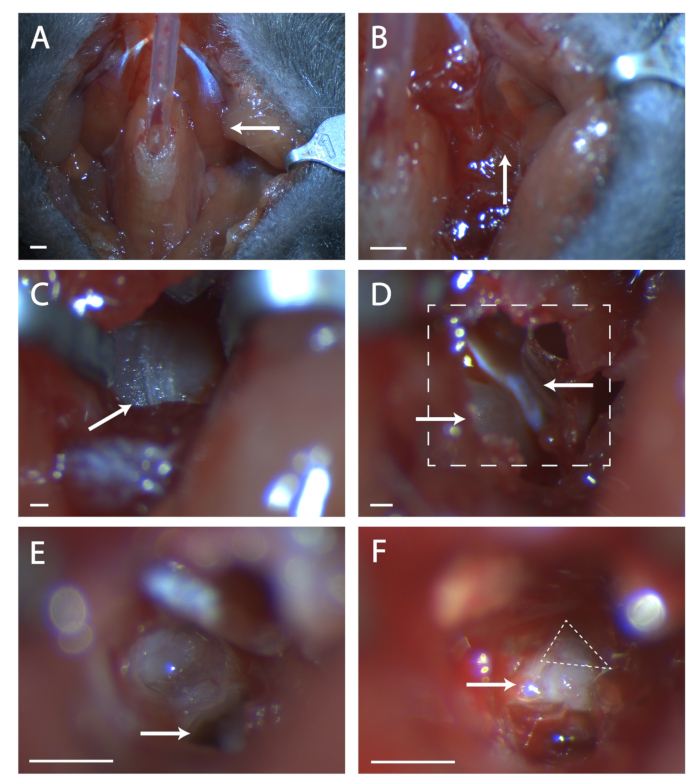
图1:气管切除术后小鼠颈腔的手术暴露。 (A) 小鼠颈腔图像。箭头指向位于图其余部分探索的手术区域上的深格肌肉。(B) 先前指示的肌肉下区域图像。箭头表示用于钝解剖的肌肉中的接缝。(C) 廷帕尼奇布拉的形象。箭头表示骨骼中的接缝,以便用手术探头断裂。(D) 打开牛皮后手术区域的图像。左下箭头表示科奇拉,上箭头指向滕索·廷帕尼。盒装线表示(E)和(F)中的区域。(E) 科奇拉被打破后手术区域的图像,并删除其内容。白色箭头指示在协议步骤 5.6 中引用的手术探头的位置。(F) 暴露的生菌结石的图像。箭头表示身体的第七神经,虚线三角形包围着原生结石。面板 A - b, 刻度 = 5 毫米。 面板 C - f, 刻度 = 1 毫米。请点击这里查看此图的较大版本。
6. 运行烤面包板
- 使用吸力从生源上去除液体。可选放置吸水点,以帮助缓解显微镜导航中的渗漏和辅助。
- 将动物放在显微镜下的吸水垫上。找到原生结石:有用的地标包括公牛留下的洞,时间骨的洞,和第七神经。使用表观范围上的FITC/GFP过滤器,检查单个GCaMP表达的遗传性结核神经元。10 倍目标(工作距离 10mm)将提供足够的分辨率来跟踪单个细胞的活动,但也可以使用 20 倍目标(工作距离 12 毫米)。
- 将配药针牢牢地放在动物的嘴里。将培养皿放在动物的嘴下以捕捉液体。
- 确保摄像机正在查看显微镜的视野。将视频录制的开始与 tastant 演示的开始同步。
- 在录制过程中,观看实时源以了解响应、漂移和渗漏。
- 如果渗漏发生,吸吸液体,直到基因视图清晰并重复。如果发生漂移,请检查头柱的所有部分是否牢固地拧紧。如果没有反应,检查液体是否流动,显微镜和摄像头聚焦在适当的位置,而不会遮挡视野。
- 重复,直到获得所需的视频数量。轻轻放松缩回器,然后在另一侧重复步骤 3-6。
- 在获得所有所需黑帮所需的视频后,通过宫颈错位对动物实施安乐死。
结果
按照协议,转基因Snap25-GCaMP6s动物被镇定,基因结节被暴露,在录制视频时将烤面包涂在舌头上。实验的目的是确定哪些塔斯特引起每个细胞的反应。18 种溶解在 DI 水中,5 mM 奎宁、60 mM NaCl、50 mM IMP = 1 mM MPG、50 mM 柠檬酸)18 被溶解在 DI 水中,并应用于舌头 2 s 由 13 s DI 水分离。
讨论
这项工作描述了一个分步协议,以手术暴露基因结节和视觉记录其神经元与GCaMP6的活动。这个程序非常类似于之前描述的17,有几个明显的例外。首先,使用头部柱子可以方便地调整手术过程中的头部定位。其次,在刺激性输送方面,吴和德沃里亚奇科夫的方法通过食管17流式刺激,而这个协议则用分配针将液体直接输送到嘴里。这两种方法都可以通过刺激真菌...
披露声明
作者没有利益冲突可以报告。
致谢
作者感谢胡马云对老鼠的饲养。这项工作的资金部分由UTSA的脑健康联盟毕业生和博士后种子赠款(B.E.F.)和NIH-SC2-GM130411提供给L.J.M。
材料
| Name | Company | Catalog Number | Comments |
| 1 x #5 Inox Forceps | Fine Science Tools | NC9792102 | |
| 1ml Syringe with luer lock | Fisher Scientific | 14-823-30 | |
| 2 x #3 Inox Forceps | Fine Science Tools | M3S 11200-10 | |
| 27 Gauge Blunt Dispensing Needle | Fisher Scientific | NC1372532 | |
| 3M Vetbond | Fisher Scientific | NC0398332 | |
| 4-40 Machine Screw Hex Nuts | Fastenere | 3SNMS004C | |
| 4-40 Socket Head Cap Screw | Fastenere | 3SSCS04C004 | |
| Absorbent Points | Fisher Scientific | 50-930-668 | |
| Acesulfame K | Fisher Scientific | A149025G | |
| Artificial Tears | Akorn | 59399-162-35 | |
| BD Allergist Trays with Permanently Attached Needle | Fisher Scientific | 14-829-6D | |
| Blunt Retractors | FST | 18200-09 | |
| Breadboard | Thor Labs | MB8 | |
| Citric Acid | Fisher Scientific | A95-3 | |
| Cohan-Vannas Spring Scissors | Fine Science Tools | 15000-02 | |
| Contemporary Ortho-Jet Liquid | Lang | 1504 | |
| Contemporary Ortho-Jet Powder | Lang | 1520 | |
| Cotton Tipped Applicators | Fisher | 19-062-616 | |
| Custom Head Post Holder | eMachineShop | See attached file 202410.ems | |
| Custom Metal Head Post | eMachineShop | See attached file 202406.ems | |
| DC Temperature Controller | FHC | 40-90-8D | |
| Digital Camera, sCMOS OrcaFlash4 Microscope Mounted | Hamamatsu | C13440 | |
| Disection Scope | Leica | M80 | |
| Hair Clippers | Kent Scientific | CL7300-Kit | |
| IMP | Fisher Scientific | AAJ6195906 | |
| Ketamine | Ketaved | NDC 50989-996-06 | |
| LED Cold Light Source | Leica Mcrosystems | KL300LED | |
| Luer Lock 1/16" Tubing Adapters | Fisher | 01-000-116 | |
| Microscope | Olympus | BX51WI | |
| Mini-series Optical Posts | Thorlabs | MS2R | |
| MPG | Fisher Scientific | AAA1723230 | |
| MXC-2.5 Rotatable probe Clamp | Siskiyou | 14030000E | |
| NaCl | Fisher Scientific | 50-947-346 | |
| petri dishes | Fisher Scientific | FB0875713A | |
| Pressurized air | Airgas | AI Z300 | |
| Quinine | Fisher Scientific | AC163720050 | |
| Self Sticking Labeling Tape | Fisher Scientific | 159015R | |
| Silicone Pinch Valve Tubing 1/32" x 1/16" o.d. (per foot) | Automate Scientific | 05-14 | |
| Sola SM Light Engine | Lumencor | ||
| Snap25-2A-GCaMP6s-D | JAX | 025111 | |
| Student Fine Scissors | Fine Science Tools | 91460-11 | |
| Surgical Probe | Roboz Surgical Store | RS-6067 | |
| Surgical Probe Holder | Roboz Surgical Store | RS-6061 | |
| Thread | Gütermann | 02776 | |
| BD Intramedic Tubing | Fisher Scientific | 22-046941 | |
| Two Stage Gas Regulator | Airgas | Y12FM244B580-AG | |
| Tygon vinyl tubing - 1/16" | Automate Scientific | 05-11 | |
| Valvelink8.2 digital/manual controller | Automate Scientific | 01-18 | |
| Valvelink8.2 Pinch Valve Perfusion System | Automate Scientific | 17-pp-54 | |
| Xylazine | Anased | NADA# 139-236 |
参考文献
- Krimm, R. F. Factors that regulate embryonic gustatory development. BMC Neuroscience. 8, 4 (2007).
- Taruno, A., Matsumoto, I., Ma, Z., Marambaud, P., Foskett, J. K. How do taste cells lacking synapses mediate neurotransmission? CALHM1, a voltage-gated ATP channel. Bioessays. (35), 1111-1118 (2013).
- Taruno, A., et al. Taste transduction and channel synapses in taste buds. Pflugers Archiv-European Journal of Physiology. 473, 3-13 (2021).
- Kinnamon, S. C., Finger, T. E. A taste for ATP: neurotransmission in taste buds. Frontiers in Cell Neuroscience. 7, 264 (2013).
- Chandrashekar, J., Hoon, M. A., Ryba, N. J., Zuker, C. S. The receptors and cells for mammalian taste. Nature. 444 (7117), 288-294 (2006).
- Yarmolinsky, D. A., Zuker, C. S., Ryba, N. J. Common sense about taste: from mammals to insects. Cell. 139 (2), 234-244 (2009).
- Ninomiya, Y., Tonosaki, K., Funakoshi, M. Gustatory neural response in the mouse. Brain Research. 244 (2), 370-373 (1982).
- Formaker, B. K., MacKinnon, B. I., Hettinger, T. P., Frank, M. E. Opponent effects of quinine and sucrose on single fiber taste responses of the chorda tympani nerve. Brain Research. 772 (1-2), 239-242 (1997).
- Frank, M. The classification of mammalian afferent taste nerve fibers. Chemical Senses. 1 (1), 53-60 (1974).
- Ogawa, H., Yamashita, S., Sato, M. Variation in gustatory nerve fiber discharge pattern with change in stimulus concentration and quality. Journal of Neurophysiology. 37 (3), 443-457 (1974).
- Sollars, S. I., Hill, D. L. In vivo recordings from rat geniculate ganglia: taste response properties of individual greater superficial petrosal and chorda tympani neurones. Journal of Physiology. 564, 877-893 (2005).
- Yokota, Y., Bradley, R. M. Geniculate ganglion neurons are multimodal and variable in receptive field characteristics. Neuroscience. 367, 147-158 (2017).
- Breza, J. M., Curtis, K. S., Contreras, R. J. Temperature modulates taste responsiveness and stimulates gustatory neurons in the rat geniculate ganglion. Journal of Neurophysiology. 95 (2), 674-685 (2006).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits: A decade of progress. Neuron. 98 (4), 865 (2018).
- Barreto, R. P. J., et al. The neural representation of taste quality at the periphery. Nature. 517, 373-376 (2015).
- Wu, A., Dvoryanchikov, G. Live animal calcium imaging of the geniculate ganglion. Protocol Exchange. , 106 (2015).
- Lee, H., Macpherson, L. J., Parada, C. A., Zuker, C. S., Ryba, N. J. P. Rewiring the taste system. Nature. 548 (7667), 330-333 (2017).
- Dana, H., et al. High-performance calcium sensors for imaging activity in neuronal populations and microcompartments. Nature Methods. 16 (7), 649-657 (2019).
- Wu, A., Dvoryanchikov, G., Pereira, E., Chaudhari, N., Roper, S. D. Breadth of tuning in taste afferent neurons varies with stimulus strength. Nature Communications. 6, 8171 (2015).
- Yarmolinsky, D. A., et al. Coding and plasticity in the mammalian thermosensory system. Neuron. 92 (5), 1079-1092 (2016).
- . dF Over F movie ImageJ Plugin Available from: https://gist.github.com/ackman678/5817461 (2014)
- Cantu, D. A., et al. EZcalcium: Open-source toolbox for analysis of calcium imaging data. Frontiers in Neural Circuits. 14, 25 (2020).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, (2019).
- Zhang, J., et al. Sour sensing from the tongue to the brain. Cell. 179 (2), 392-402 (2019).
- Lee, D., Kume, M., Holy, T. E. A molecular logic of sensory coding revealed by optical tagging of physiologically-defined neuronal types. bioRxiv. , 692079 (2019).
- Moeyaert, B., et al. Improved methods for marking active neuron populations. Nature Communication. 9 (1), 4440 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。