Method Article
人体外伤模型和全山染色方法,以准确评估皮肤修复
摘要
在这里,我们展示了一个优化的技术,使用前体内人体皮肤结合全安装染色方法评估伤口修复。该方法为潜在伤口疗法的评估提供了临床前平台。
摘要
慢性非愈合性伤口主要影响老年人和糖尿病患者,是临床未满足需求的一个重要领域。不幸的是,目前的慢性伤口治疗是不够的,而现有的临床前模型对新疗法的临床疗效预测不佳。在这里,我们描述了一个高吞吐量,临床前模型,以评估人类皮肤修复反应的多个方面。部分厚度伤口是在人体前体皮肤中产生的,并在愈合过程中培养。皮肤伤检被收集固定为全安装染色程序。固定样品在原发性抗体中受阻和孵化,通过荧光结合二级抗体进行检测。在计算每次活检中伤口闭合百分比(重新表皮化)之前,伤口通过共聚焦显微镜进行反涂和成像。应用此协议,我们揭示,在健康的供体皮肤中产生的2毫米切除伤口在受伤后的第4-5天完全重新表皮化。相反,糖尿病皮肤伤口的闭合率显著降低,同时进行扰动屏障改造。将人体皮肤损伤与新型全安装染色方法相结合,采用快速可重复的方法来量化前体外伤口修复。总的来说,本协议为评估潜在伤口疗法的有效性、转化临床前检测和验证提供了宝贵的人类平台。
引言
慢性、非愈合性伤口在老年人和糖尿病患者中非常普遍,是临床未满足需求的主要未受重视领域。这些伤口给病人带来沉重的身心负担,每年花费数十亿美元来治疗1人。尽管对伤口生物学的了解有所提高,技术进步,但多达40%的慢性伤口仍然无法按照最佳标准护理治愈。因此,14-26%的糖尿病足部溃疡患者随后需要截肢3,而5年后截肢死亡率约为70%4。因此,迫切需要开发有效的新疗法,以提高患者的生活质量,同时减轻愈合不良造成的大量医疗负担。预测性差的临床前模型仍然是开发有效新疗法的一大障碍。
伤口修复是一个动态和多方面的过程,涉及各种细胞类型,无数的沟通水平和组织环境,是时间重塑。皮肤愈合由四个主要的修复阶段支撑:止血、炎症、增殖和基质重塑。这些阶段最终采取行动,以防止失血和感染,关闭伤口表面(一个过程称为重新表皮化),并返回皮肤到未受伤的状态5。慢性伤口与不同的病因和广泛的扰动愈合过程有关,进一步复杂化了治疗目标的识别。然而,已经开发了广泛的模型,以阐明伤口病理学的分子和细胞驱动因素,并测试新的治疗方法7。
最常用的伤口修复模型是鼠标急性伤口。老鼠是高度可驾的机械研究,并提供老化和糖尿病8的验证模型。尽管小鼠和人类愈合之间有普遍的相似性,但皮肤结构和愈合动力学的物种间差异依然存在。这意味着大多数的穆林伤口研究不容易转化为诊所9。因此,人们开始推动具有高适用性和可翻译性的人体体外和外体系统10,11。
在这里,我们提供了一个深入的协议,以执行部分厚度切除伤口在外体内的人类皮肤。我们还概述了我们的全安装染色方法作为一种高度可重复的方法来评估前体内人类皮肤愈合。我们展示了表皮修复(重新表皮化)和随后的屏障形成的轨迹,评估健康与糖尿病人类皮肤的伤口闭合率。最后,我们演示了如何调整全安装染色,以使用一系列抗体来评估愈合反应的各个方面。
研究方案
人类皮肤是在城堡山医院和赫尔皇家医务室(英国赫尔)接受重建手术的患者在充分知情、书面患者同意、机构指南和道德认可(LREC:17/SC/0220 和 19/NE/0150)下获得的。非糖尿病皮肤是从接受常规手术的患者(平均年龄 = 68 岁)收集的。糖尿病皮肤是从已确定II型糖尿病和溃疡史(平均年龄 = 81 岁)的捐赠者中挑选出来的。手术样本在手持介质中运输,抵达实验室后立即处理。使用未修复的人体组织的所有实验步骤均在生物安全级 2 (BSL-2) 中执行,该步骤位于 II 类层压流生物安全柜中。
1. 皮肤培养介质和染色试剂的制备
注:所有试剂和耗材详情均在 材料表中提供。确保用于人体组织加工和培养的所有试剂和设备都是无菌的。使用前对仪器进行消毒,在与组织接触后用消毒剂消毒。处置前将废品在1%消毒剂中净化。
- 持有介质:补充高葡萄糖杜尔贝科的改良鹰中等(DMEM)与2mM L-谷氨酰胺和4%(v/v)抗生素抗菌解决方案。
- 汉克的平衡盐溶液 (HBSS) 与抗生素: 添加 4% (v/v) 抗生素抗菌解决方案到 HBSS.在 4 °C 下存储,直到使用。
- 杜尔贝科的磷酸盐缓冲盐水 (DPBS): 通过每升蒸馏水溶解 9.6 克 DPBS 粉末 (dH2O) 来准备 DPBS。高压灭菌,并在 4 °C 下储存,直到使用。
- 人类皮肤生长介质:补充高葡萄糖DMEM与2mM L-谷氨酰胺,1%(v/v)抗生素抗肌酸溶液和10%(v/v)胎儿牛血清。在 4 °C 下存储,直到使用。
- 皮肤固定剂:至450 mL dH2O,加入40mL甲醛溶液、10mL冰川醋酸、4.5克氯化钠和0.25克溴化铝。在室温下存储(RT),并在几天内使用。
警告:固定剂是危险的(刺激性和易燃性)。小心处理,并通过适当的路线处理。 - 磷酸盐缓冲盐水(PBS):通过在100 mL磷酸盐缓冲液和900 mL dH2O中加入6克氯化钠,为全安装染色做好准备。
- 染色洗涤缓冲器:在 PBS 中溶解 0.5% (v/v) 特里顿 X-100。
- 阻塞缓冲器:在染色洗涤缓冲器中加入 0.2% (w/v) 钠阿齐德和 2% (v/v) 动物血清。在 4 °C 下存放长达两周。
注:阻断二级抗体宿主物种的血清。阿齐德钠在孵化过程中可以防止细菌生长。 - DAPI 工作解决方案:在硫化二甲基 (DAPI) 中准备 5 毫克/mL 的 4+、6-二甲基二苯丙胺 (DAPI) 库存。在染色洗涤缓冲器中稀释库存 1:1,000,以提供 5 μg/mL DAPI 工作解决方案。
- 过氧化酶块:在染色洗涤缓冲器中加入0.3%(v/v)过氧化氢。在 4 °C 下存储,直到使用。保持在黑暗中,以防止分解。
- ABC-HRP 套件:
- HRP 结合二级抗体:5 mL 染色缓冲器中 1 滴生物染色兔抗山羊 Igg。在 4 °C 下存放长达两周。
注:使用的试剂盒/二次将取决于原发性抗体的宿主物种。 - 阿维丁生物素复合物 (ABC) 试剂:2 滴试剂 A 和 2 滴试剂 B 在 5 mL 的染色洗涤缓冲器中。ABC 试剂应在使用前至少 30 分钟准备。在 4 °C 下存放长达两周。
- HRP 结合二级抗体:5 mL 染色缓冲器中 1 滴生物染色兔抗山羊 Igg。在 4 °C 下存放长达两周。
- 过氧化物酶基板:3滴试剂1,2滴试剂2,2滴试剂3和2滴过氧化氢在5mL dH2O.过氧化酶基板应在使用前立即准备,不能存储。
2. 为伤口准备皮肤
注:这些步骤应在 II 类层压流生物安全柜中执行。
- 收集持有介质和运输到 BSL-2 机柜的皮肤。
- 将皮肤真皮侧放在90毫米无菌的培养皿内,用无菌剪刀切除脂肪组织。
- 将皮肤放在含有 25 mL HBS 的 50 mL 管中,在 RT 处使用抗生素 10 分钟。间歇性摇动以去除任何残留的血液和脂肪组织。
- 使用新的 50 mL 管重复步骤 2.3。
- 将皮肤放在含有 25 mL HBSS 的新鲜 50 mL 管中,这次在 RT 10 分钟内不使用抗生素。
- 将皮肤放入 25 mL DPBS 的新管中,进行最后的皮肤冲洗。皮肤现在准备伤口了。
3. 制造前体内人体皮肤伤口
注:这些步骤应在 II 类层压流生物安全柜中执行。
- 受伤前准备皮肤培养菜肴。在 60 mm Petri 菜肴中,堆叠两个无菌吸水垫,并通过菜的侧面添加 4 mL 的人体皮肤介质。将无菌尼龙过滤膜放在吸水垫堆栈上。
注意:皮肤介质可以根据所需的治疗条件进行更改。每个堆栈上最多可培养三个伤口外植物。 - 在 90 mm Petri 盘中干燥无菌纱布上皮肤的皮肤侧,以去除残留的 DPBS。
注意:这可以防止皮肤在受伤时滑动。 - 将皮肤真皮侧放在干净的 90 mm Petri 菜盖上,用新鲜的无菌纱布擦干表皮。
注意:在培养皿盖中伤口皮肤比在底座上更容易。应迅速开展后续工作,防止皮肤干燥。 - 紧握皮肤,用2毫米活检拳压住皮肤,轻轻扭动。不要完全打穿皮肤。
注:部分厚度伤口设计用于冲穿表皮,部分打入真皮。创建部分厚度伤口所需的力中可能有捐赠者对捐赠者和现场到现场的变异性。 - 使用弯曲的齿形组织钳子拾取 2 mm 伤口的每一侧,并在 2 mm 伤口下钩住弯曲的虹膜剪刀,使其均匀切除。
- 使用 6 mm 活检冲床对中央 2 毫米伤口进行活检,在中心创建部分厚度为 2 mm 伤口的 6 mm 外植。
注:6 毫米活检冲床可用于标记皮肤,以标记每个 2 mm 伤口的位置。小心不要完全穿透组织。以蜂窝模式创建伤口外植,以减少浪费。 - 将伤口外皮侧放在尼龙过滤膜堆栈上(以第 3.1 步准备)。
注意:处理伤口外植时,请注意不要损坏中心伤口。使用小钳子,在对面捡起每个外生植物。 - 在潮湿的大气(90-95%)中将伤口在 32-37 °C 和 5% CO2 中孵育 1-7 天。每 2-3 天更换一次媒体。
4. 前体外伤口的全安装污渍
注:本节描述了免疫荧光和免疫过氧化酶染色方法。使用前混合所有试剂。
- 荧光染色方法
- 在 1.5 mL 微中心管中收集伤口外植物,其中含有 500 μL 的皮肤固定剂,并在 4 °C 下孵育过夜。
注:此协议中使用的固定剂适用于描述的抗体。其他抗体需要优化。组织固定时间超过 24 小时可能导致过度固定。 - 第二天取出固定剂,代之以 1 mL 的染色洗涤缓冲器。活检可在染色前 4 °C 至 2 周储存在染色洗涤缓冲器中。
注意:对于所有洗涤缓冲步骤,使用血清移液器或移液器尖端,注意不要损坏伤口。 - 吸气染色洗涤缓冲器,并用 1 mL 的染色洗涤缓冲器再冲洗一次。
- 计算步骤 4.1.5-4.1.6 所需的阻塞缓冲器量(样本数量 x 300 μL = μL 中的阻塞缓冲器数量)。如有必要,提供额外的缓冲。
- 在每个样品中加入 150 μL 的阻隔缓冲器,并在 RT 孵育 1 小时。对于所有染色步骤,确保每个样品都有足够的覆盖,并且没有覆盖活检伤口表面的气泡。
注:此步骤可在 1.5 mL 微中心管或 48 井板中执行。如果使用 48 井板,则将伤口朝下孵育在每口井中。 - 在剩余的阻塞缓冲器中稀释主要抗体。
注:防鼠角蛋白14(K14)稀释1:1,000在阻塞缓冲效果良好。优化此步骤以用于其他抗体或多个探头。 - 吸气阻塞缓冲器,每口井/微中原管添加150微升原发性抗体。在 4 °C 的一夜之间在原位抗体中孵育伤口除植物。
- 第二天,在RT(每个样品500微升)中,将含有0.2%钠阿齐德的原发性抗体和冲洗液吸气。
- 使用染色洗涤缓冲器(每次洗涤 30 分钟,每个样品 500 μL)再执行三个冲洗步骤。
- 在染色洗涤缓冲器中稀释荧光结合的二级抗体(例如,山羊抗鼠标 488 在 1:400 稀释)中。
- 计算所需的二级抗体量(样本数量 x 150 μL = μL 中的量)。
- 在每个井/微中心管中加入 150 μL 的二级抗体。在 RT. 在 RT 下孵育 1 小时, 在黑暗中执行孵化步骤 4.1.10 - 4.1.16, 因为次要抗体对光敏感。
注意:如果需要,此步骤可以在 4 °C 的夜间执行。优化足够信号和有限背景染色所需的二次抗体浓度。 - 去除二级抗体,用染色洗涤缓冲器(每个样品 500 μL)进行 3 x 30 分钟的冲洗。
- 丢弃剩余的洗涤缓冲器并计算所需的 DAPI 工作解决方案量(根据步骤 4.1.11)。
- 在 Rt 用 150 μL 的 DAPI 工作解决方案对每个外植物进行计数, 持续 10 分钟。
注:DAPI 将染色细胞核蓝色。霍奇斯特染料可以用作 DAPI 的替代品。 - 用染色洗涤缓冲器(每个样品 500 μL)进行最后两次 30 分钟洗涤。活检可在成像前两周在黑暗中 4 °C 的染色洗涤缓冲器中存储。
- 在 1.5 mL 微中心管中收集伤口外植物,其中含有 500 μL 的皮肤固定剂,并在 4 °C 下孵育过夜。
- 布莱特菲尔德染色方法。
- 执行步骤 4.1.1 - 4.1.3。
- 在 4 °C 的夜间用过氧化酶块奎奇内源过氧化酶活性。
注:此步骤在使用 HRP 结合抗体以减少组织中的非特定背景染色时非常重要。高度血管化的组织将包含更多的内源性过氧化酶活性。 - 丢弃过氧化酶块,在染色洗涤缓冲器中冲洗两次,持续 30 分钟。
- 执行步骤 4.1.4 - 4.1.8。
注:第 4.1.7 步后洗涤对于从样品中去除阿齐德钠尤为重要。如果钠酸钠未充分去除,它将使 HRP 失活并干扰染色检测。 - 在每个井/微中心管中加入 150 μL HRP 结合的二级抗体,并在 RT 的 4 °C 或 1 h 孵育过夜。
- 去除二级抗体,在染色洗涤缓冲器中进行 3 x 30 分钟的洗涤。
- 在每个井/微中心管中加入 150 μL ABC 试剂,并在 4 °C 或 RT 的 1 小时孵育过夜。
- 吸气 ABC 试剂,在染色洗涤缓冲器中进行 3 x 30 分钟的洗涤。
- 将 150 μL 过氧化酶基板添加到一个外植物中,并确定检测明显颜色变化所需的时间。
注意:选择预期有强污渍的示例。在这种情况下,一个红色的戒指,以显示迁移表皮(K14)。3,3'-二恶氮-4,或任何其他适当的染色基质,可以用作这种过氧化酶基质的替代品。 - 一旦观察到颜色变化,取出过氧化酶基板,代之以 1 mL dH2O。
- 重复对其他外生植物的过氧化酶基板检测,在步骤 4.2.11 确定的时间内进行孵育。
- 用 1 mL dH2O 冲洗所有外植物,去除残留过氧化酶基板。虽然在成像前,在 4 °C 下最多可以储存一周,但最好尽快对它们进行成像,以防止过氧化酶基板随着时间的推移渗入 dH2O 中。
5. 成像和量化
- 荧光成像
注:荧光成像使用共聚焦激光扫描显微镜进行。但是,倒荧光显微镜可能足以获取 2D 图像来量化伤口闭合率。在选择二级抗体时,确保所选的荧光片与现有显微镜设备的激发和发射光谱相容。- 使用配备 2.5 倍、10 倍和 20 倍目标、x-y-z 电动舞台、数码相机和采集软件的共聚焦激光扫描显微镜。打开传输的光探测器 (TPMT),以便轻松可视化每个活检,并实现伤口完全闭合的测量。或者,在荧光成像后通过亮场显微镜测量每个伤口。
- 在成像平台上放置一个 60 mm 的 Petri 菜底座,并添加 DPBS 的薄层(约 1 mL)。
注意:如果使用过多的DPBS,活检将在成像过程中移动。或者,如果有板架可用,则使用 48 井板。 - 使用小组织钳子将伤口外植物从井/微中心管转移到含有DPBS的培养皿中。将活检伤口侧放在培养皿中。
- 使用目镜和荧光灯定位并聚焦于伤口。如果气泡被困在视野中的样本下,则用组织钳子拾起伤口并重新定位。
- 设置成像软件,确保通道之间的针孔大小相等,以获得最佳的共聚焦性。为此,检查每个通道一个通风单元的价值,并选择最大值。选择扫描速度、图像质量和平均值。
注:结合的二次抗体和所选计数器(例如 DAPI)的荧光片将决定所需的通道。 - 打开实时采集软件,将每个通道的激光功率和增益调整到可视化染色所需的水平。通过增加数字偏移来减少背景噪音。
- 将伤口放置在成像平面的中心。
注意:如果伤口因使用较小的目标或创建较大的伤口而无法填充整个图像,请拍摄图像面板并将它们拼接在一起(手动或在相关成像软件中具有瓷砖功能)。 - 获取伤检图像。在外植之间使用相同的成像设置。
注:更高的功率图像将允许对组织结构和细胞标记表达和位置进行评估。 - 收集串行 Z 堆栈通过伤口,特别是当组织不是完全平对培养皿。使用分析软件将 Z 堆栈折叠成单个最大强度投影图像。
- 布莱特菲尔德成像
注:可以多种方式进行免疫过氧化酶染色活检的布莱特菲尔德成像。- 倒置显微镜成像:将伤口植入培养皿/以及步骤 5.1.2-5.1.3 中描述的伤口外植植物进行成像。在装有数码相机的倒置显微镜上获得亮场照明下的数字图像。如果需要,将多个图像拼接在一起。
- 无线数字显微镜成像:使用连接到手机或笔记本电脑的无线数字显微镜以经济高效的方式获取高质量图像。将外植物侧面涂在某些组织上,并从样品储存中取出任何残留的 dH2O(或染色洗涤缓冲器)。将伤口植入显微镜视野的中心。使用连接的摄像机获取图像。
- 量化
注:任何允许绘制和测量手形的软件都可以量化百分比伤口封闭。ImageJ 可用于执行以下量化:- 打开图像以在 ImageJ 软件中量化。
- 使用徒手形状工具在重新上皮的伤口外部绘制,使其符合正常皮肤。按 M( 或 分析|测量)获取"外部"区域测量。
注:重新上皮的伤口组织纹理不同于正常皮肤。在进行此类分析之前,无需对图像进行缩放。 - 使用徒手形状工具在开放的伤口区域周围绘制。这是开放性伤口与重新上皮组织内边缘相遇的地方。按 M( 或 分析|测量)获得"内部"区域测量。
- 使用以下方程推断百分比伤口重新表皮化/关闭:
% 封闭 = (外伤区 - 内伤区) / (外伤区) x 100
注:抗体的百分比面积覆盖率可以以同样的方式推断(例如K14),或作为总伤口面积的百分比。百分比强度还可以提供有关感兴趣标记组织水平表达的半定量信息,而高功率成像则呈现细胞水平的表达数据。
结果
在这份报告中,我们提出了一种新的前体内皮肤损伤和全安装染色方法,以评估影响人体皮肤修复反应的因素。图1A显示了程序管道的示意图,可在3-10天内完成,具体取决于伤口孵化时间。部分厚度伤口在空气中的膜堆上培养:膜接口,可收集用于全安装染色,嵌入石蜡或OCT介质,用于一般组织学,或冷冻在液氮中进行生化分析(图1B)。我们通常在 6 毫米外植的中心创建 2 mm 部分厚度伤口。但是,伤口和周围外植物的大小可能会根据要求而改变。全安装程序已成功地适应免疫过氧化酶和免疫荧光染色方法(图1C)。
免疫荧光允许用多种抗体探测组织。为此,我们建议使用不同物种中产生的主要抗体,以及物种匹配的荧光结合二级抗体,以限制跨物种反应。抗体浓度和孵化时间需要优化。如果观察到背景染色,则降低抗体浓度,增加洗涤步骤,并在二级抗体中添加阻塞缓冲。新鲜组织生存能力可以直接评估与商业生存能力染料(见材料表)。我们还表明,组织可能是固定后生存性染色和成功成像时,它是实际合适的(图1D)。
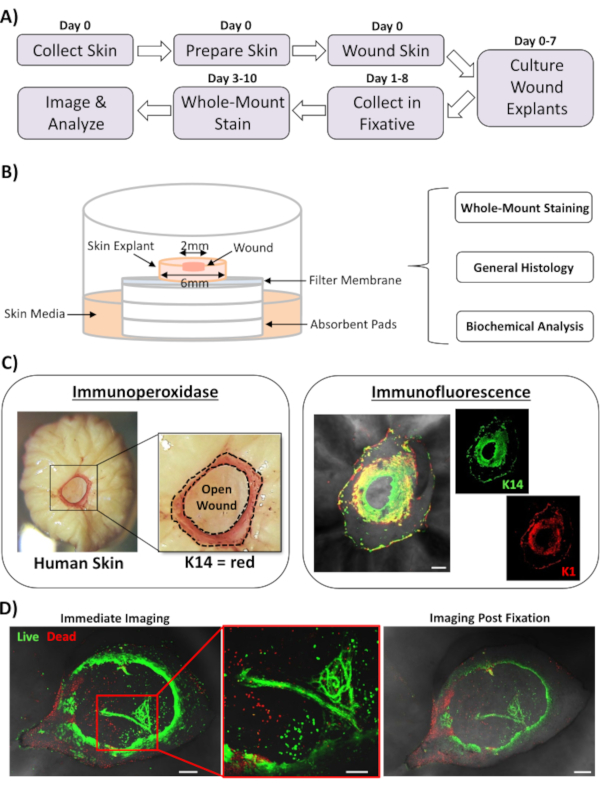
图1:人体前体损伤和全安装染色方法。(A)管道描绘了从采集皮肤、实施前体外伤、染色组织到分析数据等程序性工作流程。(B) 图示,通过定期对组织进行分析,演示人体前体皮肤伤口培养系统。(C) 全安装染色可同时使用免疫过氧化酶和免疫荧光技术。K14 = 角蛋白 14。(D) 活组织可能沾染有商业活性染料,并在固定后成功成像。酒吧 = 100μm。这种染色是在非糖尿病皮肤上进行的。请单击此处查看此图的较大版本。
最广泛适用的伤口全安装染色用途是以比通过组理剖面提供的更可重复的方式确定伤口闭合率。百分比闭合被量化为伤口表面的百分比重化,如 图2A所示。特定标记的百分比面积覆盖率可以从总伤口面积或重新表皮化伤口的百分比来衡量。我们描述愈合在健康(非糖尿病)与糖尿病皮肤在7天的时间过程,收集伤口在受伤后每天(代表性的图像, 图2B)。健康的皮肤伤口会随着时间推移而关闭,大多数样本在 4-5 日之前会完全闭合。相反,糖尿病皮肤伤口未能在七天分析期内完全愈合(图2C)。在比较受伤后每个时间点的愈合率(P < 0.001 到第 6 天 ,P < 0.05 在第 6 天和 P < 0.05 到 P < 0.001 在第 7 天的 愈合 率时,观察到伤口关闭的显著延迟。
在评估总体伤口闭合率后;我们测量了整个伤口区域( 图2A的外侧)的百分比,其中K14正细胞可以可视化( 图2B中的绿色染色)。有趣的是,我们观察到,在健康的前体皮肤伤口中,K14染色在第2天达到峰值,然后迅速下降(与第2天峰值相比,每个时间点的意义, 图2D)。这可能反映了早期表皮屏障的重新形成,不包括K14抗体通过差异化表皮层的渗透(见 图2E 示意图)。在重新表皮化过程中,基底层 (K14+ve) 角膜细胞在开放性伤口上向内迁移,使表皮更接近外伤口边缘比表皮更靠近内伤口边缘(迁移前部)。当新形成的表皮的前缘继续迁移以关闭剩余的开放性伤口时,外边缘表皮开始区分以改革其他表皮层。因此,在早期愈合中,我们希望看到大部分重新表皮化区域由基底(K14+ve)细胞组成,而在以后的修复中,K14 染色会随着表皮与外部内在的区别而丢失(见 图 2E中的全安装图像)。因此, 图 2D( 向下箭头)中显示的 K14 染色量的下降与表皮分化增加相关。有趣的是,可见K14染色在健康(第2天)与糖尿病(第4天)伤口的早期达到顶峰,进一步表明糖尿病皮肤伤口的重新表皮化和随后的表皮分化被延迟。
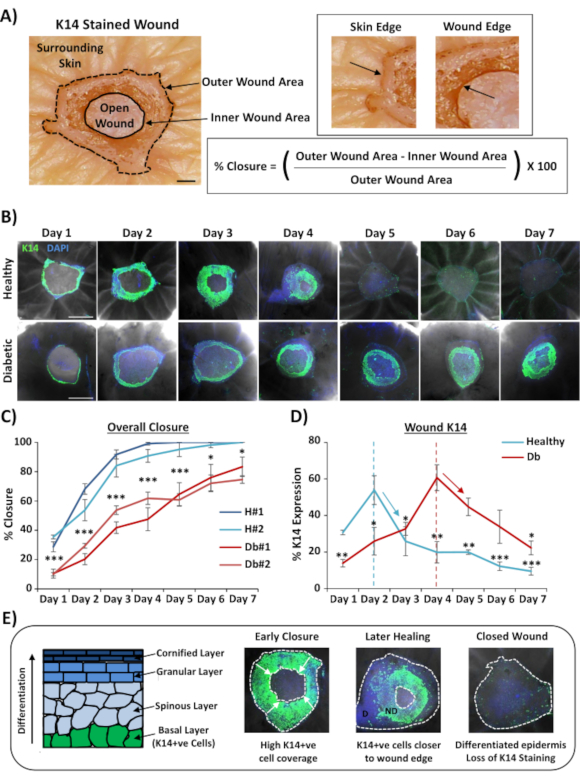
图2:全安装染色显示糖尿病与健康皮肤的相关愈合率。 (A) 用于从外侧和内侧伤口测量中量化伤口闭合的方法。光明场图像显示角蛋白 14 (K14) 染色为红色。酒吧 = 300μm.(B) 健康和糖尿病皮肤中随着时间(受伤后的一天)愈合的代表性图像。酒吧 = 500μm. K14 = 绿色。达皮 = 蓝色核。(C) 伤口闭合率(百分比再上皮)的量化显示,健康皮肤的外体伤口比糖尿病皮肤的前活体伤口关闭速度快得多。H = 健康。Db = 糖尿病患者。(D) 百分比 K14 染色峰值早期在健康与糖尿病皮肤,然后下降,以配合增加表皮分化(向下箭头)。(E) K14(基础表皮细胞)染色会随着表皮的分化而丢失。D = 差异化。ND = 没有区别。白色虚线描绘内侧和外侧伤口边缘。白色箭头 = 迁移方向。n = 每个捐赠者每次点有 6 处伤口。平均 +/- SEM. * P < 0.05, ** * P < 0.01 和 *** = P < 0.001。健康和糖尿病比较在 C 的每个愈合时间点(P 值最不显著的比较)。K14染色的时间变化与 D中每个捐赠者的峰值相比。 请单击此处查看此图的较大版本。
接下来,我们使用全安装染色来探索非糖尿病皮肤中其他伤口相关标记的组织表达和定位(图3)。所有使用的抗体及其工作浓度均在 材料表中提供。开放伤口中的血管与α平滑肌作用素(a-SMA)抗体呈正色,与K14结合使用,在低功率图像中描绘表皮边缘(图3A)。皮肤基质被胶原蛋白I型(COL 1)和纤维素(Fn)的抗体染色。在这里,胶原蛋白被观察为丰富的厚纤维,而纤维素纤维是稀疏的,波浪状的,薄的(图3A)。我们的全安装染色方法也能够提供细胞水平的污渍分辨率,如K14阳性角膜细胞(图3B)所示。
最后,我们显示,人类前体伤口具有常驻免疫细胞,兰格汉斯细胞在受伤后的第3天(图3C)在新形成的表皮周围检测到。事实上,这些结果表明,全安装染色可用于研究愈合反应的关键特征,包括炎症,增殖和细胞外基质(图4A)。综合起来,我们的数据表明,结合前体皮肤损伤和全安装染色程序是评估健康和糖尿病(病理)人类皮肤修复各个方面的有效方法。
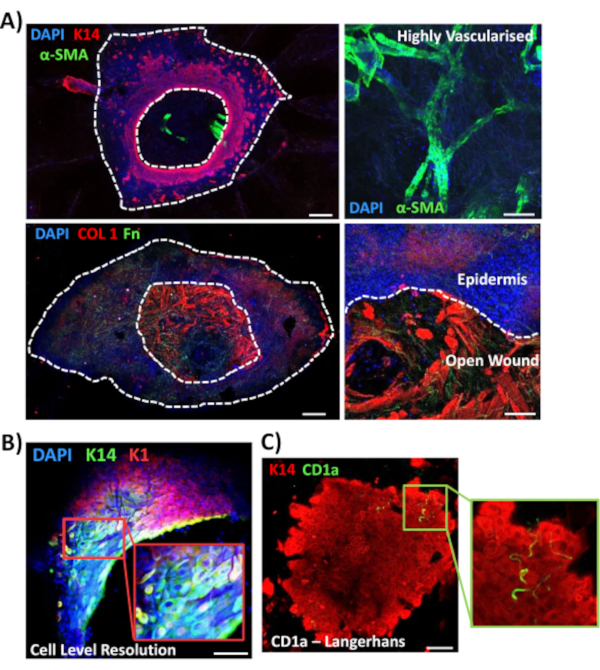
图3:优化用于其他抗体的全安装染色方法。(A ) 血管沾染阿尔法光滑肌肉作用素(α-SMA,绿色)和角蛋白14(K14,红色),而基质纤维沾染胶原蛋白I(COL 1,红色)和纤维素(Fn,绿色)。(B) 全安装程序提供高达细胞水平的本地化分辨率(K14,绿色:K1,红色)。(C) 在新形成的表皮中观察到的CD1a+ve兰格汉斯细胞(绿色)。达皮 = 蓝色核。酒吧 = 100μm。白色虚线显示内侧和外侧伤口边缘,以及与表皮分开的伤口。这种染色是在非糖尿病皮肤上进行的。请单击此处查看此图的较大版本。
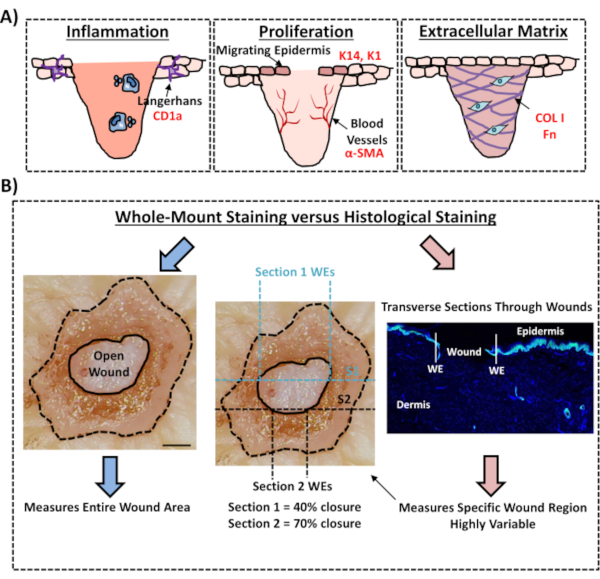
图4:评估伤口愈合的全安装染色程序的有效性。 (A) 说明全安装染色技术如何评估伤口相关过程。使用的抗体 = 红色文本。K14 = 角蛋白 14。科尔 1 = 胶原蛋白 1 。Fn = 纤维素。(B) 全安装染色程序(蓝色箭头)对伤口封闭测量的变异性比标准组织分析(红色箭头)要小。S1 = 第 1 节。我们 = 伤口边缘。酒吧 = 300μm。这种染色是在非糖尿病皮肤上进行的。请单击此处查看此图的较大版本。
讨论
在这个实验协议中,我们描述了一种优化的方法,使用全安装组织染色来评估人体前体皮肤的伤口闭合。这是一个重要资源,使潜在的伤口治疗的关键评估,并提供更好地了解人类伤口修复反应。我们曾于12日、13日公布过前体皮肤伤口的愈合评估,但这些报告中并没有使用全安装染色方法来测量伤口的闭合。全安装染色要容易得多,需要的技术经验比标准组理学少得多,这涉及石蜡或 OCT 嵌入和样品分割。全安装过程还减少了实验变异性,允许量化整个伤口,而不仅仅是组织内固定位置的单个横截面(请参阅图 4B进行比较说明)。我们完全支持量化整个非对称伤口结构愈合的重要性,正如Rhea和Dunwald对穆林急性伤口14的明确概述。这些作者展示了在活体切除伤口中连续分割的重要性,以便可重复和精确地测量伤口形态。序列分割同样适用于人体前体外伤口:然而,对于伤口闭合和再表皮化的精确量化,高通量全安装染色应是首选方法。我们注意到,此全安装染色协议还应与后续处理 (蜡或 OCT) 兼容,以便进行传统的组织学分析。
全安装染色并非没有缺点。虽然它提供了更高的可重复性伤口愈合实验,它确实需要使用更多的组织进行分析比标准组织技术。这可能是组织访问受限的问题,尤其是在需要评估多个抗体的情况下。另一种方法是采用切口伤口法,伤口宽度相对均匀,变异性降低(如鼠标和人体伤口15、16)。然而,切除性伤口仍然更适用于大多数病理伤口类型17。
在这项研究中,在6毫米皮肤外植的中心产生了2毫米的部分厚度伤口。这种方法可以优化为替代切除伤口和外植大小在不同的皮肤深度18。此外,产生伤口所需的力在捐赠者之间会有所不同,因为老年皮肤需要的活检力量较小。我们还避免使用显示显著拉伸痕迹或其他结构变化的皮肤。我们已经验证了一系列抗体,以考虑前体内愈合反应的不同方面。此协议还可用于其他与皮肤相关的抗体,其中抗体浓度和孵化时间需要优化。然而,我们相信我们的协议最适合绝对量化完全伤口封闭,然后是空间评估特定的感兴趣的蛋白质。虽然全安装提供免疫本地化的分辨率低于组织部分的标准组织学分析,但它提供了标准 2D 组织学中缺少的其他 3D 信息。
评估前体内皮肤与体内模型愈合的一个警告是,它缺乏系统性反应。伤口修复的一个重要方面是炎症和随后的组织造粒,这是由炎症细胞和内皮细胞从血管19的涌入造成的。尽管有这种限制,前体内皮肤仍然提供比细胞为基础的伤口检测更好的临床愈合回顾。体外实验一般涉及单细胞类型单层或在组织培养塑料上生长的共培养物,而前体内皮肤为探索细胞行为提供了一个原生环境。最近,一些皮肤等价系统已经出现,其中皮肤生长在实验室设置从人工基质和孤立的皮肤细胞20,21。虽然这些模型比大多数体外方法更好地模仿人体皮肤,但它们仍然不能完全模拟本地组织环境,而且通常太脆弱,无法重复伤害。此外,我们(和其他人)已经证明,前体内人体皮肤组织保留常驻免疫细胞,这无疑将有助于修复22,23。今后的工作重点应放在扩大晚期愈合评估前体内模型的可行性和免疫能力上。一个选择是进一步推进有前途的芯片器官技术,能够延长组织生存能力,并保持本地皮肤结构长达两个星期的文化25。前体内模型也开始考虑皮肤炎症反应的重要性,成功地将免疫细胞,如中性粒细胞,纳入宿主组织26或注射宿主组织与抗体,以引起免疫反应27。我们期望这些发现将为今后开发更精致和可翻译的方法铺平道路。
使用前体皮测量伤口闭合的一个主要好处是能够比较健康(例如,非糖尿病)和病理组织(例如糖尿病或老年)组织的愈合率。在这里,我们表明,在糖尿病与健康的前体内伤口相比,重新表皮化和屏障形成确实受到损害。事实上,这为病理修复的临床前评估提供了一条途径,其中衰老和糖尿病是发展慢性伤口的主要危险因素1。虽然体外病理模型存在,如从老年和糖尿病组织分离的细胞,或在高葡萄糖培养的细胞,以模仿高血糖28,29,这些细胞可以迅速失去他们的表型,一旦从体内微环境删除。外在病理愈合环境的一个重要组成部分是皮肤基质,它在衰老和糖尿病30中都发生了变化。事实上,这种扰动矩阵影响居民和天真的成纤维细胞的行为31,32。因此,研究细胞在其宿主组织环境中的重要性不可低估。
总之,我们的协议提供了一个重要的平台,量化人体伤口再表皮化,探索调控因素,并测试潜在的治疗方法的有效性和有效性12,13。虽然临床前测试仍然需要体内方法,但使用前体内人体组织和体内木质伤口的综合策略应完善临床前途径,减少动物使用,同时提高跨物种的可翻译性。
披露声明
作者声明没有利益冲突。
致谢
我们要感谢保罗·马图西先生和乔治·史密斯先生提供病人组织。我们也感谢琥珀玫瑰斯塔福德小姐协助组织收集和黛西呼吁提供实验室设施。
材料
| Name | Company | Catalog Number | Comments |
| 50 mL Falcon Tubes | Falcon | 352070 | For skin washing |
| 1.5 ml TubeOne Microcentrifuge Tubes, Natural (Sterile) | Starlab | S1615-5510 | For whole-mount staining |
| 48-Well CytoOne Plate, TC-Treated | Starlab | CC7682-7548 | For whole-mount staining |
| Acetic Acid Glacial | Fisher Chemical | A/0400/PB15 | Part of fixative |
| Alkyltrimethylammonium Bromide | Sigma-Aldrich | M7635 | Part of fixative |
| Anti-Alpha Smooth Muscle Actin Antibody [1A4] | Abcam | ab7817 | Stains blood vessels |
| Anti-Collagen I Antibody | Abcam | ab34710 | Stains collagen |
| Anti-Cytokeratin 14 Antibody [LL002] | Abcam | ab7800 | Stains epidermis |
| CD1A Antibody (CTB6) | Santa Cruz Biotechnology | sc-5265 | Stains Langerhans cells |
| DAPI (4',6-diamidino-2-phenylindole, dihydrochloride) | Thermo Fisher Scientific | 62247 | Counterstain for cell nuclei |
| Falcon 60mm Petri dishes | Falcon | 353004 | Human ex vivo culture |
| Fibronectin Antibody (EP5) | Santa Cruz Biotechnology | sc-8422 | Stains fibronectin |
| Formaldehyde, Extra Pure, Solution 37-41%, SLR | Fisher Chemical | F/1501/PB17 | Part of fixative |
| Gauze Swabs | Medisave | CS1650 | To clean skin |
| Gibco™ Antibiotic-Antimycotic Solution | Thermo Fisher Scientific | 15240062 | Human ex vivo culture |
| Gibco DMEM, high glucose, no glutamine | Thermo Fisher Scientific | 11960044 | Human ex vivo culture |
| Gibco Fetal Bovine Serum | Thermo Fisher Scientific | 10500064 | Human ex vivo culture |
| Gibco HBSS, no calcium, no magnesium | Thermo Fisher Scientific | 14170088 | Human ex vivo culture |
| Gibco L-Glutamine (200 mM) | Thermo Fisher Scientific | 25030081 | Human ex vivo culture |
| Hydrogen Peroxide | Sigma-Aldrich | H1009-100ML | For immunoperoxidase staining |
| ImageJ Software | National Institutes of Health | N/A | For image analysis |
| Invitrogen IgG (H+L) Cross-Adsorbed Goat anti-Mouse, Alexa Fluor 488 | Thermo Fisher Scientific | A11001 | Secondary antibody used depends on required fluorochromes and primary antibody |
| Invitrogen IgG (H+L) Cross-Adsorbed Goat anti-Rabbit, Alexa Fluor 594 | Thermo Fisher Scientific | A11012 | Secondary antibody used depends on required fluorochromes and primary antibody |
| Invitrogen LIVE/DEAD Viability/Cytotoxicity Kit, for mammalian cells | Thermo Fisher Scientific | L3224 | For viability assessment of tissue |
| Iris Forceps, 10 cm, Curved, 1x2 teeth | World Precision Instruments | 15917 | To create wounds |
| Iris Scissors, 11 cm, Curved, SuperCut, Tungsten Carbide | World Precision Instruments | 501264 | To create wounds |
| Iris Scissors, 11 cm, Straight, SuperCut, Tungsten Carbide | World Precision Instruments | 501263 | To remove adipose tissue |
| Keratin 1 Polyclonal Antibody, Purified | Biolegend | 905201 | Stains epidermis |
| Keratin 14 Polyclonal Antibody, Purified | Biolegend | 905301 | Stains epidermis |
| LSM 710 Confocal Laser Scanning Microscope | Carl Zeiss | Discontinued | For fluorescent imaging |
| Merck Millipore Absorbent pads | Merck Millipore | AP10045S0 | Human ex vivo culture |
| Merck Millipore Nylon Hydrophilic Membrane Filters | Merck Millipore | HNWP04700 | Human ex vivo culture |
| Normal Goat Serum Solution | Vector Laboratories | S-1000-20 | Animal serum used depends on secondary antibody |
| Phosphate Buffer Solution | Sigma-Aldrich | P3619 | For wash buffer |
| Sodium Azide | Sigma-Aldrich | S2002 | For blocking buffer |
| Sodium Chloride | Fisher Bioreagents | BP358-212 | Part of fixative |
| Sterilisation Pouches | Medisave | SH3710 | To sterilise instruments |
| Stiefel 2mm biopsy punches | Medisave | BI0500 | For partial thickness wound |
| Stiefel 6mm biopsy punches | Medisave | BI2000 | For outer explant |
| Thermo Scientific Sterilin Standard 90mm Petri Dishes | Thermo Fisher Scientific | 101VR20 | To prepare skin |
| Triton X-100 | Fisher Chemical | T/3751/08 | For wash buffer |
| VECTASTAIN Elite ABC-HRP Kit, Peroxidase (Rabbit IgG) | Vector Laboratories | PK-6101 | For immunoperoxidase staining; HRP kit used depends on primary antibody |
| Vector NovaRED Substrate Kit, Peroxidase (HRP) | Vector Laboratories | SK-4800 | For immunoperoxidase staining |
| Wireless Digital Microscope | Jiusion | N/A | For brightfield imaging |
参考文献
- Lindholm, C., Searle, R. Wound management for the 21st century: combining effectiveness and efficiency. International Wound Journal. 13, 5-15 (2016).
- Guest, J. F., et al. Health economic burden that different wound types impose on the UK's National Health Service. International Wound Journal. 14 (2), 322-330 (2017).
- Guest, J. F., Fuller, G. W., Vowden, P. Diabetic foot ulcer management in clinical practice in the UK: costs and outcomes. International Wound Journal. 15 (1), 43-52 (2018).
- López-Valverde, M. E., et al. Perioperative and long-term all-cause mortality in patients with diabetes who underwent a lower extremity amputation. Diabetes Research and Clinical Practice. 141, 175-180 (2018).
- Wilkinson, H. N., Hardman, M. J. The role of estrogen in cutaneous ageing and repair. Maturitas. 103, 60-64 (2017).
- Frykberg, R. G., Banks, J. Challenges in the treatment of chronic wounds. Advances in Wound Care. 4 (9), 560-582 (2015).
- Wilkinson, H. N., Hardman, M. J. Wound healing: cellular mechanisms and pathological outcomes. Open Biology. 10 (9), 200223 (2020).
- Ansell, D. M., Holden, K. A., Hardman, M. J. Animal models of wound repair: Are they cutting it. Experimental Dermatology. 21 (8), 581-585 (2012).
- Elliot, S., Wikramanayake, T. C., Jozic, I., Tomic-Canic, M. A modeling conundrum: murine models for cutaneous wound healing. Journal of Investigative Dermatology. 138 (4), 736-740 (2018).
- Mazio, C., et al. Pre-vascularized dermis model for fast and functional anastomosis with host vasculature. Biomaterials. 192, 159-170 (2019).
- Wilkinson, H. N., Iveson, S., Catherall, P., Hardman, M. J. A novel silver bioactive glass elicits antimicrobial efficacy against Pseudomonas aeruginosa and Staphylococcus aureus in an ex vivo skin wound biofilm model. Frontiers in Microbiology. 9, 1450 (2018).
- Wilkinson, H. N., et al. Elevated local senescence in diabetic wound healing is linked to pathological repair via CXCR2. Journal of Investigative Dermatology. 139 (5), 1171-1181 (2019).
- Wilkinson, H. N., et al. Tissue iron promotes wound repair via M2 macrophage polarization and the chemokine (CC motif) ligands 17 and 22. The American Journal of Pathology. 189 (11), 2196-2208 (2019).
- Rhea, L., Dunnwald, M. Murine excisional wound healing model and histological morphometric wound analysis. Journal of Visualized Experiments. 162, e61616 (2020).
- Ansell, D. M., Campbell, L., Thomason, H. A., Brass, A., Hardman, M. J. A statistical analysis of murine incisional and excisional acute wound models. Wound Repair and Regeneration. 22 (2), 281-287 (2014).
- Rizzo, A. E., Beckett, L. A., Baier, B. S., Isseroff, R. R. The linear excisional wound: an improved model for human ex vivo wound epithelialization studies. Skin Research and Technology. 18 (1), 125-132 (2012).
- Olsson, M., et al. The humanistic and economic burden of chronic wounds: a systematic review. Wound Repair and Regeneration. 27 (1), 114-125 (2019).
- Mendoza-Garcia, J., Sebastian, A., Alonso-Rasgado, T., Bayat, A. Optimization of an ex vivo wound healing model in the adult human skin: Functional evaluation using photodynamic therapy. Wound Repair and Regeneration. 23 (5), 685-702 (2015).
- Brownhill, V. R., et al. Pre-clinical assessment of single-use negative pressure wound therapy during in vivo porcine wound healing. Advances in Wound Care. , (2020).
- Diekmann, J., et al. A three-dimensional skin equivalent reflecting some aspects of in vivo aged skin. Experimental Dermatology. 25 (1), 56-61 (2016).
- Vidal Yucha, S. E., Tamamoto, K. A., Nguyen, H., Cairns, D. M., Kaplan, D. L. Human skin equivalents demonstrate need for neuro-immuno-cutaneous system. Advanced Biosystems. 3 (1), 1800283 (2019).
- Dijkgraaf, F. E., et al. Tissue patrol by resident memory CD8+ T cells in human skin. Nature Immunology. 20 (6), 756-764 (2019).
- He, X., de Oliveira, V. L., Keijsers, R., Joosten, I., Koenen, H. J. Lymphocyte isolation from human skin for phenotypic analysis and ex vivo cell culture. Journal of Visualized Experiments. (110), e52564 (2016).
- Pupovac, A., et al. Toward immunocompetent 3D skin models. Advanced Healthcare Materials. 7 (12), 1701405 (2018).
- Ataç, B., et al. Skin and hair on-a-chip: in vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a Chip. 13 (18), 3555-3561 (2013).
- Kim, J. J., et al. A microscale, full-thickness, human skin on a chip assay simulating neutrophil responses to skin infection and antibiotic treatments. Lab on a Chip. 19 (18), 3094-3103 (2019).
- Jardet, C., et al. Development and characterization of a human Th17-driven ex vivo skin inflammation model. Experimental Dermatology. 29 (10), 993-1003 (2020).
- Chen, J. L., et al. Metformin attenuates diabetes-induced tau hyperphosphorylation in vitro and in vivo by enhancing autophagic clearance. Experimental Neurology. 311, 44-56 (2019).
- Demirovic, D., Rattan, S. I. Curcumin induces stress response and hormetically modulates wound healing ability of human skin fibroblasts undergoing ageing in vitro. Biogerontology. 12 (5), 437-444 (2011).
- Wilkinson, H. N., Hardman, M. J. Wound senescence: A functional link between diabetes and ageing. Experimental Dermatology. 30 (1), 68-73 (2020).
- Fisher, G. J., et al. Collagen fragmentation promotes oxidative stress and elevates matrix metalloproteinase-1 in fibroblasts in aged human skin. The American Journal of Pathology. 174 (1), 101-114 (2009).
- Quan, T., Little, E., Quan, H., Voorhees, J. J., Fisher, G. J. Elevated matrix metalloproteinases and collagen fragmentation in photodamaged human skin: impact of altered extracellular matrix microenvironment on dermal fibroblast function. Journal of Investigative Dermatology. 133 (5), 1362 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。