需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在微加工微流体平台中生成简化的三维芯片皮肤模型
摘要
在这里,我们提出了一个协议,使用微加工微流体平台生成三维简化和无差别皮肤模型。平行流动方法允许真皮隔室 的原位 沉积,以便在顶部接种上皮细胞,所有这些都由注射器泵控制。
摘要
这项工作提出了一种新的,具有成本效益的,可靠的微流体平台,具有产生复杂多层组织的潜力。作为概念证明,已经对包含真皮(基质)和表皮(上皮)隔室的简化和无差别的人体皮肤进行了建模。为了实现这一目标,已经开发了一种多功能且坚固耐用的乙烯基器件,分为两个腔室,克服了基于聚二甲基硅氧烷(PDMS)的微流体器件在生物医学应用中存在的一些缺点,例如使用昂贵和专用的设备或吸收小的疏水分子和蛋白质。此外,还开发了一种基于平行流动的新方法,使真皮和表皮隔室 的原位 沉积成为可能。皮肤结构由含有人原代成纤维细胞的纤维蛋白基质和播种在上面的永生化角质形成细胞的单层组成,随后在动态培养条件下维持。这种新的微流体平台开辟了模拟人类皮肤病并推断产生其他复杂组织的方法的可能性。
引言
最近,在开发和生产用于分析化妆品和药品毒性的体外人体皮肤模型方面取得了进展1。制药和护肤行业的研究人员一直在使用动物,小鼠是最常见的,来测试他们的产品2,3,4,5。然而,在动物身上测试产品并不总是预测人类的反应,这经常导致药物失败或对人类的不良反应,从而导致经济损失5,6。英国是1998年第一个禁止使用动物进行美容测试的国家。后来,在2013年,欧盟禁止在动物身上测试和批准化妆品(欧盟化妆品法规第1223/2009号)7。
其他国家也在考虑这一禁令,例如美国的"人道化妆品法案"8。除了道德问题之外,动物和人类皮肤之间的解剖学差异使得动物试验耗时,昂贵且通常无效。此外,到2025年,全球 体外 毒理学检测市场规模预计将达到269.8亿美元9。由于这些原因,需要为这些 体外 研究开发新的方法和替代方案,例如生物工程人体皮肤模型,以便在不使用动物的情况下测试化妆品和药物的安全性和毒性作用。
市售有两种不同的体外,人体皮肤模型。第一种类型由分层的表皮当量组成,这些表皮当量含有多层分化的角质形成细胞,这些细胞接种在不同的材料上。其中一些已获得经济合作与发展组织(OECD)的批准,并得到(欧洲替代方法验证中心(ECVAM))的验证,用于皮肤腐蚀和刺激测试,例如EpiDerm或SkinEthic10,11,12。第二种类型是全皮肤等效物,具有一层分化的人类角质形成细胞,这些角质形成细胞接种在含有成纤维细胞的三维(3D)支架上,例如T-Skin和EpiDerm-FT。然而,这些模型是在静态条件下培养的,这使得它们无法准确表示人体生理条件。
最近的兴趣集中在以动态灌注13,14,15,16,17,18,19的细胞插入(CCI)格式生成体外3D皮肤模型。然而,根据它们在该领域的经典定义,这些系统不能严格意义上被视为微流体的芯片皮肤。Ingber对芯片上器官的定义指出,器官必须放置在微流体通道内,这是只有少数设备满足20,21的条件。到目前为止,芯片上的皮肤已经将大部分简单的上皮模拟为由多孔膜隔开的单细胞层和/或真皮细胞层22,23。虽然在微流体系统中对皮肤建模有一些进展16,24,但目前没有文献显示一个符合Ingber定义的芯片器官系统,能够在原位产生多层皮肤,包括上皮和基质成分。
在这项工作中,提出了一种新的,经济高效,强大的,基于乙烯基的微流体平台,用于芯片皮肤应用。该平台通过微加工生产,这为制造过程提供了更多的简单性,并在设备布局中增加了灵活性和多功能性,克服了PDMS25的一些局限性 。还设计了一种通过注射泵控制的平行流量引入简化的皮肤结构的方法。平行流动允许两种粘度非常不同的流体(在这种情况下是缓冲液和纤维蛋白预凝胶)通过通道灌注而不相互混合。作为概念证明,在装置中引入了含有嵌入在模仿真皮的纤维蛋白基质中的成纤维细胞的真皮表皮构建体,在其上加载单层角质形成细胞以模拟未分化的表皮。真皮隔室高度可以通过改变流速来调节。与之前描述的模型22,26,27,28,29相比,这项工作的主要新颖之处在于通过微流体在微室内开发3D结构。虽然本文提出了一种简化的未分化皮肤,但长期目标是生成和表征完全分化的皮肤结构,以证明其在药物和化妆品测试目的中的可行性和功能。
研究方案
1. 芯片设计及微加工参数
- 使用FreeCAD开源设计软件设计微流控芯片层;有关通道的尺寸,请参阅 表1。 在设计中包括四个直径为 2.54 mm 的孔,以使用定制的对准器实现正确的层叠加。
| 长度(微米) | 宽度(微米) | |
| 下腔室 | 28,400 | 800 |
| 上腔室 | 31,000 | 800 |
表1:设备的上下通道尺寸。
- 将 95 μm 厚的粘合透明乙烯基片切割成 30 cm x 30 cm 的正方形,以正确放入绘图仪中。
- 使用Brother CanvasWorkspace软件创建一个30厘米x 30厘米的工作空间,并用芯片不同层的设计图案填充它(图1A)。将其存储在.svg文件中。
- 用边缘绘图仪切割30厘米x 30厘米的乙烯基片(图1B-D)。
- 将乙烯基板粘在低粘性粘合剂垫上,并在必要时消除所有气泡。
- 将.svg文件上传到绘图仪,并设置切割参数:切割刀片:3级;切割压力:0级;切割速度:1级。将带有乙烯基的粘合垫放入绘图仪中,然后开始切割过程。
- 按照前面的步骤,在 12 μm 厚的双面胶带乙烯基上切割顶部通道图案。

图1:芯片设计和微加工工艺(A)软件布局显示了为芯片设计的顶部和底部图案的工作空间。(B)切割过程中的边缘绘图仪;图中显示了切割刀片、整张乙烯基片材和粘合垫。(C) 图案乙烯基从切割的薄片上分离。(D) 采用顶部通道设计图案的粘性乙烯基层的样品。请点击此处查看此图的放大版本。
2. PDMS层制造
- 以10:1(v / v)的比例混合PDMS和固化剂,并将混合物置于真空下15分钟以除去气泡。将55mL混合物倒入55cm2 方形培养皿中,以获得2mm厚的层。用针头去除气泡。
- 将混合物(步骤2.1)在80°C的烘箱中固化1小时。 拆下PDMS的模具,并将其切割成具有芯片尺寸的矩形。用18 G注射器针头为管子打孔。
3. 芯片组装
注意:为了更好地理解,请参阅 图 2。
- 使用对准器组装整个设备,以正确调整通道、入口和出口。堆起四个乙烯基层(带有相应的底部微图案)用于组装下部通道,保持底层的盖带,以避免粘在对准器上。
- 将聚碳酸酯(PC)多孔膜切割并放置在下通道的顶部,以将其与上通道分开。注意不要覆盖下部通道的入口。
- 添加十个乙烯基层与上腔室设计。粘贴双面胶带乙烯基层,顶部有顶部通道图案。从对准器中取出芯片,然后将其粘贴在载玻片上。
- 将 2 mm 厚的 PDMS 板放在双面胶带乙烯基层的顶部,为管道提供适当的锚固并避免泄漏。在芯片顶部留下一个重量过夜,以确保芯片完全防水。通过冲洗70%v / v乙醇5分钟对芯片进行灭菌,然后用蒸馏的H2O洗涤。
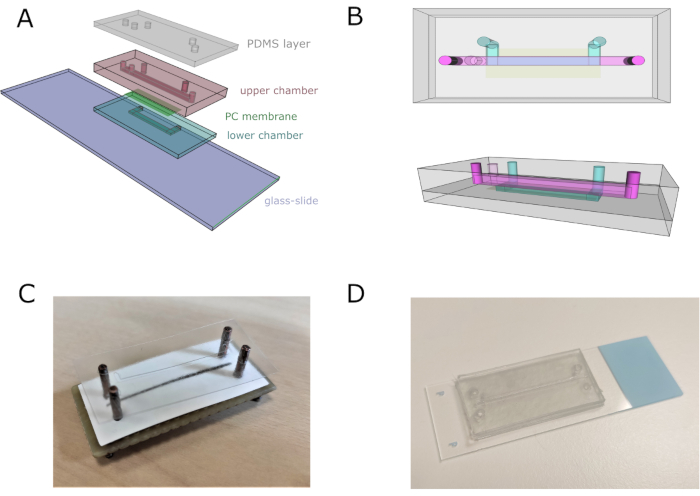
图2:微流控芯片组件。 (一)设备组装的一般方案。下腔室和上腔室分别由四张和十一张叠加的乙烯基板组成。(B)微流控芯片的顶部和侧面视图。顶部和底部通道分别以粉红色和蓝色表示。(C) 使用定制对准器的芯片组件的图像。(D) 完成组装后的芯片映像。 请点击此处查看此图的放大版本。
4. 泵连接
注:泵连接的图形表示 如图3所示。
- 将泵 1 连接到上腔室入口 1 (UCi1)。
- 将泵 2 连接到上腔室入口 2 (UCi2)。
- 将泵 3 连接到下腔室入口 (LCi)。
- 将上腔室出口 (UCo) 和下腔出口 (LCo) 连接到废气管。
- 使用聚四氟乙烯 (PTFE) 管和 18 G 不锈钢连接器将注射器连接到每个入口。
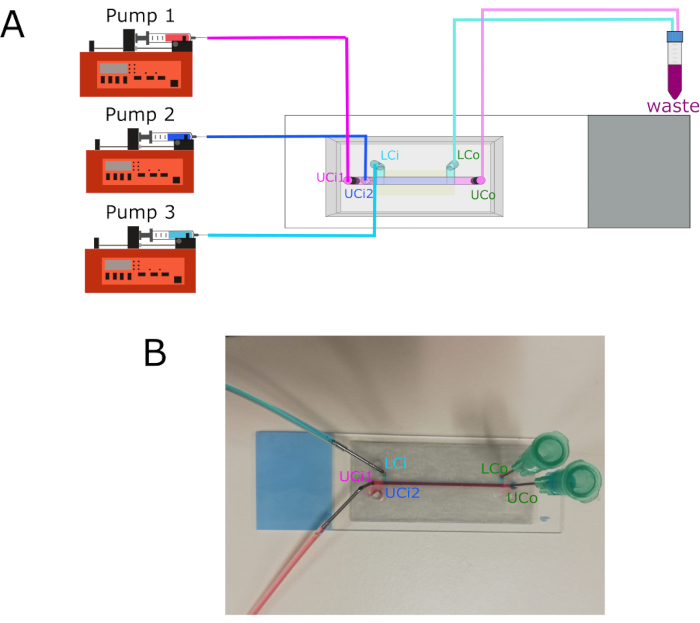
图3:泵的连接和入口/出口位置。 (A) 图显示了三个不同泵与各自入口的连接。出口连接到废物容器。(B) 带有标签的入口和出口的芯片图像。缩写: LCi = 下腔室入口;LCo = 下腔出口;UCi1 = 上腔室入口 1;UCi2 = 上腔入口 2;UCo = 上腔室出口。 请点击此处查看此图的放大版本。
5. 细胞培养
注意:HaCaT细胞系具有商业来源。人类原发性成纤维细胞来自健康的供体,是从"卡洛斯三世健康研究所国家生物研究机构"登记的人类来源生物样本中获取的。
- 在细胞培养罩中工作,事先在紫外线下灭菌并用乙醇擦拭。
- 在37°C下解冻H2B-GFP-HaCaT细胞(人永生化皮肤角质形成细胞,hKCs)和GFP-人原代成纤维细胞(hFBs),加入2mL培养基,并在20°C下以250×g离心7分钟。
注意:H2B-GFP-HaCaT细胞是人类永生化的角质形成细胞,经过修饰以表达杂交组蛋白H2B-绿色荧光蛋白(GFP),为其细胞核提供绿色荧光。GFP-hFB是用载体pLZRS-IRES-EGFP转化的人原发性成纤维细胞,以表达细胞质绿色荧光。这些细胞按照先前公布的协议30,31进行了修改 - 在补充10%胎牛血清和1%抗生素/抗真菌剂溶液的1x DMEM中培养hKCs和hFBs。使用前将培养基预热至37°C。
- 通过用1x磷酸盐缓冲盐水(PBS)洗涤细胞,加入2mL胰蛋白酶/乙二胺四乙酸(EDTA)并在37°C下孵育10分钟来分离细胞。
- 灭活胰蛋白酶,加入4mL培养基。重悬细胞,并将其转移到15 mL管中。除去10μL以在Neubauer室中计数细胞并确定适当的浓度。
- 将15 mL管在20°C下以250×g离心7分钟。 除去上清液,并以所需浓度重悬沉沉淀:hFB为50,000个细胞/ mL,hKCs为5·×106个细胞/ mL。
6. 纤维蛋白原凝胶前制剂
- 通过将1mL CaCl2(NaCl 中的1%w / v)添加到小瓶中来激活凝血酶。
- 加入以下组分,以终浓度为3.5mg / mL的纤维蛋白获得1mL纤维蛋白水凝胶:59μL活化凝血酶(10 NIH单位/ mL),59μL氨甲环酸(材料表,100mg / mL),764μL含有50,000 hFBs / mL的培养基,118μL纤维蛋白原(20mg / mL NaCl(0.9%w / v))。
注意:必须在最后一刻添加纤维蛋白原。
7. 并行流协议
- 在整个过程中,泵 3 通过 LCi 以 50 μL/min 的速度泵送 1x PBS。
- 泵 2 泵以 100 μL/min 的速度通过 UCi2 泵牺牲液 (1x PBS)。
- 用预凝胶加载注射器,迅速将其放入泵1中,并以200μL / min的速度运行(图4A)。
- 一旦预凝胶离开UCo,停止泵1和2。
- 在37°C下离开芯片而不取出管子至少10分钟以允许凝胶化。
- 用泵3至UCi2以50μL / h泵泵培养基过夜。
- 用盖子块 UCi1。
8. hKCs单层播种
- 在显微镜下检查hFBs在真皮室生成后24小时是否扩散。
- 用泵2至UCi2以5×·106个细胞/mL以40μL/min的速度引入hKCs,持续1分钟(图4B)。
- 将芯片在37°C下在湿度饱和的培养箱中过夜,以便附着细胞。
- 用泵3仅通过LCi以50μL / min泵泵送新鲜培养基(图4C)。
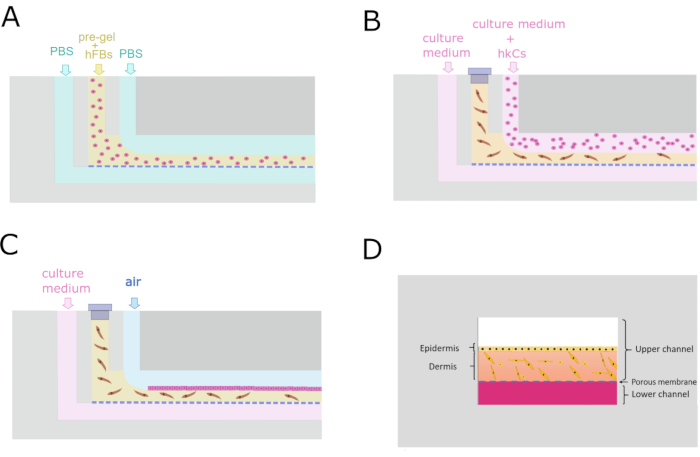
图4:用于生成真皮 - 表皮结构的微流体方案(A)横向横截面显示了产生真皮隔室的平行流动过程。(B) 角质形成细胞单层在真皮室生成后24小时播种。(C)细胞培养维持在微流体装置内。(D)芯片内部皮肤的横截面再现。请点击此处查看此图的放大版本。
9. 细胞活力测定
注意:活/死试剂盒根据细胞的活或死状态用绿色或红色荧光染色细胞。为了进行适当的活力分化,必须在该步骤中使用非荧光hKCs和hFBs。该过程中的所有步骤都是通过UCi2与泵2一起执行的。
- 用1x PBS以50μL / min洗涤顶部通道5分钟以除去培养基。
- 泵送空气以50 μL/min的速度除去1x PBS。
- 按照制造商的说明准备钙黄素AM/锭同源二聚体-1试剂盒(活/死)溶液。
- 以50μL/分钟泵送活/死溶液2分钟。
- 在37°C的黑暗中孵育30分钟。
- 通过以50μL / min泵送1x PBS 2分钟以除去任何剩余的试剂来洗涤顶部通道。
- 在共聚焦显微镜下观察样品。对于活细胞和死细胞,分别使用495/590 nm的激发波长和519/617 nm的发射波长。
结果
设计的芯片由两个流体室组成,由一个5μm孔径的PC膜隔开,该膜允许细胞通过允许促进生长的分子从下腔室通过。上腔室容纳组织构建体,在这种情况下,在含有hFBs的纤维蛋白水凝胶上放置单层hKCs。
通道的高度由添加到每个通道的粘合片数量决定。下腔室由4层(380μm)和10个单面胶带层和双面带层(962μm)组成。芯片的尺寸为4 cm x 2 cm,这增强了其操作性。粘性乙烯基板为?...
讨论
开发这种方法的动机是希望在高通量平台中模拟皮肤病并研究新的创新疗法的效果。迄今为止,该实验室通过手动或借助3D生物打印技术将纤维蛋白凝胶与成纤维细胞一起投射到细胞培养插入板中并在其上接种角质形成细胞来生产这些真皮表皮等效物。一旦角质形成细胞达到汇合,3D培养物暴露于气液界面,其诱导角质形成细胞分化,产生分层的表皮,从而完全发育出圆周间人皮肤32,33,34。
披露声明
作者声明他们没有相互竞争的经济利益。
致谢
我们衷心感谢哈维尔·罗德里格斯博士、玛丽亚·路易莎·洛佩斯博士、卡洛斯·马特兰和胡安·弗朗西斯科·罗德里格斯提供的非常有用的建议、讨论和/或初步数据。我们也衷心感谢Sergio Férnandez,Pedro Herreros和Lara Stolzenburg对这个项目的贡献。特别感谢Marta García博士获得GFP标签的hFBs和hKCS。最后,我们承认吉列尔莫·比斯凯诺和安吉利卡·科拉尔的出色技术援助。这项工作得到了"马德里社区投资集团活动计划",项目S2018/BAA-4480,Biopieltec-CM的支持。这项工作也得到了"Excela de excelencia"项目EPUC3M03,CAM的支持。CONSEJERÍA DE EDUCACIÓN E INVESTIGACIÓN.
材料
| Name | Company | Catalog Number | Comments |
| Amchafibrin | Rottafarm | Tranexamic acid | |
| Antibiotic/antimycotic | Thermo Scientific HyClone | ||
| Calcium chloride | Sigma Aldrich | ||
| Culture plates | Fisher | ||
| DMEM | Invitrogen Life Technologies | ||
| Double-sided tape vynil | ATP Adhesive Systems | GM 107CC, 12 µm thick | |
| Edge plotter | Brother | Scanncut CM900 | |
| FBS | Thermo Scientific HyClone | ||
| Fibrinogen | Sigma Aldrich | Extracted from human plasma | |
| Glass slide | Thermo Scientific | ||
| GFP-Human dermal fibroblasts | - | Primary. Gift from Dr. Marta García | |
| H2B-GFP-HaCaT cell line | ATCC | Immortalized keratinocytes. Gift from Dr. Marta García | |
| Live/dead kit | Invitrogen | ||
| PBS | Sigma Aldrich | ||
| Polycarbonate membrane | Merk TM | 5 µm pore size | |
| Polydimethylsiloxane | Dow Corning | Sylgard 184 | |
| Sodium chloride | Sigma Aldrich | ||
| Syringes | Terumo | 5 mL | |
| Thrombin | Sigma Aldrich | 10 NIH/vial | |
| Transparent adhesive vinyl | Mactac | JT 8500 CG-RT, 95 µm thick | |
| Trypsin/EDTA | Sigma Aldrich | ||
| Tubing | IDEX | Teflon, 1/16” OD, 0.020” ID |
参考文献
- McNamee, P., et al. A tiered approach to the use of alternatives to animal testing for the safety assessment of cosmetics: Eye irritation. Regulatory Toxicology and Pharmacology. 54 (2), 197-209 (2009).
- Mathes, S. H., Ruffner, H., Graf-Hausner, U. The use of skin models in drug development. Advanced Drug Delivery Reviews. 69-70, 81-102 (2014).
- Abd, E., et al. Skin models for the testing of transdermal drugs. Clinical Pharmacology: Advances and Applications. 8, 163-176 (2016).
- Flaten, G. E., et al. In vitro skin models as a tool in optimization of drug formulation. European Journal of Pharmaceutical Sciences. 75, 10-24 (2015).
- Avci, P., et al. Animal models of skin disease for drug discovery. Expert Opinion on Drug Discovery. 8 (3), 331-355 (2014).
- Mak, I. W., Evaniew, N., Ghert, M. Lost in translation: animal models and clinical trials in cancer treatment. American Journal of Translational Research. 6 (2), 114-118 (2014).
- Pronko, P. P., VanRompay, P. A., Zhang, Z., Nees, J. A. Pronko et al. Reply. Physical Review Letters. 86 (7-12), 1387 (2001).
- H.R.2858 - Humane Cosmetics Act. 114th Congress Available from: https://congress.gov/bill/114th-congress/house-bill/2858 (2016)
- . Global in-vitro toxicology testing market report: size, share & trends analysis 2014-2015 Available from: https://www.prnewswire.com/news-releases/global-in-vitro-toxicology-testing-market-report-size-share--trends-analysis-2014-2025-300704958.html (2018)
- Zhang, Z., Michniak-Kohn, B. B. Tissue engineered human skin equivalents. Pharmaceutics. 4 (1), 26-41 (2012).
- OECD. In vitro skin corrosion: reconstructed human epidermis (RhE) test method. Test Guideline No.431. OECD Guideline for Testing of Chemicals. , (2019).
- Almeida, A., Sarmento, B., Rodrigues, F. Insights on in vitro models for safety and toxicity assessment of cosmetic ingredients. International Journal of Pharmaceutics. 519 (1-2), 178-185 (2017).
- vanden Broek, L. J., Bergers, L. I. J. C., Reijnders, C. M. A., Gibbs, S. Progress and future Prospectives in Skin-on-Chip Development with Emphasis on the use of Different Cell Types and Technical Challenges. Stem Cell Reviews and Reports. 13 (3), 418-429 (2017).
- Ataç, B., et al. Skin and hair on-a-chip: In vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a Chip. 13 (18), 3555-3561 (2013).
- Abaci, H. E., Gledhill, K., Guo, Z., Christiano, A. M., Shuler, M. L. Pumpless microfluidic platform for drug testing on human skin equivalents. Lab on a Chip. 15 (3), 882-888 (2015).
- Wu, R., et al. Full-thickness human skin-on-chip with enhanced epidermal morphogenesis and barrier function. Materials Today. 21 (4), 326-340 (2017).
- Materne, E. -. M., et al. The multi-organ chip - a microfluidic platform for long-term multi-tissue coculture. Journal of Visualized Experiments: JoVE. (98), e52526 (2015).
- Schimek, K., et al. Bioengineering of a full-thickness skin equivalent in a 96-well insert format for substance permeation studies and organ-on-a-chip applications. Bioengineering. 5 (2), 43 (2018).
- Alberti, M., et al. Multi-chamber microfluidic platform for high-precision skin permeation testing. Lab on a Chip. 17, 1625-1634 (2017).
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature BIotechnology. 32 (8), 760-772 (2014).
- Huh, D., Hamilton, G. A., Ingber, D. E. From 3D cell culture to organs-on-chips. Trends in Cell Biology. 21 (12), 745-754 (2011).
- Wufuer, M., et al. Skin-on-a-chip model simulating inflammation, edema and drug-based treatment. Scientific Reports. 6, 37471 (2016).
- Ramadana, Q., Ting, F. C. W. In vitro micro-physiological immune-competent model of the human skin. Lab on a Chip. 16, 1899-1908 (2016).
- Kim, K., Jeon, H. M., Choi, K. C., Sung, G. Y. Testing the effectiveness of Curcuma longa leaf extract on a skin equivalent using a pumpless skin-on-a-chip model. International Journal of Molecular Sciences. 21 (11), 3898 (2020).
- Halldorsson, S., Lucumi, E., Gómez-Sjöberg, R., Fleming, R. M. T. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosensors and Bioelectronics. 63, 218-231 (2015).
- Huh, D., Matthews, B. D., Mammoto, A., Montoya-Zavala, M., Hsin, H. Y. Reconstituting organ-level lung functions on a chip. Science. 328 (5986), 1662-1668 (2010).
- Huh, D. A human disease model of drug toxicity - induced pulmonary edema in a lung-on-a-chip microdevice. Scientific Translational Medicine. 4 (159), (2012).
- Beckwitt, C. H., et al. Liver ' organ on a chip '. Experimental Cell Research. 363 (1), 15-25 (2018).
- Poceviciute, R., Ismagilov, R. F. Human-gut-microbiome on a chip. Nature Biomedical Engineering. 3 (7), 500-501 (2019).
- Kanda, T., Sullivan, K. F., Wahl, G. M. Histone-GFP fusion protein enables sensitive analysis of chromosome dynamics in living mammalian cells. Current Biology. 8 (7), 377-385 (1998).
- Escámez, M. J., et al. Assessment of optimal virus-mediated growth factor gene delivery for human cutaneous wound healing enhancement. Journal of Investigative Dermatology. 128 (6), 1565-1575 (2008).
- Llames, S. G., et al. Human plasma as a dermal scaffold for the generation of a completely autologous bioengineered skin. Transplantation. 77 (3), 350-355 (2004).
- Llames, S., et al. Clinical results of an autologous engineered skin. Cell Tissue Bank. 7 (1), 47-53 (2006).
- Cubo, N., Garcia, M., del Cañizo, J. F., Velasco, D., Jorcano, J. L. 3D bioprinting of functional human skin: production and in vivo analysis. Biofabrication. 9 (1), 015006 (2016).
- Mori, N., Morimoto, Y., Takeuchi, S. Skin integrated with perfusable vascular channels on a chip. Biomaterials. 116, 48-56 (2017).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), 7-15 (2016).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nature Communications. 7, 11535 (2016).
- Marx, U., et al. Human-on-a-chip' developments: A translational cuttingedge alternative to systemic safety assessment and efficiency evaluation of substances in laboratory animals and man. Alternatives to Laboratory Animals. 40 (5), 235-257 (2012).
- Bein, A., et al. Microfluidic organ-on-a-chip models of human intestine. Cellular and Molecular Gastroenterology and Hepatology. 5 (4), 659-668 (2018).
- Bennet, D., Estlack, Z., Reid, T., Kim, J. A microengineered human corneal epithelium-on-a-chip for eye drops mass transport evaluation. Lab on a Chip. 18, 1539-1551 (2018).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a chip. 12, 2165-2174 (2012).
- Kim, H. J., Ingber, D. E. Gut-on-a-chip microenvironment induces human intestinal cells to undergo villus differentiation. Integrative Biology. 5 (9), 1130-1140 (2013).
- O'Neill, A. T., Monteiro-Riviere, N. A., Walker, G. M. Characterization of microfluidic human epidermal keratinocyte culture. Cytotechnology. 56 (3), 197-207 (2008).
- Ren, K., Chen, Y., Wu, H. New materials for microfluidics in biology. Current Opinion in Biotechnology. 25, 78-85 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。