Method Article
评估原发性纤毛的人工智能方法
摘要
与常用方法相比,使用人工智能(Ai)分析图像正在成为一种功能强大,偏见较少且快速的方法。在这里,我们训练Ai识别细胞器,原代纤毛,并以严格和可重复的方式分析长度和染色强度等特性。
摘要
纤毛是基于微管的细胞附属物,在许多哺乳动物细胞类型中充当多种信号通路的信号中心。纤毛长度高度保守,严格调节,并且在不同的细胞类型和组织之间变化,并且与直接影响其信号传导能力有关。例如,纤毛已被证明会改变其长度以响应睫状体G蛋白偶联受体的激活。然而,准确且可重复地测量许多纤毛的长度是一项耗时且劳动密集型的过程。目前的方法也容易出错和偏倚。人工智能(Ai)程序可用于克服许多这些挑战,因为其功能允许对大量数据集进行同化,操作和优化。在这里,我们证明了可以训练Ai模块识别体内和体外样品图像中的纤毛。在使用经过训练的Ai鉴定纤毛后,我们能够设计和快速利用应用程序,分析单个样品中数百个纤毛的长度,荧光强度和共定位。这种无偏见的方法增加了我们在体外以及动物内部和动物之间不同大脑区域比较来自不同初级神经元准备的样本时的信心和严谨性。此外,该技术可用于以高通量方式可靠地分析来自多个样品和处理组的任何细胞类型和组织的纤毛动力学。最终,基于人工智能的方法可能会成为标准,因为大多数领域都朝着偏见更少、可重复性更强的图像采集和分析方法发展。
引言
原代纤毛是从大多数哺乳动物细胞类型1,2,3,4中突出的感觉细胞器。它们通常是孤立的附属物,通过整合细胞外信号5,6,7来协调不同的细胞信号通路。原发性纤毛在胚胎发育和成人组织稳态中起重要作用,其功能或形态的破坏与几种遗传性疾病有关,这些疾病统称为纤毛病。由于纤毛几乎无处不在的性质,纤毛病与广泛的临床特征有关,可以影响所有器官系统8,9,10,11,12。在纤毛病的动物模型中,睫状体结构或信号传导能力的丧失表现为几种临床相关的表型,包括食欲亢进相关的肥胖3,13,14,15。在许多模型系统中,纤毛长度变化已被证明会影响它们的信号传导能力和功能16,17,18,19。然而,在准确和可重复地评估纤毛长度和组成方面,存在一些耗时的技术挑战。
成年哺乳动物中枢神经系统(CNS)是一种生物学背景,对理解纤毛形态和功能提出了挑战。虽然似乎整个CNS中的神经元和细胞都拥有纤毛,但由于观察和分析这些纤毛的工具和能力有限,因此对其功能的理解仍然难以捉摸20。例如,典型的纤毛标志物,乙酰化α-微管蛋白,不标记神经元纤毛20。研究这些纤毛的困难通过发现几种G蛋白偶联受体(GPCR),信号机制和膜相关蛋白部分解决,这些蛋白富集在神经元纤毛21,22上。所有这些直接的基本观察都暗示了中枢神经系统纤毛的重要性和多样性,迄今为止,它似乎是其他组织无法比拟的。例如,可以在整个大脑中观察到纤毛长度和GPCR定位的变化,与其他核19,23相比,某些神经元核的长度不同。类似地,它们的GPCR含量和信号机制互补显示出基于神经解剖位置和神经元类型2,24,25,26,27,28,29的多样性。这些简单的观察表明,哺乳动物中枢神经系统纤毛的长度和组成受到严格调节,就像在模型生物中一样,如衣原体reinhardtii,但这些长度差异对纤毛功能,信号传导和最终行为的影响仍然不清楚16,30,31,32。
准确测量纤毛长度和组成被证明是一项技术挑战,容易出现用户错误和不可重复性。目前体内和体外纤毛最常使用免疫荧光方法识别纤毛蛋白或富含纤毛的荧光报告等位基因33,34,35。然后使用图像分析程序(如ImageJ36)中的线测量工具从二维(2D)图像中测量这些荧光标记的纤毛的长度。这个过程不仅繁琐和劳动密集,而且容易出现偏见和错误。在测量纤毛强度时会出现这些相同的障碍,这有助于指示纤毛结构的变化37。为了最大限度地减少这些类型的图像分析中的不一致,人工智能(Ai)程序正变得越来越普遍和负担得起选项38。
Ai是计算机系统的进步,它利用计算机算法和编程的优势来执行通常需要人类智能的任务39。人工智能设备被教导感知反复出现的模式、参数和特征,并采取行动,以最大限度地提高创造成功结果的几率。Ai是多功能的,可以被训练来识别感兴趣的特定物体或结构,如纤毛,然后被编程为对识别的物体进行各种分析。因此,Ai38可以快速且可重复地生成复杂的图像数据。捕获图像的自动化和AI分析将提高功效和效率,同时限制任何潜在的人为错误和偏差39。建立基于Ai的纤毛鉴定方法为所有研究小组分析和解释纤毛数据创造了一种一致的方法。
在这里,我们利用Ai模块在2D图像上识别 体内 和 体外的 纤毛。使用一组样本图像,Ai被训练来识别纤毛。训练完成后,指定的Ai用于在图像中Ai识别的纤毛上应用二进制掩码。如有必要,Ai应用的二进制文件是可修改的,以确保正确识别图像中的所有纤毛并消除非特异性识别。在利用Ai识别纤毛后,使用定制的通用分析(GA)程序执行不同的分析,例如测量纤毛长度和荧光强度。收集的数据被导出到一个表格中,该表格可以轻松读取,解释并用于统计分析(图1)。使用自动化技术和Ai来识别纤毛并获得实验组之间的特定测量值将有助于未来旨在了解CNS纤毛功能和形态对细胞 - 细胞通讯和行为的影响的研究。
研究方案
1. 获取原始图像
- 根据需要固定和免疫标记样品20.
- 使用共聚焦显微镜在最大位深度下使用与奈奎斯特分辨率相同的像素大小对纤毛进行成像。
- 将图像导出为单色标记图像格式 (.tif) 文件。
注意:此协议概述了如何在 NIS Elements 软件中专门使用 Ai 模块。如果图像是作为 .nd2 文件获取的,则无需将图像导出为.tif文件,用户可以直接继续执行步骤 2.3。如果图像是在不同的系统上获取的,则可以单独购买NIS Elements许可证,并且可以按照后续步骤中的概述转换.tif文件。
2. 训练艾智识别纤毛
- 打开训练数据集。
- 选择大约 50 张样本图像,每帧至少一个纤毛,以训练软件并将其复制到单个文件夹中。此文件夹用于在打开图像时定向软件。在单个 ND2 文档中打开这 50 个帧,每个文档至少打开一个纤毛。选择"文件>导入/导出">"从文件序列创建 ND 文件"。
- 选择包含训练数据集的文件夹。这将打开对话窗口中心的文件列表。使用上面下拉菜单中的至少一个选项手动定义文件的组织。选项包括多点(对于多个最大投影文件)、Z 系列(对于 z 堆栈图像)、时间(对于延时图像)和波长(对于来自多个通道的文件)。
- 在每个选定选项下输入相应的数值。在未选择选项的位置选择" 无 "。单击" 转换 "以打开 ND 文档。
- 校准图像。
- 在图像左下角输入像素大小:右键单击" 未校准>校准文档>像素大小"。
- 识别纤毛。
- 通过使用二进制工具栏中的"自动检测"或"绘制对象"精确跟踪所有打开的帧上的单个纤毛结构,手动识别纤毛。这将在感兴趣的对象上绘制二进制掩码。这些二进制文件将作为样本对象,用于训练软件,以识别未来实验图像分析中基于像素的特征的纤毛。选择"查看>分析控件">二进制工具栏>绘制对象"。
注意:删除任何没有任何二进制文件的帧,因为软件不会开始训练,除非它能够检测到所有打开的帧上的二进制文件。
- 通过使用二进制工具栏中的"自动检测"或"绘制对象"精确跟踪所有打开的帧上的单个纤毛结构,手动识别纤毛。这将在感兴趣的对象上绘制二进制掩码。这些二进制文件将作为样本对象,用于训练软件,以识别未来实验图像分析中基于像素的特征的纤毛。选择"查看>分析控件">二进制工具栏>绘制对象"。
- 训练艾。
- 开始训练软件。这将打开火车 Segment.ai 箱。选择 NIS.ai >火车 Segment.ai。
- 在 "训练 Segment.ai" 框中,选择要用于训练的源通道。如果来自多个通道的文件处于打开状态,请仅选择一个通道作为源通道。然后选择要训练 Ai 的相应地面实况二进制文件。最后,根据二进制文件的大小和分布选择训练 Ai 所需的迭代次数。
注意:如果二进制文件很容易从周围环境中检测到,并且在整个图像中分布良好,则软件可能需要不到1000次迭代才能训练以识别图像。如果图像的信噪比较低,则在训练时至少运行1000次迭代是理想的,以使Ai能够以高置信度识别测试样本中的纤毛。 - 选择目标文件夹以保存训练的 Ai 文件 (.sai),然后单击 训练 以训练软件。该软件现在将继续训练自己,以根据跟踪的二进制文件识别纤毛。此过程需要几个小时。
注意:训练时,软件将显示显示训练损失的图表。该图最初将显示一个峰值,然后逐渐减少到理想的1%左右的损失,在其余训练中处于稳定状态。通过选中"火车 Segment.ai"框中的 "保存图表屏幕截图 "框(补充图1)来保存图表以供将来参考。 - 如果需要进一步优化训练,请继续在同一数据集上进行训练。或者,使用完全相同的参数在新数据集上进行训练。不建议在具有不同参数或不同感兴趣对象的新数据集上训练已经训练的Ai。选择"训练 segment.ai >继续训练>选择训练的 AI 文件"。
3. 使用训练有素的 Ai 识别纤毛
- 打开实验数据集。
- 通过将样本.tif文件转换为.nd2文件,在软件中打开纤毛的实验共聚焦图像,类似于步骤2.1。选择"文件>导入/导出">"从文件序列创建 ND 文件"。
注意:图像的像素大小应与用于训练 Ai 的图像相同。如果图像已采用 ND2 格式,请跳到步骤 3.3。
- 通过将样本.tif文件转换为.nd2文件,在软件中打开纤毛的实验共聚焦图像,类似于步骤2.1。选择"文件>导入/导出">"从文件序列创建 ND 文件"。
- 校准图像。
- 在图像的左下角输入像素大小。右键单击 未校准>校准文档>像素大小"。
- 对打开的文件运行经过训练的 Ai。
- 开始使用Ai识别纤毛。现在,该软件将根据它在上一步中接受的训练在纤毛上绘制二进制文件。此过程将需要几秒钟。选择"NIS.ai > Segment.ai"。
注:如果打开了多个通道,软件将提示选择通道。此处按频道各自的名称列出。否则,将自动选中标记为"Mono"的框。
- 开始使用Ai识别纤毛。现在,该软件将根据它在上一步中接受的训练在纤毛上绘制二进制文件。此过程将需要几秒钟。选择"NIS.ai > Segment.ai"。
- 检查图像中是否有错误识别的二进制文件。
- 一旦Ai识别了纤毛并绘制了二进制文件,请检查图像中是否有任何错误识别的物体。如果需要,请手动删除任何错误识别的二进制文件。选择" 查看>分析控件">二进制工具栏>删除对象"。
4. 测量纤毛长度和强度
- 创建新的一般分析 3 (GA3) 配方。
- 现在纤毛已经被识别和分割,继续使用GA3工具分析纤毛的不同参数,例如长度和强度。这将打开一个新窗口,在中心有一个空格,将在其中定义分析。选择"图像>新的 GA3 配方"。
- 选择要分析的二进制文件。
- 由于纤毛已经使用 Segment.ai 进行分段,GA3将自动检测根据Ai适当标记的二进制文件并包括节点。选择"自动Detect_AI>二进制文件"或"绘制Object_AI>二进制文件"。
- 选择分析所需的通道。GA3还会自动检测图像中的通道,并在" 通道"下显示其选项卡。
- 移除接触框架边框的对象。
- 由于Ai将分割框架中所有类似纤毛的物体,因此它还将沿着框架的边缘检测不完整的纤毛。这些对象可以在步骤 3.4 中手动删除,也可以在 GA3 中自动删除。选择" 二进制处理>删除触摸边框>对象"。
- 选择要测量纤毛的参数。
- 拖放要测量的参数,如纤毛长度(长度)和强度(总对象强度)。将节点连接到相应的二进制节点(连接 A)和通道节点(连接 B)。将鼠标悬停在节点连接上可获取工具提示,以显示节点所属的连接。选择 "物体大小测量>>长度 "和 "物体强度>测量>Obj强度之和"。
注意:节点 长度 仅连接到二进制节点,而 Sum Obj 强度 同时连接到二进制节点和通道节点。
- 拖放要测量的参数,如纤毛长度(长度)和强度(总对象强度)。将节点连接到相应的二进制节点(连接 A)和通道节点(连接 B)。将鼠标悬停在节点连接上可获取工具提示,以显示节点所属的连接。选择 "物体大小测量>>长度 "和 "物体强度>测量>Obj强度之和"。
- 在单个表中追加测量值。
- 通过将节点"追加列"拖放到分析流程图中并将其连接到测量节点"长度"和"总 Obj 强度",将所有测量值合并到单个输出表中。选择"数据管理">"基本>追加列"。
- 测量纤毛。
- 通过单击" 运行"来测量纤毛。这个过程需要一些时间来测量实验图像中的所有纤毛。长度和强度将显示在新的 "分析结果" 窗口中。
注意:该表有时可以包括来自Ai识别为纤毛但太小而无法被人眼检测到并在步骤3.4中消除的面罩的数据。在进行统计分析之前,可以通过使用筛选器从数据集中删除这些对象。在这里,使用1μm的过滤器用于图2中的体外纤毛长度测量,体外纤毛使用2μm的过滤器。这可以在使用以下路径导出数据之前完成。选择"分析结果"窗口>定义筛选器>输入值>使用筛选器。
- 通过单击" 运行"来测量纤毛。这个过程需要一些时间来测量实验图像中的所有纤毛。长度和强度将显示在新的 "分析结果" 窗口中。
- 导出数据以进行统计分析。
5. 共定位研究
注意:共定位分析可以包含在用于测量纤毛长度和强度分析的相同GA3配方中。如果使用相同的配方,请按如下所述打开文件,并测量两个通道的长度和强度以及同一分析管道中的共定位系数。
- 打开实验数据集。
- 通过将样本.tif文件转换为.nd2文件,打开软件中纤毛的实验共聚焦图像。选择"文件>导入/导出">"从文件序列创建 ND 文件"。
- 在弹出窗口中,从位于弹出窗口第一列的窗口资源管理器中从所有感兴趣的通道中选择 16 位深度单色文件。从第一个下拉菜单中选择 多点 或 Z 系列 ,然后分别输入与图像或堆栈总数相对应的值。
- 在第二个下拉框中,选择"波长",然后将该值更改为文件夹中的通道总数。该软件将自动解锁位于弹出窗口右下角的波长选择窗口。使用颜色下拉菜单选择每个通道的颜色。在"名称"列下为每个通道提供不同的名称。更新所有信息后,单击"转换"。该软件将自动生成一个所有图像文件,该文件覆盖着来自所有选定通道的所有单个图像。
- 校准图像。
- 在图像的左下角输入像素大小。右键单击 未校准>校准文档>像素大小"。
- 在第一个通道上运行经过训练的 Ai。
- 开始识别其中一个开放通道上的纤毛(例如,ACIII;图 5A)使用 Ai。该软件现在将根据它为该通道接受的训练,在ACIII标记的纤毛上绘制二进制文件。此过程将需要几秒钟。NIS.ai > Segment.ai > ACIII >选择"源通道"。
- 在第二个通道上运行经过训练的 Ai。
- 开始识别另一个开放通道上的纤毛(例如,MCHR1; 图 5B)使用 Ai。该软件现在将根据它为该通道接受的训练,在MCHR1标记的纤毛上绘制二进制文件。此过程将需要一些时间。 NIS.ai > Segment.ai > MCHR1 >选择"源通道"。
- 检查图像中是否有错误识别的二进制文件。
- 一旦Ai识别出纤毛并绘制了二进制文件,请检查图像中是否有任何错误识别的物体。如有必要,请手动删除任何错误识别的二进制文件。选择"查看>分析控件">二进制工具栏>"删除对象"。
- 创建新的 GA3 配方。
- 现在纤毛已被识别和分割,使用GA3工具进行共定位分析。这将打开一个新窗口,在中心有一个空格,将在其中定义分析。将生成一个包含所有已识别的二进制文件和通道的窗口。验证分析所需的所有所需通道和二进制文件是否存在并已选中。选择"图像>新的 GA3 配方"。
- 移除接触框架边框的对象。
- 由于Ai将分割框架中的所有纤毛样物体,因此它还将沿着框架的边缘检测不完整的纤毛。这些对象可以在步骤 5.5 中手动删除,也可以在 GA3 中自动删除。选择 二 进制处理 > 删除触摸边框>对象。
- 在GA3中设置共定位途径。
- 要测量纤毛内两个通道的重叠,请使用曼德系数相关。将 Manders 系数 节点拖放到 GA3 配方的空白区域,并将其连接到相应的二进制和通道。此处,"连接 A"与 ACIII 二进制文件连接,"连接 B"与 MCHR1 通道连接,"连接 C"与 ACIII 通道连接,以确定 ACIII 二进制文件中 MCHR1 的重叠。选择 "测量>目标比率法>曼德斯系数"。
注意:该软件允许使用与此协议40中描述的相同步骤使用Pearson系数相关性测量共定位。
- 要测量纤毛内两个通道的重叠,请使用曼德系数相关。将 Manders 系数 节点拖放到 GA3 配方的空白区域,并将其连接到相应的二进制和通道。此处,"连接 A"与 ACIII 二进制文件连接,"连接 B"与 MCHR1 通道连接,"连接 C"与 ACIII 通道连接,以确定 ACIII 二进制文件中 MCHR1 的重叠。选择 "测量>目标比率法>曼德斯系数"。
- 在单个表中追加测量值。
- 将所有测量值合并到单个输出表中。选择"数据管理">"基本>追加列"。
- 测量共定位。
- 通过单击" 运行"来测量纤毛。这个过程需要一些时间来测量实验图像中的所有纤毛。数据将显示在新的 "分析结果" 窗口中。
- 导出数据以进行统计分析。
结果
训练 Ai 识别纤毛
测量和评估纤毛结构长度和组成可能是一个繁琐、耗时且容易出错的过程。在这里,我们使用Ai从大量图像中准确分割纤毛,并使用分析工具分析其长度和强度(图1)。所有Ai方法都需要训练步骤才能实现。我们建立了一个训练管道来识别纤毛,这是通过在纤毛结构上手动应用二进制掩码来执行的。然后,此信息用于根据所应用的二进制文件下的像素特征训练 Ai。作为一般准则,训练涉及软件经历几次迭代,大约1000次,如果训练损失或错误率小于1%,则认为是最佳的。但是,训练过程中的迭代次数和错误次数可能会有所不同,具体取决于用于训练的示例图像。例如,在使用 体外 神经元纤毛图像进行训练后,错误率为1.378%,而 体内 脑切片图像的错误率为3.36%(补充图1)。训练完成后,Ai就可以在几秒钟内从实验图像中分割纤毛,并将产生的二进制掩模用于测量结构参数。这消除了使用传统的强度阈值方法分割物体的需要,这在具有高背景噪声的图像中或当物体彼此靠近时可能很困难。Ai还通过在所有图像上应用相同的算法来减少错误和偏差的可能性,而不管用户是谁。
使用 GA3 测量纤毛长度
纤毛长度受到严格调节,与纤毛信号传导的功能影响有关16,19。在这里,我们使用NIS Elements软件中称为General Analysis 3或GA3的分析管道测量纤毛长度。GA3 有助于在单个工作流程中组合多个工具,为每个实验构建自定义例程。我们从测量细胞系中的纤毛长度开始。小鼠髓内收集管(IMCD-3)细胞上的纤毛用乙酰化微管蛋白免疫标记并使用共聚焦显微镜成像。我们在用 segment.ai 分割后使用GA3测量纤毛长度(补充图3A)。虽然乙酰化的α微管蛋白优先存在于原代纤毛中,但它也存在于其他富含微管的区域,如细胞骨架以及细胞动力学桥。经过训练的Ai在图像中正确识别纤毛,但未识别其他非睫状,乙酰化小管蛋白阳性结构。IMCD细胞上的纤毛范围为0.5μm至4.5μm,平均长度为1.8±0.04μm(图2A)。接下来,我们测试了Ai在原代神经元培养物中测量纤毛长度的能力。我们从新生小鼠的下丘脑和海马体培养神经元10天,并用纤毛标志物腺苷酸环化酶III(ACIII)21,41对它们进行免疫标记。在分析神经元培养物时,我们发现在统计分析长度之前应用过滤器很有用。由于信噪比较低,因此鉴定出几个小于1μm的物体不是纤毛。因此,我们过滤了数据以消除长度小于1μm的任何物体,以确保仅分析纤毛。在培养的下丘脑神经元中,纤毛长度范围为2μm至7μm,平均长度为3.8±0.19μm(图2B)。有趣的是,培养的海马神经元纤毛较长,平均长度为6.73±0.15μm(图2C)。据报道,下丘脑内的不同神经元核显示出不同的纤毛长度,并且这些纤毛以细胞核特异性方式响应生理变化而改变其长度19,23。因此,我们还用ACIII标记了成年雄性C57BL / 6J小鼠的下丘脑切片,并对弓形核(ARC)和心室旁核(PVN)进行了成像。使用GA3测量纤毛长度,我们观察到体内下丘脑纤毛比体外纤毛出现的时间更长。具体而言,体内下丘脑纤毛的范围为1μm至约15μm(图3)。PVN中的纤毛长度(5.54±0.0.42μm)与ARC中的纤毛长度(6.16±0.27μm)之间没有显着差异(图3C)23。类似地,海马体角膜(CA1)区域的纤毛显示出从1μm到10μm的较窄长度范围,平均长度为5.28±0.33μm(图3)。根据先前发表的研究,我们使用Ai和GA3工具进行的分析表明,来自不同大脑区域的纤毛在长度19,23中显示出多样性。此外,使用这种Ai方法,我们能够快速评估大量的纤毛。
使用GA3测量纤毛成分
原发性纤毛是许多途径的信号传导枢纽,它们利用不同类型的蛋白质来执行独特的功能,如运动蛋白,鞭内转运蛋白和GPCR,仅举几例3,24,42,43。在纤毛内保持这些蛋白质的适当水平对于正常运作很重要,并且通常看起来取决于细胞环境。这些蛋白质的荧光标记不仅使我们能够可视化它们,而且还量化它们的强度,作为相对较小的隔室20内标记蛋白质量的量度。因此,我们试图确定睫状体GPCR,黑色素浓缩激素受体1(MCHR1)的强度,在体内的ARC和PVN的成年雄性小鼠的下丘脑24,44。使用Ai和GA3,我们测量了MCHR1阳性纤毛的长度以及强度,以确保计数的物体是纤毛(补充图3A)。我们消除了分析后长度小于2μm的物体,并分析了剩余二进制掩模的强度。有趣的是,我们发现PVN中睫状体MCHR1的强度显着高于ARC中的强度,这表明PVN中纤毛MCHR1的存在更强(图4)。需要进一步的研究来确定睫状体MCHR1在这些神经元回路中的重要性。我们还测量了下丘脑和海马体原代培养神经元中睫状体MCHR1的强度。来自两种培养物的纤毛显示出MCHR1强度的广泛分布,表明存在异质性神经元群体(补充图2)。因此,使用Ai和GA3等复杂的分析工具可以评估同一组织内或多个组织之间的纤毛异质性。看看其他神经元GPCR是否在同一组织的神经元内的定位方面表现出类似的差异,以及这是否响应于生理变化而改变,这将是很有趣的。
共定位
虽然测量完整图像场内的荧光强度可以给人以蛋白质的印象,但它无法提供诸如空间分布或与其他附近蛋白质和细胞结构的接近度之类的信息。在这里,我们通过绘制每个二进制掩模的MCHR1强度与ACIII的强度来测量MCHR1与ACIII作为纤毛标志物的重叠(图5)。该图显示,大多数纤毛ACIII和MCHR1均呈阳性,尽管一些纤毛对一个通道的表达比另一个通道更强。此外,有一些纤毛显示ACIII或MCHR1的存在,这从分别位于x轴和y轴上的点可以明显看出。为了量化这种重叠,我们测量了Mander的重叠系数,并比较了ARC和PVN40的神经元纤毛中MCHR1表达的程度。有趣的是,我们的分析显示,PVN的系数(0.6382±0.0151)比ARC中的系数(0.5430±0.0181)显着增加(图5C)。这与我们之前的数据一致,在这些数据中,与ARC相比,我们在PVN中观察到更高的MCHR1强度(图4)。这些数据表明,像纤毛长度一样,MCHR1在睫状体室中的表达模式在大脑的不同区域有所不同。使用相同的分析管道,可以确定其他纤毛GPCR,如神经肽Y受体2型(NPY2R)和生长抑素受体3型(SSTR3)是否显示出相似的多样性。
测量沿纤毛的强度分布
一旦使用 segment.ai 鉴定纤毛,就可以修改GA3配方,将纤毛分析与图像中其他感兴趣的结构的鉴定相结合。例如,使用基础体标记进行标记有助于识别纤毛极性。为了进行这项分析,我们对表达ARL13B-mCherry和Centrin2-GFP的P0小鼠的下丘脑切片进行了成像,并对ARC和PVN34进行了成像。在这里,像以前一样使用Ai鉴定纤毛,但现在修改后的GA3配方包括鉴定Centrin2-GFP,一种在纤毛基部发现的中心蛋白(补充图3B)。通过标记Centrin2-GFP,可以将纤毛的基底与ARL13B-mCherry阳性纤毛的尖端区分开来(图6A)。然后,我们不是测量整个纤毛内的强度,而是能够测量沿着纤毛长度的ARL13B强度的变化(图6B)。我们还可以比较纤毛近端和远端之间ARL13B强度的差异。为此,我们将纤毛长度从底部开始划分为1微米箱,并将第一个微米箱指定为近端,最后一个微米箱指定为远端。我们的分析显示,在ARC和PVN中,ARL13B明显多于纤毛尖端,这与先前发表的人类软骨细胞45 的研究一致(图6C)。在这种类型的分析中,不是应用长度过滤器从分析中排除小的非纤毛物体,而是仅分析与Centrin2-GFP标记相关的纤毛。在基因突变导致纤毛非常短的情况下,或者如果涉及纤毛亚结构域(如过渡区或尖端)的变化,这可能是有利的。使用Ai和GA3分析鉴定纤毛具有高度的适应性,可以定制以适应各种复杂的研究问题。
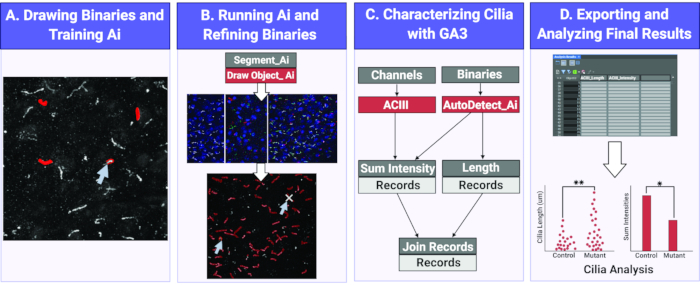
图 1.使用 Ai 测量纤毛长度和强度的工作流程。(A)为了训练Ai,在原始训练图像上感兴趣的对象(纤毛)周围绘制二进制文件。使用绘制的二进制文件,Segment Ai 被训练来识别纤毛的形状和像素强度。(B) 接下来,将经过训练的片段 Ai 应用于原始实验图像。它在它识别为纤毛的对象上绘制二进制文件。可以对这些二进制文件进行细化,以确保分析所有且仅分析纤毛。(C)构建了一个GA3程序来分析Ai识别的物体的强度和长度。(D) 记录被导入到软件中的表中。然后可以导出此表以进行进一步分析。 请点击此处查看此图的放大版本。

图 2.体外纤毛长度测量。纤毛在(A)IMCD细胞(绿色,乙酰化微管蛋白)(B)原代下丘脑培养物(绿色,ACIII)和(C)海马培养物(绿色,ACIII)中的代表性图像。训练有素的Ai用于识别纤毛,如二进制掩模(洋红色)所示,然后使用GA3测量纤毛长度。纤毛长度的分布图为0.5或1.0微米箱中纤毛的百分比。* 表示 Ai 未正确识别细胞动力学桥。来自3个重复的IMCD细胞中的n = 225纤毛,下丘脑细胞中的54个纤毛和来自3只动物的海马培养物中的139个纤毛。比例尺 10 μm.请单击此处查看此图的放大版本。
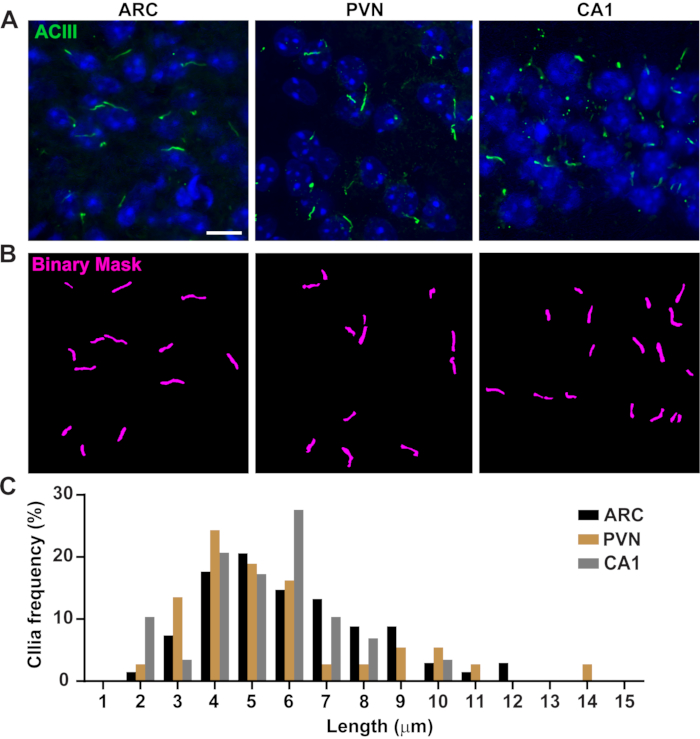
图 3.体内纤毛长度测量。(A) 成年小鼠大脑切片的 ARC、PVN 和 CA1 中纤毛(绿色、ACIII)的代表性图像。(B)NIS Elements中训练有素的Ai用于识别纤毛,如二进制掩模(洋红色)所示,然后GA3用于测量纤毛长度。(C) 纤毛长度的分布图为一微米箱中纤毛的百分比。n= 68 纤毛在 ARC 中,36 在 PVN 中,29 在 CA1 中,来自 3 只动物。比例尺 10 μm.请单击此处查看此图的放大版本。
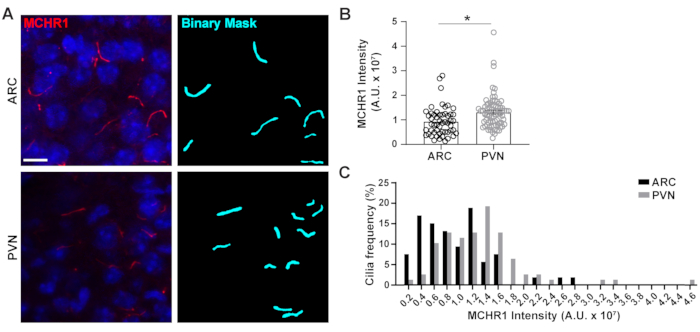
图 4.Ai辅助下丘脑神经元纤毛的纤毛染色强度测量。 (A) 成年小鼠大脑部分ARC和PVN中纤毛(MCHR1,红色)的代表性图像。使用NIS Elements中训练有素的Ai来识别纤毛,如二进制掩模(青色)所示,然后使用GA3测量纤毛中MCHR1染色的强度。(B) MCHR1強度被繪成平均±S.E.M。每个点代表一个纤毛。* p < 0.05,学生的 t-检验。(C) MCHR1 强度的分布绘制为 0.2 x 107 任意单位 (A. U.) 的箱子中纤毛的百分比。n = ARC 中的 53 个纤毛,3 只动物的 78 个 PVN。比例尺 10 μm. 请单击此处查看此图的放大版本。
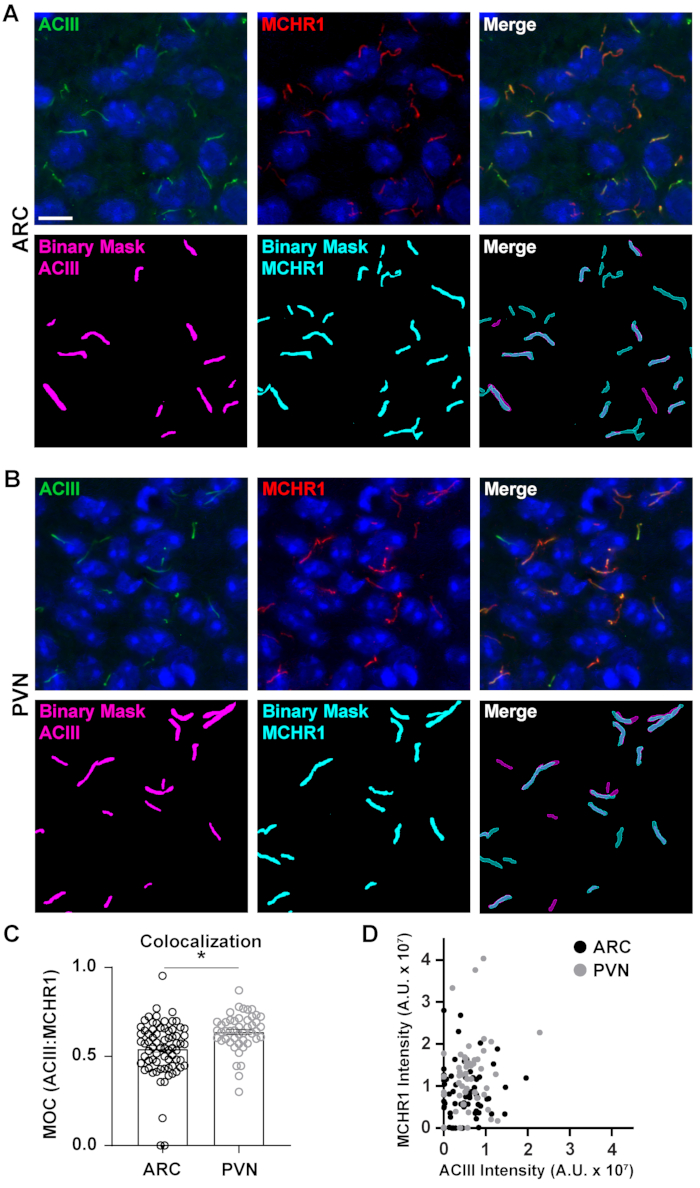
图 5.Ai辅助纤毛共定位分析。 (A, B)分别是 ARC 和 PVN 中纤毛的代表性图像。纤毛被标记为ACIII(绿色)和MCHR1(红色)。在NIS Elements中训练有素的Ai用于识别纤毛,如二进制面罩所示(洋红色表示ACIII标记纤毛,青色表示MCHR1标记纤毛)。GA3用于识别同时含有ACIII和MCHR1的纤毛。(C) 曼德重叠系数 (MOC) 值绘制为 S.E.M ±平均值。每个点代表一个纤毛。* p < 0.05,学生的 t-检验。(D) ARC 和 PVN 中 MCHR1 强度与 ACIII 强度的散点图。每个点代表一个纤毛。n = ARC 中的纤毛为 72,PVN 为 47,来自 3 只动物。比例尺 10 μm. 请单击此处查看此图的放大版本。
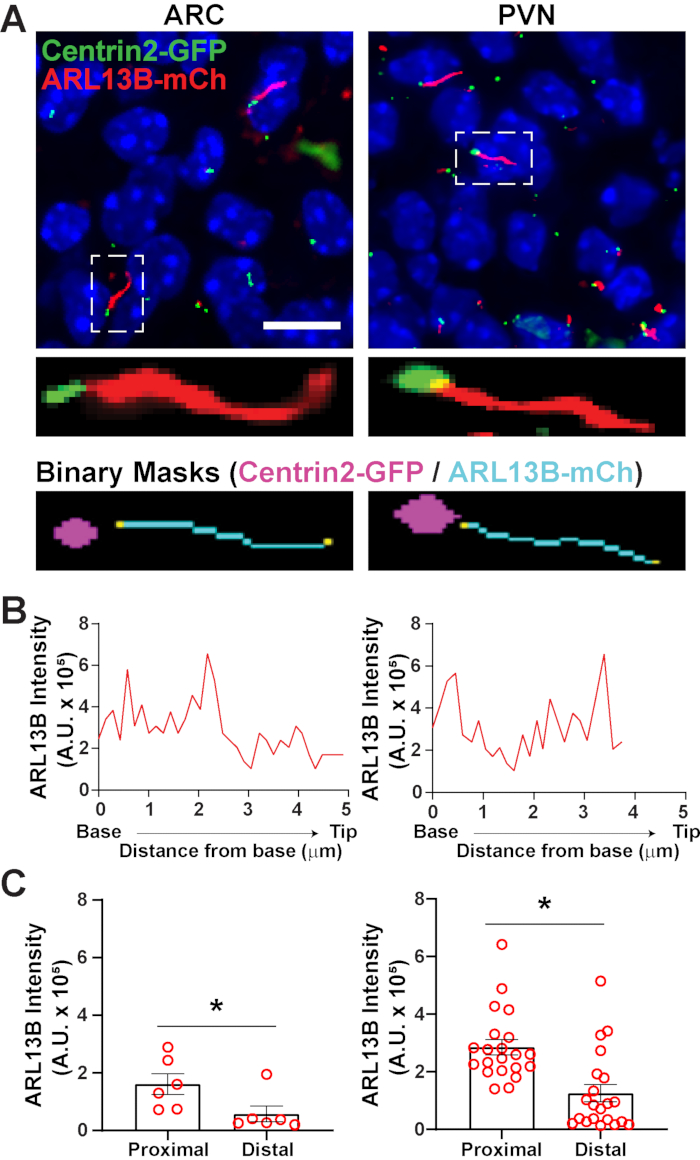
图 6.纤毛和基底体分析。(A) P0 小鼠 ARC 和 PVN 中纤毛(红色,ARL13B-mCherry)和基底体标记(绿色,Centrin2-GFP)的代表性图像。训练有素的Ai被用来识别纤毛,如二进制面具(青色)所示。基底体(洋红色)的二进制掩模是通过GA3配方中的阈值绘制的。(B) 纤毛的代表性线阵扫描强度。(C) Ai鉴定出的纤毛近端和远端的ARL13B强度为S.E.M±平均值。近端和远端分别定义为距纤毛基部前1μm长度和最后1μm长度的区域。每个点代表一个纤毛。* p < 0.05。n = 2 只动物的 ARC 中的 6 个纤毛和 3 只动物的 PVN 中的 21 个纤毛。比例尺 10 μm. 请单击此处查看此图的放大版本。
补充图1。AI 训练损失图。 (A, B) 分别显示神经元纤毛 在体外 和 体内 的 segment.ai 训练损失的图。 请点击此处下载此文件。
附图2。Ai辅助纤毛染色强度测量 体外 神经元纤毛。(A, B)原发性下丘脑培养物和海马培养物中纤毛(MCHR1,红色)的代表性图像。使用NIS Elements中训练有素的Ai来识别纤毛,如二进制掩模(青色)所示,然后使用GA3测量纤毛中MCHR1染色的强度。MCHR1强度的分布图为下丘脑培养物的1000 A.U.箱和海马培养物的2000 A.U.箱中纤毛的百分比。n= 3 只动物的下丘脑为 30 只纤毛,海马培养物为 106 只纤毛。比例尺 10 μm. 请点击这里下载此文件。
补充图3。一般分析 纤毛分析的3个食谱。 (A) 用于测量纤毛长度、强度和曼德系数的简单一般分析 (GA3) 配方。(B) 复杂的GA3配方,用于使用基底体的标记物测量沿着纤毛长度的强度。 请点击此处下载此文件。
讨论
长度和强度测量是分析原发性纤毛的常用方法,但是,该领域没有使用标准化的常规方法。使用ImageJ等软件识别和定量原发性纤毛非常耗时,并且容易出现用户偏差和错误。这使得准确分析大型数据集变得困难。在这里,我们展示了使用Ai程序可以克服许多这些挑战,使初级纤毛的高通量分析成为可能。在本文中,我们描述了训练基于Ai的应用程序以识别原发性纤毛的过程,并概述了分析长度和强度所需的步骤。
虽然Ai识别纤毛的初始训练需要用户花费大量时间,但一旦完成,它就可以用于使用相同参数获取的任何数据集。Ai 生成的二进制掩码是可修改的,因此可以更正任何错误。然而,纤毛识别中的错误应该向用户发出信号,即Ai需要用额外的图像进一步训练。这种方法的一个主要优点是,可以训练Ai识别2D和3D中不同样品类型的纤毛。以前在实验室内生成的分析方法有各种局限性,包括需要手动阈值进行识别,以及从细胞密度高36,46,47的组织切片中识别纤毛的问题。这些方法也专门用于纤毛分析,而使用NIS Elements软件的分析可以同时评估图像的多个方面。由于这里描述的Ai是NIS Elements软件包的一部分,因此使用尼康显微镜采集的图像可以轻松地持续到分析。但是,使用此方法不需要使用尼康进行成像。无论捕获的原始数据文件格式如何,".tif"文件都可以由NIS Elements打开以在Ai中使用。
NIS Elements中的Ai应用程序已广泛使用,并且可能已经是研究初级纤毛的实验室使用的图像分析软件的一部分。随着人工智能技术的普及,其他成像软件可能会扩展其分析选项,以包括类似的人工智能模块。将Ai分析应用于纤毛鉴定可用于纤毛分析的几个不同方面。虽然我们概述了一些简单分析的方法,如长度(图2和图3),强度(图4)和共定位(图5),但更复杂的分析可以添加到GA3分析工作流程中,如图6所示。例如,评估纤毛亚定位可能感兴趣的不是测量完全纤毛的强度,而是纤毛亚区域内的强度差异。纤毛子区域内的强度差异可能表明蛋白质在纤毛的尖端或基部积聚,例如Gli蛋白如何在纤毛48的尖端富集。此外,此Ai应用程序可用于轻松识别基因型或治疗组之间的差异。虽然我们的实验室主要使用这种方法来分析从大脑切片或神经元培养物中成像的纤毛,但它可以应用于从各种细胞系或其他组织类型获得的图像。该应用可用于的样品类型的灵活性使得这种分析方法对于研究原发纤毛或正在评估的任何离散细胞器(如线粒体,细胞核或ER)的许多不同组都很有价值。
披露声明
合著者Wesley Lewis是尼康的员工。没有财务披露。
致谢
这项工作由国家糖尿病,消化和肾脏疾病研究所R01 DK114008资助给NFB和美国心脏协会奖学金赠款#18PRE34020122 RB。我们感谢尼康软件总经理Rich Gruskin,Melissa Bentley,Courtney Haycraft和Teresa Mastracci对手稿的深刻评论。
材料
| Name | Company | Catalog Number | Comments |
| Intel Xeon, 3.6 GHz, 32GB RAM | Intel Corporation | W-2123 | Processor used for running NIS Elements. |
| Nikon Elements Software | Nikon Instruments Inc. | - | Ai and GA3 software |
| Quadro RTX 4000 Graphics card | NVIDIA Corporation | Quadro RTX 4000 | |
| Windows 10 Professional 64-bit | Microsoft Inc. | - | Operating system used for running NIS Elements |
| Workstation | HP Development Company, L.P. | HP Z4G4 | Workstation used for running NIS Elements |
参考文献
- Wang, L., et al. Ciliary gene RPGRIP1L is required for hypothalamic arcuate neuron development. JCI Insight. 4 (3), (2019).
- Siljee, J. E., et al. Subcellular localization of MC4R with ADCY3 at neuronal primary cilia underlies a common pathway for genetic predisposition to obesity. Nature Genetics. 50 (2), 180-185 (2018).
- Davenport, J. R., et al. Disruption of intraflagellar transport in adult mice leads to obesity and slow-onset cystic kidney disease. Current Biology. 17 (18), 1586-1594 (2007).
- Berbari, N. F., O'Connor, A. K., Haycraft, C. J., Yoder, B. K. The primary cilium as a complex signaling center. Current Biology. 19 (13), 526-535 (2009).
- Walz, G. Role of primary cilia in non-dividing and post-mitotic cells. Cell Tissue Research. 369 (1), 11-25 (2017).
- Nachury, M. V., Mick, D. U. Establishing and regulating the composition of cilia for signal transduction. Nature Reviews. Molecular Cell Biology. 20 (7), 389-405 (2019).
- Goetz, S. C., Anderson, K. V. The primary cilium: a signalling centre during vertebrate development. Nature Reviews Genetics. 11 (5), 331-344 (2010).
- Engle, S. E., Bansal, R., Antonellis, P. J., Berbari, N. F. Cilia signaling and obesity. Seminars in Cell and Developmental Biology. , (2020).
- Reiter, J. F., Leroux, M. R. Genes and molecular pathways underpinning ciliopathies. Nature reviews. Molecular Cell Biology. 18 (9), 533-547 (2017).
- Waters, A. M., Beales, P. L. Ciliopathies: an expanding disease spectrum. Pediatric Nephrology. 26 (7), Berlin, Germany. 1039-1056 (2011).
- Hildebrandt, F., Benzing, T., Katsanis, N. Ciliopathies. New England Journal of Medicine. 364 (16), 1533-1543 (2011).
- Vaisse, C., Reiter, J. F., Berbari, N. F. Cilia and Obesity. Cold Spring Harbor Perspectives in Biology. 9 (7), (2017).
- Berbari, N. F., et al. Leptin resistance is a secondary consequence of the obesity in ciliopathy mutant mice. Proceedings of the National Academy of Sciences of the United States of America. 110 (19), 7796-7801 (2013).
- Jacobs, D. T., et al. Dysfunction of intraflagellar transport-A causes hyperphagia-induced obesity and metabolic syndrome. Disease Models & Mechanisms. 9 (7), 789-798 (2016).
- Arsov, T., et al. Fat aussie--a new Alström syndrome mouse showing a critical role for ALMS1 in obesity, diabetes, and spermatogenesis. Molecular Endocrinology. 20 (7), 1610-1622 (2006).
- Tam, L. W., Ranum, P. T., Lefebvre, P. A. CDKL5 regulates flagellar length and localizes to the base of the flagella in Chlamydomonas. Molecular Biology of the Cell. 24 (5), 588-600 (2013).
- Rajagopalan, V., Subramanian, A., Wilkes, D. E., Pennock, D. G., Asai, D. J. Dynein-2 affects the regulation of ciliary length but is not required for ciliogenesis in Tetrahymena thermophila. Molecular Biology of the Cell. 20 (2), 708-720 (2009).
- Bengs, F., Scholz, A., Kuhn, D., Wiese, M. LmxMPK9, a mitogen-activated protein kinase homologue affects flagellar length in Leishmania mexicana. Molecular Microbiology. 55 (5), 1606-1615 (2005).
- Han, Y. M., et al. Leptin-promoted cilia assembly is critical for normal energy balance. Journal of Clinical Investigation. 124 (5), 2193-2197 (2014).
- Caspary, T., Marazziti, D., Berbari, N. F. Cilia: Methods and Protocols. Satir, P., Tvorup Christensen, S. , Springer. New York. 203-214 (2016).
- Bishop, G. A., Berbari, N. F., Lewis, J., Mykytyn, K. Type III adenylyl cyclase localizes to primary cilia throughout the adult mouse brain. Journal of Comparative Neurology. 505 (5), 562-571 (2007).
- Domire, J. S., Mykytyn, K. Markers for neuronal cilia. Methods in Cell Biology. 91, 111-121 (2009).
- Sun, J. S., et al. Ventromedial hypothalamic primary cilia control energy and skeletal homeostasis. Journal of Clinical Investigation. 131 (1), (2021).
- Berbari, N. F., Johnson, A. D., Lewis, J. S., Askwith, C. C., Mykytyn, K. Identification of ciliary localization sequences within the third intracellular loop of G protein-coupled receptors. Molecular Biology of the Cell. 19 (4), 1540-1547 (2008).
- Brailov, I., et al. Localization of 5-HT(6) receptors at the plasma membrane of neuronal cilia in the rat brain. Brain Research. 872 (1-2), 271-275 (2000).
- Domire, J. S., et al. Dopamine receptor 1 localizes to neuronal cilia in a dynamic process that requires the Bardet-Biedl syndrome proteins. Cellular and Molecular Life Sciences. 68 (17), 2951-2960 (2011).
- Handel, M., et al. Selective targeting of somatostatin receptor 3 to neuronal cilia. Neuroscience. 89 (3), 909-926 (1999).
- Koemeter-Cox, A. I., et al. Primary cilia enhance kisspeptin receptor signaling on gonadotropin-releasing hormone neurons. Proceedings of the National Academy of Sciences of the United States of America. 111 (28), 10335-10340 (2014).
- Mukhopadhyay, S., et al. The ciliary G-protein-coupled receptor Gpr161 negatively regulates the Sonic hedgehog pathway via cAMP signaling. Cell. 152 (1-2), 210-223 (2013).
- Berman, S. A., Wilson, N. F., Haas, N. A., Lefebvre, P. A. A novel MAP kinase regulates flagellar length in Chlamydomonas. Current Biology. 13 (13), 1145-1149 (2003).
- Nguyen, R. L., Tam, L. W., Lefebvre, P. A. The LF1 gene of Chlamydomonas reinhardtii encodes a novel protein required for flagellar length control. Genetics. 169 (3), 1415-1424 (2005).
- Tam, L. W., Wilson, N. F., Lefebvre, P. A. A CDK-related kinase regulates the length and assembly of flagella in Chlamydomonas. Journal of Cell Biology. 176 (6), 819-829 (2007).
- O'Connor, A. K., et al. An inducible CiliaGFP mouse model for in vivo visualization and analysis of cilia in live tissue. Cilia. 2 (1), 8(2013).
- Bangs, F. K., Schrode, N., Hadjantonakis, A. K., Anderson, K. V. Lineage specificity of primary cilia in the mouse embryo. Nature Cell Biology. 17 (2), 113-122 (2015).
- Delling, M., et al. Primary cilia are not calcium-responsive mechanosensors. Nature. 531 (7596), 656-660 (2016).
- Saggese, T., Young, A. A., Huang, C., Braeckmans, K., McGlashan, S. R. Development of a method for the measurement of primary cilia length in 3D. Cilia. 1 (1), 11(2012).
- Kobayashi, Y., Hamamoto, A., Saito, Y. Analysis of ciliary status via G-protein-coupled receptors localized on primary cilia. Microscopy. 69 (5), 277-285 (2020).
- Zhou, L. Q., et al. Artificial intelligence in medical imaging of the liver. World Journal of Gastroenterology. 25 (6), 672-682 (2019).
- Naugler, C., Church, D. L. Automation and artificial intelligence in the clinical laboratory. Critical Reviews in Clinical Laboratory Sciences. 56 (2), 98-110 (2019).
- Dunn, K. W., Kamocka, M. M., McDonald, J. H. A practical guide to evaluating colocalization in biological microscopy. American Journal of Physiology-Cell Physiology. 300 (4), 723-742 (2011).
- Bansal, R., et al. Hedgehog Pathway Activation Alters Ciliary Signaling in Primary Hypothalamic Cultures. Frontiers in Cellular Neuroscience. 13, 266(2019).
- Jin, H., et al. The conserved Bardet-Biedl syndrome proteins assemble a coat that traffics membrane proteins to cilia. Cell. 141 (7), 1208-1219 (2010).
- Liew, G. M., et al. The intraflagellar transport protein IFT27 promotes BBSome exit from cilia through the GTPase ARL6/BBS3. Developmental Cell. 31 (3), 265-278 (2014).
- Engle, S. E., et al. A CreER Mouse to Study Melanin Concentrating Hormone Signaling in the Developing Brain. Genesis. , (2018).
- Thorpe, S. D., et al. Reduced primary cilia length and altered Arl13b expression are associated with deregulated chondrocyte Hedgehog signaling in alkaptonuria. Journal of Cellular Physiology. 232 (9), 2407-2417 (2017).
- Lauring, M. C., et al. New software for automated cilia detection in cells (ACDC). Cilia. 8, 1(2019).
- Dummer, A., Poelma, C., DeRuiter, M. C., Goumans, M. J., Hierck, B. P. Measuring the primary cilium length: improved method for unbiased high-throughput analysis. Cilia. 5, 7(2016).
- Haycraft, C. J., et al. Gli2 and Gli3 localize to cilia and require the intraflagellar transport protein polaris for processing and function. PLoS Genetics. 1 (4), 53(2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。