Method Article
基因工程按蚊的小笼实验室试验
摘要
这里报告的方案说明了在实验室封闭的小笼试验中评估用于病媒控制的基因工程蚊子性能的三种替代方法。每个方案都是根据蚊子品系所承受的特定修饰(基因驱动或非基因驱动)和测量的参数类型量身定制的。
摘要
已提出使用转基因病媒控制蚊媒病原体,作为补充传统控制策略的有希望的工具。基于CRISPR的归巢基因驱动系统使转基因技术在科学界更容易获得。在小型实验室网箱试验中对转基因蚊子性能的评估以及与野生型蚊子的比较,为随后的田间笼实验和实验评估的设计提供了宝贵的数据,以完善疾病预防策略。在这里,我们介绍了实验室环境中使用的三种不同的方案,以评估疟疾按蚊病媒中的转基因传播。这些包括淹没性释放(无基因驱动系统)以及基因驱动重叠和非重叠的世代试验。这三项试验在许多参数上有所不同,可以适应所需的实验设置。此外,在小型网箱中进行昆虫研究是工程昆虫从实验室逐步过渡到露天释放的一部分。因此,这里描述的规程代表了提供经验价值的宝贵工具,最终将有助于实地实施消除疟疾的新技术。
引言
正在推行基于基因工程蚊子的战略,以控制病媒传播病原体(如导致疟疾的病原体)的传播1。这些技术包括1)旨在减少 按蚊 的数量和密度(种群抑制),或2)旨在损害导致人类疾病(种群改变,替换或改变)的寄生虫传播能力的技术,其中载体菌株被设计为表达阻止病原体传播的效应基因。这些遗传方法得到了基于CRISPR / Cas9的基因驱动的支持,在寄生虫传播蚊子中有效传播有效载荷性状以及笼中抗寄生虫效应分子的概念证明。
小型实验室网箱试验是评估转基因菌株特性的第一步,作为分阶段开发其现场应用方法的一部分2。具体的结局考虑因素包括引入DNA在竞争环境中的遗传性、表型的外显率和表达性以及稳定性。相关的实验设计特征包括笼子的大小、蚊子密度、重复次数、重叠或不重叠的世代、年龄结构的目标种群、工程菌株的单次或多次释放、仅雄性、仅雌性或混合性别释放、释放比率、血粉来源(人工或活体动物)以及筛查程序。
我们在这里描述了用于评估按属素蚊子菌株的过量释放(无基因驱动系统)以及那些携带由Cas9内切酶介导的自主基因驱动系统并引导RNA(gRNA)的方案。这些协议的应用出现在Pham 等人身上。 (2019)2, Carballar-Lejarazú et al. (2020)3、阿道菲 等人。 (2020)4.
淹没释放试验评估了孟德尔遗传下设计转基因在大量转基因蚊子多次释放到野生种群后的传播率。在没有将转基因连接到驱动系统的情况下,来自淹没性释放试验的数据提供了有关稳定人群中感兴趣的转基因的适应性和动态的信息。
当蚊子种群包含自主基因驱动系统时,小型笼试验旨在通过确定单次引入转基因雄性后显性标志物增加的速率来评估所需转基因传播的动态。自主基因驱动元件携带编码Cas9核酸酶,gRNA和显性标记的基因,其方式以在后代中活跃的方式连接。
"重叠"世代是指在同一笼子中同时存在多代,以产生年龄结构的连续种群,而"非重叠"是指每个连续笼中种群中的单个离散世代2。一旦确定了驱动(转换)速率的初始动力学(取决于构建体,为8-10代),基因驱动笼实验就可以终止,虽然它们提供了有关蚊子种群内转基因短期稳定性的信息,但它们可能无法揭示当以及如果优势标记频率达到或接近完全引入时会发生什么(每只蚊子携带至少一个基因驱动系统拷贝)。
研究方案
动物伦理声明
这项研究严格按照美国国立卫生研究院《实验动物护理和使用指南》中的建议进行。协议由加州大学机构动物护理和使用委员会批准(动物福利保证编号A3416.01)。
1. 非基因驱动蚊子的泛滥释放试验(图1)
- 保持架设置和维护
- 通过连续三周内在每个网箱中添加60个二龄野生型(WT)幼虫,设置三套一式三份的0.216立方米网箱。
注意:不可能通过光学显微镜确定二龄幼虫的性别,因此添加到每个笼子的样本将由雄性和雌性组成。 - 每周,在每个笼子中为成年雌性提供麻醉小鼠作为血粉源(图2A)和血粉后3天的产卵容器。
注意:虽然可以使用替代的人工喂养设备,但为血液测量提供活麻醉小鼠可以在这些大型(0.216 m3)笼式中提供更好的蚊子喂养性能。这需要批准的动物使用方案和相关(例如,机构动物护理和使用委员会,IACUC)批准使用小鼠。
注意:用4mg /小鼠氯胺酮盐酸盐和0.4mg /小鼠木肼嗪的混合物麻醉个体小鼠。向动物注射0.1-0.5毫升这种混合物。 - 每周从每个笼子中孵化卵,并随机选择60只二龄(L2)幼虫返回各自的笼中,以抵消死亡率(第4-8周)。
注:步骤1.1.1至1.1.3对于在网箱中建立稳定和分布的年龄结构种群是必要的,称为"初始阶段"。 - 在第9周,将步骤1.1.1中组装的笼子随机一式三份分配,以释放所需的雄性释放比例。
- 指定一组一式三份的笼子作为对照,以评估整个实验的一致性。
- 为每个所需的释放比例指定一组一式三份(例如,1:1 或 1:0.1 转基因:WT 雄性)。
注意:这一点称为"实验阶段"。
- 通过连续三周内在每个网箱中添加60个二龄野生型(WT)幼虫,设置三套一式三份的0.216立方米网箱。
- 复制和释放比率
- 每周向对照笼中加入60只WT蛹(30只雄性和30只雌性)。
- 为了保持1:1的比例,每周将30个转基因雄性蛹和60个(30个雄性和30个雌性)WT蛹加入每个各自的笼中。
- 为了保持1:0.1的比例,每周将300个转基因雄性蛹和60个(30只雄性和30只雌性)WT蛹加入每个相应的笼中。
注:继续向笼子中添加野生蚊子可保持笼子密度,由于与年龄相关的成虫死亡率,预计笼子密度每周都会减少。
- 表型筛查
- 从每个笼子中随机选择总共300个幼虫。使用配备荧光滤光片的体视显微镜,筛选幼虫和蛹阶段荧光显性标记物的表达,并对所得成虫的性别进行评分(图3)。
注意:表型筛选将取决于整合到蚊子中的转基因构建体中包含的显性标记(例如, Discosoma sp. 红色荧光蛋白[DsRed],青色荧光蛋白[CFP],绿色荧光蛋白[GFP]),以及驱动其表达的启动子(蚊子转基因中最常用的是3xP3启动子驱动眼睛和神经索中的表达)。 - 根据实验设计中定义的结果参数的要求,遵循该协议的任意数量的世代。
注意:当所有蚊子都至少有一个转基因拷贝(由显性荧光标记物的存在决定)或笼中转基因蚊子与WT蚊子的比例稳定并且在几代(3-5)代后不会大幅波动时,试验通常会终止。
- 从每个笼子中随机选择总共300个幼虫。使用配备荧光滤光片的体视显微镜,筛选幼虫和蛹阶段荧光显性标记物的表达,并对所得成虫的性别进行评分(图3)。
2. 基因驱动蚊子的重叠世代试验(图4)
注意:携带基因驱动系统的蚊子需要书面和审查的协议,并应得到机构生物安全委员会(IBC)或同等机构的批准,并在必要时获得其他机构的批准。防蚊(ACL 2+ 级)应遵循建议的程序5,6,7。具体来说,基因驱动实验应该采用两种严格的禁闭策略。第一种通常是生物体与环境之间的物理屏障(屏障策略)。这需要有一个安全的昆虫和标准操作程序(包括监测),以确保蚊子无法逃脱。第二种限制策略可以是分子,生态或生殖5。
- 保持架设置
- 为每个所需的转基因:WT雄性释放比设置两组一式三份的0.216 m3 网箱。
- 为了达到1:1的雄性释放比,在每个复制笼中加入120个转基因雄性,120个WT雄性和120个WT雌性在蛹阶段。
- 为了达到1:10的释放比,在每个复制笼中加入12个转基因雄性,120个WT雄性和120个WT雌性在蛹阶段。
注意:可以测试不同的释放比率(1:1,1:3,1:10等),并且用于启动实验的蚊子数量也相应地有所不同。但是,重要的是要考虑低数字对数据统计评估的影响。
- 为每个所需的转基因:WT雄性释放比设置两组一式三份的0.216 m3 网箱。
- 人口维持和筛查
- 使用麻醉小鼠在每个笼子中为4-7天大的雌性提供血粉(图2A)。
- 血粉后三天,在每个笼子中插入产卵容器。
- 在幼虫盘中孵化卵,从每个笼子中随机选择约240个第一龄(L1)幼虫,将它们饲养到成年期,然后将它们放回各自的笼子。
- 如步骤2.2.1所述,每3-4天为新出现的成年人提供额外的(2-3)血液餐。
注意:在后续任何一代中,没有添加额外的转基因雄性。 - 从每个笼子中随机选择总共300个幼虫,并使用荧光体视显微镜筛选幼虫和蛹阶段是否存在显性标记表型,并对新生的成虫进行性别评分(图3)。
注意:与以前一样,表型筛选将取决于基因驱动系统中包含并整合到转基因蚊子(例如DsRed,CFP或GFP)中的优势标记和启动子。如果靶向基因的纯合或异位基因破坏导致可见的表型(例如,与眼色素沉着相关的基因),则该性状的筛选将取决于哪个阶段最容易可视化改变的表型。 - 根据实验设计中定义的结果参数的要求,遵循该协议的任意数量的世代。
注意:每一代(以血粉分隔)需要大约三周的时间。当所有蚊子都被认为是基因驱动构建体的纯合子,或者种群稳定在携带至少一个基因驱动构建体拷贝的蚊子的最大百分比时,试验通常会终止。
3. 基因驱动蚊子的非重叠世代试验(图5)。
- 保持架设置
- 为要研究的转基因与WT雄性的每个特定释放比例设置0.005 m3 网箱种群(例如,三组一式三份网箱,每组以1:1,1:3,1:10的释放比设置)。设置所有饲养箱的雄性和雌性总数相等。
注: 补充文件 是演示0.005 m3 菌落笼构造的视频。- 将50个转基因雄性、50个WT雄性和100个WT雌性添加到三个重复笼中,以实现1:1的雄性释放比。
- 将25只转基因雄性、75只WT雄性和100只WT雌性加入三个重复笼中,以实现1:3的雄性释放比。
- 将9个转基因雄性,90个WT雄性和100个WT雌性添加到三个重复笼中,以实现1:10的雄性释放比。
注意:可以测试不同的释放率,并且用于启动实验的蚊子数量可能会相应地变化。然而,重要的是要考虑蚊子数量少对统计分析的影响。这些是单一版本;在任何后代中都没有添加额外的转基因雄性。
- 为要研究的转基因与WT雄性的每个特定释放比例设置0.005 m3 网箱种群(例如,三组一式三份网箱,每组以1:1,1:3,1:10的释放比设置)。设置所有饲养箱的雄性和雌性总数相等。
- 人口维持和筛查
- 连续两天使用人工喂养装置(图2B)为每个笼子中4-7天大的雌性提供血餐。
注意:女性的常规血餐包括由喂养设备提供的市售血液来源(例如,小牛血液)。活麻醉小鼠仅用于提供较大(0.216 m3)笼状形式的血粉,以获得更好的喂养性能。 - 在第二次血粉后3天加入产卵容器。三天后,取出产卵容器。
注意:在此步骤中,可以从每个笼子中随机选择5-10只雌性,并单独放置在小瓶中,以评估额外的适应性参数,例如生育能力和繁殖力,如果需要的话。 - 所有留在笼子里的成虫(死的和活的)按性别评分,并将它们储存在-80°C进行分子分析。
- 孵化卵,并从1:1和1:3比例的网箱中随机选择200只L1幼虫,为下一代填充新的网箱。
注意:由于在1:10比例的笼子中启动转基因个体的频率较低,随机抽样可能导致下一代转基因后代过度损失以延续种群。 - 为确保对1:10的网箱和足够数量的转基因蚊子进行准确采样,请对所有幼虫进行筛选,以寻找主要标记,并选择反映观察到的转基因频率的200只幼虫来填充新的网箱。
注意:当1:10笼达到≥80%的转基因频率时,可以与1:1和1:3笼子保持相同。 - 从每个笼子中随机选择500个幼虫进行深入分析。在荧光体视显微镜下筛选幼虫和蛹期的预期标志物表型以及成虫性别评分(图3)。
注意:"特殊"表型可以选择进一步交叉并进行分子分析,以监测抗性等位基因的形成。 - 该协议可以按照实验设计中定义的结果参数的要求,遵循任意数量的世代。
注意:每一代由血粉分隔,需要大约三周的时间。当所有蚊子都被认为是基因驱动构建体的纯合子或种群稳定在转基因蚊子的最大流行率时,试验通常会终止。和以前一样,表型的筛选将取决于转基因蚊子(例如,DsRed,CFP,GFP)或靶向基因中整合的显性标记和启动子,如果它们具有可见的表型(例如,与眼睛色素沉着相关的基因)。
- 连续两天使用人工喂养装置(图2B)为每个笼子中4-7天大的雌性提供血餐。
结果
如"方案"部分所述,为承受非基因驱动或自主基因驱动修饰而产生的转基因按蚊进行笼式试验。这里显示的代表性结果描述了Pham等人进行的每个笼试验实验中表现最佳的重复的表型动态 。 (2019)2 只用于 按蚊 。这三项试验(分别为1- 3项:淹没性非基因驱动、重叠基因驱动和非重叠基因驱动)在不同参数上有所不同,例如笼子的大小(0.216 m3 vs 0.005 m3),目标人群是否为年龄结构,血粉来源(小鼠或人工饲养者)和释放率。作为一种表示方式, 图6 显示了在七代过程中从所有三种协议的相同释放比(1:1)中选择的观测数据。
1:1 非驱动版本在 6-7 代内达到 >80% 的转基因引入。对于基因驱动转基因笼试验,非重叠和重叠方案中的1:1释放在3-4代内达到这一水平,从而验证了基因驱动系统的单次释放比非驱动淹没释放更有效的期望转基因引入。更快的轨迹也可以通过趋势线的斜率来确认。尽管设置不同,但两种基因驱动方案都呈现出相似的角度和斜率趋势。在观察结束时,非驱动笼子达到约80%的携带转基因的个体,而具有基因驱动个体的笼子达到完全(或接近完全)引入。使用此处描述的协议的单个实验结果的完整数据和处理细节可以在Pham等人的图1-3中找到 。 (2019)2,图2-3的Carballar-Lejarazú 等人。 (2020)3 和图3的阿道菲 等人。 (2020)4.
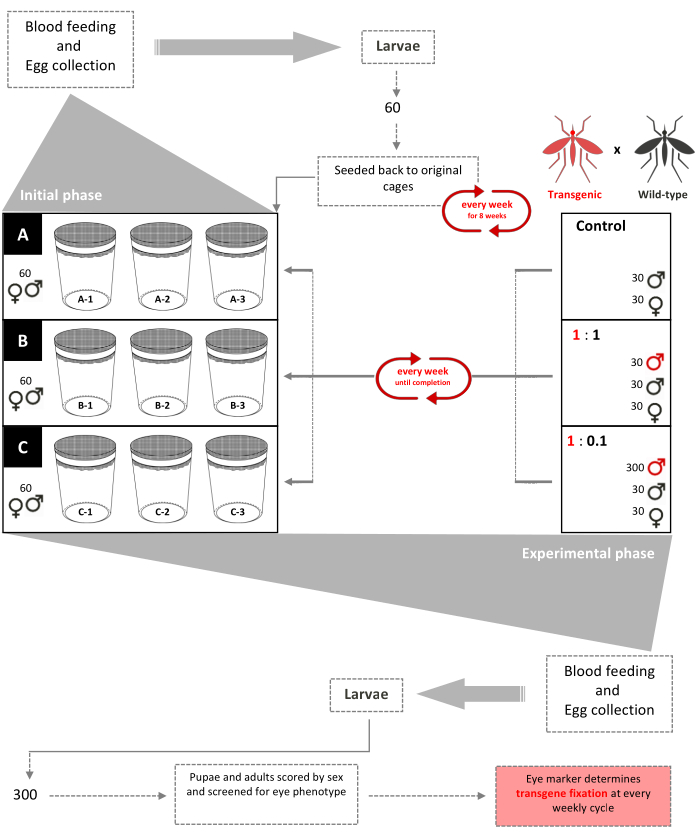
图 1.非驱动器淹没释放试用示意图。 设置了9个0.216立方米的 网箱,每个网箱中增加了60个野生型二龄(混性)幼虫。从第3周开始,每周为雌性提供一次血粉,收集和孵化卵。直到第8周,随机选择60只幼虫并每周返回各自的网箱,以在网箱中形成年龄结构的种群(初始阶段)。从第9周开始,根据转基因:野生型雄性释放比率(实验阶段),随机分配9个笼子,一式三份。网箱A(对照)没有添加转基因蛹。每周为雌性提供一次血粉,卵被收集,孵化和饲养到蛹。30只雄性和30只雌性野生型蛹被放回笼子里。笼子1:1增加了30个转基因雄性蛹。笼子1:0.1增加了300个转基因雄性蛹。随机选择9个笼子中每个笼子中的300个幼虫,并筛选荧光标记。该过程每周重复一次,直到转基因固定(几代后转基因野生型蚊子的稳定比例)。改编自Pham 等人。 (2019)2. 请点击此处查看此图的放大版本。

图 2.笼养种群的血液。 (A) 麻醉小鼠或 (B) Hemotek喂血器分别用于0.216 m3 笼或0.005 m3 小笼子上的供血雌性蚊子。请点击此处查看此图的放大版本。

图 3.筛查非驱动、重叠基因驱动和非重叠基因驱动笼试验的表型。 转基因或野生型表型的幼虫,蛹和成虫的荧光图像。在这个例子中, An. stephensi 个体被筛查为由眼睛中的3xP3启动子(DsRed+或DsRed-)驱动的DsRed标记,在所有三个阶段都可见,并且成年人被筛查性行为(♀或♂)。注意野生型幼虫的背景荧光与中肠中的食物推注有关。请点击此处查看此图的放大版本。
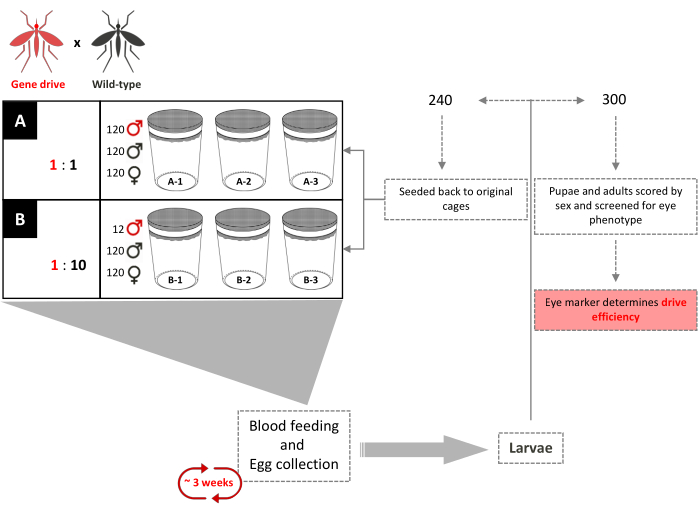
图 4.重叠基因驱动笼试验示意图。 6个0.216 m3 笼子根据其基因驱动:野生型雄性释放比例一式三份设置。每个笼子增加了120只野生型雄性和120只野生型雌性。基因驱动雄性释放比为1:1的笼子增加了120只转基因雄性。雄性释放比为1:10的笼子增加了12只转基因雄性。在转基因完全引入之前,每3周为成年雌性提供血粉,收集和孵化卵。共随机挑选了240只幼虫,并将其放回各自的网箱。随机选择三百(300)个幼虫并筛选出优势标记。它们后来被筛选为蛹和成虫的眼睛颜色和性别。原始网箱中没有增加额外的转基因雄性。改编自Pham 等人。 (2019)2. 请点击此处查看此图的放大版本。
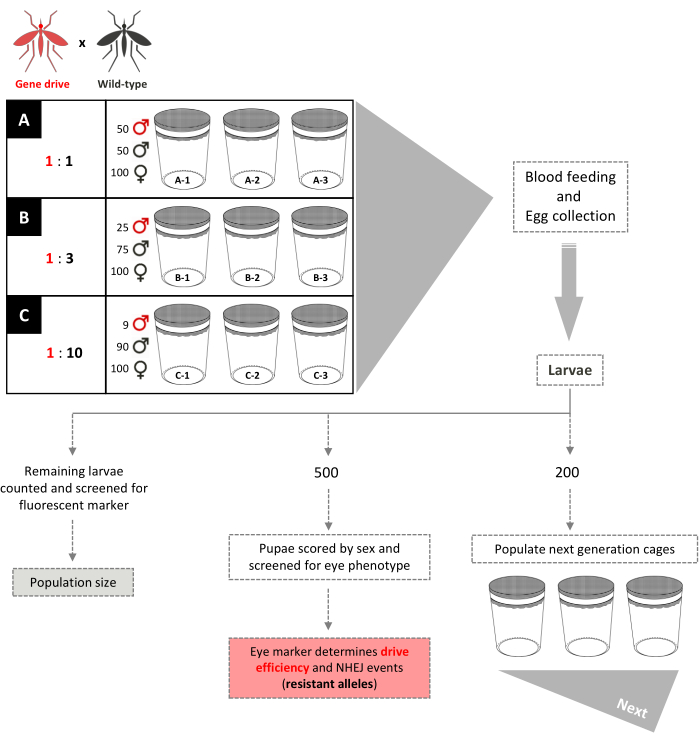
图 5.非重叠基因驱动笼试验示意图。 9个0.005 m3 的小网箱根据其基因驱动:野生型雄性释放比例一式三份设置。雄性释放比为1:1的笼子增加了100只野生型雌性,50只野生型雄性和50只基因驱动雄性。雄性释放比为1:3的笼子增加了100只野生型雌性,75只野生型雄性和25只基因驱动雄性。笼子1:10雄性释放比例增加了100只野生型雌性,90只野生型雄性和9只基因驱动雄性。为雌性提供血粉,收集和孵化卵。对于1:1和1:3的网箱,随机选择200个幼虫,用于填充新的网箱,与父母的笼子分开,供下一代使用。随机选择另外500只幼虫,并在筛选显性标记基因时将其饲养至蛹。然后将500只蛹饲养成虫,并按性别评分。对所有剩余的幼虫进行标记物筛查。对于1:10的网箱,所有幼虫都分为1-12代,200个幼虫反映现有的转基因频率,用于填充新的网箱。从第13代开始,这些笼子的设置与1:1和1:3的笼子相同。改编自Pham 等人。 (2019)2 和Carballar-Lejarazú 等人。 (2020)3. 请点击此处查看此图的放大版本。
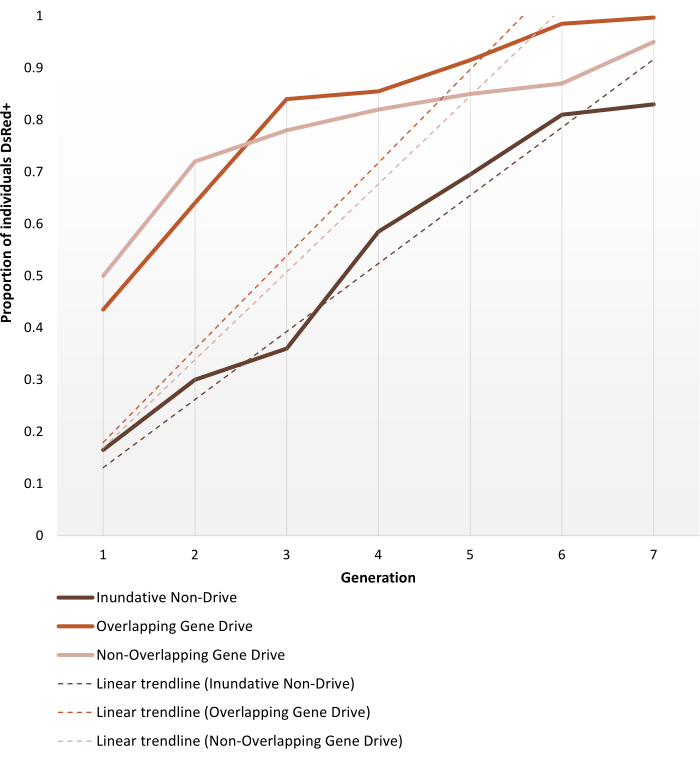
图 6.预测不同种群替代笼试验的转基因固定动态. 表示Pham等人进行的每个笼试验实验中表现最佳的重复的预期表型动态 。 (2019)2、监控超过7代。实验设置在协议中描述。预测基于1:1释放模型上所有9个实验的数据(三种不同笼式试验方案中每个实验的重复)。X轴是初始引入后的世代数,Y轴是幼虫在一段时间内显示DsRed标记表型(DsRed+)的比例。虚线表示数据的线性趋势线。DsRed+表型由至少具有一个修饰等位基因拷贝的结果。因此,结果反映了转基因的传播,在基因驱动系统中加速,在观察结束时达到(接近)完全引入。有关重复和实验的完整详细数据之间的变异性,请参阅Pham 等人。 (2019)2, Carballar-Lejarazú R et al. (2020)3 和 Adolfi A et al. (2020)4.图像改编自Pham TB等人(2019)疟疾病媒蚊子 按蚊的实验性种群修饰。 PLOS Genet 15(12):e1008440。doi: 10.1371/journal.pgen.1008440, Adolfi A et al. (2020) 疟疾蚊子 按蚊按蚊中的高效种群修饰基因驱动抢救系统。 国家公报 11(1):5553。doi: 10.1038/s41467-020-19426-0 and Carballar-Lejarazú R et al. (2020) 用于疟疾病媒蚊子冈 比亚按蚊种群修饰的下一代基因驱动。 美国国家科学院院刊 117(37):22805-22814.doi: 10.1073/pnas.2010214117.请点击此处查看此图的放大版本。
补充文件:0.005 m3菌落笼的建造。 请点击此处下载此文件。
讨论
具有病原体阻断能力或具有不育基因的基因工程蚊子构成了控制病媒传播疾病的新工具。鉴于构成这些替代方法的参数的多样性,其研究的关键步骤包括实验室限制的实验评估,这些评估允许快速安全地预测合成转基因释放的潜在结果以用于控制目的1。
由于对笼中种群中转基因动力学的监测可以持续数月,因此方案的核心方面之一是重复(包括蚊子饲养,笼子大小,年龄结构种群,固定释放比率,稳定的血粉来源和微创筛查程序)之间实验设计的一致性。
仅雄性释放被认为是理想的,因为雄性蚊子既不传播病原体也不以人类为食,因此它们可以安全地将可遗传的特征引入野生种群。在实验室笼式实验中,可以检测出雄配竞争力降低的转基因菌株以及与转基因整合相关的其他适应性负荷。但是,可以进行直接和具体的实验,例如在大型笼子10中进行的实验,以正确分析雄性竞争力,以及更自然的蚊子密度中的雌性繁殖力2。此外,来自网箱试验的经验数据可用于参数化网箱种群动态模型,包括抗性等位基因形成,并就所提出技术的有效性和可能的调整提供有用的信息。
此处描述的实验方案可以根据需要轻松适应其他实验设计,对常规昆虫基础设施和条件的要求最低。此外,除了商用笼子和显微镜外,大多数材料都很便宜,并且允许低成本的多次复制和迭代试验。值得注意的是,这也允许在小型笼试验中预先筛选多个转基因菌株,以便优先考虑在分阶段测试途径中向前推进的最佳表现候选菌株,并暂停对表现出次优性能的菌株的测试。
最后,对使用转基因生物的关切促使制定、评价和应用预防蚊媒疾病的遗传战略的框架5,8,9。此处定义的协议的相关性和执行与这些准则一致。
披露声明
作者没有披露。
致谢
我们感谢Drusilla Stillinger,Kiona Parker,Parrish Powell和Madeline Nottoli的蚊子饲养。资金由加州大学欧文分校疟疾倡议提供。AAJ是加州大学欧文分校的Donald Bren教授。
材料
| Name | Company | Catalog Number | Comments |
| Artificial feeders | Hemotek | SP6W1-3 | Starter pack – 6 feeders with 3ml reservoirs |
| Cage, commercial | BioQuip | 1450D | Collapsible Cage, 24 X 24 X 24" - 0.216 m3 (60 cm3) |
| Cage tub (popcorn) | Amazon.com | VP170-0006 | 0.005 m3 (170 fl oz) |
| Dissecting microscope with fluorescence light and filters | Leica | M165FC | |
| Glue sticks | Michaels | 88646598807 | Gluesticks 40 pk, 0.4X4” |
| Hot glue gun | Woodwards Ace | 2382513 | Stanley, 40 watt, GR20 |
| Nylon screen (netting) | Joann.com | 1102912 | Tulle 108" Wide x 50 Yds - ~35.6 cm2 (14 in2) |
| Oviposition cups | Fisher | 259126 | Beaker PP grad 50 mL |
| Razor cutting tool | Office Depot | 487899 | Box cutters |
| Scissors | Office Depot | 978561 | Scotch Precision Ultra Edge Titanium Non-Stick Scissors, 8" |
| Stapler | Office Depot | 908194 | Swingline Commercial Desk Stapler |
| Surgical sleeve (stockinette) | VWR | 56612-664 | ~48 cm (19”) cut from bolt ~15 cm (6”) X ~23 m (25y) |
| Zip ties | Home Depot | 295715 | Pk of 100, 14” cable ties - 35.6 cm (14 in) |
参考文献
- Carballar-Lejarazú, R., James, A. A. Population modification of Anopheline species to control malaria transmission. Pathogens and Global Health. 111 (8), 424-435 (2017).
- Pham, T. B., et al. Experimental population modification of the malaria vector mosquito, Anopheles stephensi. PLOS Genetics. 15 (12), 1008440(2019).
- Carballar-Lejarazú, R., et al. Next-generation gene drive for population modification of the malaria vector mosquito, Anopheles gambiae. Proceedings of the National Academy of Sciences. 117 (37), 22805-22814 (2020).
- Adolfi, A., et al. Efficient population modification gene-drive rescue system in the malaria mosquito Anopheles stephensi. Nature Communications. 11 (1), 5553(2020).
- Akbari, O. S., et al. Safeguarding gene drive experiments in the laboratory. Science. 349 (6251), 927-929 (2015).
- Benedict, M. Q., et al. Recommendations for Laboratory Containment and Management of Gene Drive Systems in Arthropods. Vector-Borne and Zoonotic Diseases. 18 (1), 2-13 (2018).
- CDC/NIH Biosafety in Microbiological and Biomedical Laboratories. (6th Edition). , Available from: http://www.cdc.gov/labs/pdf/SF_19_308133-A_BMBL6_00-BOOK-WEB-final-3.pdf 1(2020).
- Adelman, Z., et al. Rules of the road for insect gene drive research and testing. Nature Biotechnology. 35 (8), 716-718 (2017).
- Long, K. C., et al. Core commitments for field trials of gene drive organisms. Science. 370 (6523), 1417-1419 (2021).
- Facchinelli, L., North, A. R., Collins, C. M., et al. Large-cage assessment of a transgenic sex-ratio distortion strain on populations of an African malaria vector. Parasites Vectors. 12, 70(2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。